Обмен веществ в костной ткани является сложным процессом, в котором участвуют многочисленные медиаторы, гормоны, клетки и продукты их обменных процессов. При этом основную роль играют два типа клеток - остеобласты (трансформирующиеся в остеоциты) и остеокласты.
Остеобласты образуются из полипотентных мезенхимальных клеток-предшественников (рис. 1-1 а) и продуцируют костный матрикс, который в дальнейшем минерализуется, трансформируясь в твердую субстанцию. В ходе трансформации костной ткани остеобласты (рис. 1-1Ь и 1-1 с) блокируются в костном матриксе и превращаются в остеоциты с низкой метаболической активностью (рис. 1-1d). Однако в таком виде они не просто поддерживают пассивную диффузию в кости, но и участвуют в транспорте ионов через щелевидные соединения цитоплазматических отростков. Этот механизм является важным условием для трофических и обменных процессов костной ткани, поскольку диффузионный обмен через минерализованный матрикс принципиально невозможен. Функция транспорта ионов обусловливает уменьшение размеров остеонов до 100 мкм. Таким образом, остеоны структурно и метаболически представляют собой единое целое (рис. 1-1е и 1-1f).
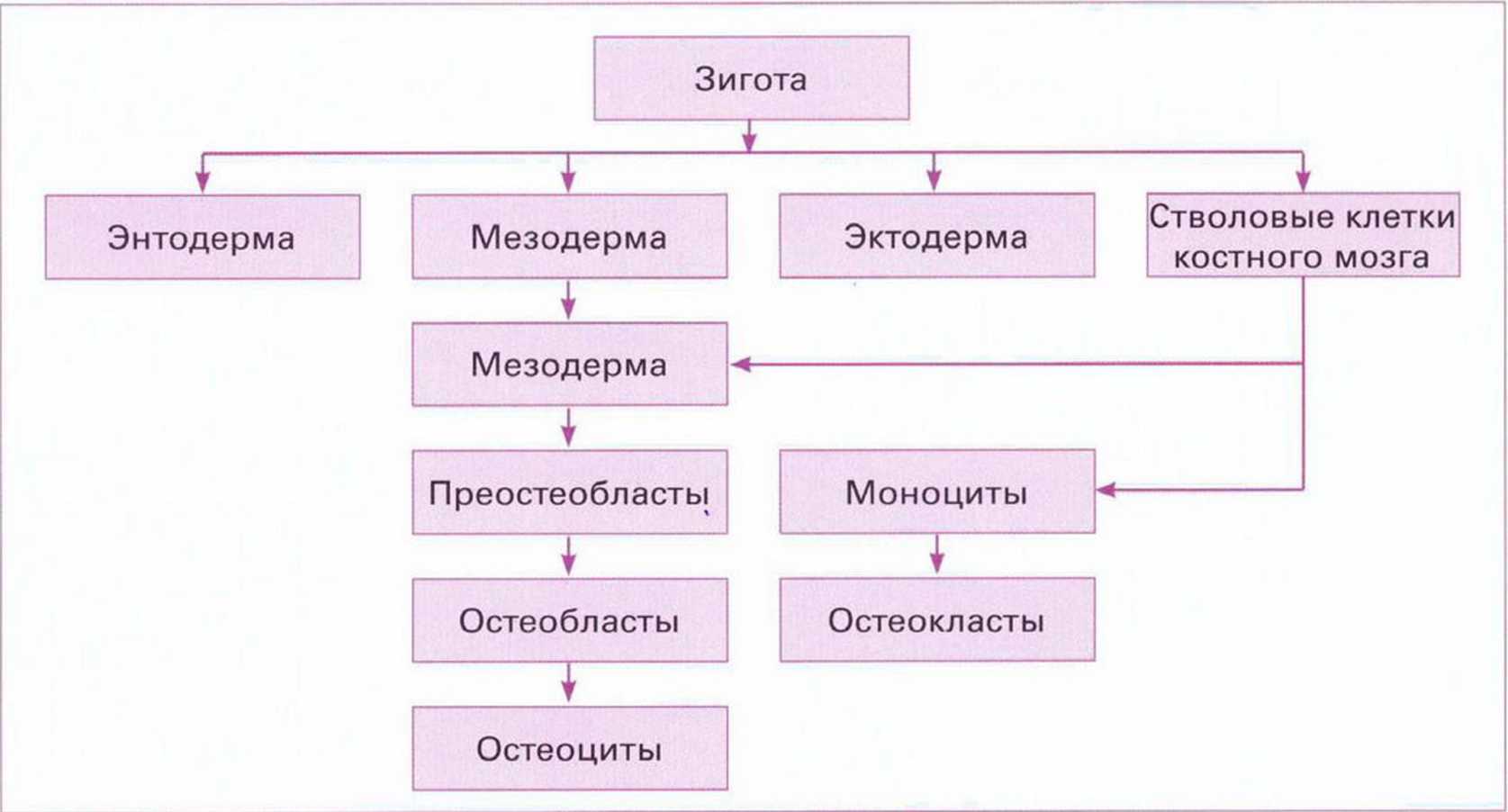
Рис. 1-1а. Дифференцирование остеобластов и остеокластов (по Nefussi, 2007)
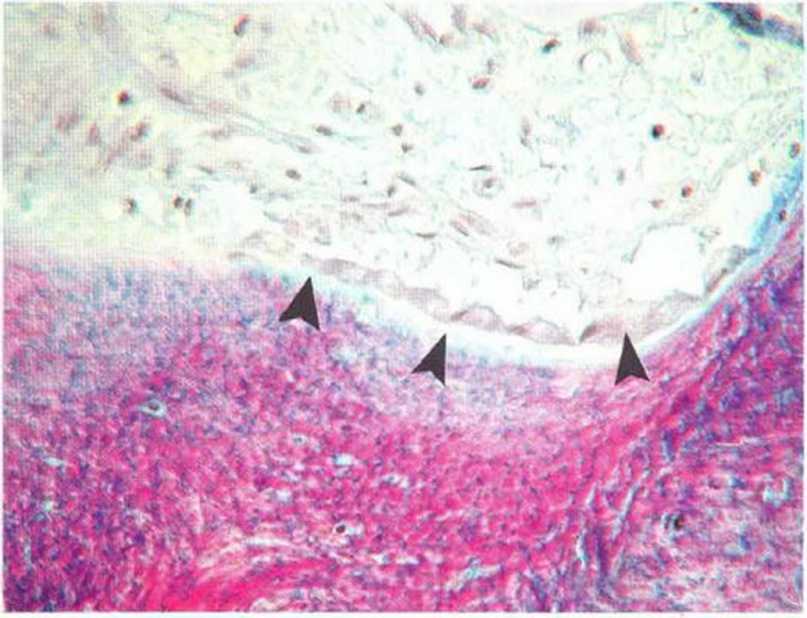
Рис. 1 -1 b Типичные остеобласты над новообразованным слоем остеоидной ткани (окраска трихромом по Массону)

Рис. 1-1 с. (а) слои остеобластов
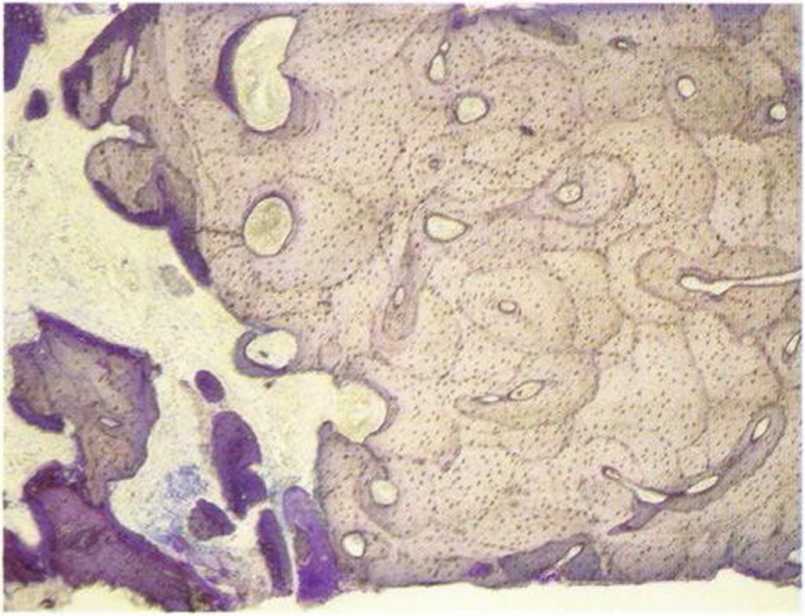
Рис. 1-1d. Многочисленные витальные отеоциты (окрашивание толуидиновым синим и основным фуксином)
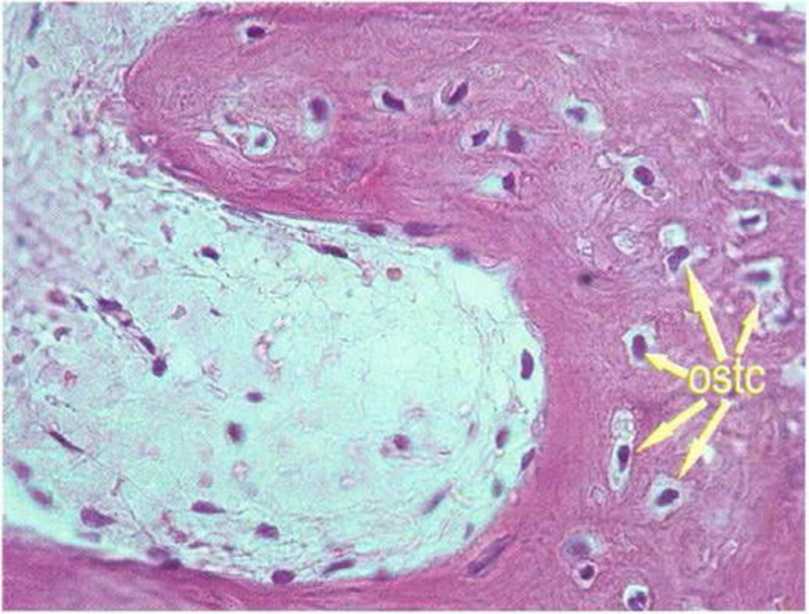
Рис. 1 -1 е. Многочисленные остеоны: остеоциты окружены очень плотной гаверсовой системой. Со временем просвет газерсовых каналов уменьшается в результате новообразования кости (окраска толуидиновым синим)
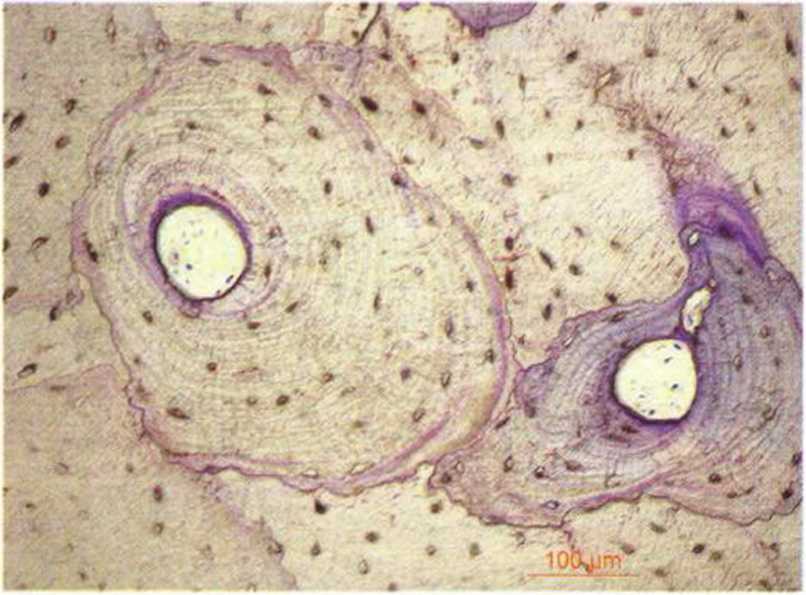
Рис. 1 -1 f. Фрагмент с рис. 1-1 е крупным планом
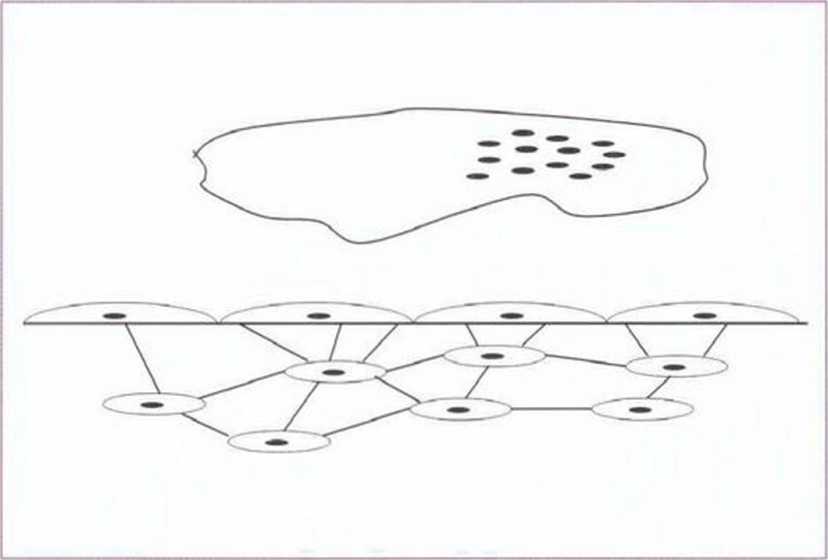
Рис. 1-2а. Схема метаболической костной единицы: выстилающие клетки кости на поверхности соединены с остеобластами. Активность остеокластов возможна только на костной поверхности, свободной от выстилающих клеток кости (по Martin,84 2008)
На поверхности кости располагаются плоские остеобласты, так называемые неподвижные остеобласты, или выстилающие клетки кости (bone lining cells) (рис. 1-2а). Они метаболически активны и наряду с этим осуществляют барьерную функцию, а также участвуют в ионном обмене между костью и окружающими тканями. Кроме того, остеобласты высвобождают медиаторы, которые вызывают сокращение неподвижных пограничных клеток и открывают костную поверхность для доступа остеокластов, одновременно стимулируя их резорбтив-ную активность (рис. 1-2а).
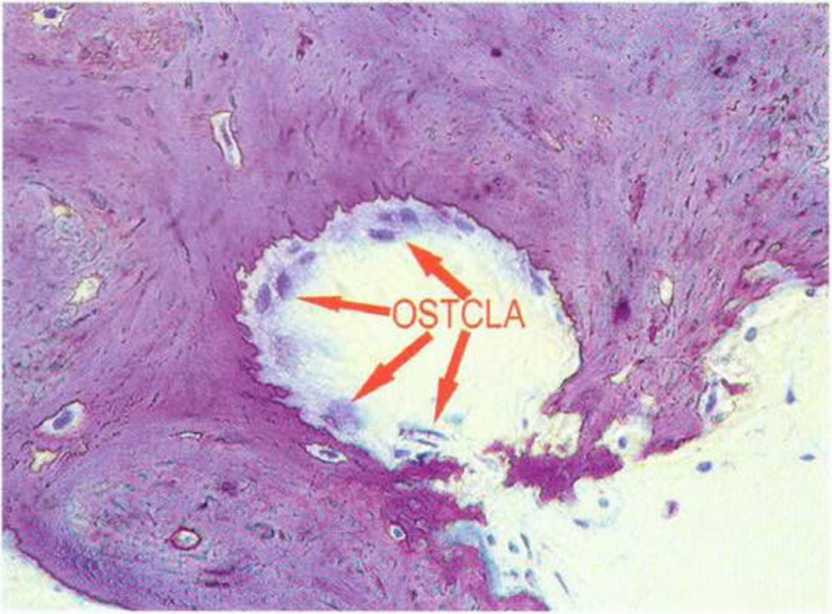
Рис. 1-2Ь. Остеокласты у резорбируемого участка кости
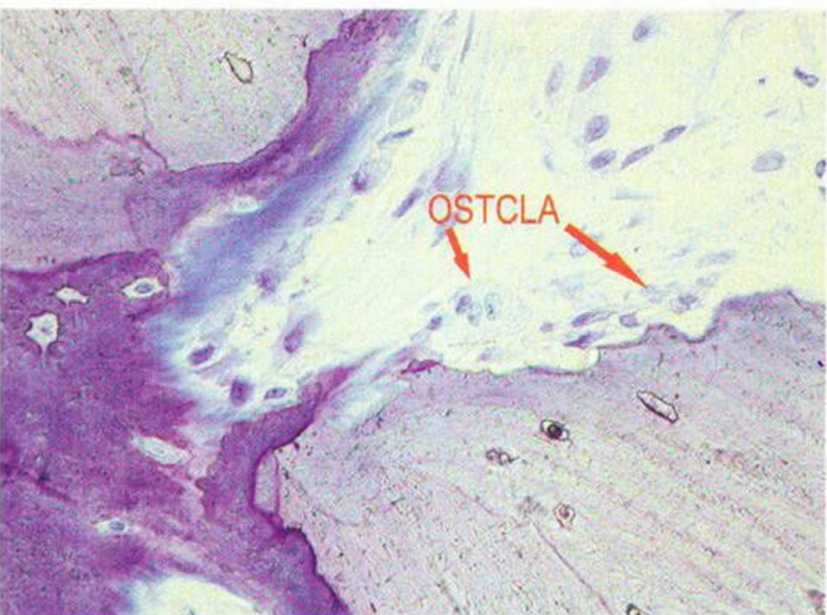
Рис. 1-2с. Многоядерные остеокласты (гистологические препараты на рис. 1-1 е—1-1 f, 1-2Ь и 1-2с предоставлены д-ром D. Moser и проф. R. Ewers, Венский университет)
В отличие от остеобластов остеокласты происходят не из мезенхимальных, а из гемопоэтических стволовых клеток, вероятно, из клеток-предше-ственников гранулоцитов-макрофагов.- Остеокласты образуют группу гигантских клеток, лизирующих минерализованных тканей (рис. 1-2Ь). Они находятся в твердых тканях в лакунах резорбции, так называемых гаушиповых лакунах, и отличаются положительной реакцией на кислую фосфатазу.Эти клетки размером 30-100 мкм содержат от 3 до 30 ядер (рис. 1 -2с). В ацидофильной цитоплазме расположены вакуоли, свидетельствующие о высокой литической активности.
Краевая область остеокласта (прозрачная зона) располагается рядом с минерализованной тканью. В центральной части поверхность гигантской клетки увеличена за счет так называемого фестончатого края (ruffled border), который образуется в результате инвагинации клеточной мембраны. На этой поверхности высвобождаются протоны, повышающие кислотность, что ведет к растворению твердых тканей. Открытые после растворения гидроксиапатита коллагеновые волокна затем расщепляются лизосомальными ферментами и колла-геназами.
Дифференциация остеокластов идет двумя путями. Первый зависит от взаимодействия с остеобластами и объясняет взаимосвязь процессов убыли и новообразования кости, которые происходят при физиологическом ремоделировании костной ткани. Второй вариант регулируется цитокинами, высвобождающимися при воспалении или травме, и связан с убылью костной ткани при патологических процессах. В полости рта особое значение имеют такие медиаторы воспаления, как интерлейкин-1 (IL-1) и фактор некроза опухолей-альфа (TNF-a).-- Есть данные, что у некоторых людей в ответ на действие ряда раздражителей происходит активное высвобождение этих медиаторов, что ускоряет резорбцию костной ткани.
В генетике и биологии развития выделяют три основных этапа образования и перестройки кости (Nefussi).
1) Клеточная концентрация, т.е. накопление и созревание клеточных масс, которые инициируют образование скелетной матрицы.
2) Активация и регуляция генов, ответственных за дифференциацию клеток.
3) Активация генов, регулирующих синтез и минерализацию матрицы, гормональную активность, а также адаптацию к нагрузке через ремоделирование.
Все три этапа проходят при участии специфических факторов транскрипции, которые активируют или блокируют определенные гены. После завершения костеобразования некоторые из этих механизмов также активируются при заживлении костной тка
Клеточной концентрацией называется индуцированное пространственно зависимыми факторами транскрипции и роста сосредоточение клеток в общую массу, что ведет к устранению костного дефекта. Такая концентрация возникает в результате любого травматического воздействия и приводит к воспалению или дегенерации (рис. 1-3). Успешное завершение регенерации требует достаточной степени и объема агломерации клеточной массы. Несоответствие последней величине дефекта ведет к убыли костной ткани.
На втором этапе локальные, местно специфические сигнальные молекулы клеточной конденсации регулируют взаимодействие между клетками и клеточным матриксом и обеспечивают остеогенную дифференциацию клеточной массы. Дифференцирование клетки заключается в ее окончательном созревании и приобретении полноценной функциональной активности. Благодаря этому процессу возникают описанные выше типы клеток -остеобласты (остеоциты) и остеокласты.
В процессе роста и заживления костной ткани остеобласты синтезируют коллаген, протеогли-каны и гликопротеины, которые во внеклеточном пространстве образуют специфическую четвертичную структуру. В дальнейшем этот матрикс подвергается минерализации. В особых секреторных везикулах остеоцитов начинается внутриклеточная аккумуляция кальция и фосфата, которые затем активно высвобождаются. В везикулах образуются апатитовые кристаллы, после выделения откладывающиеся во внеклеточных центрах минерализации (преимущественно коллагеновые волокна и
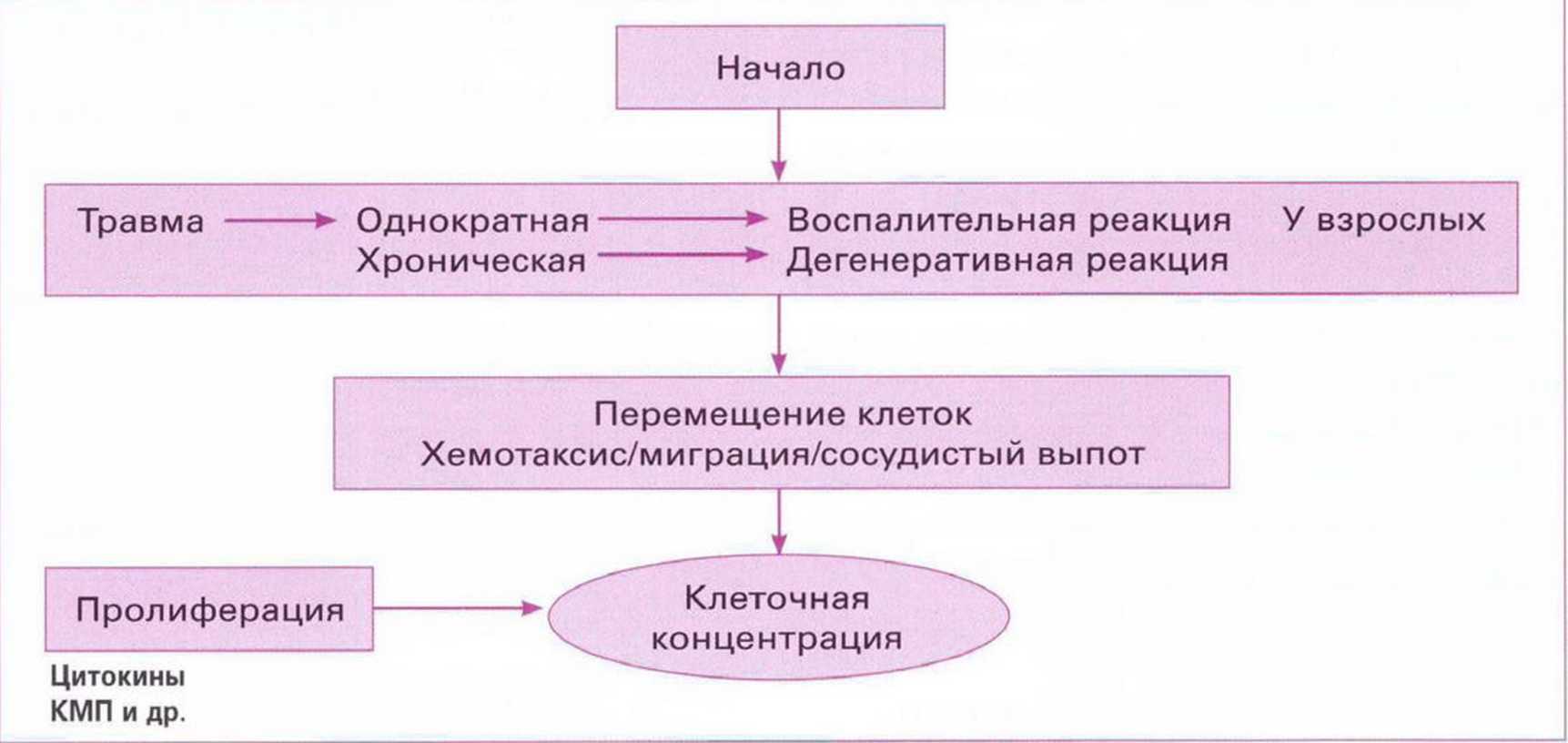
Рис. 1-3. Основные этапы клеточной концентрации (по Nefussi," 2007)
костноспецифические кальцийсвязывающие белки). В зоне минерализации отмечается повышенная активность щелочной фосфатазы остеоцитов. При отсутствии этого фермента костеобразование нарушается. После завершения минерализации кость состоит на 65 % из неорганического вещества (главным образом гидроксиапатита, а также магния, калия, хлора, железа и карбоната), на 25 % из органического вещества и на 10 % из воды. Органическая матрица состоит из коллагена I типа (90 %), а также неколлагеновых белков (остеонек-тин, остеокальцин, сиалопротеин и др.) и липидов (10%).
Дефицит объема костной ткани может быть обусловлен генетическими или местными факторами."
Генетические факторы оказывают влияние на разных стадиях костного роста, подавляя активность местно специфических сигнальных молекул и (или) факторов транскрипции. В таком случае характерно образование генерализованных дефектов, причем дисгармония роста отделэных костных сегментов частично компенсируется благодаря адаптации.
Например, травма в детском возрасте головки мыщелкового отростка нижней челюсти с ограничением функции приводит к альвеолярной адаптации на стороне поражения и уменьшению объема костной ткани на противоположной стороне. Микродентия также сопровождается недостаточно активным ростом зубоальвеолярного комплекса и последовательной потерей объема альвеолярной кости. В подобных случаях у взрослсго пациента отсутствует достаточный объем кости для установки имплантатов (рис. 1 -4а - 1-4е).
Рис. 1 -4а-1 -4е. Пациентка с гиподонтией. Агенезия зубов 11-15, 22, 23, 25, 32, 41-43 и 47 является причиной значительного дефицита альвеолярной кости
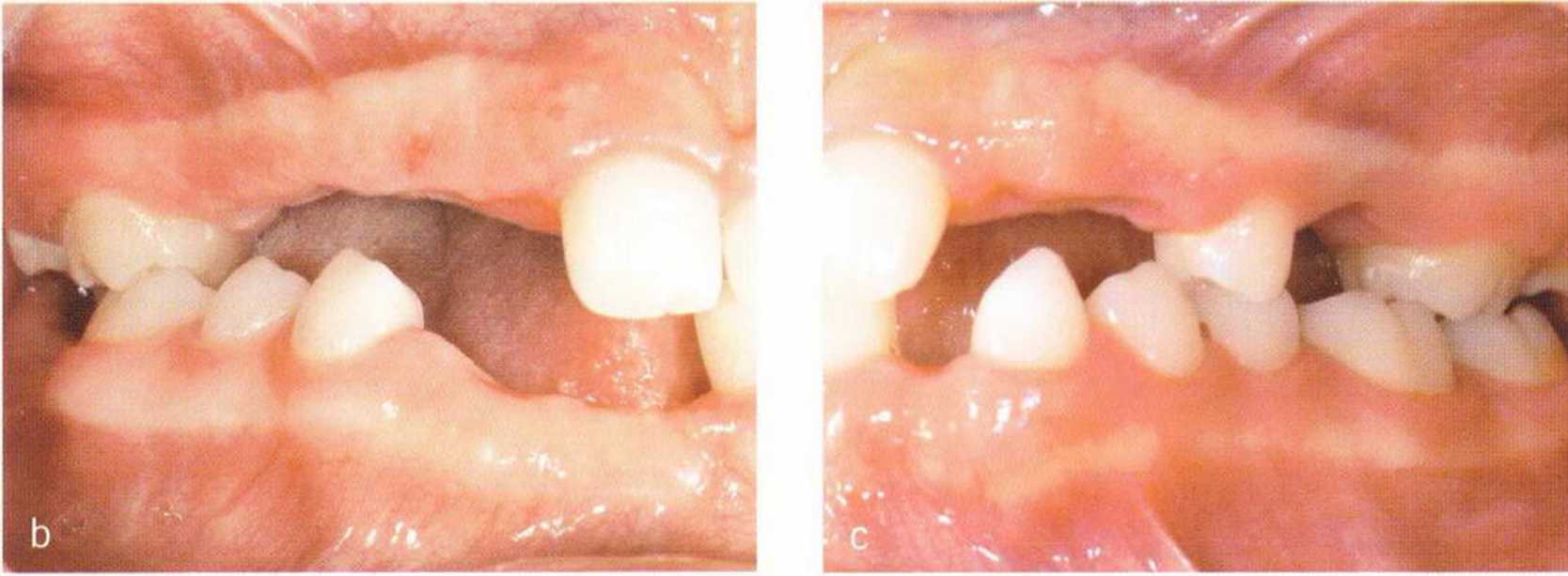
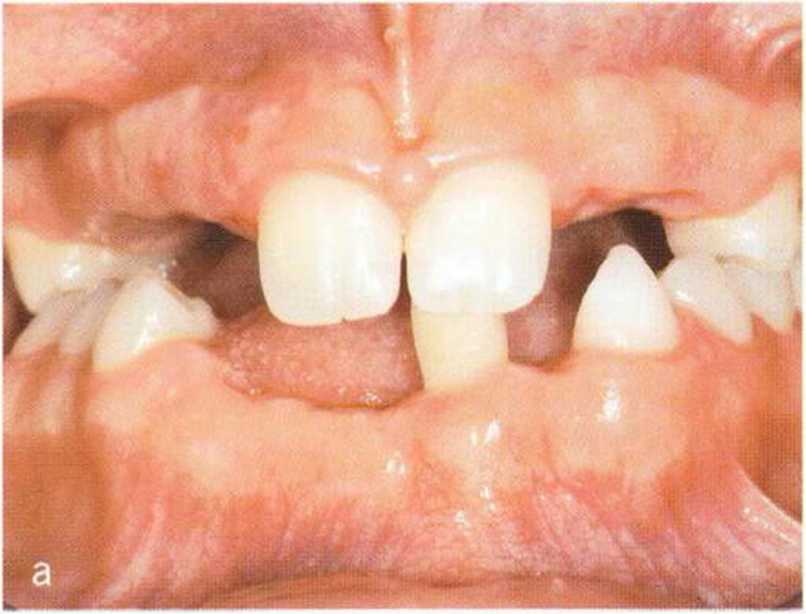
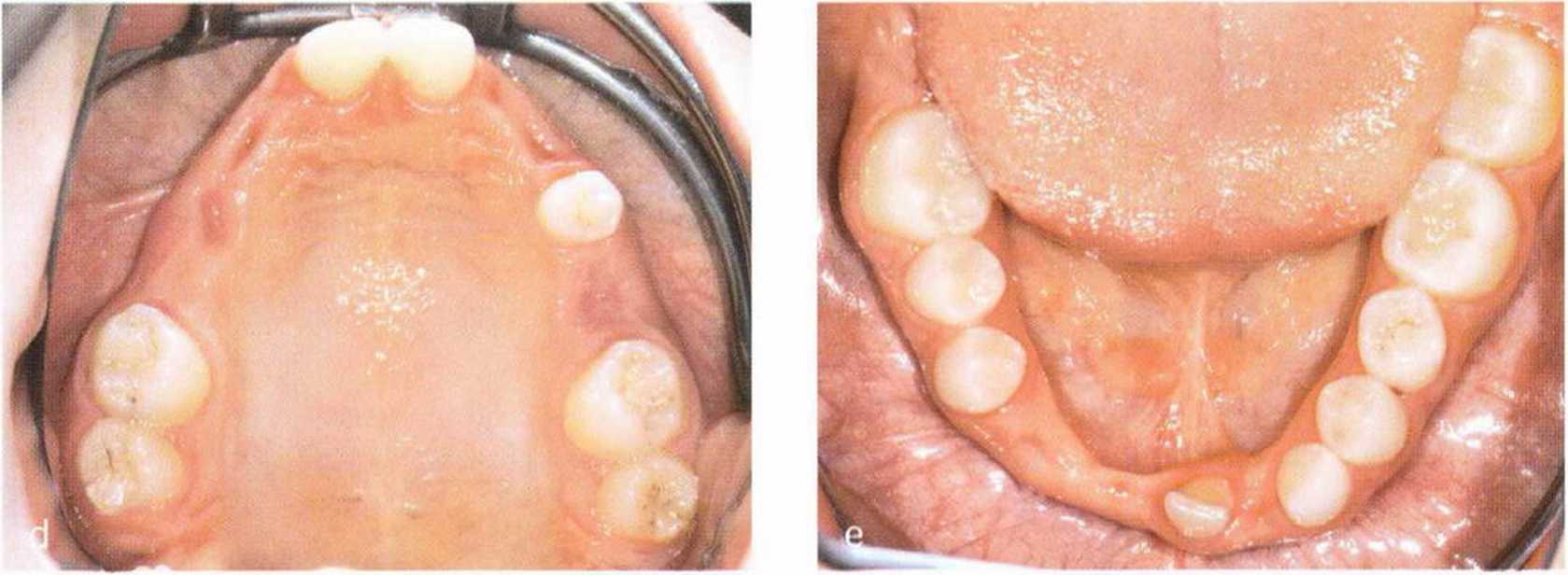

Рис. 1-5а и 1-5Ь. Полное отсутствие зубов верхней и нижней челюстей. Пациентка несколько десятков лет пользовалась съемными зубными протезами, что усугубило атрофию костной ткани
Нарушения на этапе развития зуба приводят к местному дефициту костной ткани. Это подтверждает гипотезу о том, что рост зуба предопределяет высоту и объем альвеолярной кости. При полной утрате зубов отсутствие нагрузки на растяжение и сжатие приводит к деструкции альвеолярной кости до уровня базальной части нижней или верхней челюсти (рис. 1-5а и 1-5Ы.
Убыль альвеолярной кости после утраты зуба является уникальным процессом для скелетной системы в целом. Во всех других костях скелета при отсутствии функции происходит деминерализация в форме остеопороза без какого-либо изменения внешних контуров кости. Иными словами, кортикальный каркас сохраняется на фоне уменьшения губчатой костной структуры. Однако в альвеолярной кости при отсутствии функции отмечается отчасти полная инволюция. В процессе функциональной активности окклюзионная нагрузка передается на альвеолярную кость в форме натяжения и сжатия, что приводит к периостальному аппозиционному росту кости, а при утрате функции происходит периостальная резорбция (рис. 1 -6а—1 -6с).
После утраты тканей вследствие травмы или заболевания начинается восстановительная регенерация. Опорные ткани имеют разную способность к восстановлению. В частности, хрящи не регенерируют, в то время как соединительная ткань отличается хорошей способностью к заживлению, которое, однако, характеризуется рубцеванием, причем новообразованная соединительная ткань по своим свойствам уступает первоначальной.
Единственной в своем роде способностью к полному восстановлению и регенерации обладает кость.
В определенной степени возможно полное восстановление (restitutio ad integrum), но для этого помимо механической стабильности прежде всего необходимо хорошее кровоснабжение.
Заживление альвеолярной кости имеет некоторые особенности, по сравнению с остальным скелетом. В отличие от скелетной костной ткани, регенерация в мелких очагах в альвеолярной кости также происходит с уменьшением объема. При этом заживление костной ткани в области лунки удаленного зуба нужно рассматривать отдельно, учитывая особый характер травмы.
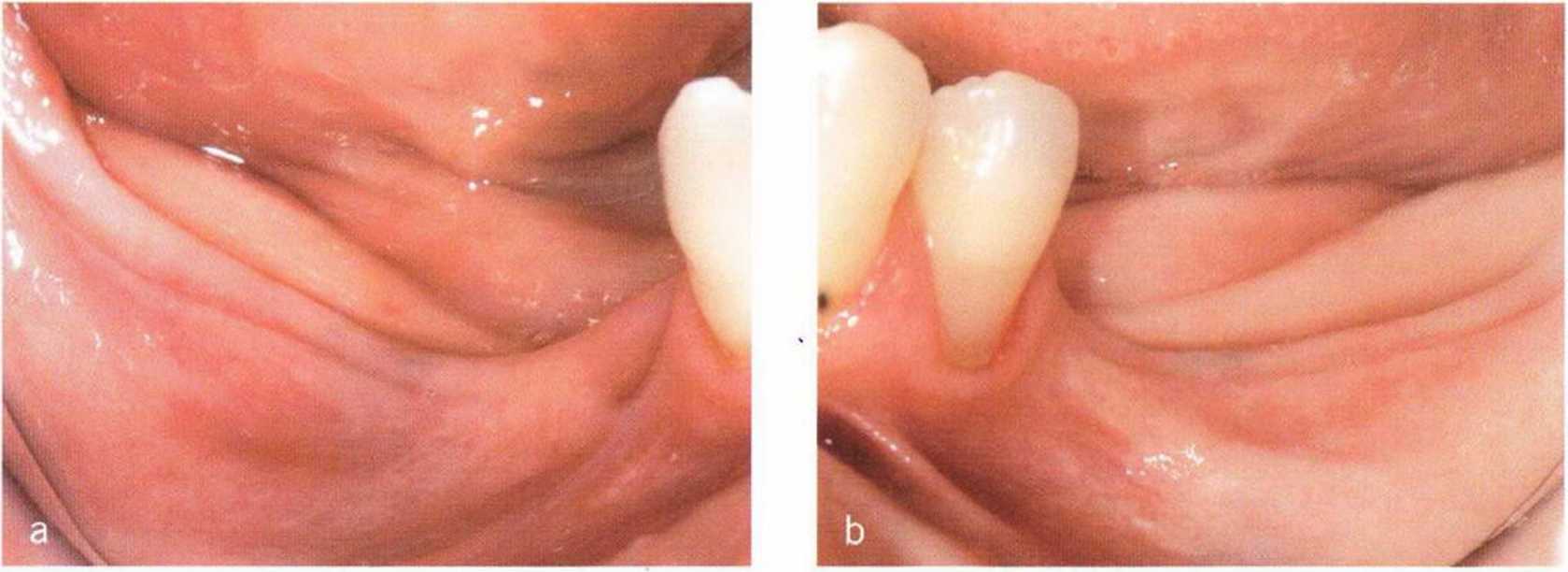
Рис. 1-6а-1-6с. Значительное уменьшение толщины и высоты альвеолярной кости нижней челюсти вследствие потери жевательных зубов
Этапы и каскады заживления костной ткани взрослого человека аналогичны процессу костеобразования (рис. 1-7). Частичное повреждение кровеносных сосудов при травме приводит к клеточному некрозу вследствие гипоксии, недостаточного поступления питательных веществ, нарушения обмена веществ и повышения кислотности. Из прилегающих к ране сосудов в нее высвобождаются клетки крови (тромбоциты, эритроциты, лейкоциты и макрофаги), которые вместе с продуктами плазмы образуют сгусток крови, что обеспечивает первичный гемостаз и защиту раны. Клетки крови повышают активность многочисленных цитокинов, в том числе PDGF, TGF-|3, IL-1, IL-6, FGFR-1, FGFR-2,.
FGF-1, FGF-2, ВМР-2-ВМР-7, TNF-a. Заживление поврежденных тканей продолжается благодаря взаимодействию этих цитокинов и факторов роста, которые должны находиться в ране в нужной концентрации и в определенное время. В результате хемотаксиса в рану привлекаются клетки крови и стволовые клетки опорной ткани, активируя определенные обменные процессы. Происходит образование грануляционной ткани, новообразование сосудов, организация сгустка крови и замещение опорной тканью.
Функциональная адаптация кости представляет собой сложный многофакторный процесс, который определяет кортикальную и трабекулярную структуру кортикального и губчатого слоев. Морфологические особенности кости формируются в результате ее адаптации к натяжению и сжатию. Любое.
изменение этих двух факторов вызывает реакцию клеток надкостницы и эндоста и инициирует ремоделирование кости. Первичное заживление после повреждения сначала происходит беспорядочно и без адаптации трабекулярных и кортикальных структур к функциональной нагрузке кости. Благодаря функциональным процессам натяжения и сжатия, которые посредством зубов передаются на альвеолярную кость, например при жевании и кусании, кость вторично реструктурируется. Определяющими для костной морфологии (толщина кортикального слоя, количество и толщина трабекул, ориентация остеонов) являются интенсивность и частота натяжения и сжатия.
Заживление кортикальной кости зависит от размера дефекта. Дефекты, которые не превышают размер остеона (0,2 мм), концентрически заполняются пластинчатой костью. В дефектах несколько большего размера вначале образуется каркас из перепончатой ретикулофиброзной кости, а в межтрабекулярных пространствах откладывается пластинчатая кость. Перепончатая ретикулофиброз-ная кость, в отличие от пластинчатой, за короткий промежуток времени способна заполнять дефекты размером до 1 мм. Этот параметр называется «длина скачка» (jumping distance) и играет важную роль при немедленной имплантации.’ Для полного заживления костной ткани в более крупных дефектах требуется больше времени. Полная оссификация дефектов размером более 3-5 мм продолжается несколько месяцев.
Отметим, что полное заполнение дефекта не означает завершение регенерации. Новообразованная кость кажется компактной, но еще не имеет прочности нативной пластинчатой кости. За счет ремоделирования гаверсовой системы происходит дальнейшая трансформация, при которой первичные остеоны замещаются вторичными.

Рис. 1-7. Костная регенерация: сложный каскад различных факторов (из учебников по стоматологии и имплантологии Мюнстерского университета)
Процесс заживления лунки удаленного зуба включает в себя определенные стадии.- В течение первых 3 дней после удаления альвеола заполняется кровяным сгустком, края которого окружены воспалительными клетками, прежде всего нейтро-фильными гранулоцитами. Через 3 дня начинаются организация сгустка и его замещение, сначала с базальной стороны богато васкуляризованной грануляционной тканью. В центральной части сгуст-.
ка происходит лизис эритроцитов. Спустя 7 дней оставшиеся волокна периодонта в значительной степени уже растворены. Содержимое альвеолы составляют новообразованные сосуды, различные лейкоциты, мезенхимальные клетки и коллагеновые волокна. В центральной части определяются зоны некроза. В области костного мозга находятся остеокласты, ускоряющие ремоделирование кости. Через 14 дней в альвеоле появляется первая твердая ткань, т.е. перепончатая ретикулофиброз-ная кость, которая находится в контакте с костным мозгом прилегающей альвеолярной кости.
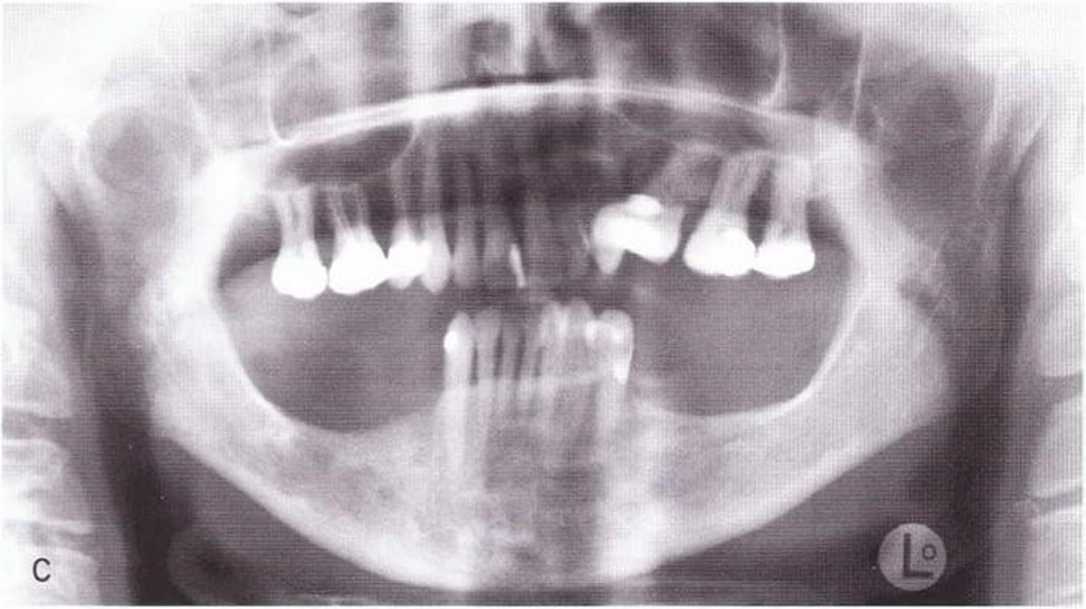
Уже по прошествии 30 дней определяются первые остеоны пластинчатой кости, связанные с интактной костью альвеолы, а основная часть альвеолы еще представлена фиброзной тканью, покрытой слоем эпителия. Через 60-90 дней появляется твердотканный мостик из перепончатой ретику-лофиброзной кости, под которой уже образовался новый костный мозг. Этот мостик спустя 120-180 дней замещается пластинчатой костью. Нужно помнить, что в процессе ремоделирования ширина и высота альвеолярной кости уменьшаются уже в первые 2 мес после удаления зуба (рис. 1-8).
Процесс заживления сопровождается убылью кости в двух случаях: при дефиците исходного материала для новообразования ткани и при отсутствии внешних стенок. В первом случае пространство, подлежащее заполнению, определяется внешними стенками, однако клетки недостаточно активны, или их количество ограничено. Во втором случае новообразование кости ограничено из-за более быстрого роста мягких тканей и нестабильности кровяного сгустка. Следовательно, любая потеря наружного кортикального слоя влечет за собой убыль кости, в то время как утрата внутренних стенок, например межкорневой перегородки, таких последствий не имеет. Таким образом, надкостничный барьер играет ключевую роль в костном заживлении. Поверхность надкостницы является местно специфической сигнальной областью, а стволовым клеткам остеобластного типа необходимо поддержание постоянного объема для восстановления оригинальной анатомической структуры. Из этого следует, что при потере наружного кортикального слоя и надкостницы прекращается поступление важных сигналов для новообразования кости, однако в случае отсутствия пространственной стабильности убыль костной ткани происходит даже при сохранении надкостницы.
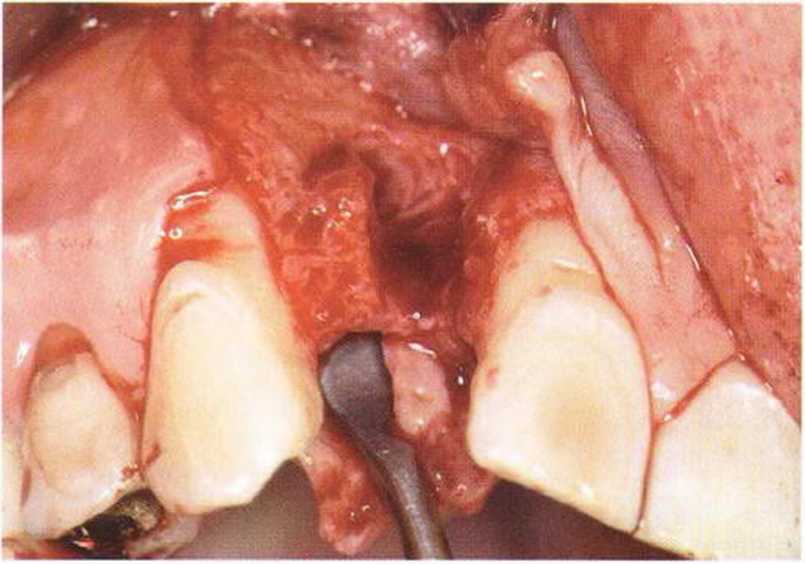
Рис. 1-8. Состояние альвеолярного отростка через 2 мес после удаления зуба: тонкая вестибулярная альвеолярная стенка полностью резорбировалась.
.
1.6 Биологическое значение заживления костной ткани для разных методик костной регенерации.
Как уже отмечалось, кость обладает высокой регенеративной способностью, но полноценной регенерации могут препятствовать следующие факторы:.
• недостаточное кровоснабжение;.
• отсутствие механической стабильности;.
• очень большой размер дефекта;.
• конкуренция с тканями, которые быстро регенерируют.
Остео-. кондуктивные | Остео-. индуктивные | Остеогенные | |
Аутогенная кость | X | X | X |
Аллогенный костный материал | X | (X) | |
Ксеногенный костный материал | X | (X?) | |
Аллопластиче-ский костный материал | X |
Рис. 1-9 Подразделение материалов для трансплантации с учетом их свойств
Для регенерации альвеолярной кости разработаны разные методы, основанные на трех принципиальных формах восстановления костной ткани: остео-кондукция, остеоиндукция и остеогенез.--
Заполнение костной тканью протяженных дефектов осуществляется в процессе остеокондукции, т.е. формирования матрицы или каркаса, на котором костные клетки откладывают новообразованную кость (рис. 1-9).
Остеокондуктивный материал должен быть биоинертным и биоактивным, а структура и размер его пор должны способствовать врастанию ткани и аппозиционному росту кости. Кроме того, необходимо, чтобы такой материал полностью резорбиро-вался и замещался новообразованной костью. Из биологических материалов требованиям к структуре и размеру пор лучше всего соответствует губчатая кость, которая обладает одновременно биоактивным и остеогенным потенциалом.
Остеогенез требует пересадки аутогенного трансплантата, включающего в себя естественные костные клетки, которые способны образовать новую кость. Большое значение при этом имеет минимальная травматичность манипуляции для сохранения жизнеспособности клеток, содержащихся в трансплантате. Синтетические костные материалы не имеют в своем составе костных клеток, а немедленная пересадка аллогенных трансплантатов не проводится из-за высокого риска иммунных и инфекционных осложнений.
Аутогенная кость также обладает остеоиндук-тивной способностью, т.е. стимулирует костные и недифференцированные мезенхимальные клетки принимающего участка к делению, дифференцированию и секреции, что способствует синтезу новой кости. Среди медиаторов особое значение имеют костные морфогенетические протеины (КМП).
Под их влиянием полипотентные мезенхимальные стволовые клетки вокруг трансплантата дифференцируются в костеобразующие клетки.’ КМП оказывают схожее действие у разных биологических видов и сохраняют свою активность в некоторых ксеногенных трансплантатах.
Таким образом, аутогенная кость может считаться идеальным материалом для транспланта-ции-’”” и обладает одновременно остеокон-дуктивными, остеоиндуктивными и остеогенными свойствами. К ее важным преимуществам относятся также отсутствие иммунологических реакций и полная трансформация аутогенного трансплантата в окружающую костную ткань.
Аллогенные материалы обладают остеокондук-тивным и потенциально остеоиндуктивным действием, однако при их использовании сохраняется (хотя и крайне низкий) риск иммунологических реакций и переноса инфекционных заболеваний.Кроме того, следует учитывать, что остеоиндук-тивный потенциал аллогенных трансплантатов зависит от возраста донора и методики обработки и стерилизации, а значит, может широко варьировать в разных партиях и у разных банков тканей (вплоть до полного отсутствия).
В большинстве случаев современные ксеногенные костные материалы представляют собой де-протеинизированную кость крупного рогатого скота. В настоящее время приводятся противоречивые данные относительно сохранности КМП в процессе обработки костного матрикса, поэтому для этих материалов характерно остеокондуктивное действие, но не исключается и остеоиндуктивное.
Требуемой остеокондуктивной активностью обладает ксеногенная кость, структура и пористость которой соответствуют кости человека. Однако при применении ксеногенных материалов также невозможно полностью исключить риск переноса инфекционных заболеваний. Большим недостатком данных материалов является медленный процесс или полное отсутствие резорбции и замещения естественной костью..
Аллопластические костные материалы искусственного и естественного происхождения отличают полное отсутствие риска инфицирования и высокая биосовместимость, но они характеризуются слабовыраженной остеокондуктивностью, а частицы таких материалов часто инкапсулируются соединительной тканью. Период до полной дегенерации может быть как очень коротким, так и продолжительным.
После удаления жевательных зубов верхней челюсти происходит уменьшение объема костной ткани за счет инволюции альвеолярного гребня, а также вследствие прогрессирующей пневматизации верхнечелюстной пазухи (рис. 1-10а). Верхнечелюстная “пазуха в период внутриутробного развития имеет очень малый объем, но после рождения непрерывно увеличивается и в пубертатный период достигает нормальных размеров. Как правило, верхнечелюстная пазуха образует отдельную полость с более или менее выраженными перегородками либо состоит из нескольких отдельных камер.-По мере взросления объем пазухи незначительно увеличивается и приобретает индивидуальную для каждого человека форму и размер. После утраты жевательных зубов верхней челюсти объем верхнечелюстной пазухи может сильно увеличиться, в некоторых случаях от полости рта ее отделяет лишь тонкая костная пластинка. Пневматизация пазухи является физиологическим состоянием, которое зависит от нагрузки на натяжение и сжатие, т.е. наличия или отсутствия зубов. Пазуха соединена с носовым ходом через естественное анатомическое отверстие и принимает участие в дыхании. При вдохе и выдохе происходят перепады давления, которые воздействуют на слизистую оболочку верхнечелюстной пазухи, стимулируя ре-зорбтивные процессы, что ведет к увеличению объема верхнечелюстной пазухи. При наличии зубов устойчивость к этим воздействиям сохраняется.
После утраты зубов возрастает влияние повышенного давления на эту область, состоящую преимущественно из губчатой кости, что может привести к значительной потере объема последней. По этой причине во многих случаях перед имплантацией в области жевательных зубов верхней челюсти показано увеличение объема костной ткани.
Регенеративные вмешательства в области верхнечелюстной пазухи основаны на уже известных принципах остеокондукции, остеоиндукции и остеогенеза. Наличие трехстеночной костной полости обеспечивает благоприятные условия для успешной регенерации кости благодаря аппозиционному росту. Феномен наблюдался у пациентов, которым в ходе радикальных операций на верхнечелюстной пазухе по Колдуэллу-Люку иссекали всю слизистую пазухи. На контрольных рентгенограммах через несколько лет отмечалась спонтанная оссифика-ция стенок верхнечелюстной пазухи (рис. 1 -1 ОЬ).
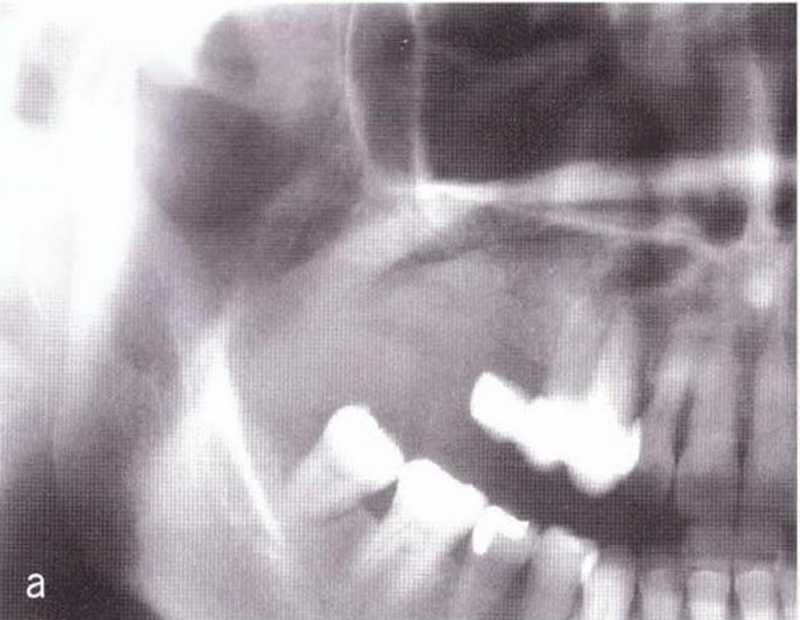
Рис. 1-10а. Прогрессирующая пневматизация верхнечелюстной пазухи после удаления жевательных зубов верхней челюсти справа
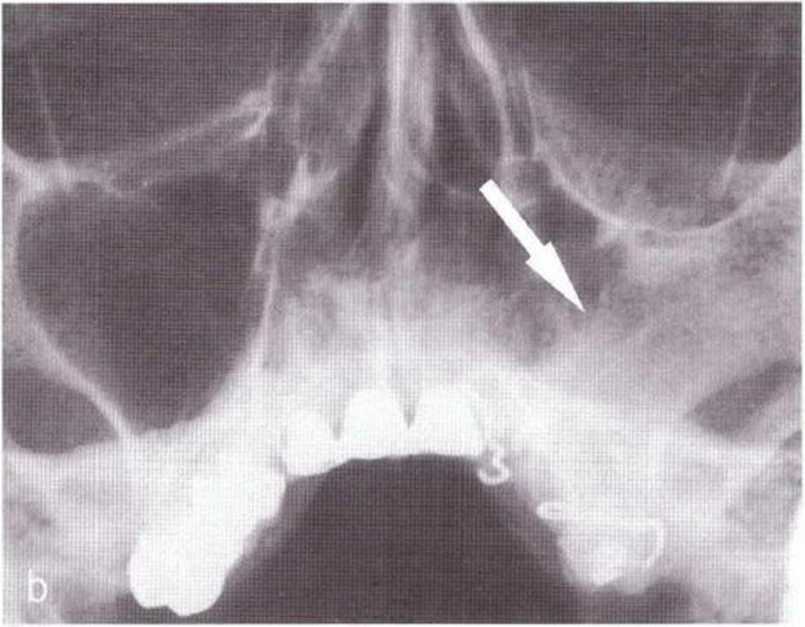
Рис. 1-1ОЬ. Рентгенограмма придаточных пазух носа через 10 лет после радикальной операции на верхнечелюстной пазухе по Колдуэллу-Люку: типичная оссифихация в области оперированной пазухи
Хирургические этапы будут подробно обсуждены ниже. Принципиально различают два метода. При увеличении объема на небольшом участке через подготовленный костный канал (или ложе имплантата) отслаивают слизистую оболочку верхнечелюстной пазухи. Такая методика называется закрытым синус-лифтингом (рис. 1-11а-1-11с).-’При этом небольшое количество костного или ал-лопластического материала вводится с помощью остеотома вокруг имплантата под слизистую оболочку пазухи. В качестве альтернативы слизистую сначала отслаивают остеотомом и затем приподнимают имплантатом, придавая ей форму шатра. Под слизистой вокруг имплантата образуется сгусток крови, который в дальнейшем может оссифицироваться.
При более обширных вмешательствах для введения аутогенного или аллопластического материала требуется латеральный доступ к верхнечелюстной пазухе, т.е. проводится открытый синус-лифтинг.При таких операциях имплантацию выполняют одно- или двухэтапно (рис. 1-12а и 1-126). Применяемая в данном случае измельченная аутогенная кость оказывает остеокондуктивное, остеоиндук-тивное и остеогенное действие, что позволяет считать ее золотым стандартом. При недостатке аутогенной кости добавляют аллопластический материал, обладающий как минимум остеокондуктив-ными свойствами. Конечный результат зависит от применяемых аллопластических материалов и их количества.- Благоприятным условием для применения таких материалов является стабильное пространство пазухи, ограниченное хотя бы тремя костными стенками (рис. 1 -1 За). В идеале аллопластический материал должен полностью заместиться аутогенной костью, однако не все материалы удовлетворяют этому требованию.-Материалы должны сохранять стабильность как минимум до завершения костной регенерации, в противном случае ее объем уменьшается. При синус-лифтинге следует гомнить об остеокласти-ческой активности слизистой верхнечелюстной пазухи, что может привести к постепенной резорбции новообразованной костной ткани. Для уменьшения выраженности данного эффекта костный материал рекомендуется помещать в пазуху в форме не гомогенной смеси с аутогенной костью, а как барьер между слизистой оболочкой и аутогенной костной стружкой, окружающей имплантат.
Дополнительное преимущество такой сэндвичной методики заключается в том, что имплантаты окру-жены только аутогенной костью. Это повышает эффективность регенерации и остеоинтеграции (рис. 1 -1ЗЬ—1 -1 Зд).
1.6 Биологическое значение заживления костной ткани для разных методик костной регенерации

Рис. 1 -11 а Рентгенограмма до лечения: значительное уменьшение высоты альвеолярного отростка верхней челюсти в области жевательных зубов
Рис. 1 -11Ь. Закрытый синус-лифтинг при имплантации в области зубов 15, 17, 25 и 27. Слизистая оболочка верхнечелюстной пазухи отслоена через костные каналы с помощью конденсаторов
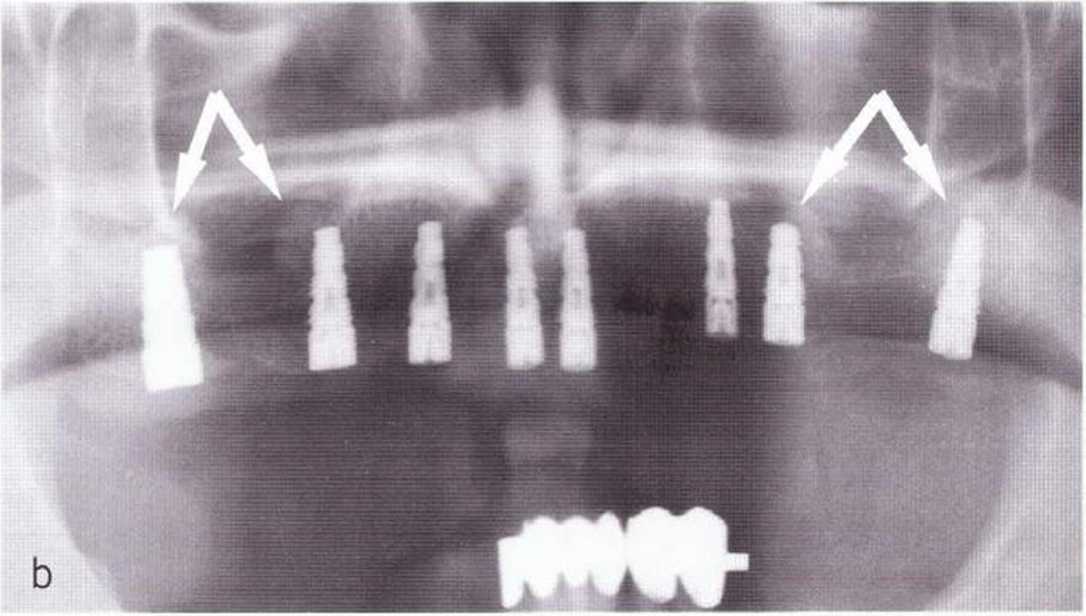
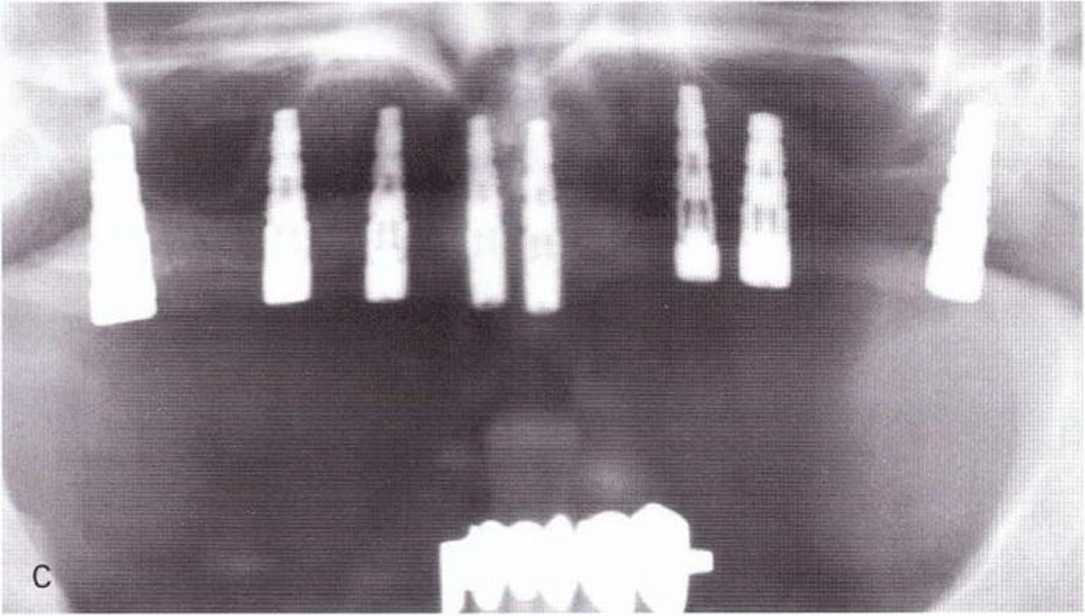
Рис. 1-11с. На контрольной рентгенограмме через 4 мес после операции определяется хорошая оссификация на оперированных участках
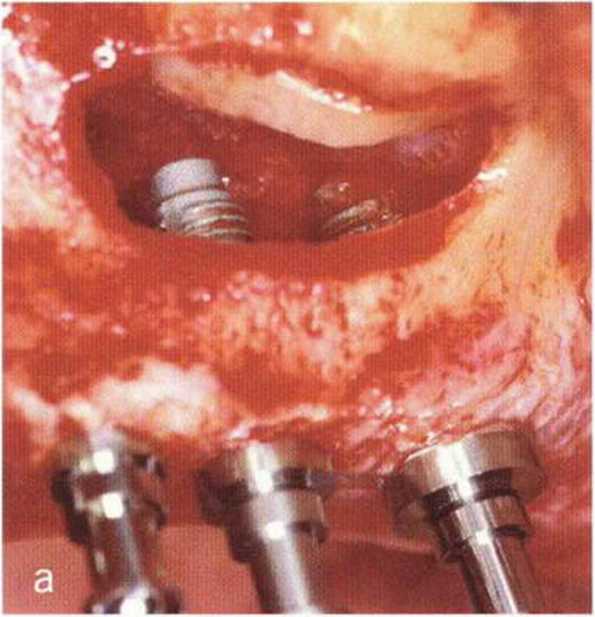
Рис. 1-12а. Открытый синус-лифтинг с одновременной имплантацией в области верхней челюсти слева. Установлено три имплантата Фриалит 2 (Дентсплай Фриадент; Frialit 2, Dentsply, Friadent)
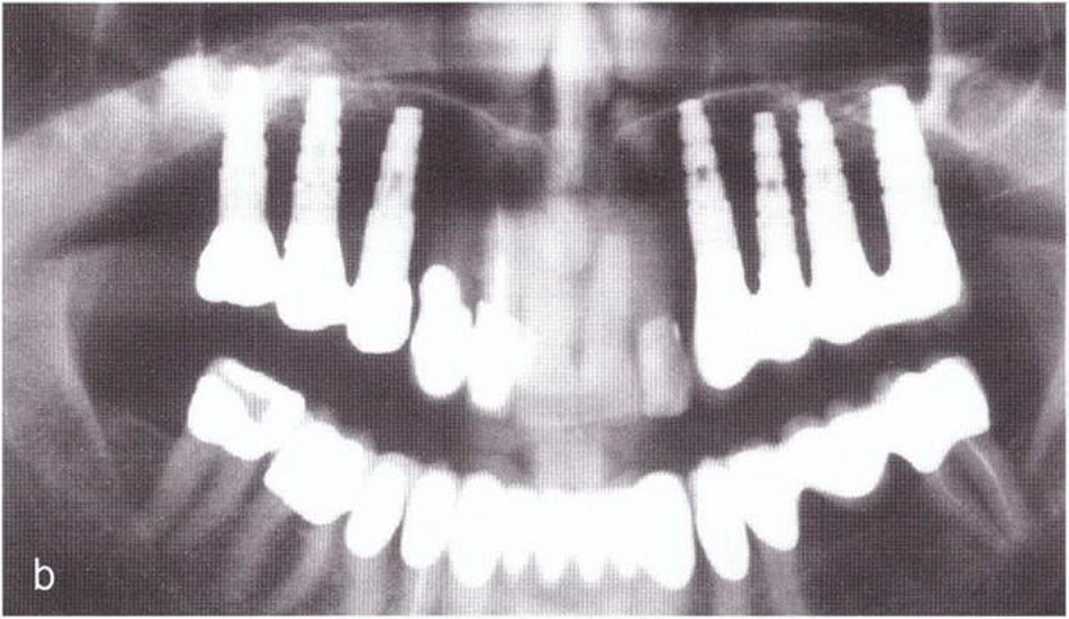
Рис. 1 -12b. Контрольная рентгенограмма через 10 лет после операции: на правой стороне также проведены увеличение объема костной ткани верхней челюсти и имплантация.
.
Имеющиеся в настоящее время научные данные позволяют считать синус-лифтинг эффективной регенеративной методикой, однако необходимо дополнительное изучение параметров механической стабильности и потенциала регенерации при использовании аллопластических материалов. При сравнении аутогенной кости и аллопластических материалов можно отметить следующее.
1. Костная регенерация происходит быстрее при пересадке аутогенной кости.
2.
При изменении соотношения в сторону аллопла-стического материала необходимо увеличить срок ожидания до установки и нагрузки имплантатов.
3.
Для стабилизации объема в области слизистой оболочки верхнечелюстной пазухи следует нанести тонкий слой плохо резорбируемого аллопла-стического материала.
Поданным гистоморфометрических исследований, интенсивность процессов регенерации и резорбции через 15-24 мес после трансплантации различных комбинаций костных материалов и аутогенной кости существенно не отличается. Стабильное трехмерное пространство является благоприятным анатомическим условием для синус-лифтинга и обеспечивает предсказуемую эффективность вмешательства по увеличению объема костной ткани с применением различных костных материалов.

Рис. 1-13а. Препарирование дна верхнечелюстной пазухи под визуальным контролем через костное окно для максимального сохранения костных стенок, что способствует быстрой регенерации кости. Одновременная имплантация с дополнительным увеличением высоты альвеолярного отростка
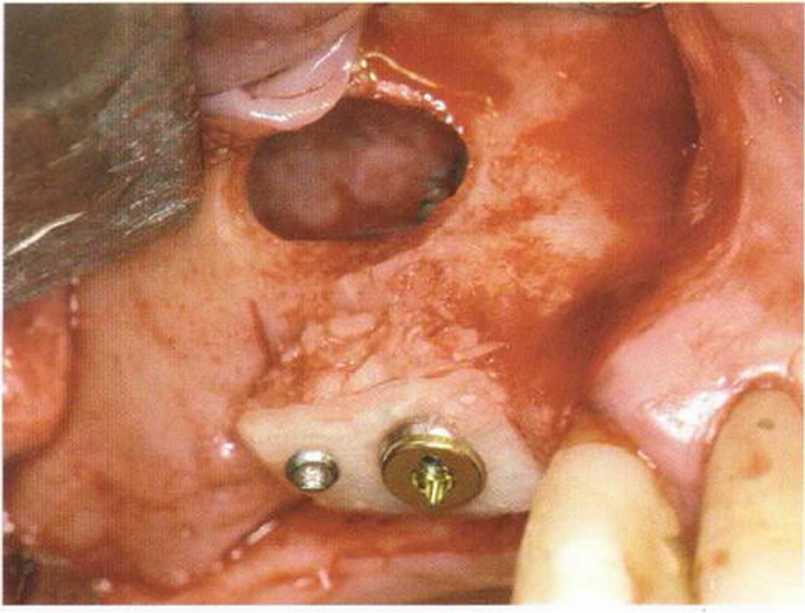
Рис. 1-13Ь. Имплантат в области зуба 15 полностью окружен аутогенной костью
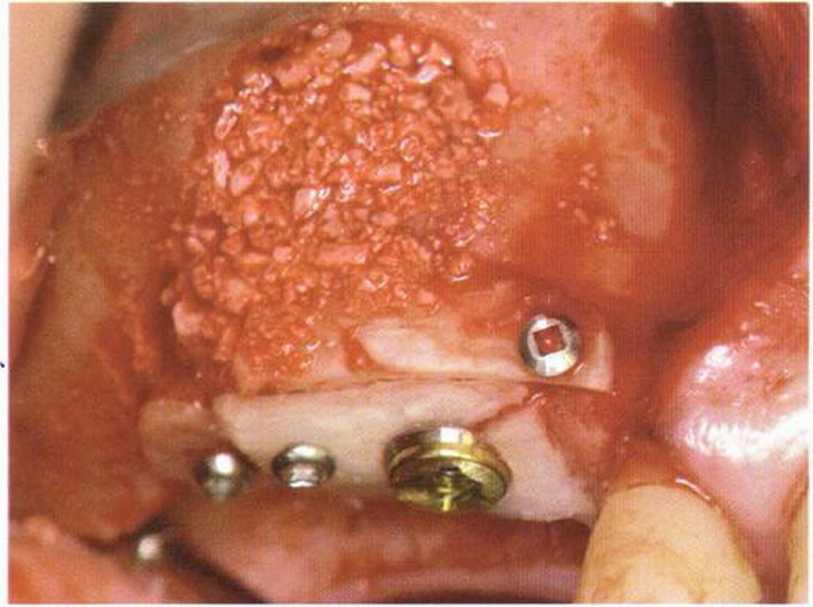
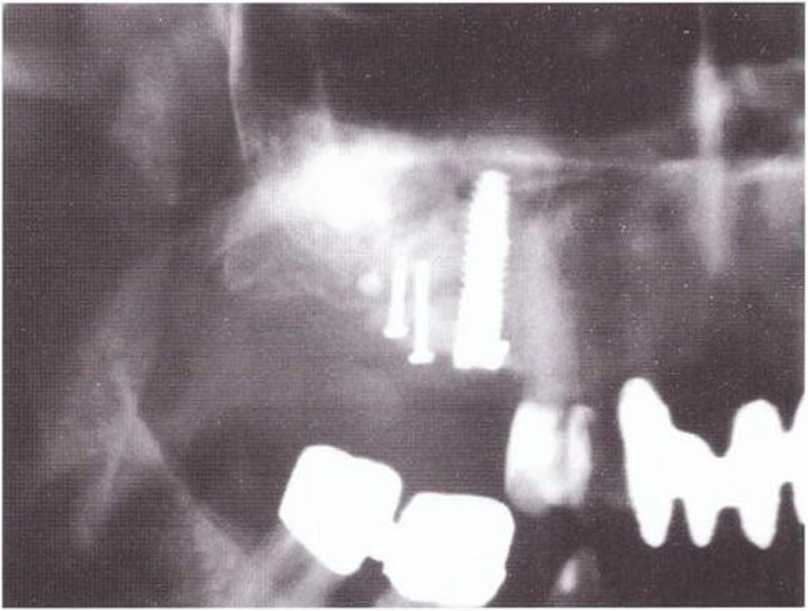
Рис. 1-13с. Послойное использование аутогенной кости и алло-пластического материала (методика сэндвича). Аллопластический материал в области слизистой верхнечелюстной пазухи формирует барьер, предотвращая резорбцию. Затем в пазуху помещают аутогенную кость. Костное окно также заполняют костным матери алом и покрыяают нерезорбируемой мембраной
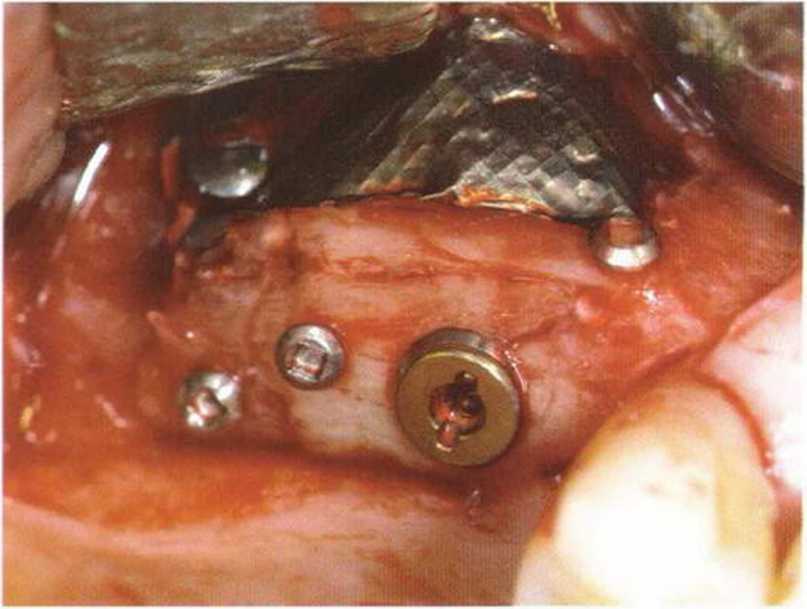
Рис. 1-13d. Рентгенограмма после операции
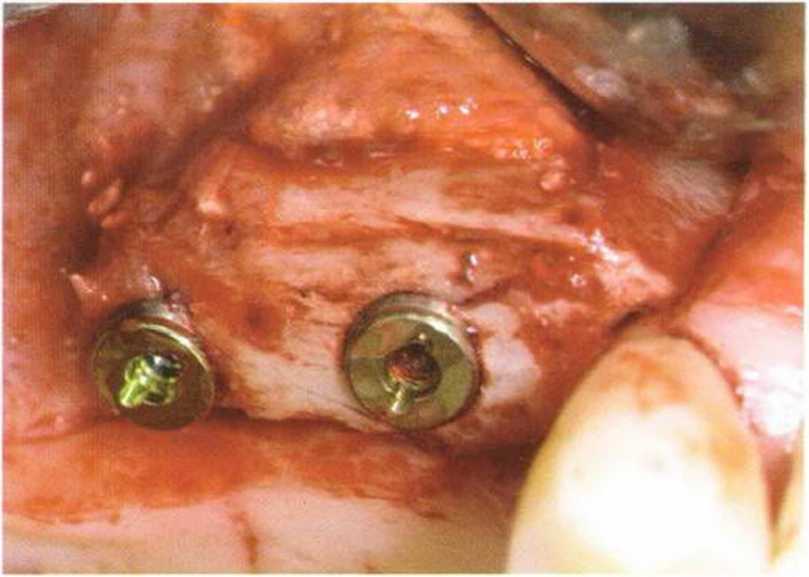
Рис. 1-13е. Клиническая ситуация через 4 мес после операции: на завершающем этапе операции костное окно в пазухе закрыли титановой фольгой
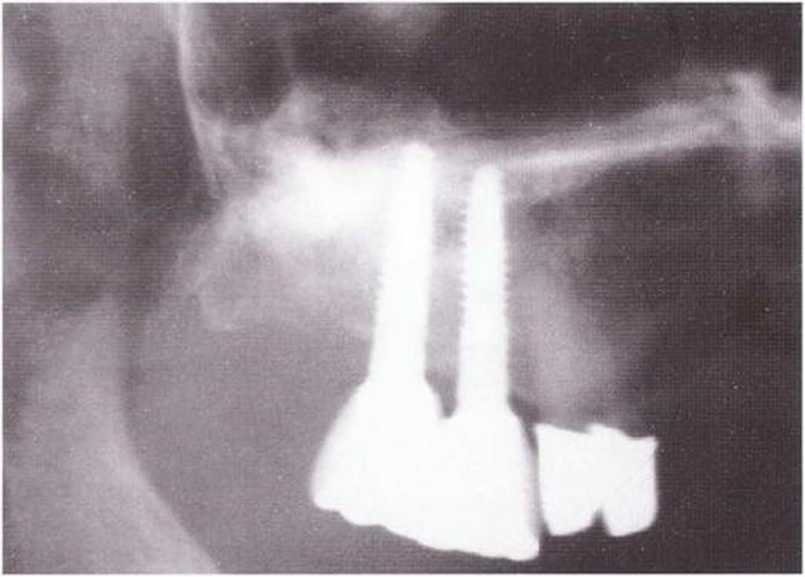
Рис. 1-1 Зд. Контрольная рентгенограмма через 6 лет после операции
Рис. 1-13f. В новообразованной кости установлен второй имплантат
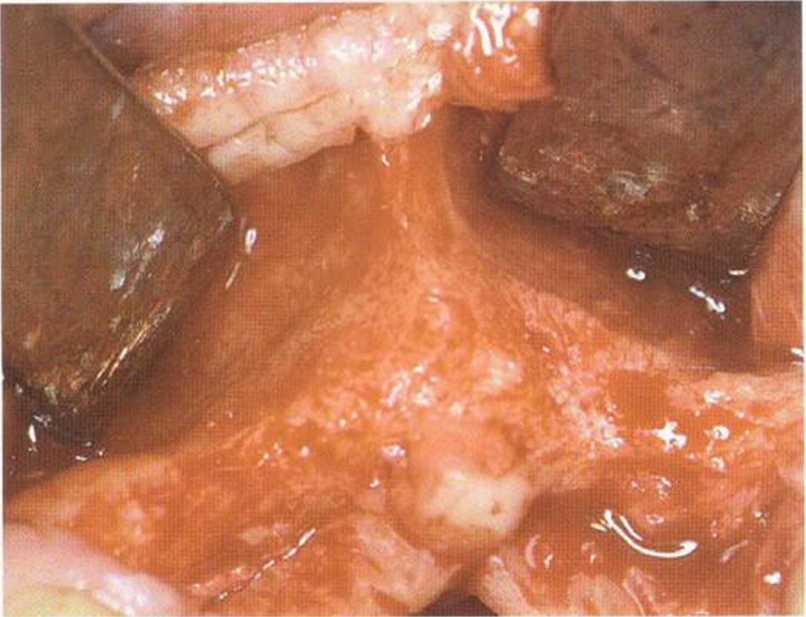
Рис. 1-14а. Атрофия костной ткани в переднем отделе верхней челюсти
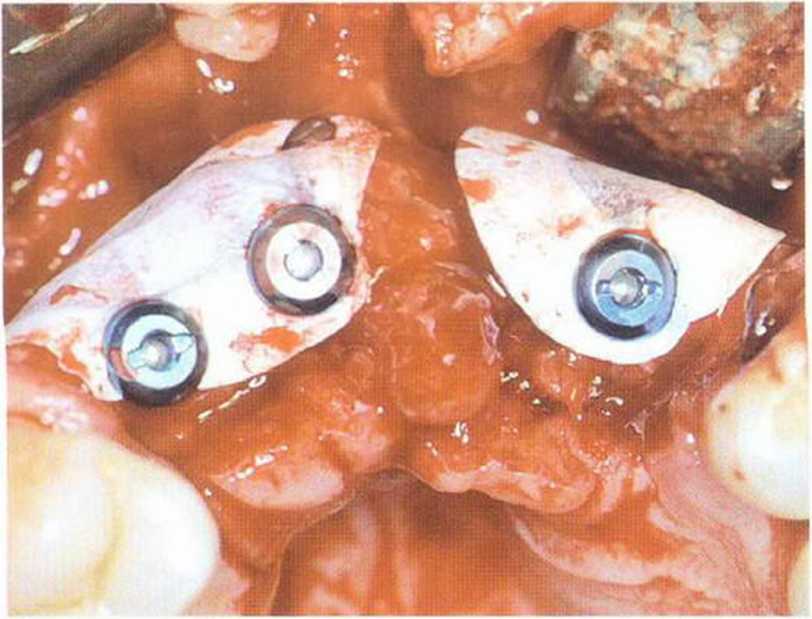
Рис. 1-14Ь. Имплантация и одновременное увеличение объема кости с помощью костного трансплантата из внутриротового источника и нерезорбируемой мембраны (р-ПТФЭ)
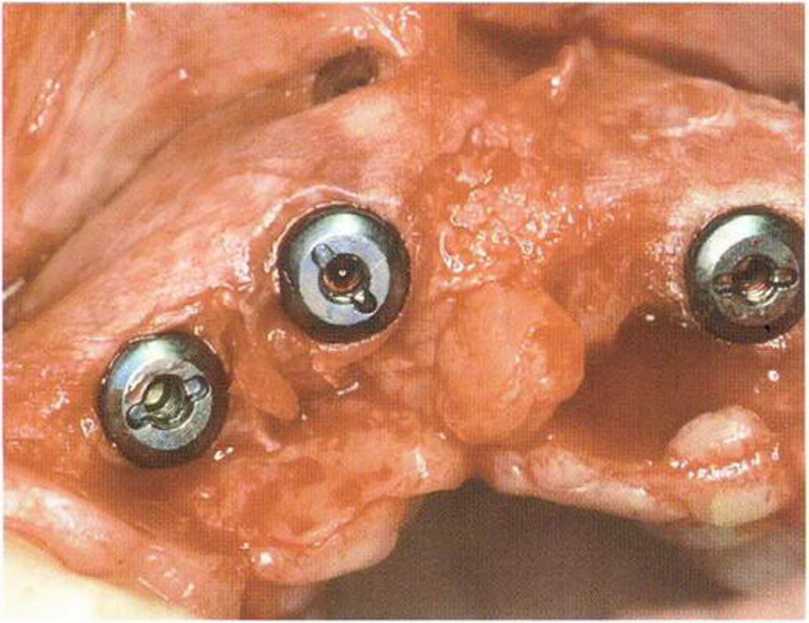
Рис. 1-14с. Клиническая ситуация после удаления мембраны через 6 мес после операции
Hurley и Boyne первыми изучили применение мембран для лучшего заживления костной ткани.После успешного внедрения методики направленной тканевой регенерации (НТР) в пародонтологии этот подход получил распространение в имплантологии в качестве направленной костной регенерации (НКР).
Принцип НКР не предусматривает остеокондук-цию, поскольку мембрана НКР не осуществляет каркасную функцию для новообразованной кости.
Мембрана прежде всего отграничивает область дефекта от конкурирующих мягких тканей, создавая условия для регенерации костной ткани. При условии достаточного срока функционирования и сохранения стабильного пространства под мембраной область дефекта заполняется костной тканью, однако в клинической практике это условие удовлетворяется не всегда. Нередко происходит смещение или прогибание мембраны под давлением мышц. Кроме того, мембрана может обнажаться и инфицироваться. В настоящее время под мембранами всегда применяются дополнительные наполнители пространства или направляющие каркасы в виде аутогенных костных трансплантатов самостоятельно либо в сочетании с костным материалом.
Это позволяет дополнительно стабилизировать трансплантаты в виде стружки. Для НТР применяются нерезорбируемые или резорбируемые мембраны (рис. 1 -14а—1 -14с, 1 -15а—1 -15d, 1 -16а-1 -16с).
Пространство под мембраной заполняют костными трансплантатами, смесью аутогенной кости с костным материалом или только сгустком крови.
Мягкие ткани остаются отграниченными мембраной от дефекта. Процессы, происходящие под мембранами, в целом соответствуют костному заживлению. Сначала образуется кровяной сгусток, после чего в него прорастают кровеносные сосуды, и постепенно сгусток замещается грануляционной тканью. Затем формируется перепончатая рети-кулофиброзная кость с характерным лабиринтом мелких костных балочек и расположенными между ними костномозговыми пространствами, сообщающимися с костным мозгом прилегающей кости.
Рост костной ткани начинается от дна, а также от мезиальных и дистальных стенок дефекта. Регенерация кости происходит исключительно со стороны окружающей костной ткани. Таким образом, решающее значение имеет стабильность пространства дефекта, окруженного костными стенками. Нужно помнить, что мембрана остается отделенной от кости слоем соединительной ткани. На первом этапе образуется первичная сеть костных балочек, которая служит направляющим каркасом для дальнейшего заживления. Затем образуется кортикальный слой, который также распространяется от костных стенок к середине дефекта. Остеобласты располагаются на поверхности сетчатой структуры первичной перепончатой ретикулофиброзной кости.
В результате их активности происходит аппозиционный рост кости, уменьшаются костномозговые пространства и уплотняется губчатая кость. Кроме .
того, одновременно формируется пластинчатая кость. Развитие завершается образованием полноценных первичных остеонов. На четвертом месяце заживления в результате ремоделирования образуются вторичные остеоны. Этот процесс также продолжается от периферии к центру, и в конце четвертого месяца максимальная активность ремоделирования наблюдается в центре. Завершается регенерация периоста и эндоста.
Для ИКР необходимы ограниченное костными стенками пространство и стабильный кровяной сгусток при отсутствии воспаления. Костные материалы способствуют сохранению пространства и не оказывают никакого действия, способствующего регенерации. От них можно отказаться, если стабильность мембраны обеспечивается титановым каркасом или формой окружающих костных стенок, однако длительное поддержание пространства под мембраной остается одной из главных проблем НТР.
Устранение костных дефектов большого объема с помощью мембран - сложная клиническая задача. Как уже отмечалось, ангиогенез и, следовательно, костная регенерация начинаются только со стороны костных стенок. В обширных костных дефектах новообразованные ткани должны заполнять значительные пространства. При использовании мембраны, отграничивающей мягкие ткани, заведомо исключается регенеративный потенциал клеток и сосудов надкостницы лоскута. В результате для полноценной регенерации требуется более продолжительное время, чем при трансплантации аутогенной кости. Таким образом, поверхность пересаженных костных блоков оказывается изолированной от сосудов надкостницы мембраной, поэтому хуже васкуляризуется (см.
главу 5), что ассоциируется с большей резорбцией таких трансплантатов к моменту установки имплантатов.
ИКР позволяет получить отличные результаты, но эффективность этого метода зависит от размера костного дефекта. Помимо длительных сроков регенерации и сложности сохранения стабильного пространства использование мембран сопряжено с риском их преждевременного обнажения и инфицирования, особенно при наличии протяженных дефектов.
Несмотря на относительно низкую вероятность обнажения, резорбируемые мембраны не являются альтернативой нерезорбируемым мембранам.
Резорбируемые мембраны не позволяют достаточно долго сохранять форму дефекта, а при их резорбции резорбируется и аутогенная кость.
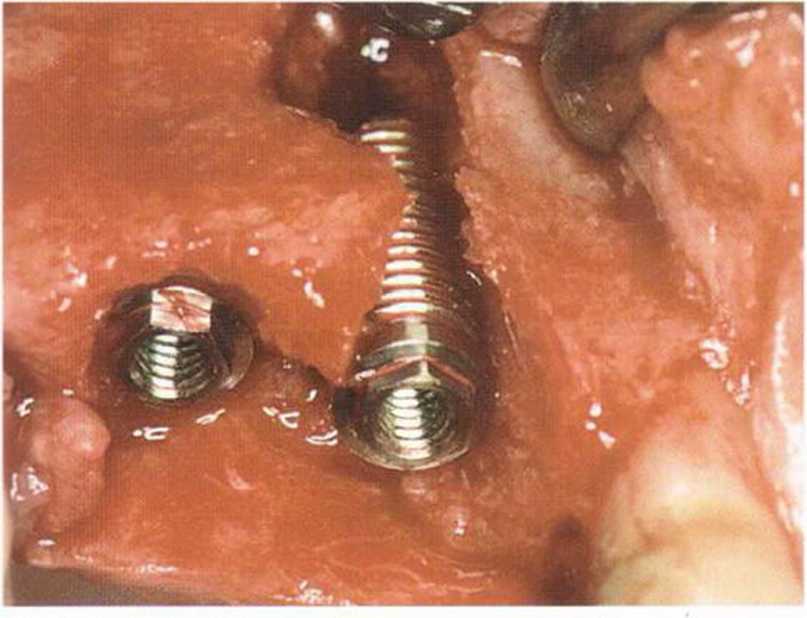
Рис. 1-15а. Протяженный костный дефект в области зуба 14. Имплантат установлен с достаточной первичной стабильностью в пределах костного дефекта
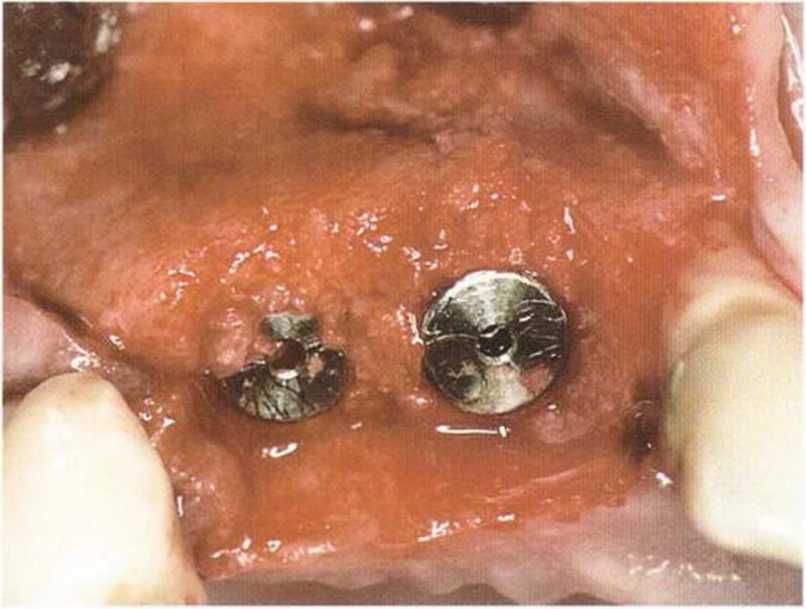
Рис. 1-15Ь. Костный дефект заполнен аутогенной костью из внутриротового источника
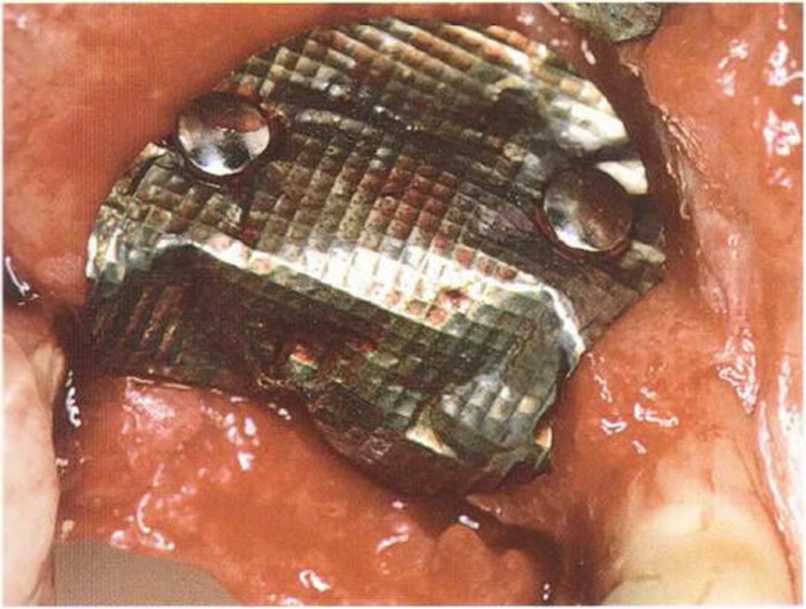
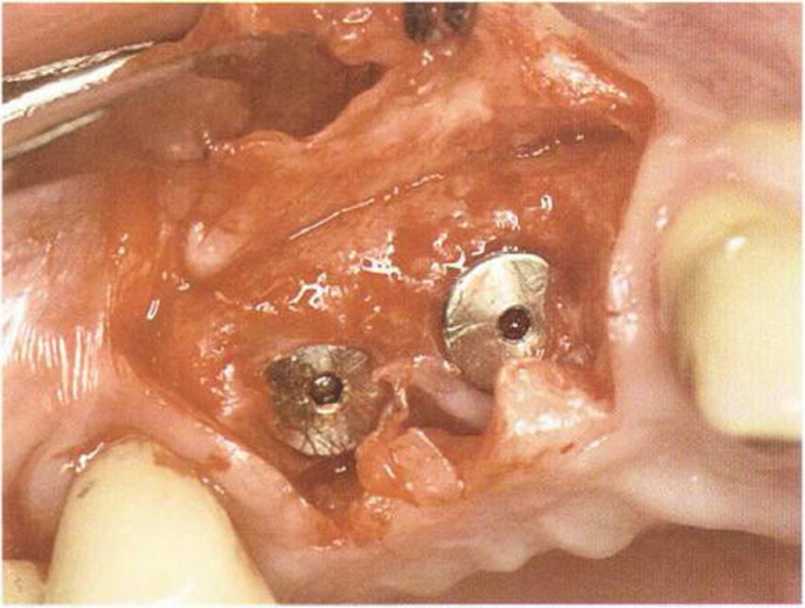
Рис. 1-15с. Установлена титановая мембрана.
.
Рис. 1-15d. Клиническая ситуация после удаления мембраны через 4 мес после операции
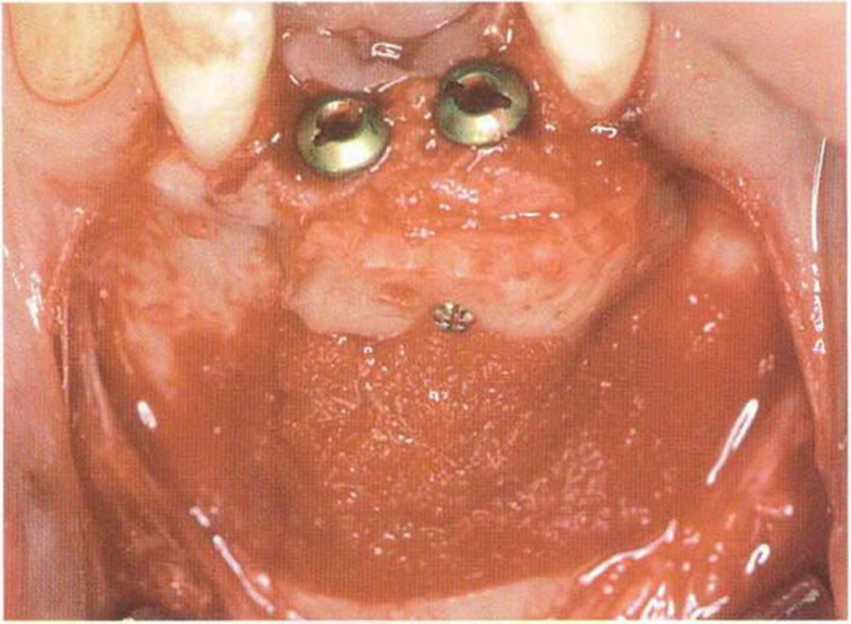
Рис. 1-16а. Имплантация в области зубов 32 и 42 и увеличение объема костной ткани с помощью трансплантата из подбородочной области
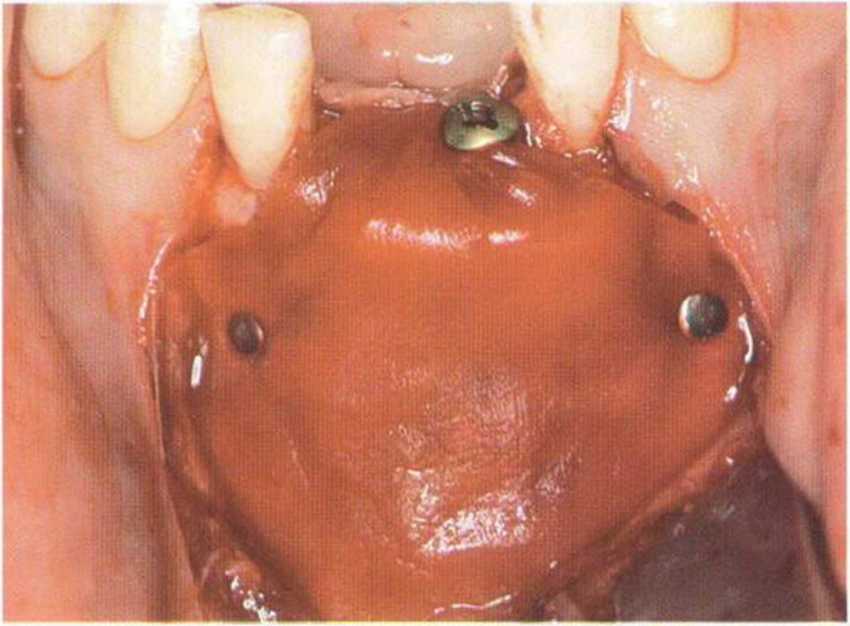
Рис. 1-16Ь. Установлена резорбируемая коллагеновая мембрана
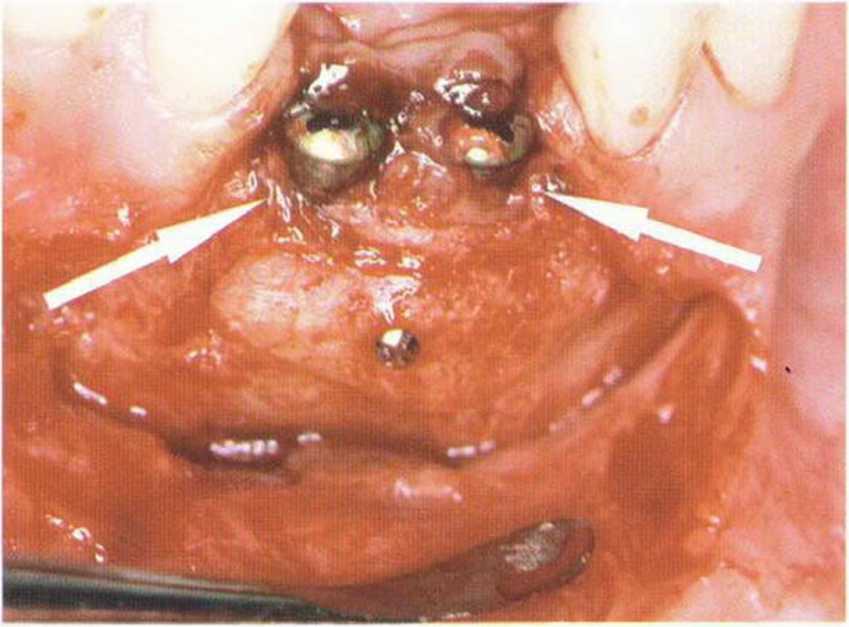
Остеодистракция (дистракционный остеогенез) заключается в новообразовании кости между поверхностями костных сегментов, которые постепенно разделяются с вытяжением костной мозоли. На первом этапе заживления кости после перелома образуется костная мозоль. Для исключения ее минерализации и уплотнения инициируется механическое движение, которое, в отличие от резкого и сильного воздействия травмы, вызывает медленное удлинение мозоли.- Непрерывная тракция костных сегментов продлевает фазу клеточной дифференцировки и пролиферации, что способствует направленному синтезу костного матрикса (рис. 1-17). Такой васкуляризованный матрикс не подвергается трансформации на фоне непрерывного воспалительного процесса.
Остеодистракция регулируется двумя основными биологическими механизмами: во-первых, механическим давлением, при котором происходит синтез и высвобождение факторов роста, участвующих в активном регенеративном процессе, и, во-вторых, васкуляризацией.--.
Образование костной мозоли при остеодистракции индуцируется после проведения распилов кости на ограниченном участке. Биологические процессы костного заживления идентичны внутреннему и наружному восстановлению костной ткани. В образовании соединительнотканной мозоли участвуют надкостница и эндост. Степень их активности влияет на оссификацию и зависит от локализации, индивидуальных особенностей организма и методики вмешательства. После остеотомии до начала тракции необходимо подождать 7 дней. В течение этого латентного периода соблюдается механический покой для образования мягкой соединительнотканной мозоли. Его продолжительность нельзя увеличивать, в противном случае происходит минерализация мозоли, что делает невозможным тракцию костных сегментов.
Затем начинается собственно дистракция. Состояние мозоли зависит от ее васкуляризации и снабжения кислородом, а эти параметры определяются целостностью раневого участка и тканями раны, т.е. качеством хирургического вмешательства. По мере тракции фрагментов создаются условия для удлинения и роста костной мозоли и перекрывающих данный участок мягких тканей.-Новообразование тканей происходит параллельно оси тяги.
На заключительной стадии достигается консолидация костной мозоли, т.е. голная минерализация новообразованной ткани и воссоединение костных фрагментов.
Остеодистракция является единственным известным методом динамического использования потенциала регенерации. Костный рост представляет собой исключительно сложный процесс, который зависит от многочисленных факторов роста, клеток, рецепторов и т.д. и состоит из определенных этапов, регулируемых специфическими градиентами концентраций биологически активных молекул и клеток. В настоящее время идентифицировано только 70 % генов, регулирующих регенерацию кости. Сегодня этот процесс изучен далеко не полностью, а его искусственная инициация пока невозможна. Дистракция имеет большое клиническое значение, поскольку позволяет прогнозируемо устранять даже вертикальные костные дефекты. Однако метод отличается повышенными требованиями к хирургической технике и степени сотрудничества пациента, поэтому применение остеодистракции ограничивается редкими клиническими ситуациями.
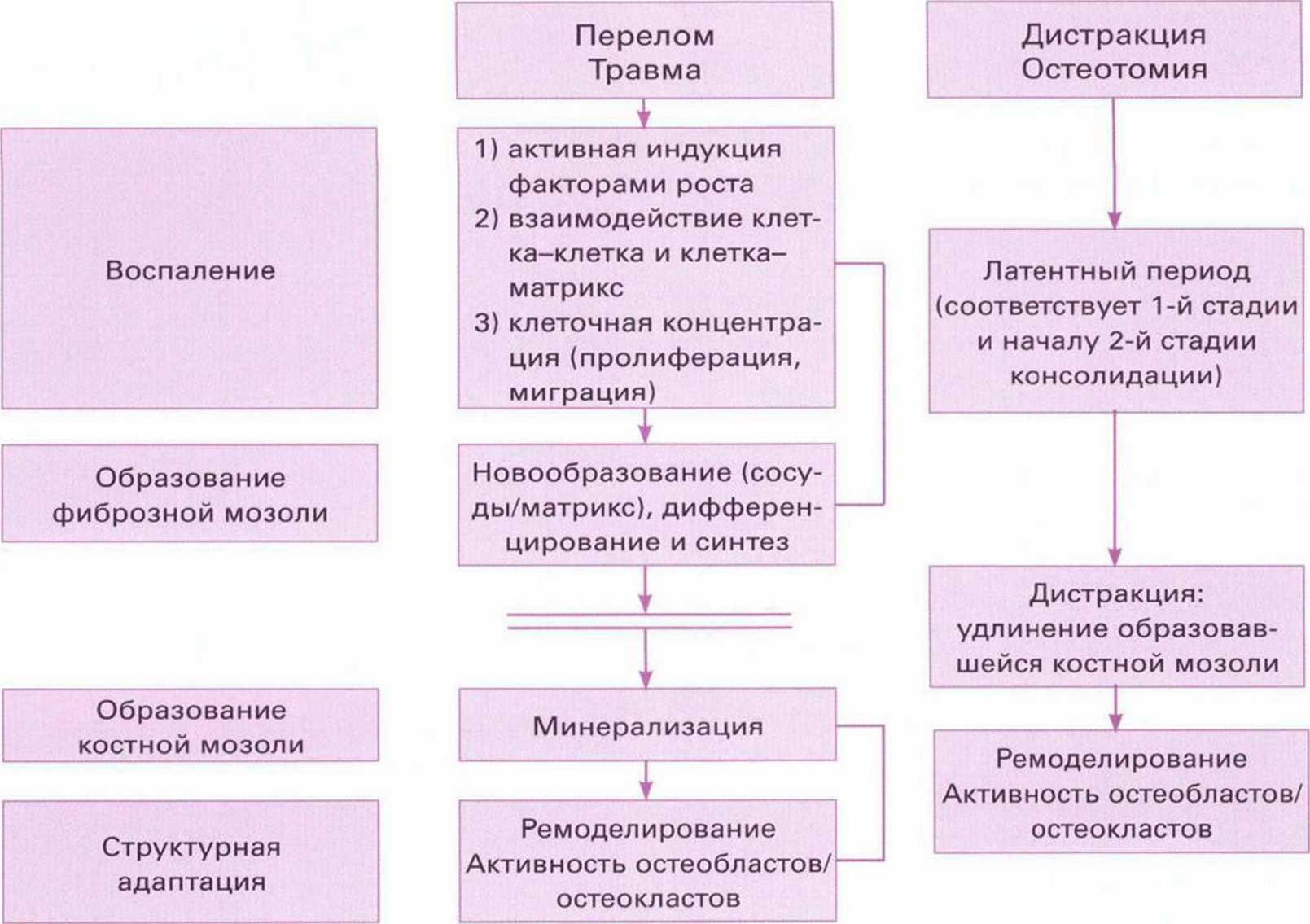
Рис. 1-17. Биологические процессы при травматическом переломе и дистракционном остеогенезе (по Nefussi," 2007). Единственное отличие заключается в удлинении костной мозоли перед минерализацией
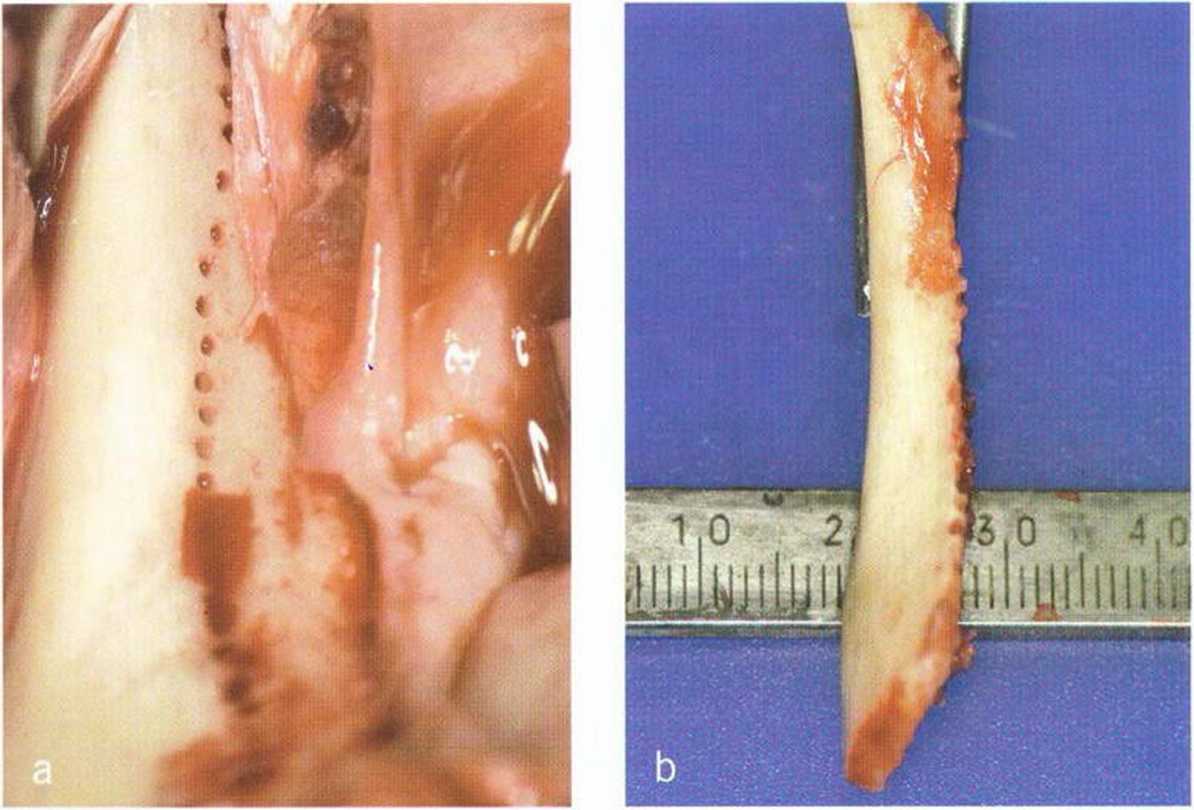
Трансплантация аутогенных костных блоков заключается в пересадке костных фрагментов из донорской области в принимающее ложе в пределах одного организма. В отличие от синус-лифтинга, ИКР и остеодистракции, где также применяется аутогенная кость, пересадка аутогенных блоков предполагает использование цельного костного фрагмента (рис. 1-18а и 1-18Ь). Ксеногенные, аллогенные и аллопластические костные блоки значительно уступают по своему качеству аутогенным.Наиболее часто костные трансплантаты получают в области наружной косой линии нижней челюсти, симфиза нижней челюсти и участках адентии альвеолярного гребня.’° При наличии крупных дефектов можно использовать внеротовые донорские участки, например гребень подвздошной кости, большеберцовую или теменную кость, однако кость мембранозного происхождения резор-бируется меньше, чем энхондрального генеза.Для пересадки можно использовать кортикальные или кортикально-губчатые костные блоки. В кортикально-губчатых блоках реваскуляризация более быстрая и богатая, но меньше, чем в костной стружке. Многие исследования подтверждают доминирующее значение скорости и степени реваскуляризации для успеха трансплантации, поскольку именно реваскуляризация определяет жизнеспособность трансплантата и влияет на вероятность его резорбции, инфицирования.
Рис. 1-18а и 1-18Ь. Аутогенный костный блок из ретромолярной области
После трансплантации костного блока начинается противодействие процессов костной резорбции и трансформации, обусловленной остеокон-дукцией, остеоиндукцией и остеогенезом. С одной стороны, организм воспринимает костный блок в процессе заживления раны как неживое инородное тело, которое должно быть разрушено и устранено активными макрофагами. С другой стороны, вызванный травмой воспалительный процесс приводит к высвобождению стимулированными тромбоцитами тромбоцитарного фактора роста (ТФР), который индуцирует клеточную пролиферацию и ангиогенез. Одновременно тромбоциты высвобождают альфа-трансформирующий фактор роста (TGF-a), регулирующий пролиферацию клеток, ангиогенез и дифференциацию соединительной ткани. Вслед за тромбоцитарными факторами роста начинают действовать макрофаги, которые также посредством ТФР и TFG-a индуцируют дальнейшую регенерацию. По мере завершения реваскуляризации и уменьшения гипоксии активность макрофагов снижается (рис. 1-19а и 1 -1ЭЬ). Источником новообразованных сосудов являются костное ложе и надкостница лоскута, что отличает данный метод от применения мембран, исключающих реваскуляризацию со стороны мягких тканей. Повышенную резорбцию кортикальных блоков можно также объяснить тем, что реваскуляризация протекает медленнее, чем резорбция.- Гистологические исследования показали, что в начальной стадии заживления решающее значение имеет иммобилизация свободного десневого трансплантата.Нарушение этого условия ограничивает или препятствует врастанию сосудов со стороны прилегающих тканей. Аналогичная ситуация наблюдается у костных трансплантатов, подвергающихся повышенной резорбции в области интенсивного мышечного натяжения. В связи с этим особенно повышенное внимание следует уделять переднему отделу нижней челюсти, на который большое влияние оказывает активность при жевании и разговоре.
Выживание трансплантата зависит главным образом от его остеогенного потенциала, определяющегося качеством хирургических мероприятий или характером операционной травмы, способностью ложа к реваскуляризации и иммобилизацией трансплантата. На первом этапе возникает соединение пересаженного блока с принимающим ложем. Реакция сравнима с образованием мозоли после перелома, однако ткани не связаны непрерывно, а только перекрывают одна другую.
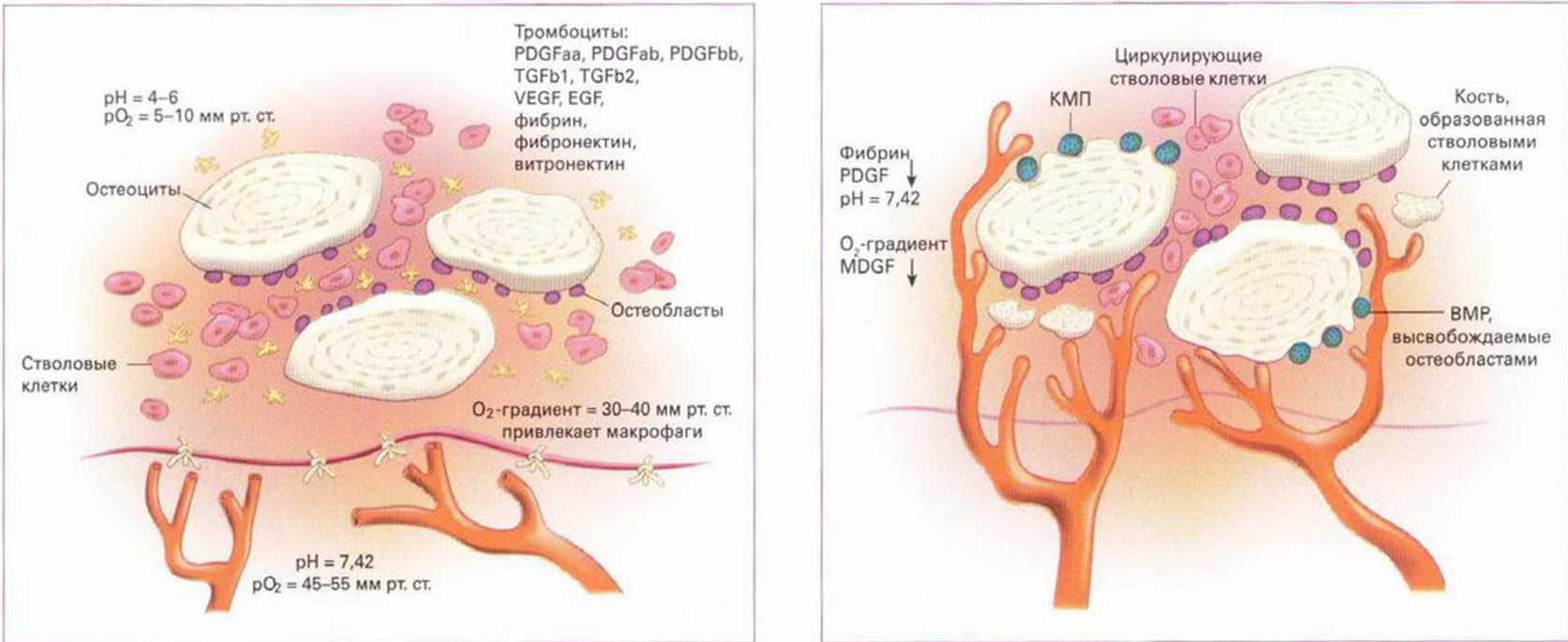
Рис. 1-19а и 1-19Ь. Схематичное изображение костного трансплантата: а - тромбоциты секретируют факторы роста (цитокины), которые стимулируют процесс заживления; b - благодаря реваскуляризации раны нормализуется градиент кислорода, что препятствует избыточной клеточной пролиферации, а также ингибирует активность макрофагов (из Marx RE, Stern D. Oral and Maxillofacial Pathology. A rationale for diagnosis and treatment. Chicago: Quintessence; 2003. P. 19)

Рис. 1-20. Трехмерная реконструкция нижней челюсти с помощью аутогенных костных блоков. Блоки расположены в области альвеолярного гребня и с вестибулярной стороны дефекта. Промежуточное пространство дефекта заполнено костной стружкой.
Влияние иммобилизации на качество и скорость реваскуляризации очевидно. Быстрое новообразование сосудов способствует сохранению жизнеспособности большинства клеток трансплантата, а значит, его остеогенному потенциалу.
Некоторые авторы предлагали перфорировать кортикальный слой костного ложа для ускорения васкуляризации блока, однако клинические и экспериментальные исследования не подтвердили преимущества такой перфорации с точки зрения ускорения и улучшения приживления блока по сравнению с неперфорированным принимающим ложем.- Кроме того, на выживаемость костного трансплантата существенно влияет состояние мягких тканей. Рассечение надкостницы для достаточной мобилизации лоскута должно быть минимальным, поскольку она является богатым источником клеточных элементов и способствует остеогенезу. Несмотря на все усилия, часть клеток трансплантата погибает, поэтому большое значение приобретают его остеокондуктивные свойства. Врастание сосудов и поступление жизнеспособных костеобразующих клеток в трансплантат происходит быстрее при меньшей толщине кортикального слоя,’ поэтому при пересадке кортикально-губчатого трансплантата из гребня подвздошной кости нередко достигается оптимальная регенерация. Недостатком трансплантатов энхондрального происхождения является их более интенсивная резорбция в дальнейшем.Напротив, трансплантаты из нижнечелюстной кости отличаются меньшей резорбцией, но состоят только из кортикального слоя или минимального количества губчатого вещества. Для объединения преимуществ обоих типов костной ткани была разработана методика трехмерной реконструкции гребня. Требуемый размер челюстного гребня создают с помощью тонких кортикальных пластинок, полученных на нижней челюсти. Сформированное под ними пространство заполняют костной стружкой, которая быстрее и лучше реваскуляри-зуется и поэтому в большей степени способствует регенерации со стороны костных стенок принимающего ложа, чем кортикальные или кортикально-губчатые трансплантаты (рис. 1-20).- Быстрая реваскуляризация способствует сохранению жизнеспособности большего количества костных клеток, компенсируя резорбтивную активность остеокластов. Новообразование кости преобладает над ее резорбцией, поэтому не происходит такой выраженной потери объема, как при пересадке трансплантатов из гребня подвздошной кости или кортикальных блоков (рис. 1-21a-1-21d).-Трансплантация костного блска позволяет эффективно и предсказуемо восстанавливать объем альвеолярной кости. Успех вмешательства зависит от соблюдения протокола операции, выполнения пациентом рекомендаций лечащего врача и обеспечения функциональной нагрузки после имплантации и последующего протезирования.
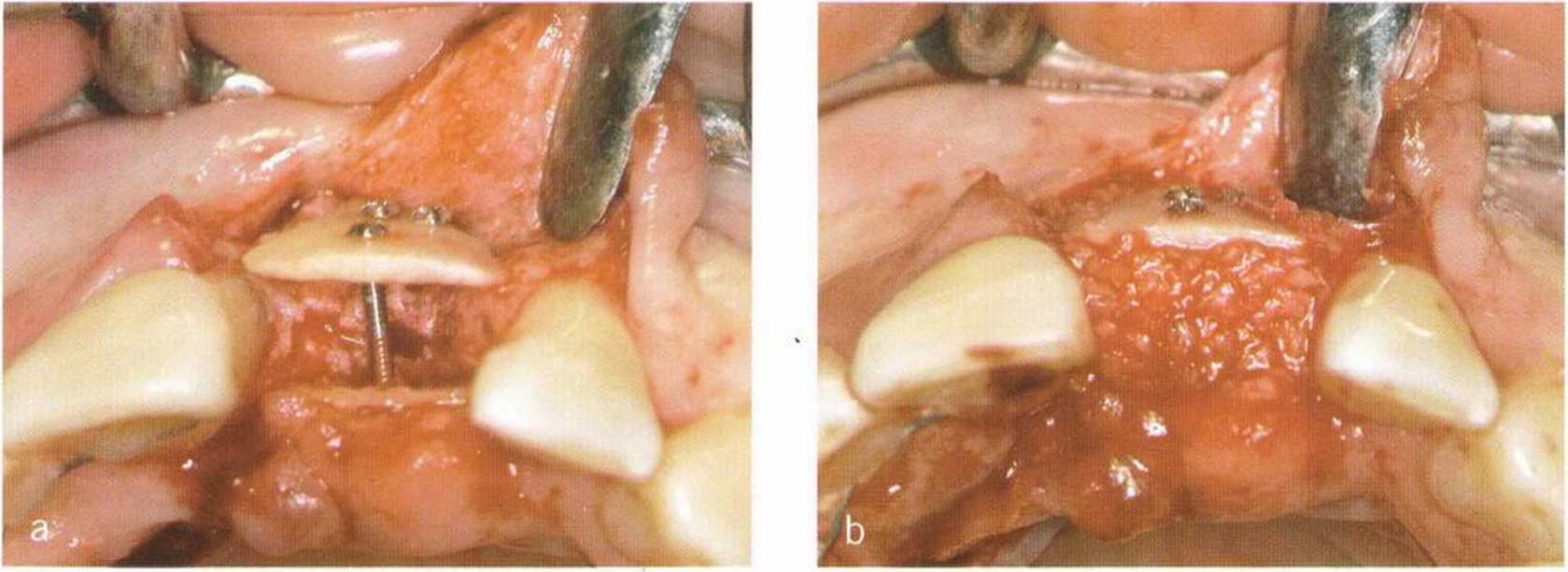
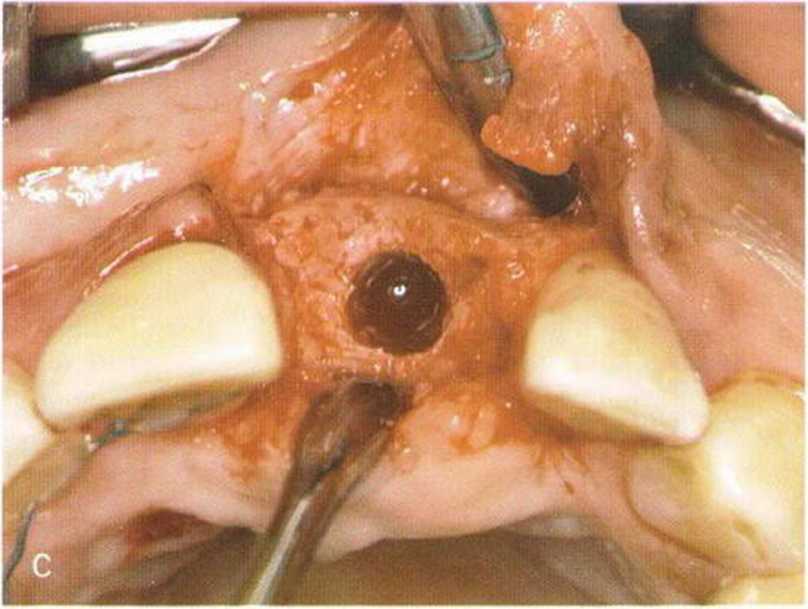
Рис. 1-21а-1-21с. Трехмерная реконструкция переднего отдела верхней челюсти с помощью вестибулярного и нёбного костных блоков, свободное пространство заполнено костной стружкой.
Через 4 мес после операции определяются хорошая реваскуляризация и незначительная резорбция трансплантата
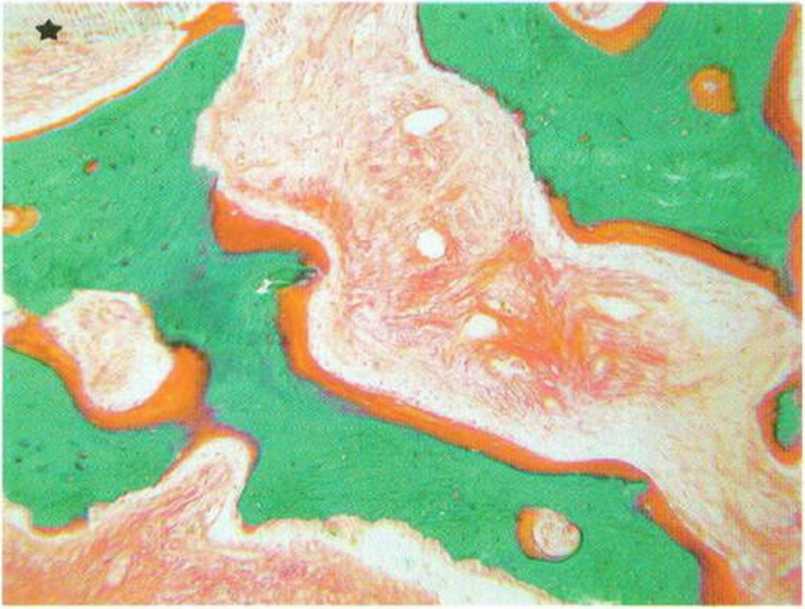
Рис. 1-21d. Костная стружка обладает выраженной остеокон-дуктивностью: образование остеоидного слоя (красный) на всех свободных поверхностях (зеленый) аутогенной кости (окраска трихромом по Массону-Гольднеру) (гистологический препарат проф. G. Brunei, Тулузский университет)
Представленные в этой главе методы восстановления кости или костных структур не предполагают активного вмешательства в процессы регенерации.
Напротив, тканевая инженерия заключается в воздействии на разные регенерационные механизмы посредством особых клеток, сигнальных молекул и матриксных материалов, непосредственно вызывая остеоиндукцию. В настоящее время лишь немногие методы тканевой инженерии преодолели экспериментальную стадию. К ним относится применение богатой тромбоцитами плазмы крови (БоТП), рекомбинантного человеческого тромбоци-тарного фактора роста (рч-ТФР-ВВ) и рекомбинантного человеческого костного морфогенетического протеина-2 (рч-КМП-2).
БоТП способствует заживлению костной и мягких тканей благодаря наличию в тромбоцитах а-гра-нул, которые, в свою очередь, содержат ТФР, тром-боцитарный фактор роста эндотелиальных клеток (PD-ECGF), инсулиноподобный фактор роста (IGF) и бета-трансформирующий фактор роста (TGF-p).Marx предложил получать БоТП из венозной крови, однако клинические исследования показали противоречивые результаты, поэтому в настоящее время значение БоТП для хирургической стоматологии остается сомнительным.’.
Успехи в синтезе рекомбинантных белков также открывают широкие возможности при получении факторов роста. Первые положительные результаты опубликованы для рч-ТФР при устранении рецессии десны и дефектов, а также восстановлении альвеолярной кости.- При этом отмечались улучшение регенерации и низкий риск послеоперационных осложнений. К сожалению, окончательно оценить эффективность БоТП невозможно из-за недостаточного количества клинических исследований.
Имеющиеся научные данные подтверждают способность рч-КМП-2 стимулировать новообразование костной ткани на эктопических участках посредством дифференциации стволовых клеток в костеобразующие клетки. К сожалению, в настоящее время изучению эффективности этого материала в пародонтологии и имплантологии посвящено относительно немного исследований, что объясняется высокой стоимостью рч-КМП-2.
Можно предположить, что в будущем тканевая инженерия станет шире применяться для восстановления альвеолярной кости. Пока клиническое использование тканевой инженерии недостаточно изучено и скорее носит экспериментальный характер, но уже заслуживает самого пристального внимания.
Для установки имплантатов в правильном, с точки зрения протезирования, положении необходим достаточный объем костной ткани. Под влиянием ряда генетических и местных этиологических факторов этот объем уменьшается и должен быть восстановлен перед имплантацией. Применяемые в настоящее время ксеногенные и аллолластические материалы не обеспечивают те преимущества, которыми обладают аутогенные трансплантаты.
Достижение оптимальных результатов синус-лиф-тинга, направленной костной регенерации, трансплантации костных блоков или дистракционного остеогенеза невозможно без глубокого понимания и целенаправленного регулирования новообразования и трансформации кости. Н1аучные исследования вышли на молекулярный уровень, и в будущем можно надеяться на повышение эффективности и снижение инвазивности методов регенерации костной ткани.