Нередко выраженная атрофия альвеолярного гребня встречается при пародонтите, а также при шинировании пораженных зубов. В результате на фоне кажущейся стабильности и сохранения зубов в полости рта резорбция прилегающей костной ткани достигает верхушки корня. Устранение ограниченных травматических дефектов, несмотря на удовлетворительное состояние других челюстных отделов, часто затрудняется значительной утратой костной ткани в конкретной области альвеолярного отростка верхней или альвеолярной части нижней челюсти. При полном отсутствии зубов на одной челюсти и сохранении зубов на другой может произойти атрофия кости беззубой челюсти вследствие оказания на нее высокой жевательной нагрузки, вплоть до полной утраты альвеолярного гребня. Удаление злокачественных опухолей также приводит к образованию значительных костных дефектов, устранение которых требует сложных реконструктивных вмешательств.
Отдельную группу составляют пациенты с установленными ранее имплантатами. Персисти-рующий в течение длительного периода периим-плантит является причиной несостоятельности имплантатов и может приводить к утрате соседних зубов с образованием дефектов, сложно поддающихся устранению.
Особую трудность для лечения представляют собой случаи неудачных регенеративных вмешательств, когда проблема рубцевания мягких тканей усугубляется наличием костных материалов, оставшихся в области операции. Все это сильно усложняет работу с костью и мягкими тканями, поскольку даже удаление грануляций становится трудновыполнимой клинической задачей. Несмотря на все перечисленные факты, пациенты предъявляют очень высокие требования к реконструктивным вмешательствам на альвеолярном гребне, подчас ожидая полного восстановления утраченных тканей и изготовления эстетичных и функциональных несъемных протезов.
Во всех этих ситуациях для устранения костных дефектов необходима трансплантация большего объема костной ткани, который не всегда можно получить в полости рта. Вследствие этого нередко показана пересадка аутогенных костных трансплантатов с внеротовых донорских участков.
Однако получение коечного трансплантата вне полости рта не должно ограничивать качество жизни пациента. Функциональные и эстетические нарушения при пересадке кости могут вызвать у него дополнительную психосоциальную травму.
В научной литературе описано несколько внеротовых донорских участков костных трансплантатов для проведения регенеративных вмешательств в стоматологии, например гребень подвздошной кости, головка большеберцовой кости и свод черепа. Костная ткань езода черепа отличается выраженной кортикальной структурой, поэтому ее препарирование нужно проводить с учетом последующей минимальной обработки трансплантата при установке. При правильном проведении вмешательство на своде черепа сопровождается незначительной болезненностью, но пациента необходимо подробно проинформировать о возможном дискомфорте. Из большеберцовой костиможно получить большой объем губчатого вещества для использования его в сочетании с ксеногенными костными матеэиалами, например при синус-лифтинге, однако пересадка объемных кортикально-губчатых трансплантатов ассоциируется с болезненностью в послеоперационном периоде.
Вследствие этого методом выбора при устранении обширных дефектов в челюстной области, особенно после ранее проведенных операций, является пересадка свободного тэансплантата из гребня подвздошной кости.
Пересадка монокортикальных костных лоскутов из свода черепа, впервые предложенная Dandy в 1929 г., продолжает использоваться при лечении тяжелых переломов основания глазницы. Метод часто применяется в челюстно-лицевой хирургии благодаря пространственной близости донорского и принимающего участков (рис. 6-1 а). Вмешательство проводят на волосистой части головы, а трансплантат получают исключительно в пределах наружной кортикальной пластинки, чтобы сохранить внутреннюю кортикальную пластинку для защиты головного мозга и исключения риска перфорации твердой мозговой оболочки. Ниже представлен метод трансплантации кости свода черепа, описанный Vinci (2006).
Пациентам назначают антибиотикопрофилакти-ку (амоксициллин с клавулановой кислотой по 1 г 3 раза в день в течение 10 дней). Предпочтительнее проводить операцию под общей анестезией, чтобы исключить неприятные ощущения и значительный психологический дискомфрт пациента вследствие высокой костной проводимости звука.
При непосредственной подготовке к операции волосы и кожу головы трижды промывают дезинфицирующим раствором (Cutasept, Bode Chemie) и просушивают стерильной марлей для максимального устранения микроорганизмов. Форма разреза на коже головы, поданным некоторых авторов, различается и зависит от длины волос. После предварительного маркирования линии разреза длинные волосы собирают в две пряди, а короткие волосы (до 10 см) разделяют стерильной расческой и затем фиксируют вазелином или антимикробным гелем (рис. 6-1Ь). В исключительных случаях можно сбрить волосы на голове на участке шириной 5 мм.
Волосы не позволяют использовать лейкопластырь, поэтому для профилактики инфицирования необходимо тщательно обработать поверхность,.
прилегающую к операционной области. Подготовку донорского участка на своде черепа проводят отдельно от принимающего участка, чтобы исключить занесение инфекции от волосистой части головы в полость рта.
В области планируемого разреза делают инфиль-трационную анестезию. Это обеспечивает местный гемостаз и облегчает отслаивание от свода черепа хорошо кровоснабжающейся плотной кожи головы.
Во избежание повреждения волосяных фолликулов и послеоперационной алопеции разрез всегда нужно проводить обычным скальпелем, а не электрическим Для достаточной визуализации кортикального слоя свода черепа длина разреза должна составлять не меньше 10 см (рис. 6-1 с). У пациентов с редкими или очень тонкими волосами разрез можно сделать по складке кожи головы. При этом нужно следить за тем, чтобы не повредить сухожилия височной мышцы - это чревато сильным послеоперационным кровотечением и образованием гематомы. Результатом должно стать отслаивание слизисто-надкостничного лоскута кожи над сводом черепа.
Костный трансплантат получают на безопасном расстоянии от швов черепа (около 1 см). Костная ткань в области швов представлена исключительно кортикальным веществом, что объясняется сращением двух костных пластинок (рис. 6-1 d). Кроме того, забор кости в области швов крайне затруднен и ассоциируется с высоким риском прободения свода черепа с повреждением твердой мозговой оболочки.
После распиливания наружного кортикального слоя осторожно отделяют долотом монокорти-кальную костную пластинку. Если трансплантат не удается отделить сразу, следует продолжить препарирование, поскольку попытки приложения большего усилия на долото повышают риск повреждения подлежащих структур (рис. 6-1 е). В зависимости от планируемого объема регенеративного вмешательства выпиливают нужное число костных фрагментов, которые отслаивают от свода черепа (рис. 6-1 f).
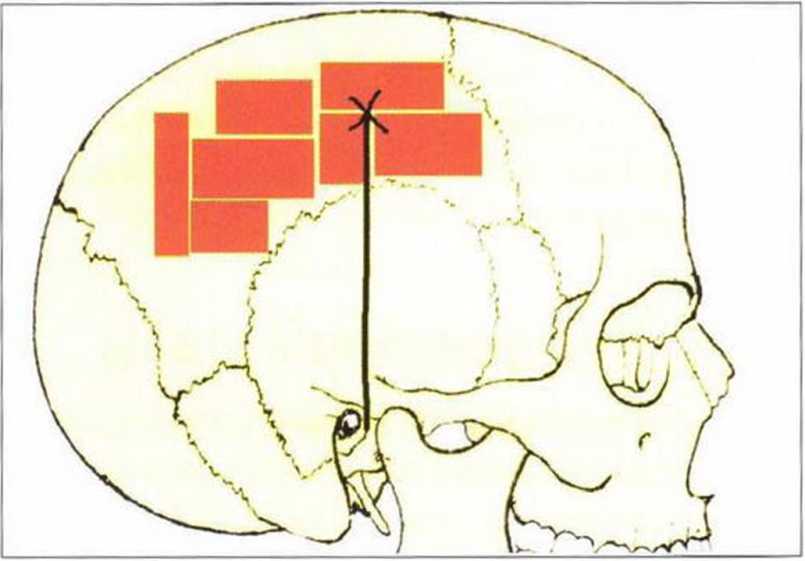
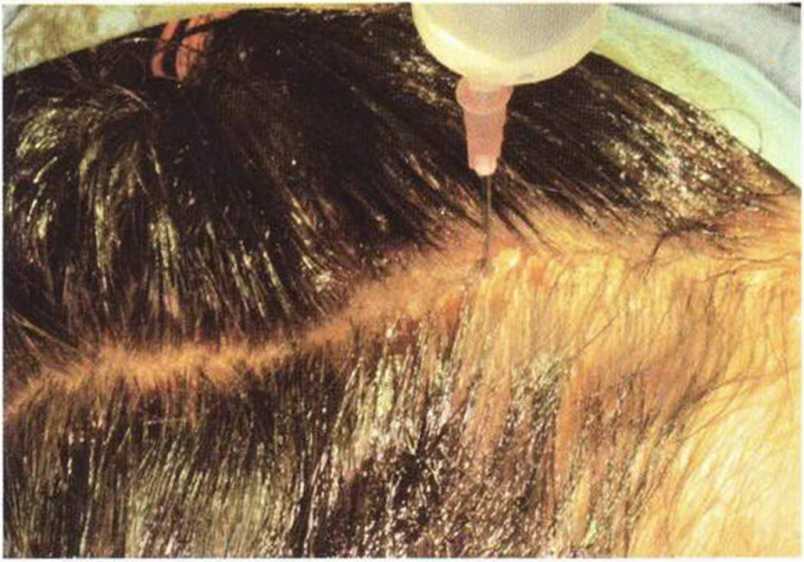
Рис. 6-1 а. Схема получения костного трансплантата на теменной кости: оптимальный участок удален от срединной линии минимум на 2 см и находится латерально и кверху от сухожилия височной мышцы и позади венечного шва (рис. 6-1а-6-1р предоставлены д-ром Raffaelle Vinci, Милан, Италия).
Рис. 6-1Ь. Для визуализации линии разреза волосы смазывают вазелином и расчесывают на две стороны. Чтобы облегчить создание доступа, под кожу под местной анестезией вводят охлажденный физиологический раствор
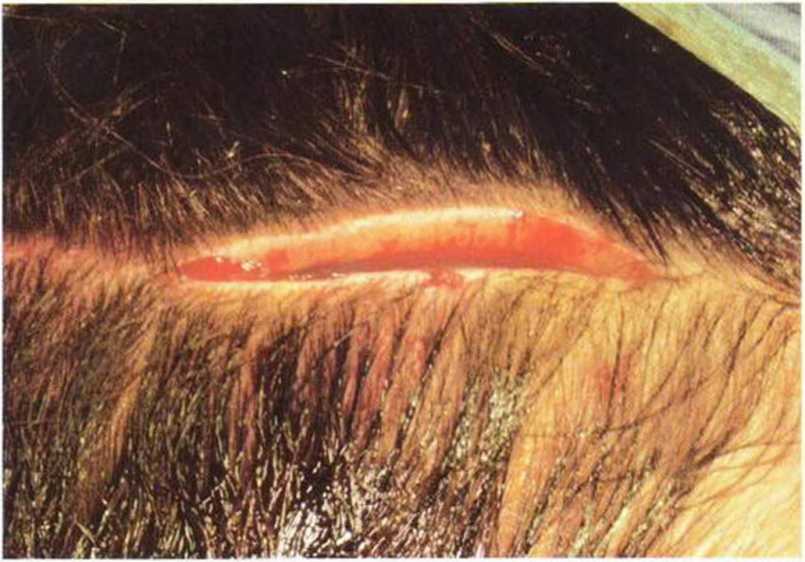
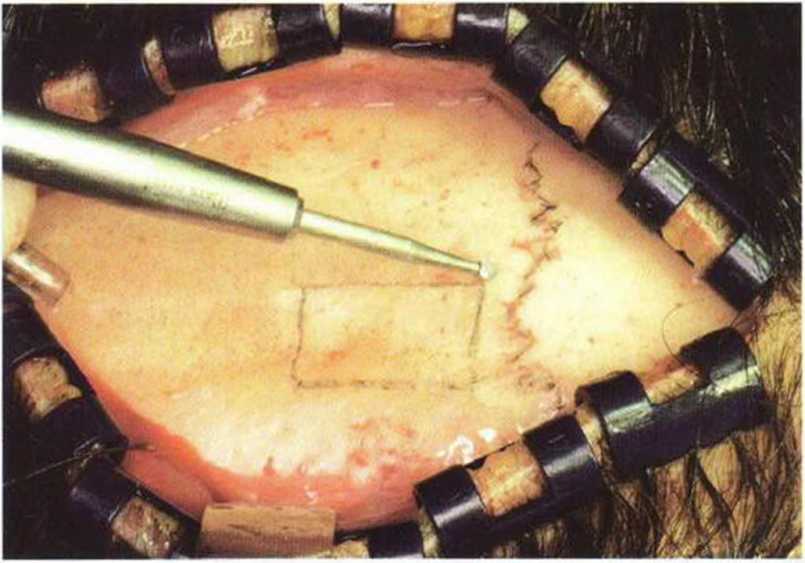
Рис. 6-1 d. Для обеспечения гемостаза накладывают скальпо-вые зажимы Рейни (Raney). Первый лоскут маркируется позади венечного шва
Рис. 6-1с. Разрез проводят прямолинейно длиной не меньше 10 см.
После выделения кортикального слоя можно дополнительно собрать некоторое количество губчатого вещества для заполнения свободных пространств в области регенеративного вмешательства. Получив костный трансплантат, целесообразно сгладить острые костные края в донорской области (рис. 6-1 д). Современные пьезохирургические насадки и костные распаторы позволяют сохранить костную стружку для использования при последующем регенеративном вмешательстве (рис. 6-1 h). С учетом интенсивного течения крови рекомендуется заполнять донорский дефект коллагеновой губкой и проводить многослойное ушивание раны с наложением подкожных швов в соединительной ткани и простых узловых швов на коже головы (рис. 6-1 i и 6-1 j). Для предупреждения образования гематомы минимум на 12 часов устанавливают дренаж и накладывают давящую повязку (рис. 6-1 к).
Помимо типичных осложнений, например гематомы и инфицирования эаны, при заборе кости в области свода черепа возможно обнажение или повреждение твердой мозговой оболочки. Примерно в 10 % случаев происходит вскрытие твердой оболочки без каких-либо последствий для пациента. Обнаженные участки восстанавливают имеющимся костным материалом, чтобы в дальнейшем не оставалось незащищенных участков оболочки, покрытых только кожей головы. При прободении оболочки (определяется по выделению ликвора) показано нейрохирургическое вмешательство для устранения ликвореи.
Проводить электрокоагуляцию в области волосяных фолликулов не рекомендуется, это может стать причиной выпадения волос. К алопеции в послеоперационной области также может привести длительное сдавление волосяных луковиц обширной гематомой.
Эпидуральные, субдуральные и внутримозговые гематомы развиваются крайне редко (менее чем в 0,02 % случаев) и ассоциируются с недостаточными мануальными навыками хирурга. Таким образом, получение костного трансплантата из свода черепа является эффективным и надежным методом. Следует отметить, что такие трансплантации отличаются хорошей долгосрочной стабильностью, что объясняется схожим происхождением костной ткани свода черепа и челюстей (рис. 6-11 - 6-1 р).
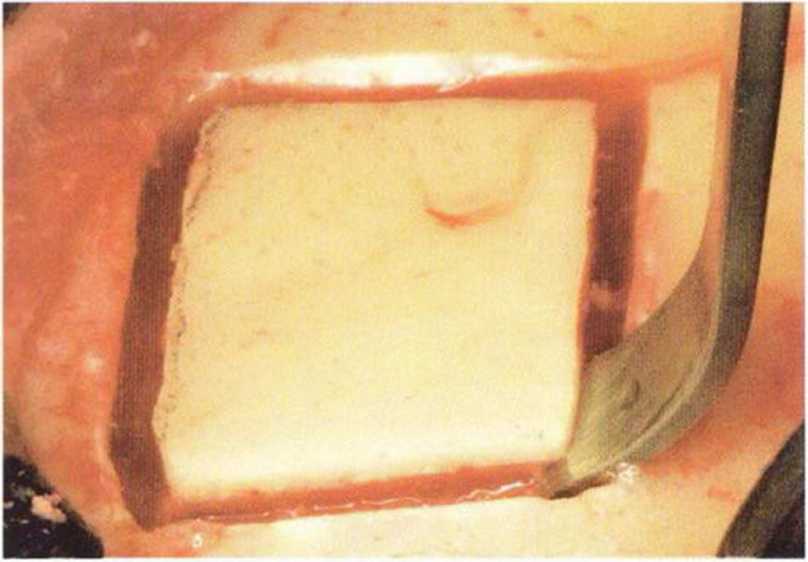
Рис. 6-1 е. После проведения распилов кортикального слоя шаровидным бором костный трансплантат отделяют с помощью долота, изогнутого под углом 120°
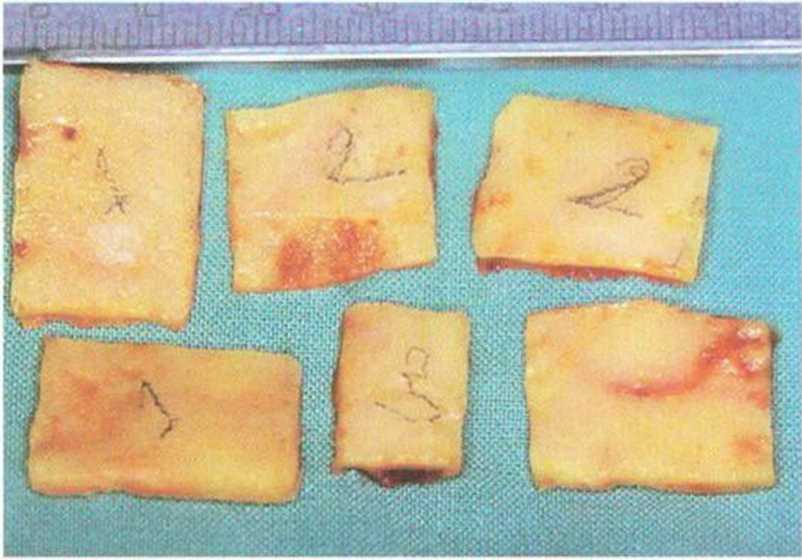
Рис. 6-1f. Взятые костные блоки
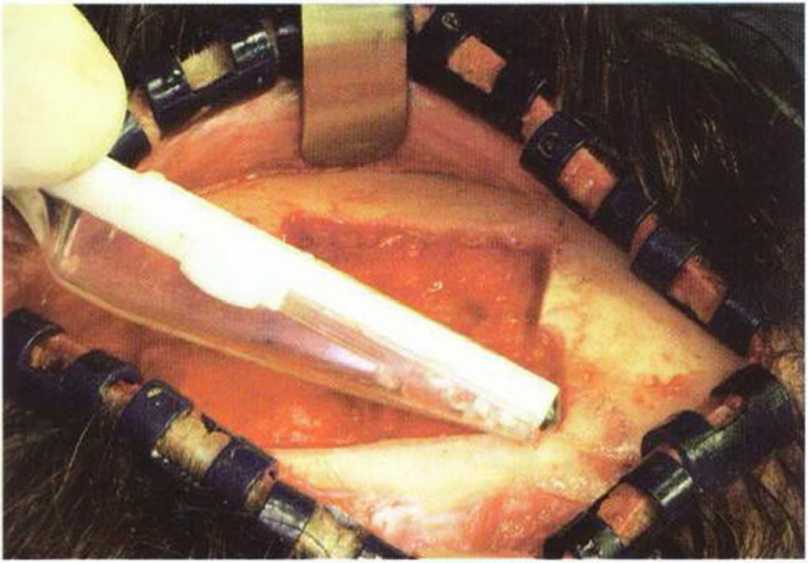

Рис. 6-1 д. Острые края донорской зоны сглаживаются скребком Bonescraper.
Рис. 6-1 h. При сглаживании краев и подлежащей губчатой кости можно получить достаточный объем костной стружки для реконструкции альвеолярного гребня
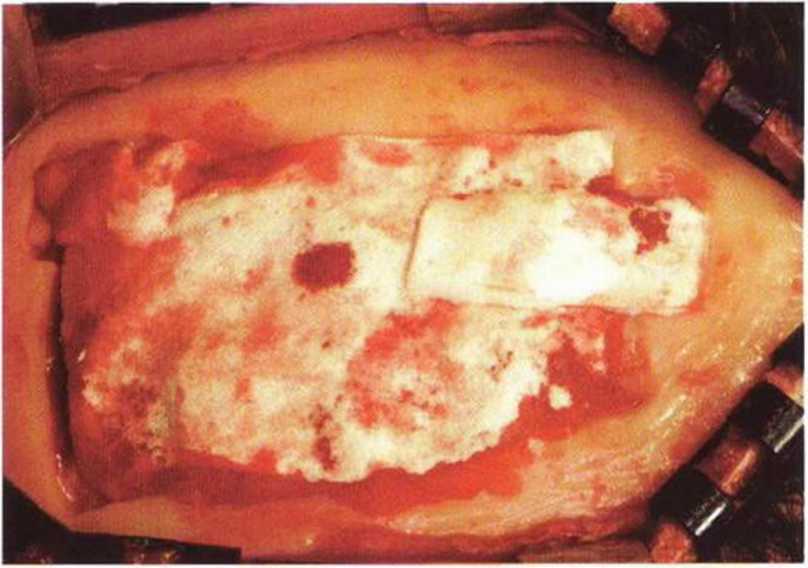
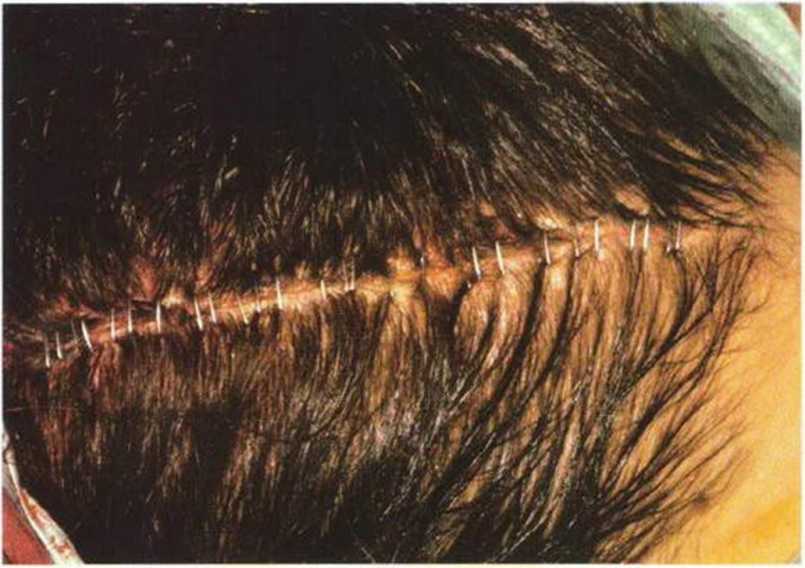
Рис. 6-1 i. Для восстановления контуров и профилактики послеоперационной гематомы на донорском участке устанавливают коллагеновую губку.
Рис. 6-1 j. Рану на волосистой части головы ушивают монофиль-ной нитью (3-0) или скрепляют металлическими скобками
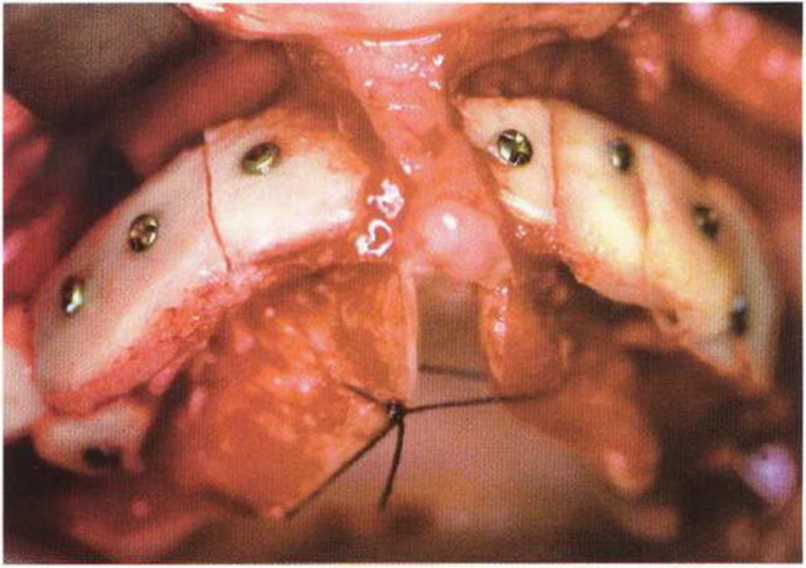
Рис. 6-11. Аутогенные блоки применяются для реконструкции верхней челюсти
Рис. 6-1 к. Для предупреждения послеоперационной гематомы на 24 часа накладывают давящую повязку с использованием эластичного бинта
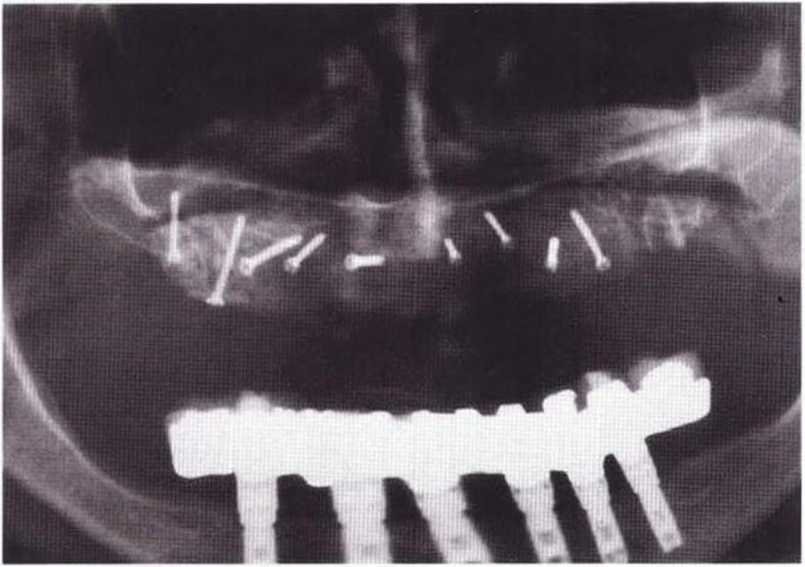
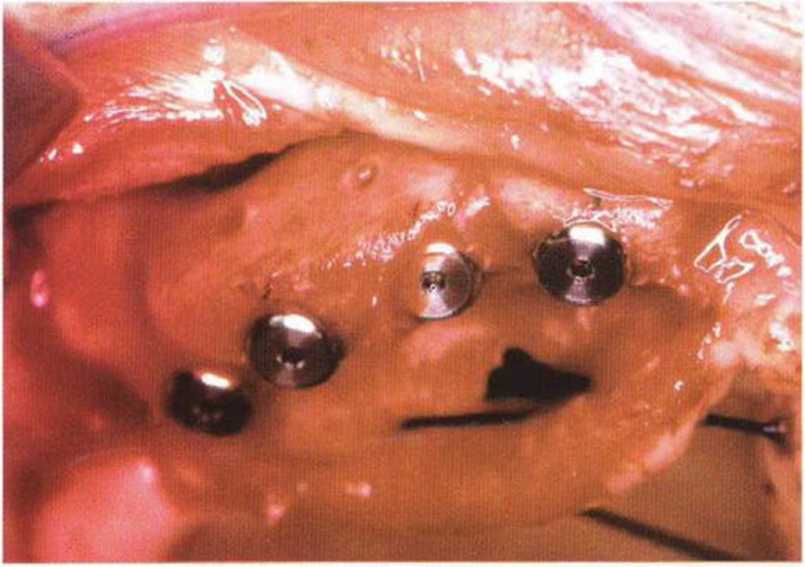
Рис. 6-1 п. Установка четырех имплантатов в новообразованной кости с правой стороны верхней челюсти
Рис. 6-1 т. Контрольная рентгенограмма через 4 мес после операции
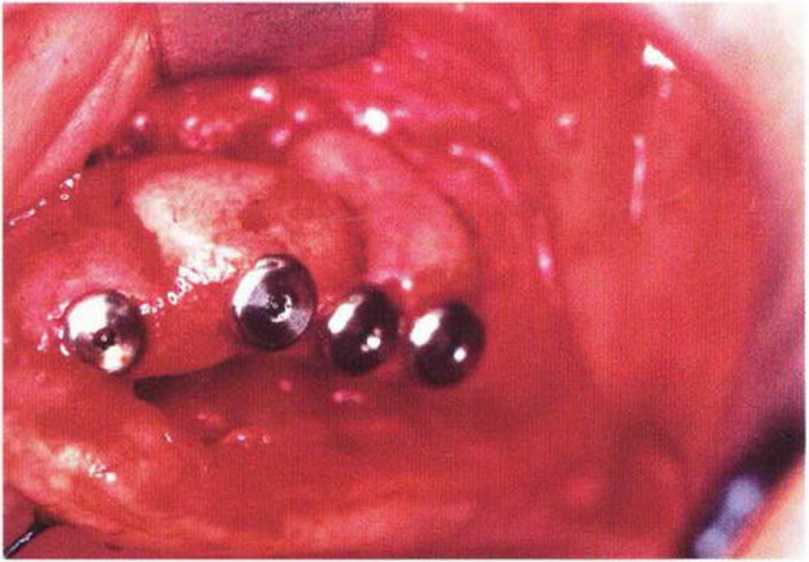
Рис. 6-1 о. Аналогичная ситуация с левой стороны верхней челюсти
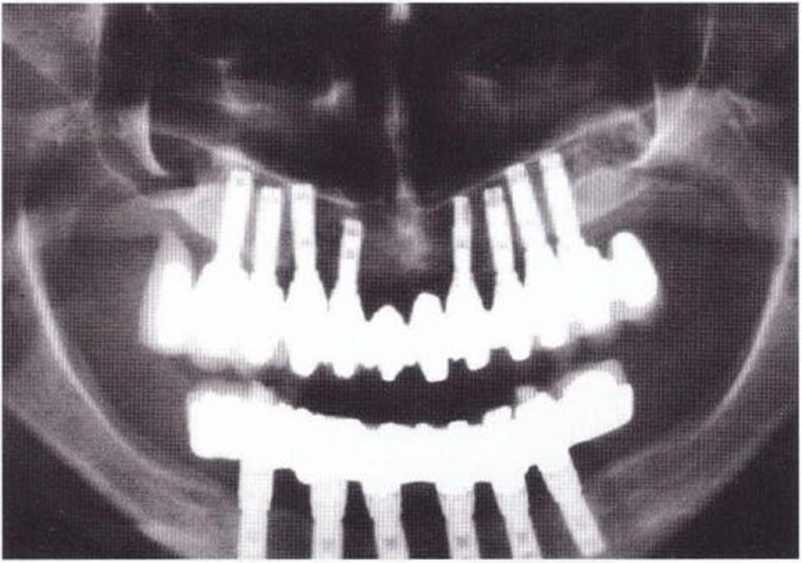
Рис. 6-1 р. Контрольная рентгенограмма через 5 лет после операции.
.
6.3 Пересадка костного трансплантата из большеберцовой кости.
Пересадка трансплантата из головки большеберцовой кости при лечении пациентов с расщелинами губы, челюсти и нёба была описана еще в 1914 г,однако этот метод сильно отличается от регенеративных вмешательств для установки имплантатов.
К преимуществам получения трансплантата из проксимального отдела большеберцовой кости относятся простота хирургического доступа даже у пациентов с избыточной массой тела, быстрая мобилизация костного блока и незначительное ограничение движений соответствующей ноги. Данное вмешательство можно проводить в амбулаторных условиях. Проксимальный отдел большеберцовой кости считается идеальным донорским участком при необходимости пересадки губчатого костного вещества. По данным исследований, объем костного трансплантата (губчатого вещества) достигает 15 мл. Кроме того, в донорской области отмечается очень низкий риск осложнений (в основном гематомы и инфицирование раны).-.
Как правило, рекомендуется медиальный доступ на уровне или немного выше бугристости большеберцовой кости, поскольку при этом, в отличие от латерального доступа, не требуется мобилизация связок или сухожилий мышц (рис. 6-2). Трансплантат можно получить в виде монокортикального или кортикально-губчатого блока. Каудальный доступ, особенно у молодых пациентов, сокращает риск повреждения эпифиза, однако ассоциируется с меньшим объемом и худшим качеством костного трансплантата. Ниже представлен метод получения трансплантата из большеберцовой кости, описанный Jakse в 2006 г.
Пациентам назначают антибиотикопрофилакти-ку (амоксициллин с клавулановой кислотой по 1 г 3 раза в день в течение 10 дней). Как правило, операцию проводят под местной анестезией. Пациент находится в положении лежа на спине, колено согнуто, голень располагается почти вертикально.
Операционную область обрабатывают антисептиком и изолируют стерильными салфетками. Для ориентирования в ходе вмешательства нужно маркировать анатомические структуры, в частности коленный изгиб, бугристость и медиальный край большеберцовой кости (рис. 6-За). Подлежащая поверхность кости легко пальпируется, над ней намечают линию разреза. Хирургический доступ длиной 2-3 см создают на 2 см ниже коленного сустава.
Каудальный край соответствует нижнему краю бугристости.
Местный анестетик без адреналина вводят в область медиального края большеберцовой кости, что приводит к выключению поднадколенной ветви подкожного нерва. После кратковременного ожидания нужно обезболить прилегающие участки кожи и надкостницу (рис. 6-ЗЬ).
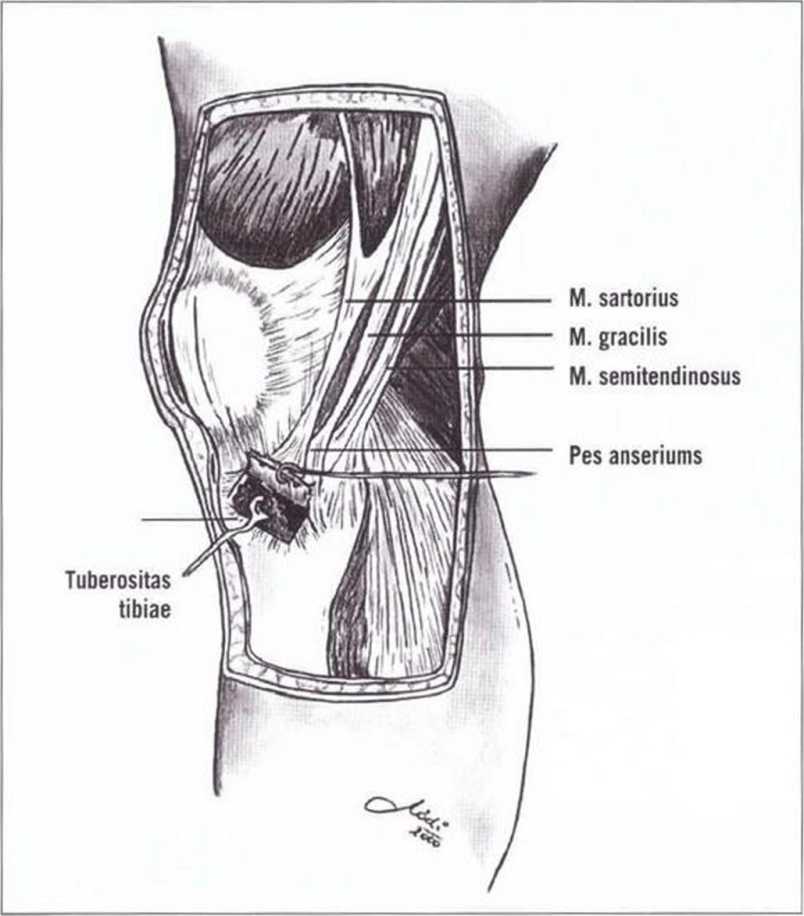
Рис. 6-2. Схема доступа для получения костного трансплантата из головки большеберцовой кости. Кортикальный костный трансплантат над губчатым веществом в области головки большеберцовой кости удерживается на ножке «гусиной лапки», (иллюстрация: д-р Volker Modrescher, стоматологическая клиника, Грац, Австрия.
Рис. 6-2-6-Зк предоставлены профессором Norbert Jakse, Г рац, Австрия)
Разрез проводят в соответствии с запланированным и обозначенным направлением и размером. Мягкие ткани рассекают до прикрепления трех бедренных сухожилий (полусухожильной, тонкой и портняжной мышц), образующих «гусиную лапку». При этом кожа и годкожные ткани удерживаются ранорасширителем для оптимальной визуализации донорского участка. Выпиленный костный фрагмент оставляют на питающей ножке у медиального отдела «гусиной лапки» (рис. 6-Зс).
Каудальный край трансплантата находится на уровне бугристости большеберцовой кости (рис. 6-3d), краниальный край располагается на 20 мм ниже поверхности коленного сустава. Кости рекомендуется распиливать осциллирующей пилой, что облегчает определение размера кортикального слоя (рис. 6-Зе). Затем долотом мобилизуют костный блок, одновременно формируя доступ к костному мозгу. После этого кюретажной ложкой с острым краем собирают нужное количество губчатой кости (рис. 6-3f-6-3i). Закончив забор костной ткани, костный лоскут фиксируют надкостничными швами в исходном положении. Многослойное закрытие раны с внутрикожным непрерывным швом снижает риск рубцевания кожи (рис. 6-3j и 6-Зк).
На рану накладывают давящую повязку, что снижает риск образования гематомы и уменьшает дискомфорт в послеоперационном периоде. Как правило, данное вмешательство можно проводить в амбулаторных условиях. В дополнение к антибио-тикопрофилактике пациенту назначают противовоспалительные и обезболивающие средства, принимать которые нужно в течение 10 дней. Обычная функциональная нагрузка на оперированную конечность допускается сразу после вмешательства.
Интенсивные нагрузки, например при спортивных занятиях, можно возобновить уже через 2 недели после вмешательства. В первые 3 мес следует избегать избыточной нагрузки на оперированное колено. Первый контрольный осмотр проводят через 5 дней после снятия давящей повязки. Обработав, рану заклеивают обычным пластырем. Кроме того, в первые 2 недели после вмешательства пациентам рекомендуется носить компрессионные чулки. Внутрикожные косметические швы удаляют через 10 дней.
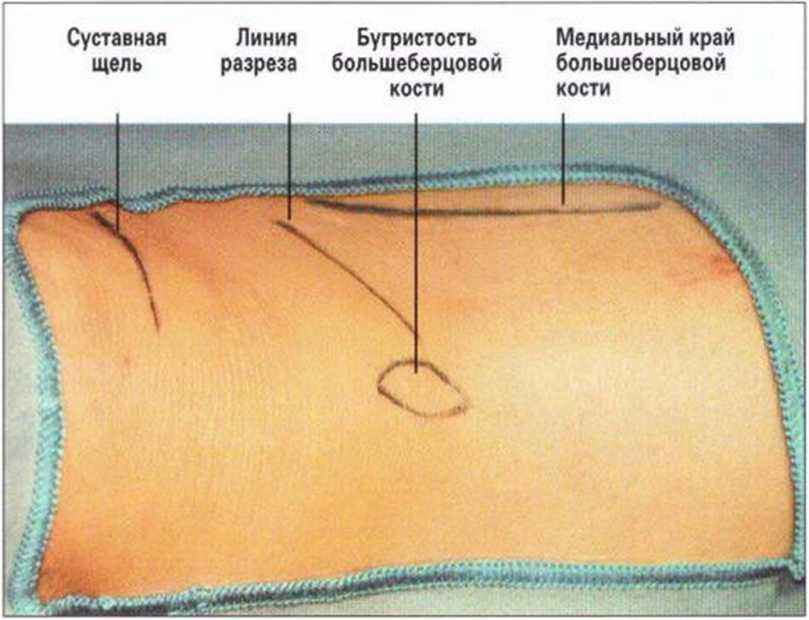
Рис. 6-За. После изоляции операционного поля маркируют анатомические структуры для определения линии разреза
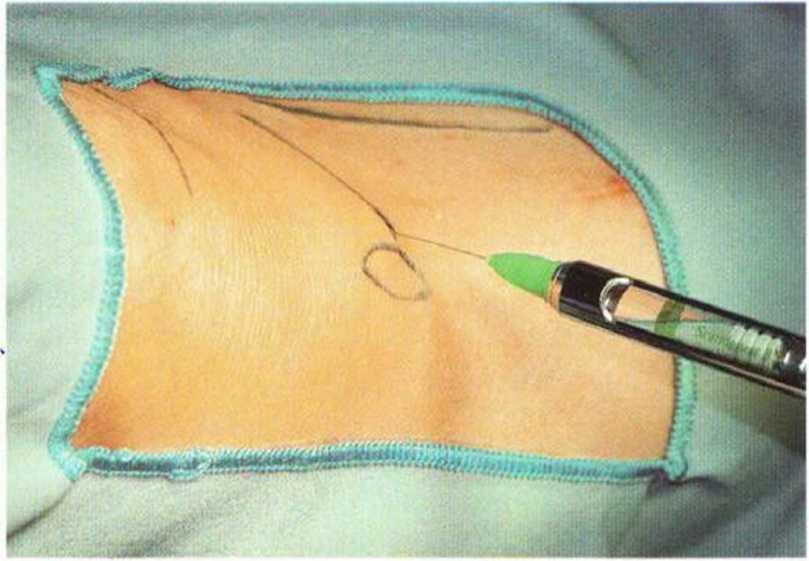
Рис. 6-ЗЬ. При введении местного анестетика первое депо создается в области медиального мыщелка для проводниковой анестезии поднадколенниковой ветви подкожного нерва. Анестезию проводят в области линии разреза кожи до надкостницы
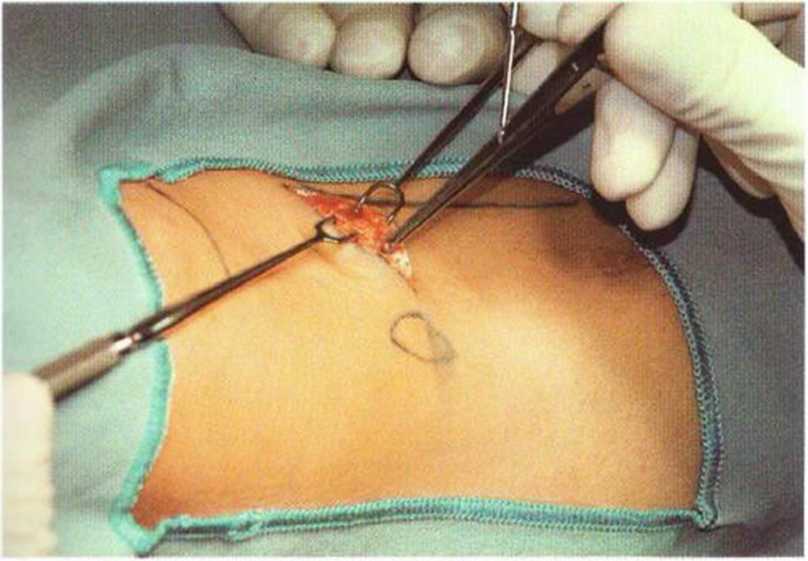
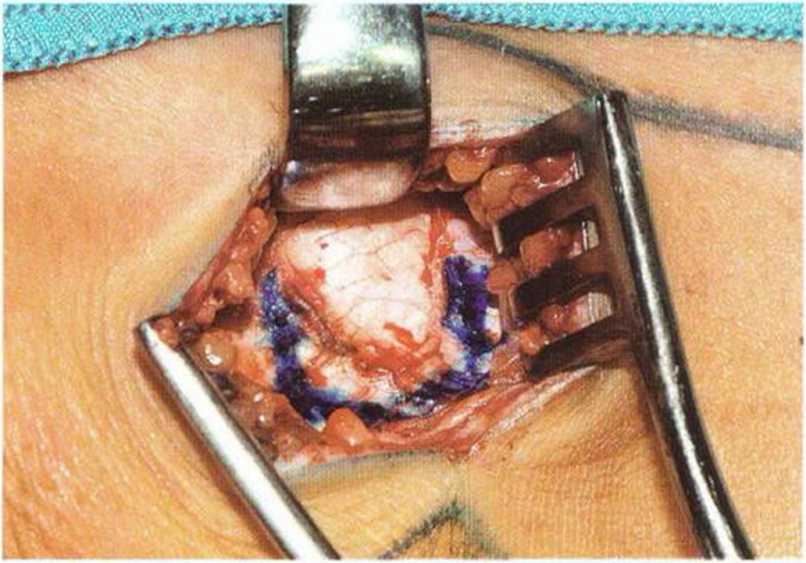
Рис. 6-3d. Визуализация кости в донорской области с помощью ранорасширителей, границы костного трансплантата маркированы
Рис. 6-Зс. В донорской области лоскут отслаивают до «гусиной лапки», гемостаз обеспечивается с помощью электрокоагуляции
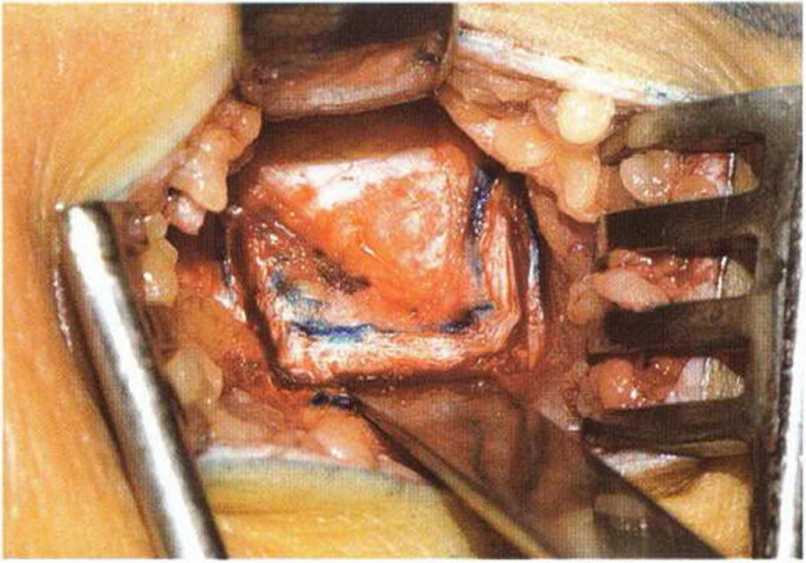
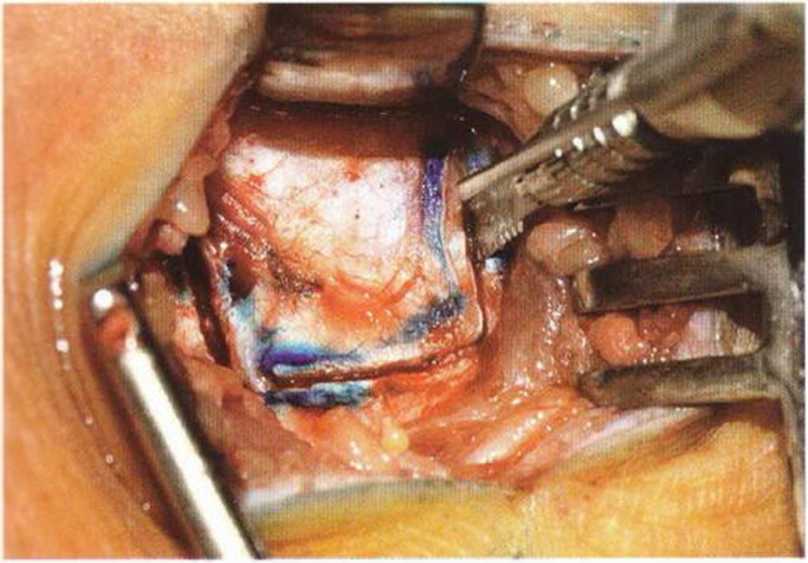
Рис. 6-Зе. Выпиливание костного трансплантата осциллирующей пилой: краниальный и каудальный распилы с сохранением медиальной ножки
Рис. 6-3f. Мобилизация костного трансплантата долотом с осуществлением доступа к губчатой кости
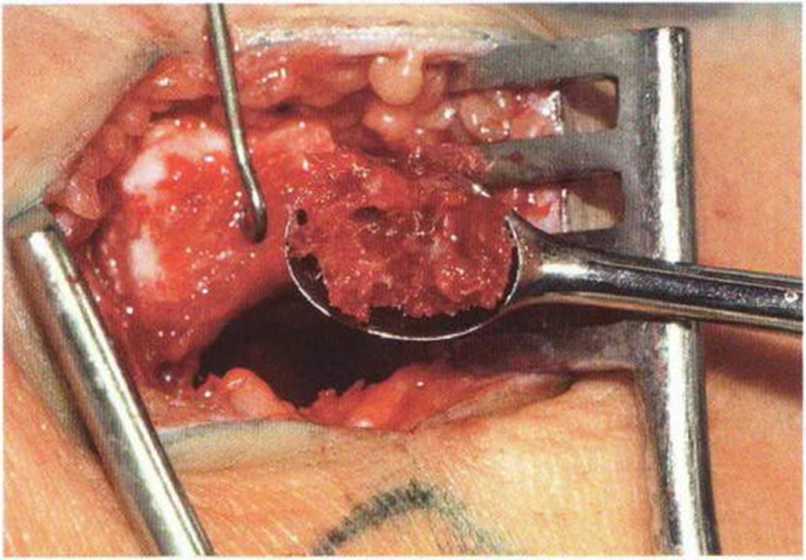
Рис. 6-Зд. Получение губчатого вещества из головки большеберцовой кости
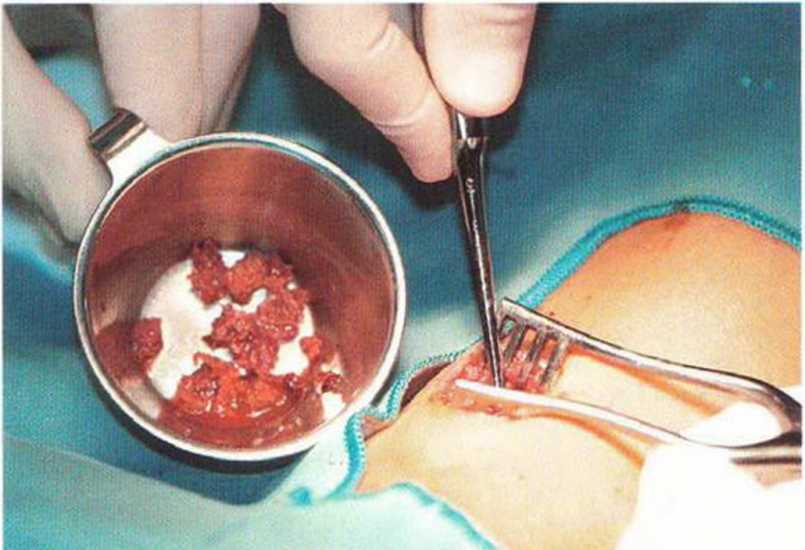
Рис. 6-3h. Крупные фрагменты губчатой костной ткани из медиальной головки большеберцовой кости
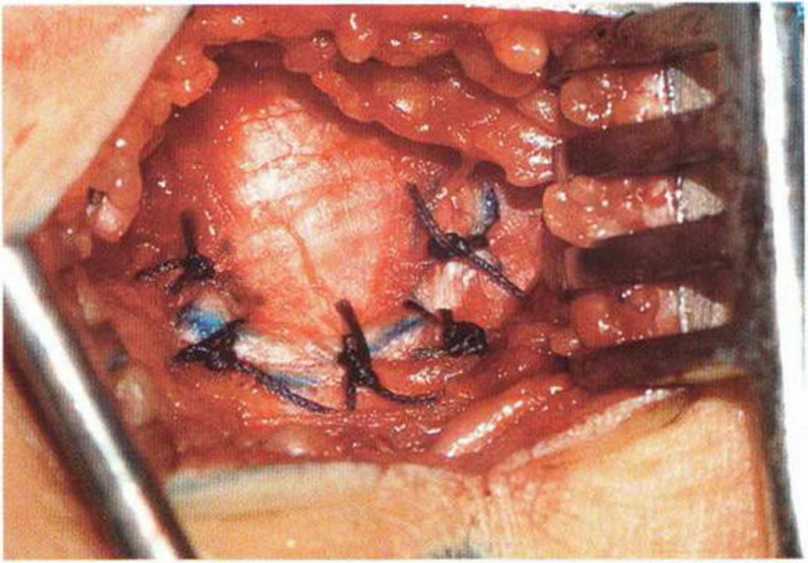
Рис. 6-3i. После репозиции костного лоскута в области донорского участка накладываются резорбируемые швы
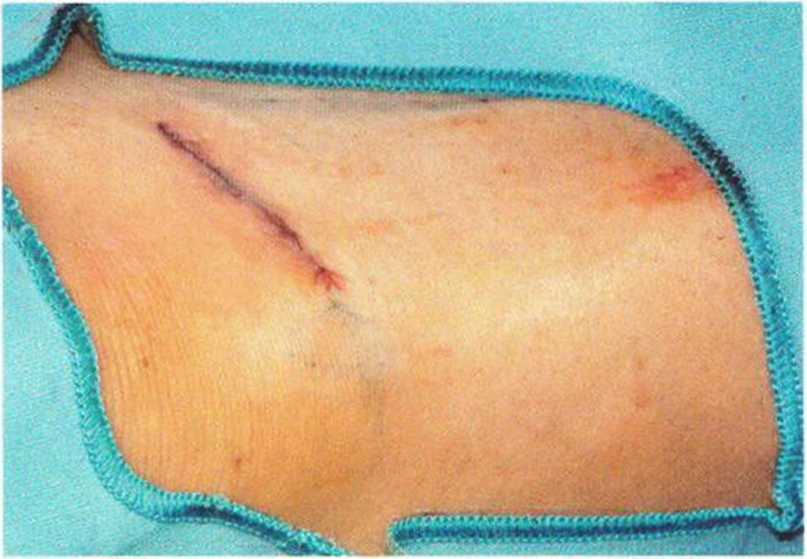
Рис. 6-3j. Ушивание раны внутрикожным швом
Головку большеберцовой кости можно использовать для получения костного трансплантата при необходимости поднятия дна верхнечелюстной пазухи на значительное расстояние. При этом полученную губчатую кость смешивают с гетерогенным материалом. Однако для увеличения высоты и толщины альвеолярного гребня трансплантация костной ткани из большеберцовой кости не показана из-за недостаточного количества кортикальной кости, которое можно получить из указанного источника.
Дискомфорт и риск осложнений после вмешательства на большеберцовой кости относительно низкие. Осложнения возникают не более чем в 2 % случаев.’ Среди осложнений чаще отмечаются кровотечение, отек, гематома или временная парестезия. Переломы происходят относительно редко, объясняются избыточной инвазивностью вмешательства и могут быть полностью исключены при проведении не прямоугольных, а закругленных распилов. Ограничения подвижности наблюдаются редко.
По имеющимся данным, жалобы пациентов на нарушение чувствительности и затруднения при ходьбе продолжаются в среднем 10 дней. Отметим, что они коррелируют с массой тела пациента.
Было установлено, что незначительные ограничения подвижности и жалобы на боль при ходьбе более 2 недель отмечались всего у 5 % пациентов, обычно пожилых и с избыточной массой тела.
У более чем 80 % пациентов после операции сохраняется полная подвижность, а у 10 % наблюдалась временная парестезия в области вмешательства, особенно при использовании медиального доступа.
Случаи трансплантации из гребня подвздошной кости были описаны при лечении травм лицевого черепа уже во время Первой мировой войны. Целостность челюстей восстанавливали с помощью бикортикальных костных блоков, фиксированных проволокой. В настоящее время бикортикальные блоки применяют при реконструкции нижней челюсти после частичных резекций при онкологических заболеваниях, если рецидива нет в течение не менее 1 года. Выраженная болезненность после забора би- или трикортикальных блоков объясняется нарушением целостности кости на значительном протяжении.- После отслаивания сухожилий пациенты длительное время ощущают боль при движении, что может привести к вынужденному ограничению подвижности. Односторонние изменения контура подвздошного гребня создают эстетические нарушения, особенно у худых пациентов.
Монокортикальные трансплантаты с внутренней части гребня подвздошной кости можно получить передним и дистальным доступом. Кажущееся преимущество незначительной послеоперационной болезненности при дистальном доступе нивелируется большей инвазивностью вмешательства, необходимостью значительного отведения тканей и вероятным получением бикортикального трансплантата вследствие затрудненного доступа.
Передний доступ (рис. 6-4а) обеспечивает хороший обзор области вмешательства. Несмотря на сравнительно короткий разрез, формируется более широкое операционное поле с возможностью отслаивания нескольких лоскутов. Благодаря хорошему обзору при переднем доступе также возможен забор достаточного количества губчатого вещества для трехмерной пластики альвеолярного гребня (рис. 6-4Ь). Монокортикальные трансплантаты с внутренней части гребня подвздошной кости фиксируют в области планируемой имплантации (рис. 6-4с). Пересадку бикортикальных блоков (рис. 6-4d) проводят при обширных реконструктивных вмешательствах на челюсти, например при нарушении непрерывности нижней челюсти после резекции злокачественных новообразований.
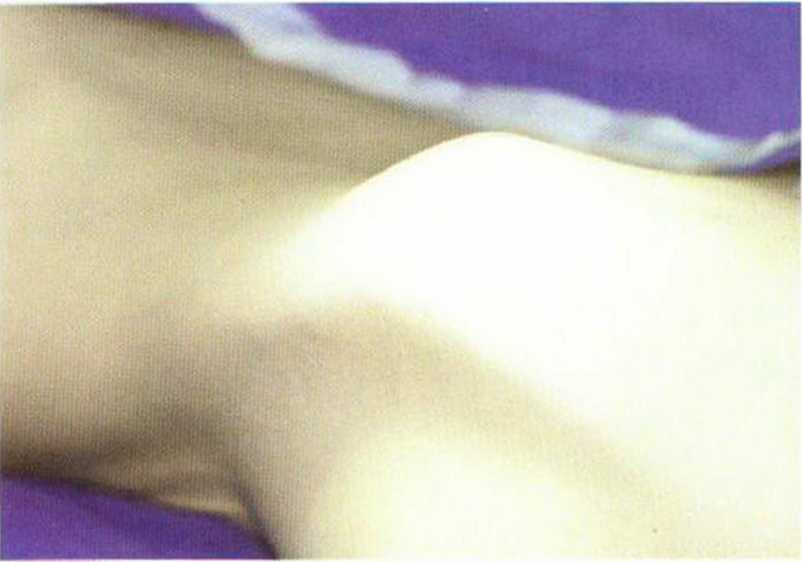
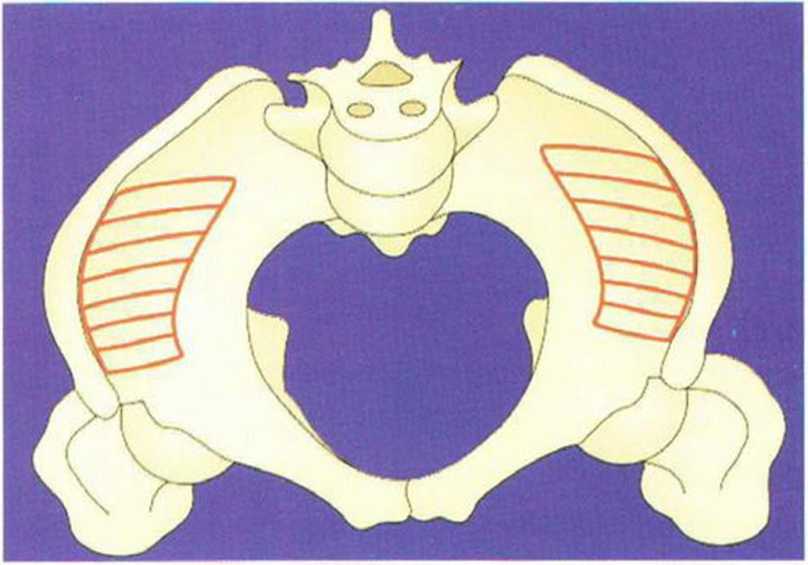
Рис. 6-4а. Донорская область в верхнем переднем отделе гребня подвздошной кости.
Рис. 6-4Ь. Схема получения монокортикальных лоскутов из гребня подвздошной кости
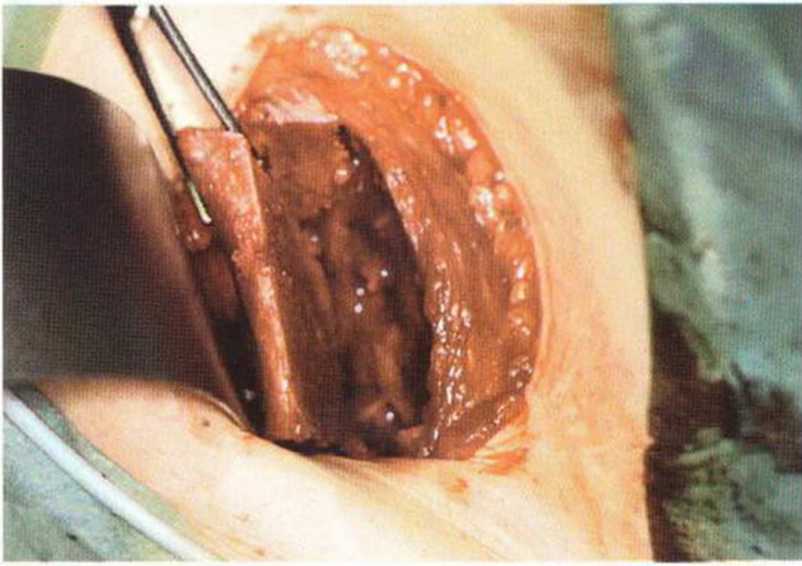
Рис. 6-4с. Традиционный забор монокортикального блока на внутренней стороне подвздошного гребня: наружные мышцы не отслаивают
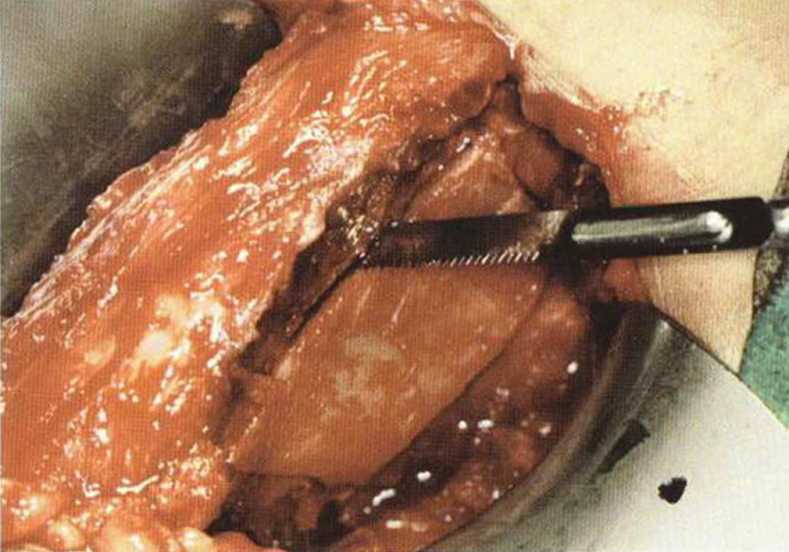
Рис. 6-4d. При заборе крупных бикортикальных костных трансплантатов (например, для восстановления непрерывности челюсти) отслаиваются все мышцы с обеих сторон подвздошной кости, что значительно ограничивает двигательную активность пациента
Для увеличения объема альвеолярного гребня с целью установки имплантатов предпочтительно применение малоинвазивных, но достаточно эффективных методов трансплантации, которые ассциируются с минимальным дискомфортом пациента в послеоперационном периоде. Вмешательство в области донорского и принимающего участков нужно проводить как можно более щадящим образом. Для улучшения состояния мягких тканей показано использование соответствующих пластических операций (в том числе на этапе раскрытия имплантатов).
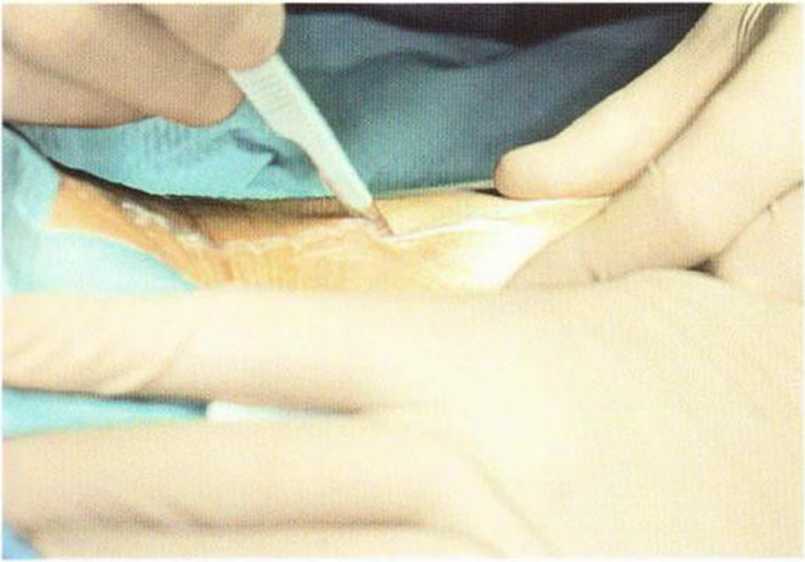
Рис. 6-5а. Разрез над передним краем подвздошного гребня с медиальной мобилизацией кожного лоскута
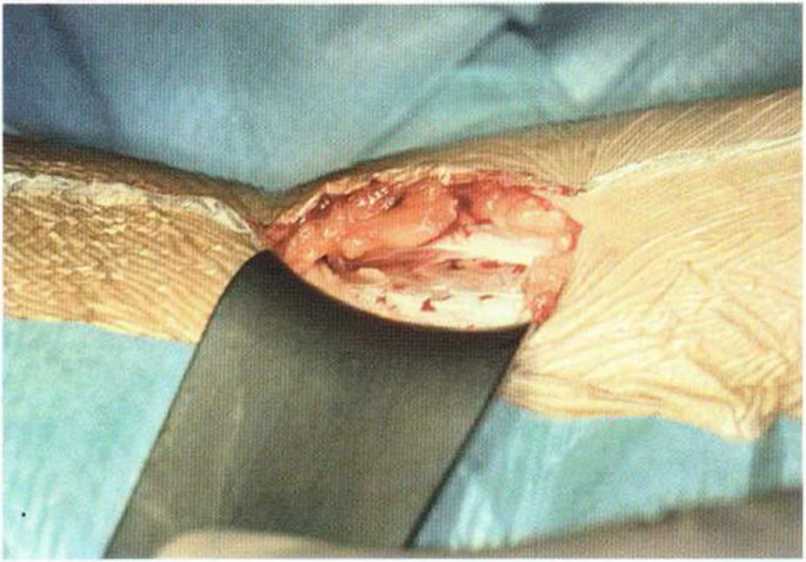
Рис. 6-5Ь. Многослойное препарирование мягких тканей над донорским участком.
Получение трансплантата из гребня подвздошной кости.
В качестве донорского участка рекомендуется внутренний край переднего отдела гребня подвздошной кости. Более простым считается вентральный доступ на правой стороне. После инфильтраци-онной анестезии (с адреналином), надавливая на брюшную стенку, кожу мобилизуют вентрально (рис. 6-5а). Разрез до надкостницы длиной 4 см проводят на 1 см латеральнее гребня подвздошной кости в соответствии с предварительной маркировкой (рис. 6-5Ь). Для остановки кровотечения при рассечении кожи показана электрокоагуляция сосудов. После выделения надкостницы накладывают большие ранорасширители. В очень редких случаях непосредственно в операционной области располагается латеральный кожный нерв бедра.
Надкостницу медиального края гребня подвздошной кости мобилизуют на глубину до 8 см, затем накладывают крючок Хоманна (Hohmann) с ретенционным элементом, который располагают в самом глубоком отделе отслаивания надкостницы на внутренней кортикальной поверхности. При этом следует избегать рассечения латерального кожного нерва бедра и подвздошно-подчревного нерва.
Чтобы уменьшить боль и избежать ограничений подвижности в послеоперационном периоде, нельзя отслаивать сухожилия средней ягодичной мышцы и мышцы, напрягающей широкую фасцию. В сагиттальном направлении надкостницу отслаивают до 0,5 см дорсально от передней границы гребня подвздошной кости.
После осуществления доступа к донорской области осциллирующей пилой проводят несколько вертикальных распилов на глубину около 5 мм.
Первый распил делают как минимум на 1,5 см дорсально и на 5-6 см каудально от вентрального края подвздошной кости. Следующий распил проводят на расстоянии около 15 мм дорсальнее первого.
Полученные таким образом монокортикальные трансплантаты размером примерно 5 х 1,5 см фиксируют на соответствующих участках альвеолярного гребня. В зависимости от конфигурации устраняемого дефекта размеры блоков могут отличаться. Забор кости отдельными фрагментами уменьшает необходимость дополнительной обработки трансплантатов (рис. 6-5с-6-5д). Кроме того, сокращается продолжительность операции, и, следовательно, снижается частота осложнений. Полученный объем костной ткани позволяет устранить дефект размером 14 х 6 см. При необходимости хирургический доступ расширяют вдоль операционного поля.
Начальное препарирование кости проводят широким долотом с внутренней стороны гребня подвздошной кости. Затем забор монокортикаль-ных лоскутов продолжают более узким долотом шириной около 12 мм. Благодаря забору трансплантата фрагментами не требуется проведение базального распила осциллирующей пилой, поскольку блоки отделяются при повороте долота. Манипуляцию продолжают до получения нужного объема костной ткани. Оставшаяся на наружной кортикальной пластинке губчатая кость также может быть использована для трансплантации (рис. 6-5h и 6-5i). При обширных регенеративных вмешательствах забор губчатой кости проводят за пределами основного донорского участка из промежуточных пространств между внутренним и наружным кортикальными слоями. Для профилактики послеоперационного кровотечения образовавшиеся костномозговые пространства запечатывают костным воском (рис. 6-5j и 6-5к). Во избежание образования гематомы в донорскую область помещают пропитанную тромбином коллагеновую губку (TachoSil, Nycomed) (рис. 6-5I). При кровотечении из внутренних мышц после забора бикортикальных лоскутов гемостатик также наносят на раневую поверхность. На период пребывания пациента в стационаре в рану устанавливают вакуумный дренаж, особенно при невозможности полного запечатывания губчатой кости костным воском.
Ушивание раны проводят на нескольких уровнях: сначала фиксируют надкостницу прочными ре-зорбируемыми швами (Vycril 0-0, Ethicon, Johnson & Johnson) для последующей адаптации мягких тканей без натяжения. Мышцы ушивают прочными ре-зорбируемыми швами (Vycril 2-0) (рис. 6-5т). Затем более тонким резорбируемым материалом (Vycril 3-0) ушивают подкожную клетчатку (рис. 6-5п).
В последнюю очередь накладывают внутрикож-ный непрерывный косметический шов (Cutalon 3-0) (рис. 6-5о). Для лучшего заживления раны и снижения риска образования рубцов рекомендуется накладывать прямоугольный шов. Края раны сводятся тонким хирургическим пластырем (Steristrips) (рис. 6-5р), рану полностью заклеивают воздухопроницаемым силиконовым пластырем, который не меняют до снятия швов (рис. 6-5q). Швы, как правило, удаляются через 10 дней, после чего края раны фиксируются хирургическим пластырем еще на 5 дней.
Молодых пациентов выписывают из стационара при условии удовлетворительного общего состояния. Пожилым пациентам, страдающим сердечно-сосудистыми заболеваниями, при обширных регенеративных вмешательствах нередко показано более продолжительное пребывание в стационаре.
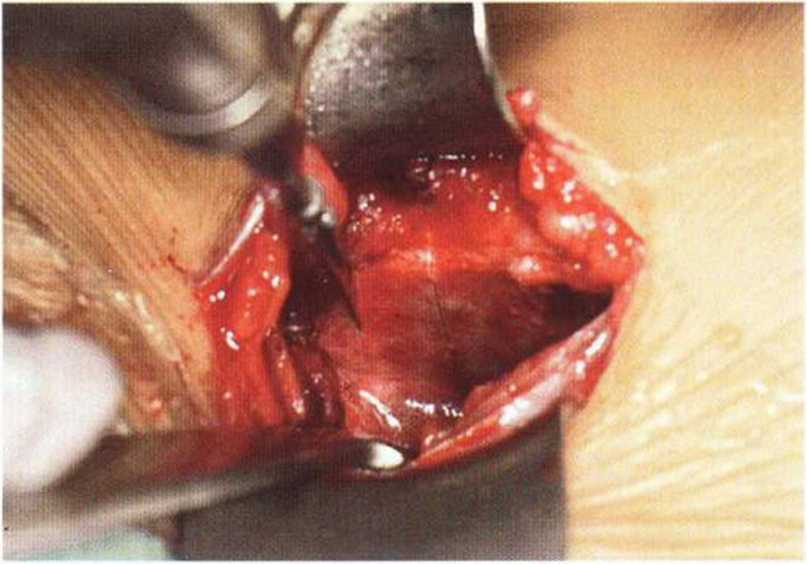
Рис. 6-5с. Вертикальный распил на внутренней стороне гребня подвздошной кости с помощью осциллирующей пилы
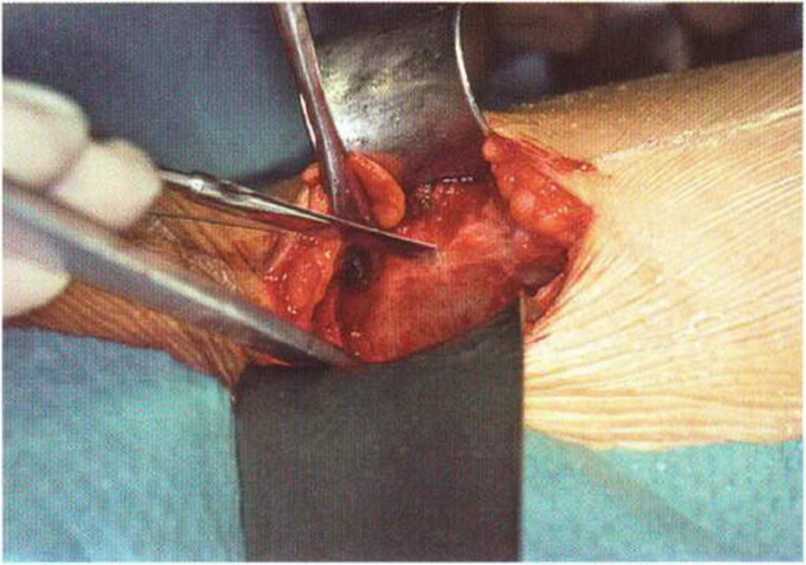
Рис. 6-5d. Распил на внутренней стороне гребня подвздошной кости для получения монокортикальных трансплантатов
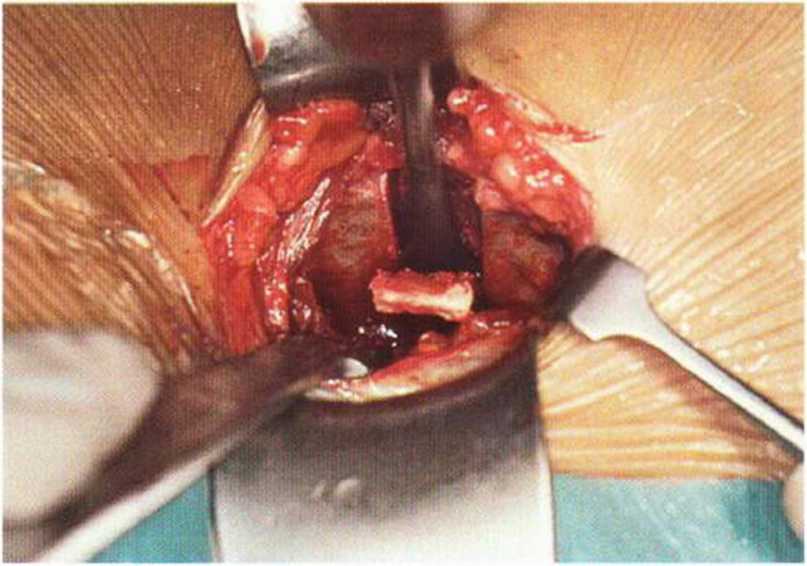
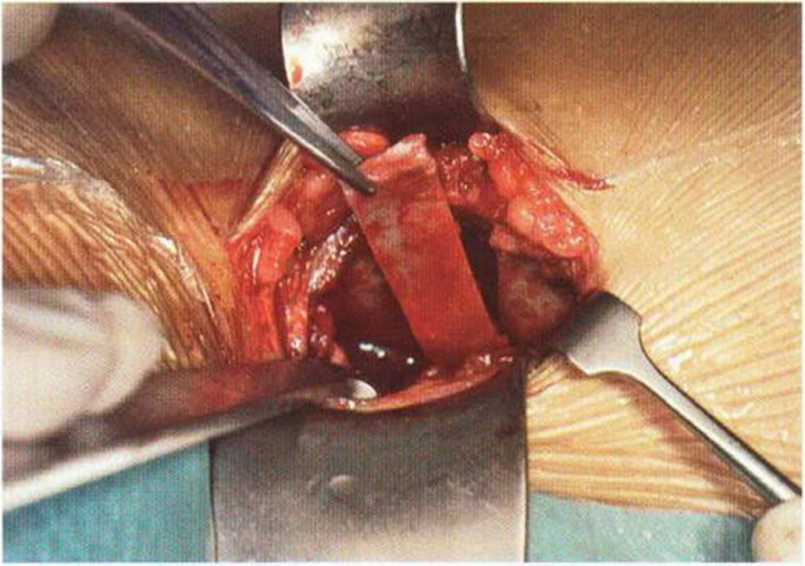
Рис. 6-5е. Отделение монокортикальных блоков долотом.
Рис. 6-5f. Получение монокортикальных блоков из переднего отдела гребня подвздошной кости
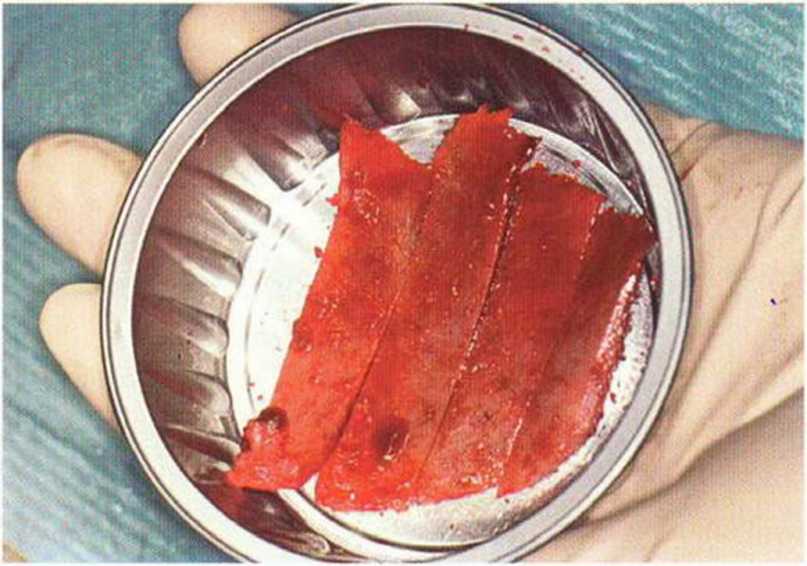
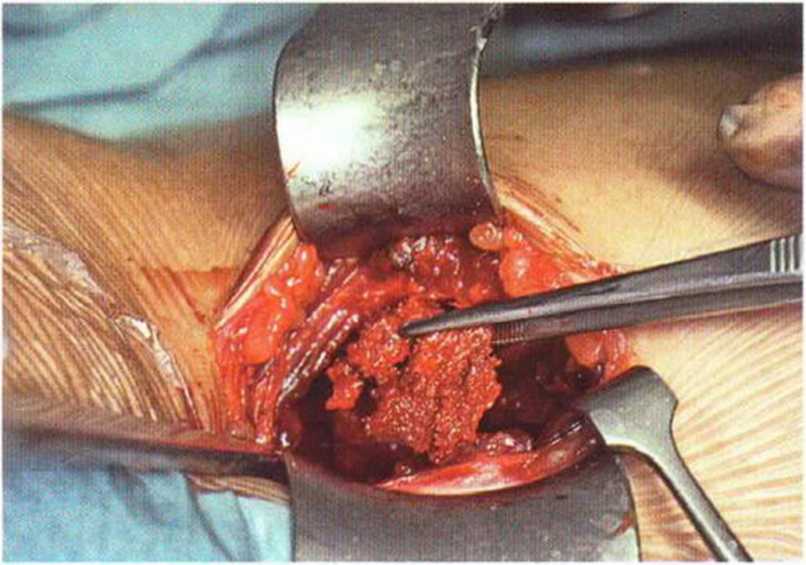
Рис. 6-5g. Четыре монокортикальных трансплантата для реконструкции нижней челюсти.
Рис. 6-5h. Забор губчатого вещества в донорской области
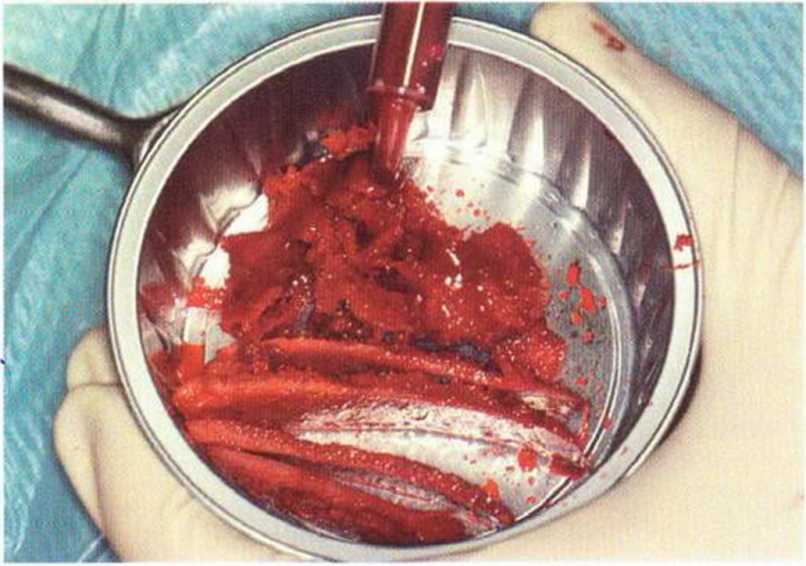
Рис. 6-5i. В одной донорской области получен большой объем костной ткани
Рис. 6-5j. Заполнение открытых губчатых пространств костным воском
Рис. 6-5к. Гемостаз обеспечивается запечатыванием губчатых пространств костным воском
Рис. 6-51. Введение пропитанной фибрином коллагеновой губки для дополнительного гемостаза в области мягких тканей
Рис. 6-5т. Адаптация прикрепляющихся к подвздошному гребню мышц брюшной стенки при многослойном ушивании раны
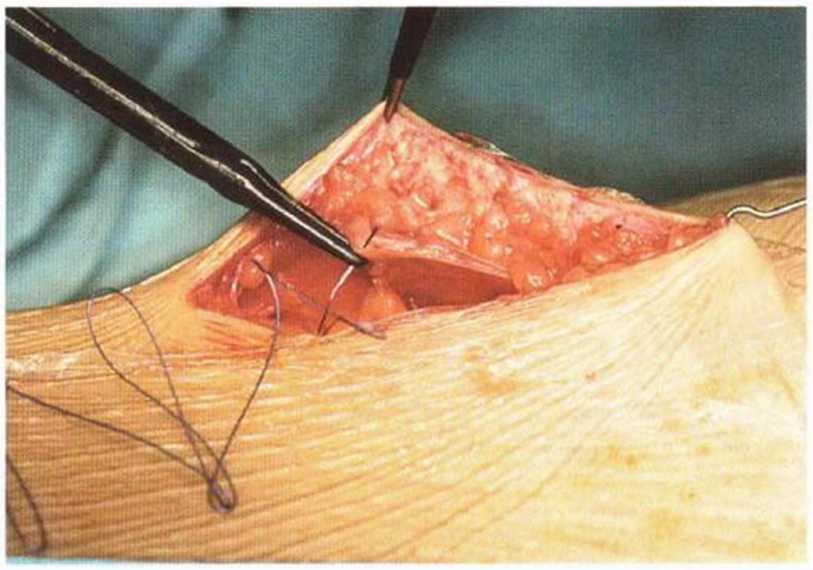
Рис. 6-5п. Подкожный шов для адаптации краев кожной раны
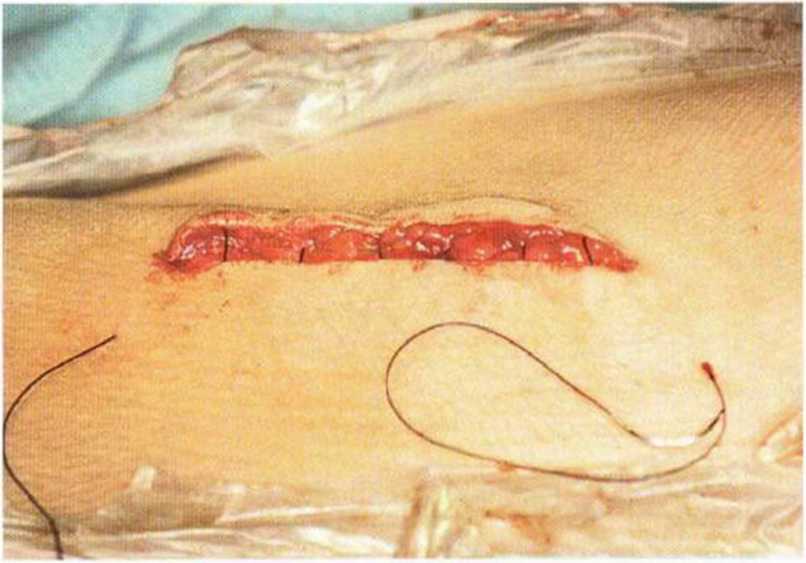
Рис. 6-5о. Заключительный внутрикожный непрерывный шов
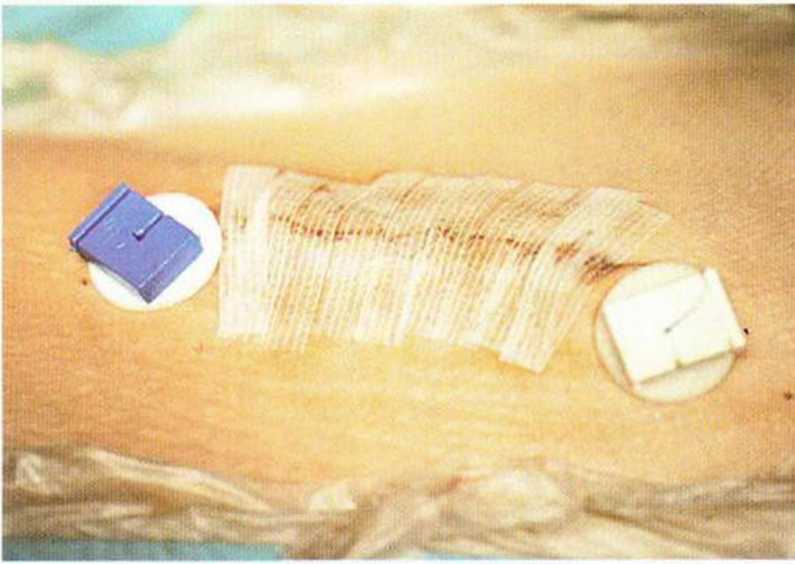

Рис. 6-5р. Фиксация непрерывного шва двумя зажимами и горизонтальная адаптация кожи пластырем Steristrip для уменьшения рубцевания.
Рис. 6-5q. Раневая повязка с воздухопроницаемым силиконовым пластырем накладывается на 10 дней.
.
Пересадка трансплантата из гребня подвздошной кости.
Монокортикальные блоки из гребня подвздошной кости можно эффективно использовать для устранения дефектов альвеолярной кости, однако для консолидации свободного трансплантата требуется его надежное перекрывание мягкими тканями без натяжения. Перфорация лоскута в период заживления может привести к частичной или полной утрате трансплантата. Известно несколько методик ушивания раны без напряжения.’ При проведении разреза по середине, а также по вестибулярному или язычному краю альвеолярного гребня необходима мобилизация лоскута с помощью рассечения надкостницы. В зависимости от размера трансплантата может потребоваться отслаивание лоскута на значительном протяжении, причем свести края раны без натяжения удается не всегда. Прогнозируемое надежное сопоставление краев раны без натяжения возможно при многослойном ушивании. Для этого сначала проводят разрез в области слизисто-десневого соединения, затем отслаивают слизистый лоскут до альвеолярного гребня. От второго разреза, который делают на уровне альвеолярного гребня, начинают отслаивать надкостничный лоскут, подготавливая ложе для установки трансплантата. В таком случае трансплантат будет перекрыт только слизистым лоскутом, поэтому для повышения надежности ушивания и снижения риска экспозиции костного трансплантата показана пересадка соединительнотканного трансплантата на питающей ножке.’ Безусловно, расширение поля вмешательства связано с дополнительным операционным риском. Кроме того, формирование соединительнотканного трансплантата на ножке возможно только на верхней челюсти. После значительного увеличения объема альвеолярного гребня рекомендуются две методики надежного перекрывания участка трансплантации мягкими тканями, описанные ниже (рис. 6-6а).
Слизисто-мышечно-надкостничный лоскут (СМН-лоскут).
Для препарирования слизисто-мышечно-надкостничного лоскута разрез проводят вестибулярнее ‘области регенеративного вмешательства. Разрез проходит глубоко в преддверии на уровне подвижной слизистой (рис. 6-6Ь). Удаленность разреза от слизисто-десневого соединения зависит от планируемого увеличения объема гребня. После первого разреза слизистой выполняют более глубокое рассечение мягких тканей. При этом мышцы рассекают как можно выше. Затем осторожно отслаивают слизисто-мышечно-надкостничный лоскут, стараясь не повредить надкостницу (рис. 6-6с).
При регенеративном вмешательстве в области подбородочного отверстия рекомендуется описанная далее тоннельная методика.
В области жевательных зубов верхней челюсти вестибулярный разрез выполняют на безопасном расстоянии от выводного протока околоушной слюнной железы (около 1 см). Во избежание нарушения чувствительности в области верхней губы разрез не должен приближаться к ее красной кайме. При рассечении мышц нередко возникает сильное кровотечение, которое обычно легко купируется с помощью электрокоагуляции.
При значительном увеличении высоты гребня СМН-лоскут формируют до язычной (нёбной) поверхности (рис. 6-6d и 6-6е). В зависимости от стабильности мягких тканей в редких случаях необходима мобилизация лоскута с помощью рассечения надкостницы. Данный этап требует особой осторожности, чтобы максимально сохранить питание лоскута. В качестве альтернативы предлагается отслаивание надкостницы распатором. При вмешательствах в непосредственной близости от зубов периодонтальную связку рассекают периотомом.
Затем весь лоскут, подобно капюшону, перемещается вертикально от прилегающих зубов.
Ушивание раны проводят поэтапно. Вначале резорбируемым шовным материалом (3-0) адаптируется мышечно-надкостничная часть лоскута,
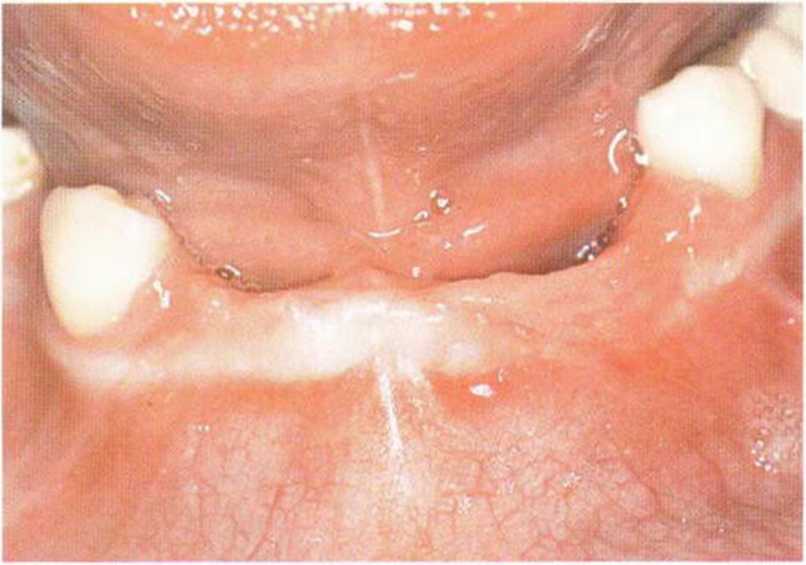
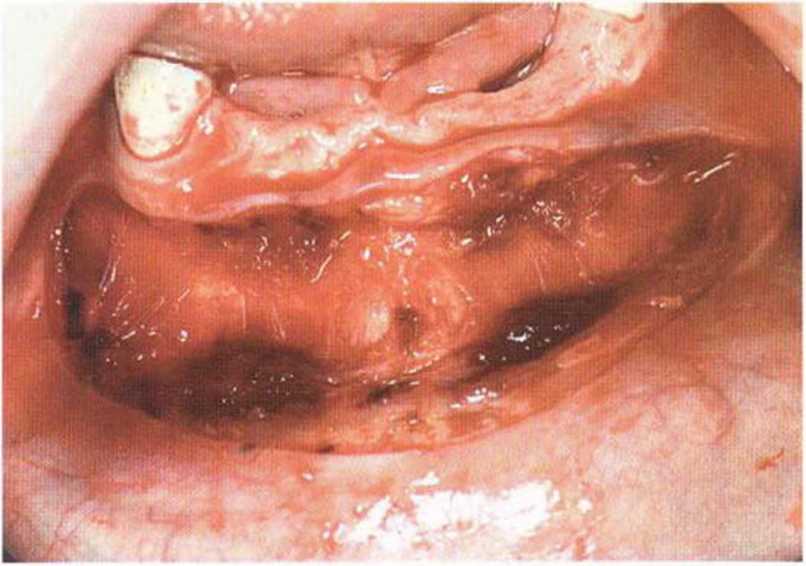
Рис. 6-6Ь. Вестибулярный разрез для визуализации альвеолярного гребня
Рис. 6-6а. Отсутствие нескольких зубов и атрофия переднего отдела нижней челюсти
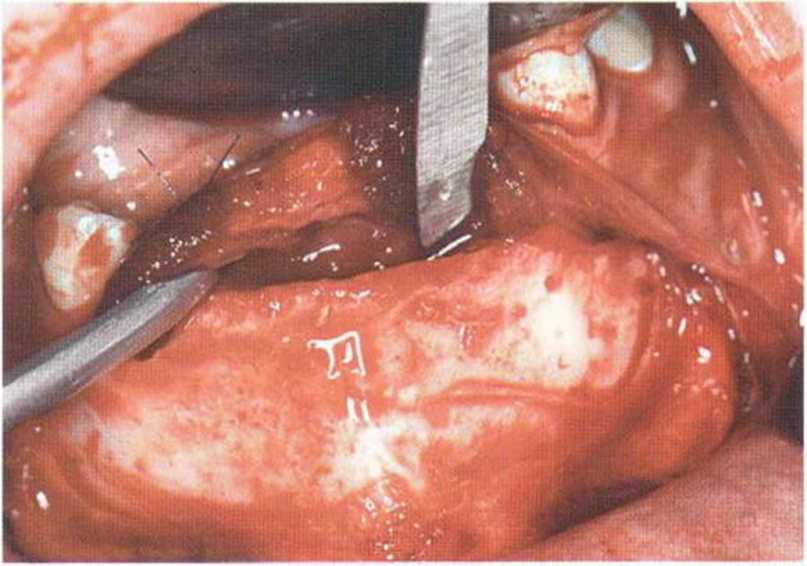
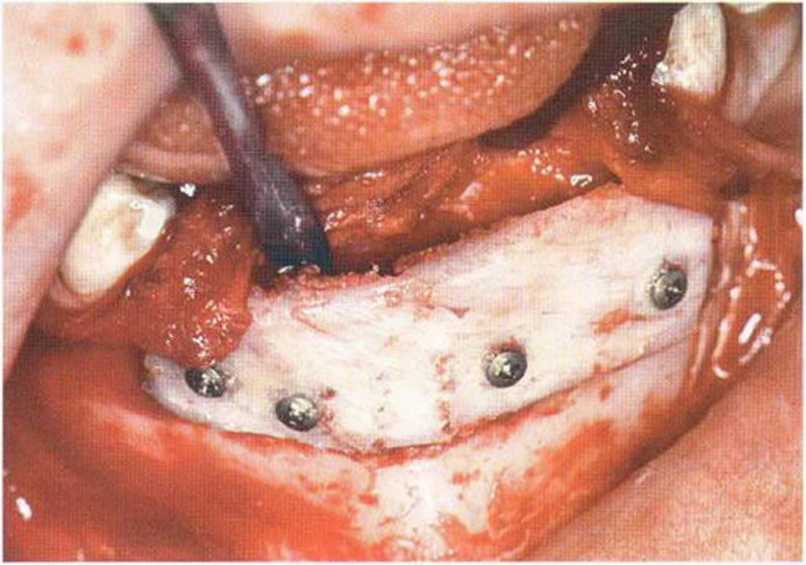
Рис. 6-6с. После отслаивания слизисто-надкостничного лоскута определяется острый край альвеолярного гребня.
Рис. 6-6d. Фиксация вестибулярного монокортикального костного трансплантата для увеличения высоты альвеолярного гребня.
что позволяет свести края раны без натяжения. Простыми узловыми швами герметично ушивают слизистый лоскут. С учетом остаточного натяжения краев раны накладываются швы плетеной.
нитью 4-0 и монофильной нитью 5-0 (рис. 6-6f).
%.
Через 8 дней, в зависимости от степени послеоперационного отека, проводят частичное или полное удаление швов. На следующем этапе нужно исключить давление временного протеза и другие факторы, которые ускоряют резорбцию трансплантата (рис. 6-6g-6-6n). Через 2-3 мес устанавливают имплантаты. На рис. 6-7a-6-7f и
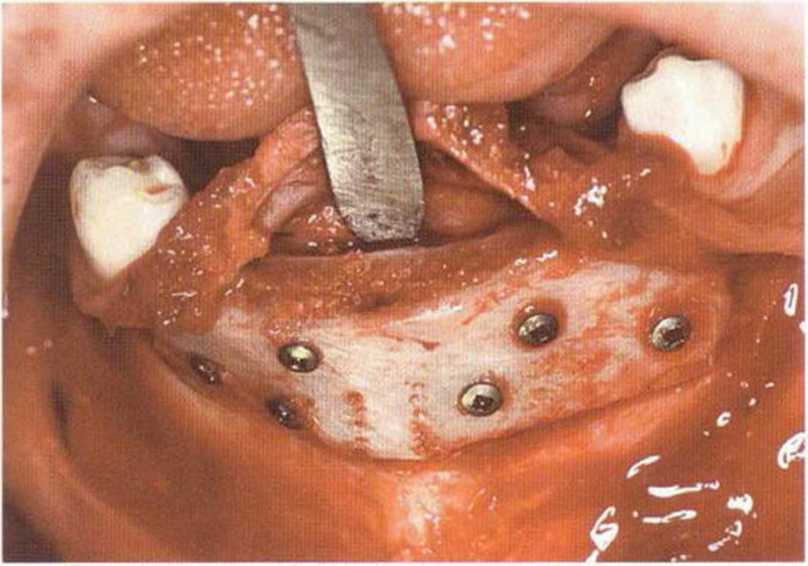
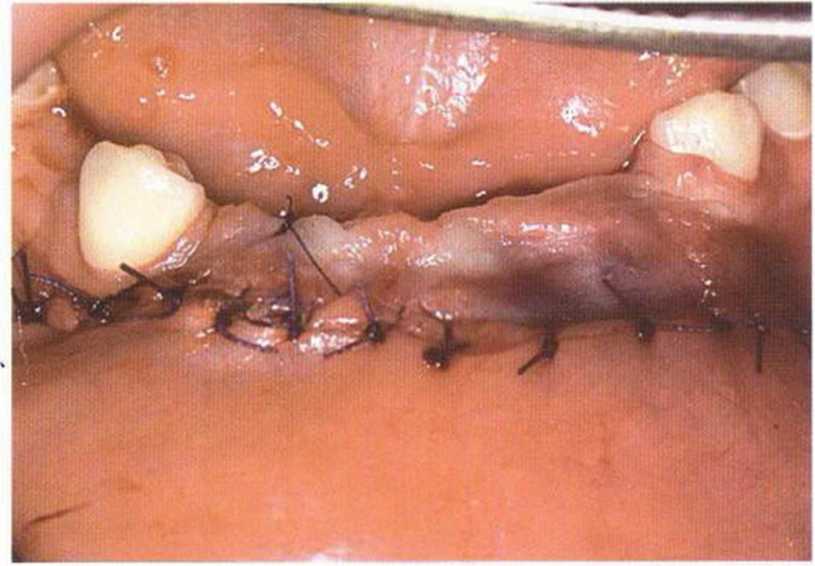
Рис. 6-6f. Окончательное ушивание раны одиночными узловыми швами после адаптации мышц и надкостницы резорбируемым шовным материалом
Рис. 6-6е. Трехмерная пластика после установки второго язычного монокортикального трансплантата и заполнения пространства губчатым веществом
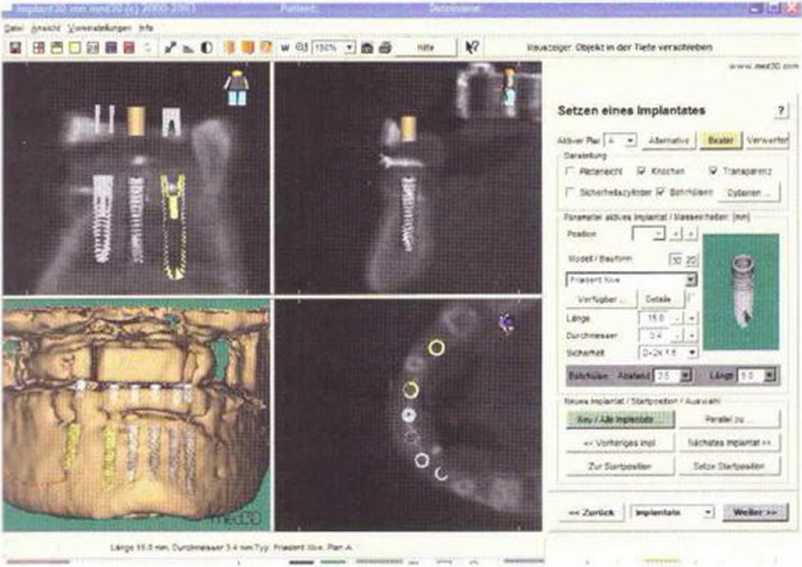
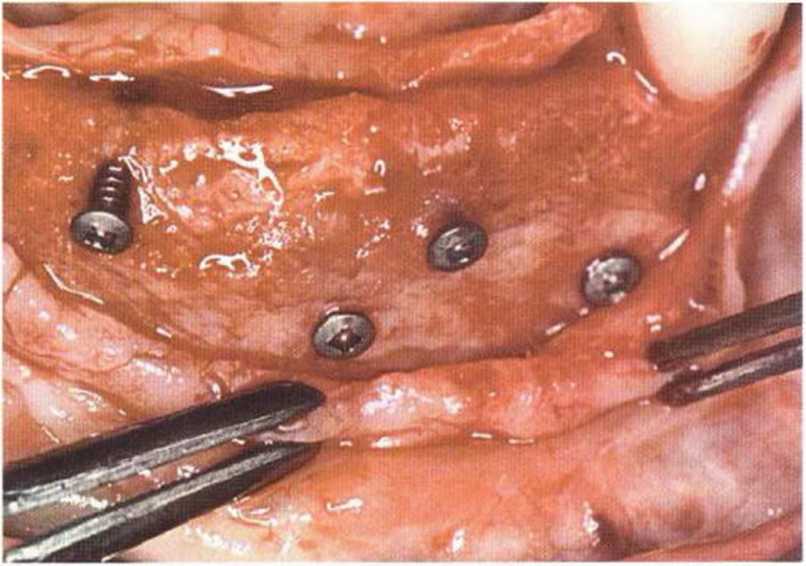
Рис. 6-6д. Операционное планирование с помощью программы med3D по данным КТ.
Рис. 6-6h. Повторное вмешательство через 3 мес после трансплантации кости.
6-8a-6-8i представлены примеры применения описанной методики.
Тоннельная методика.
При увеличении высоты альвеолярного гребня с помощью костных трансплантатов, особенно у пациентов группы риска (например, курильщиков), рекомендуется создание тоннельного принимающего ложа (см. главу А).* Для этого, как правило, в области жевательных зубов верхней и нижней челюстей проводят вертикальный или слегка ме-зиально наклоненный разрез, через который отслаивают слизисто-надкостничный лоскут на протяженности участка атрофии. Иногда для лучшего доступа требуется второй дистальный разрез. Для установки трансплантата точно в планируемом месте необходимо обеспечить достаточную мобилизацию лоскута.
При выраженной атрофии альвеолярного отростка верхней челюсти на фоне адентии горизонтальный разрез протяженностью около 2 см проводят высоко в преддверии в области премоляров (рис. 6-9а и 6-9Ь). Тоннельный доступ позволяет увеличить высоту альвеолярного гребня и провести синус-лифтинг (рис. 6-9c-6-9f). В таких случаях имплантаты также устанавливают через 3 мес после регенеративного вмешательства (рис. 6-9g-6-9i).
При фиксации трансплантата через тоннельный доступ требуется большее отслаивание лоскута, чем при стандартном доступе. Тем не менее указанная методика подготовки принимающего ложа позволяет минимизировать риск обнажения трансплантата.
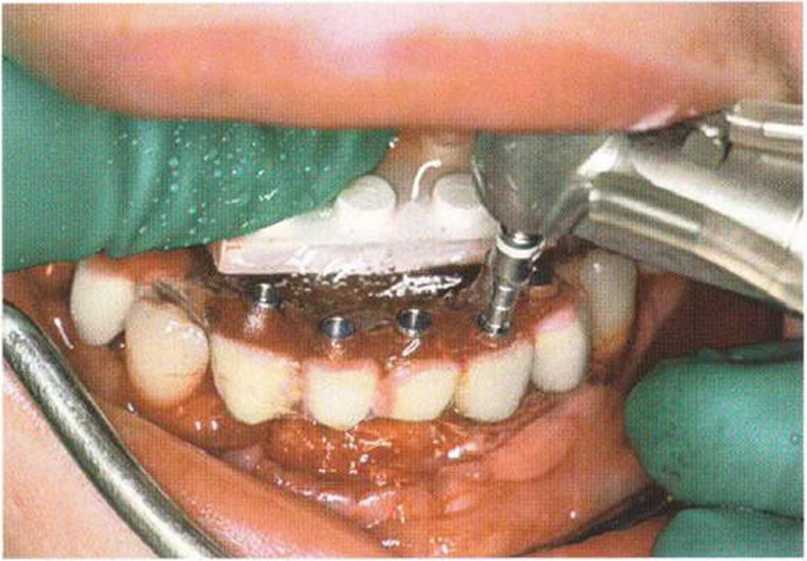
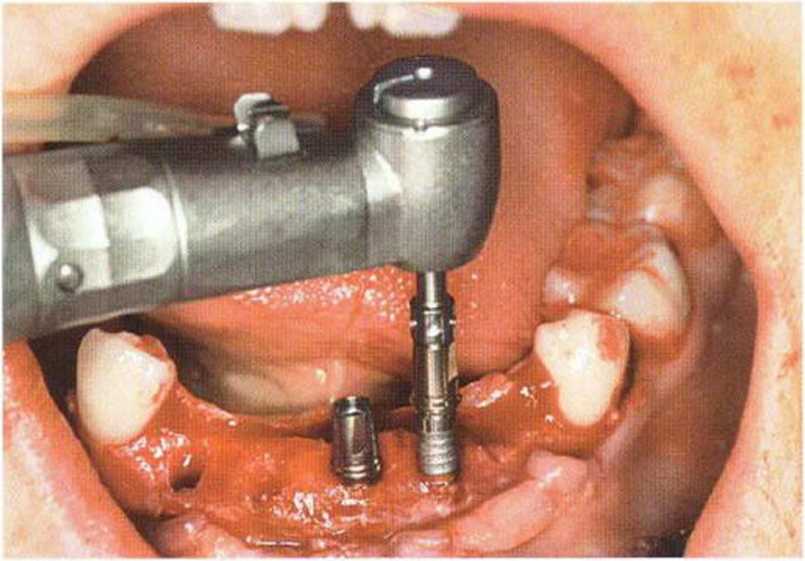
Рис. 6-6i. Установка пяти имплантатов с помощью хирургического шаблона med3D.
Рис. 6-6j. Установка имплантата XiVE (Dentsply Friadent) с абат-ментом TempBase с заданным вращающим моментом
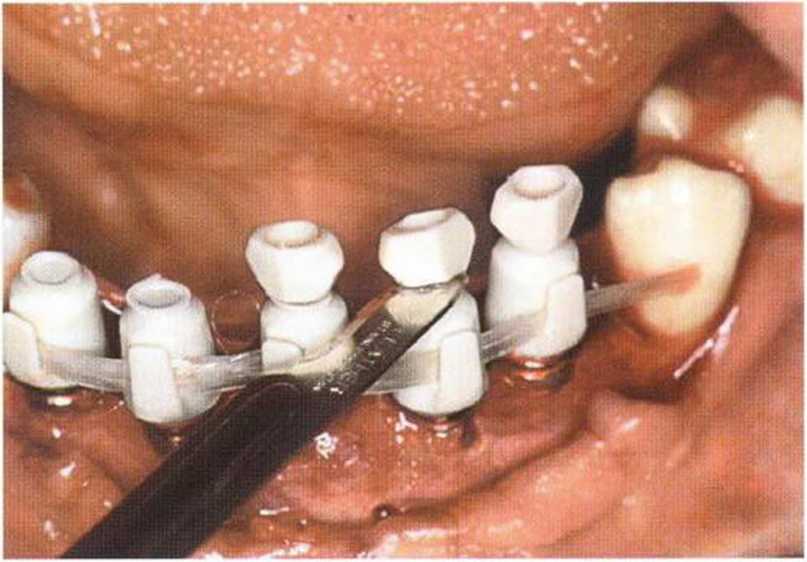
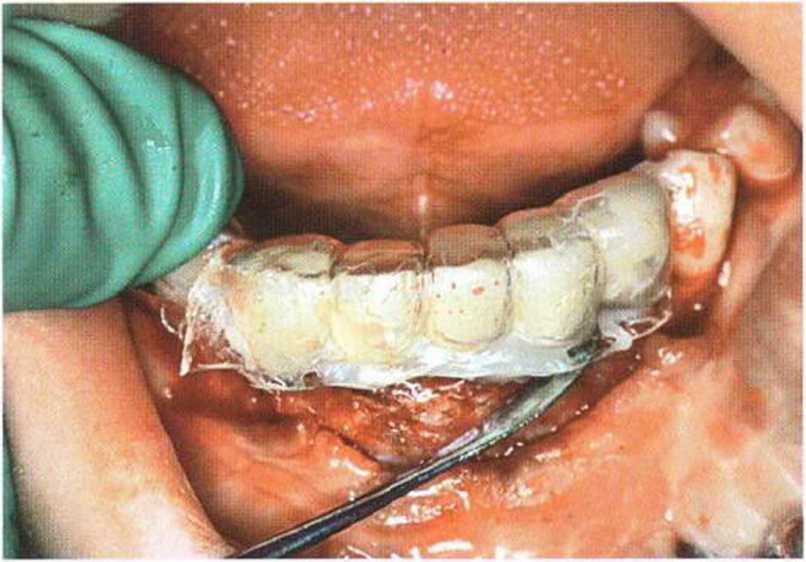
Рис. 6-61. Изготовление немедленного временного протеза с помощью прозрачного шаблона
Рис. 6-6к. Позиционирование колпачков TempBase для блокирования имплантатов
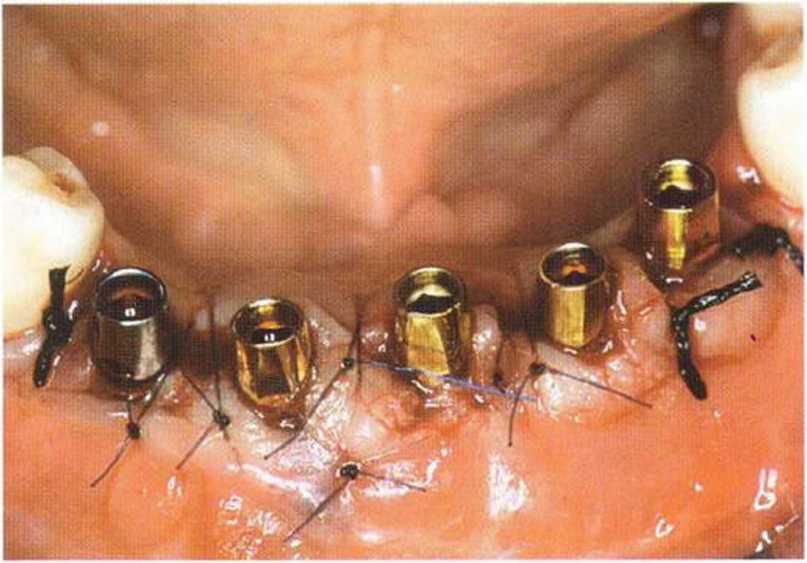
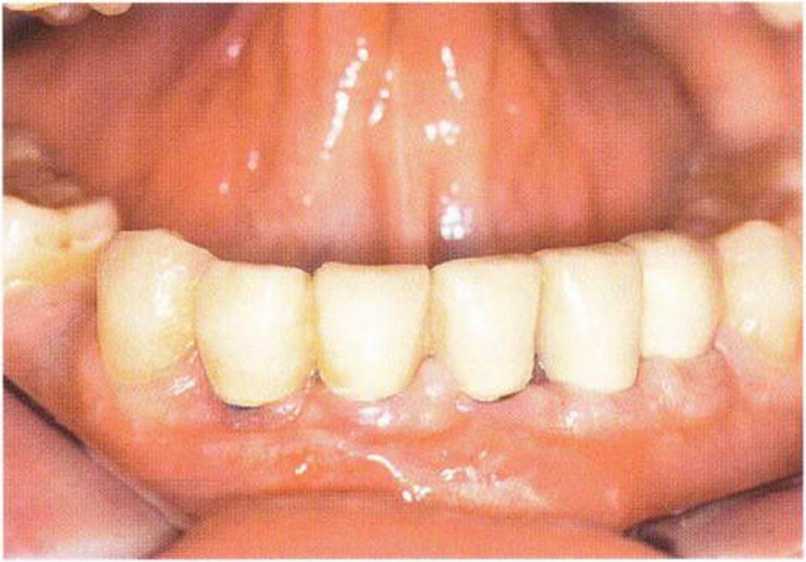
Рис. 6-6п. Состояние перед окончательным протезированием через 6 мес после имплантации и фиксации временного протеза
Рис. 6-6т. Ушивание раны при немедленном протезировании
Рис. 6-7а. Выраженная атрофия нижней челюсти

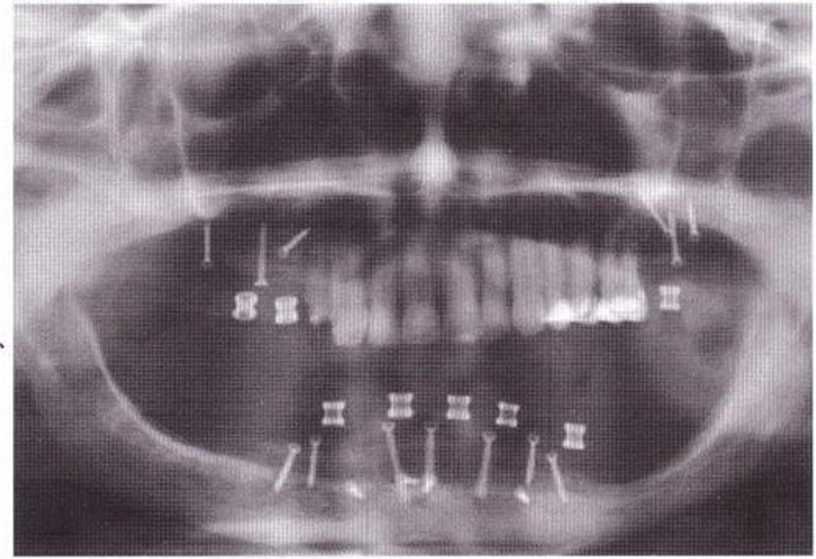
Рис. 6-7Ь. Состояние после регенеративнсо вмешательства на нижней челюсти
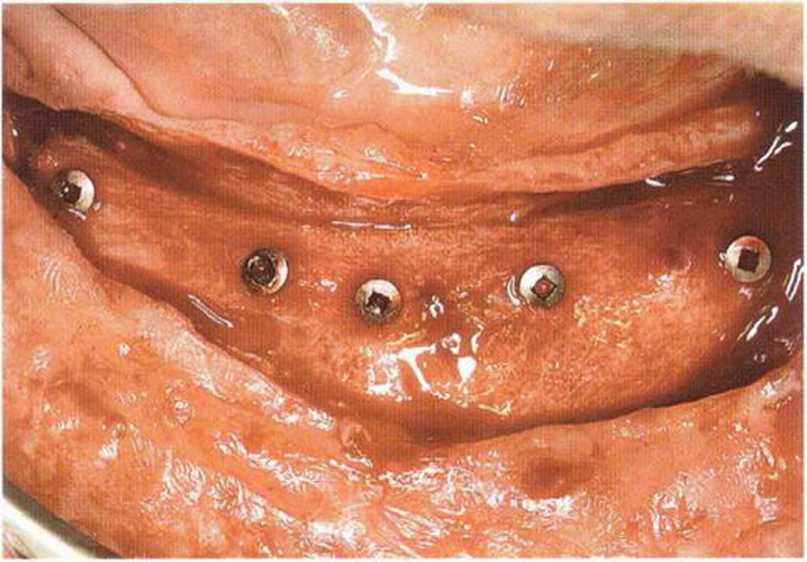
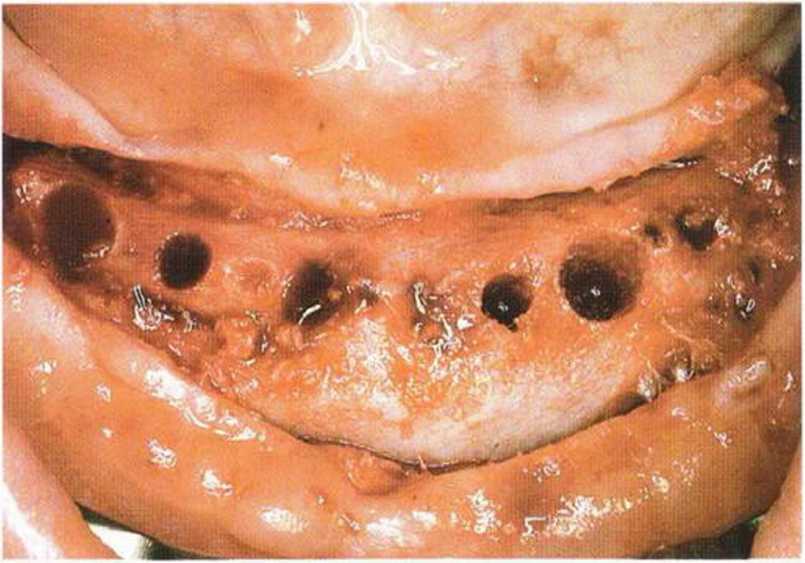
Рис. 6-7с. После пересадки трансплантата из гребня подвздошной кости для увеличения высоты альвеолярного гребня осложнения отсутствовали.
Рис. 6-7d. Кровоточивость из ложа имплантатов указывает на реваскуляризацию трансплантата
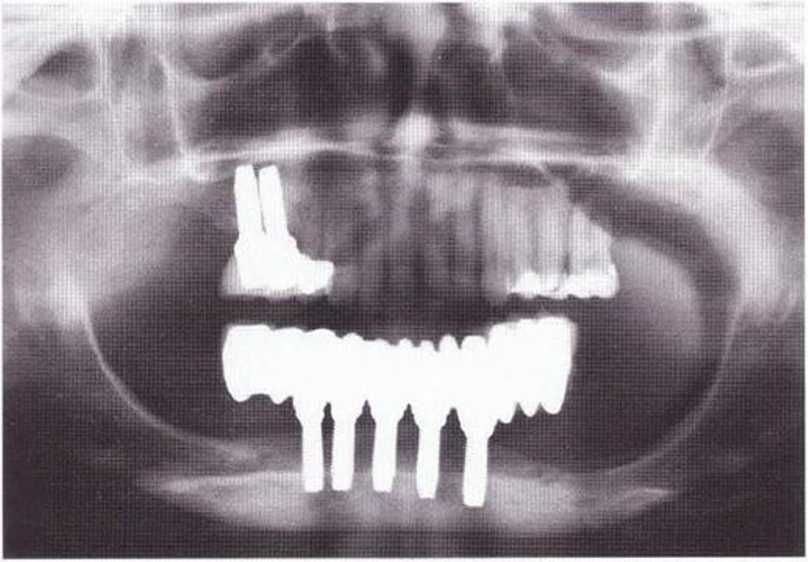
Рис. 6-7е. Контрольная рентгенограмма через 2 года после немедленного протезирования с опорой на однокомпонентные имплантаты из оксида циркония
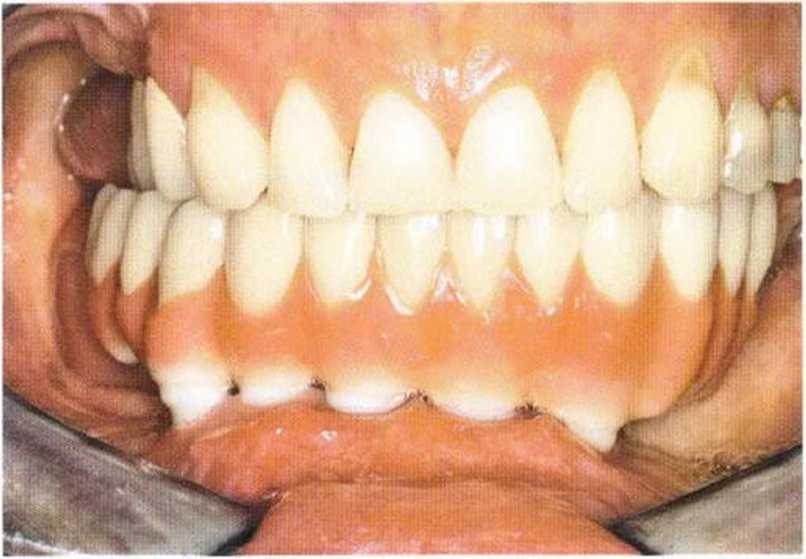
Рис. 6-7f. Клинический вид протезов
Рис. 6-8а. Дефект переднего отдела альвеолярного отростка через 4 мес после травмы
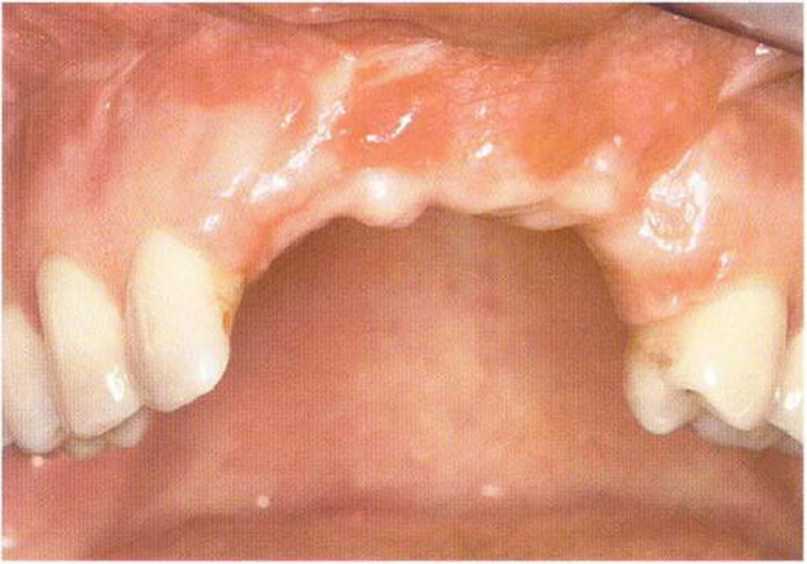
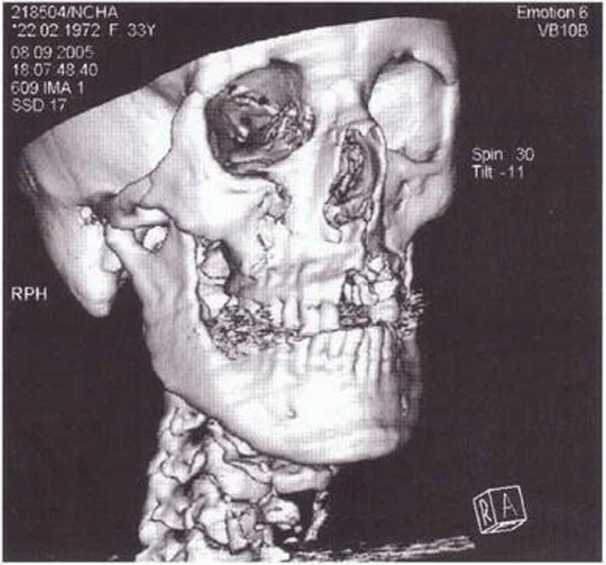
Рис. 6-8Ь. Реконструкция черепа по КТ после травмы с переломом костей среднего отдела лица и альвеолярного отростка и черепно-мозговой травмы II степени
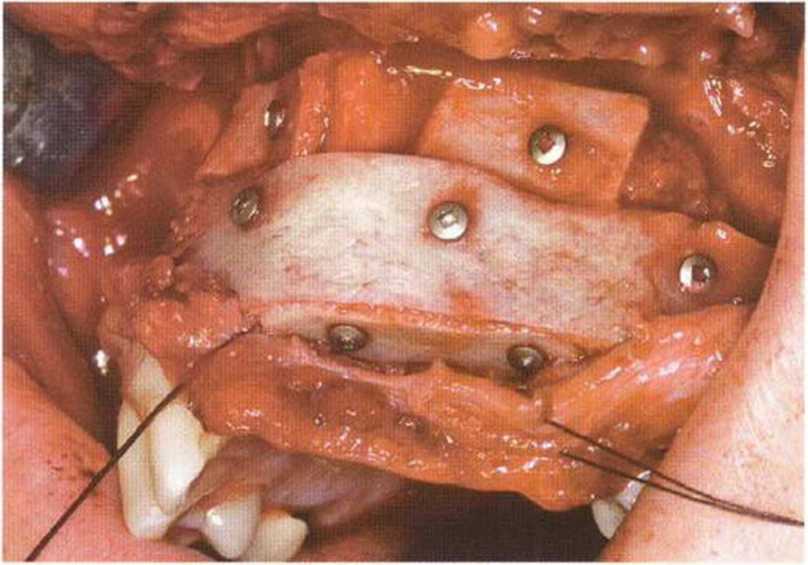
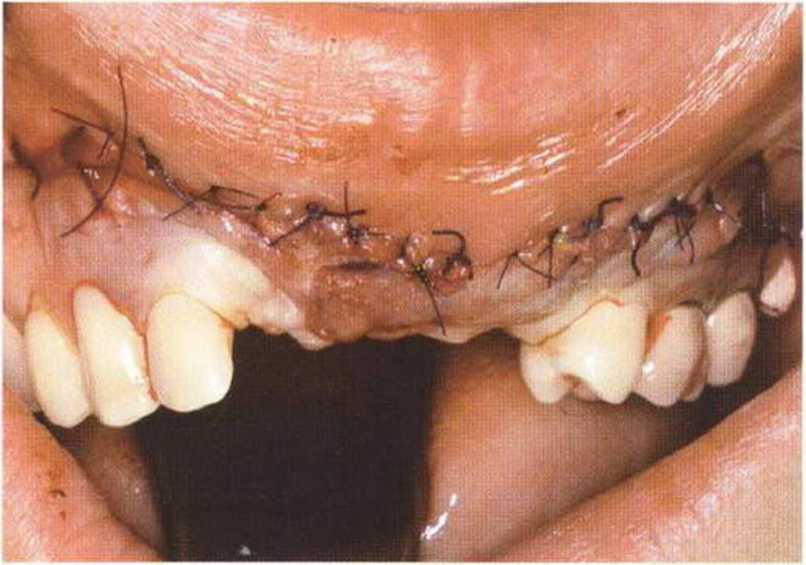
Рис. 6-8с. Трехмерная пластика для увеличения высоты и толщины альвеолярного гребня свободным трансплантатом из гребня подвздошной кости.
Рис. 6-8d. Состояние после многослойного ушивания раны при вестибулярном проведении разреза для СМН-лоскута
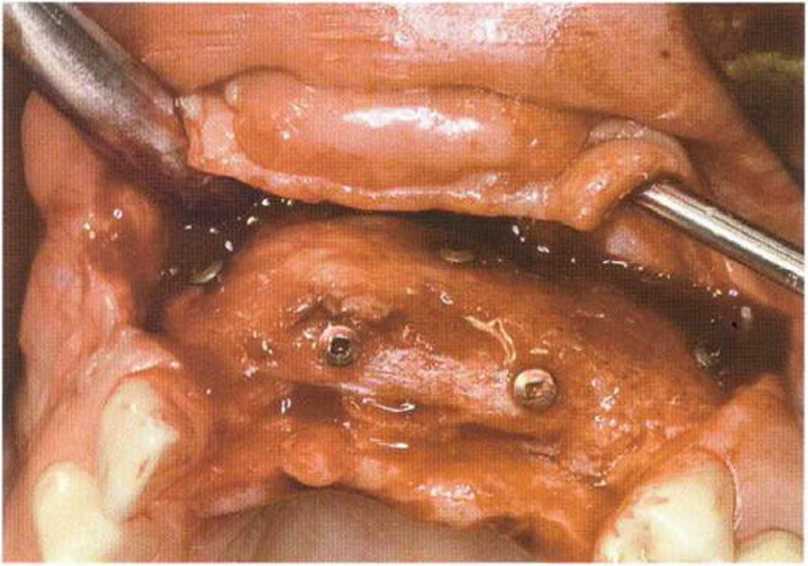
Рис. 6-8е. Регенерация трансплантата через 3 мес после операции. Шляпки винтов расположены на уровне костных трансплантатов, что указывает на отсутствие резорбции костной ткани
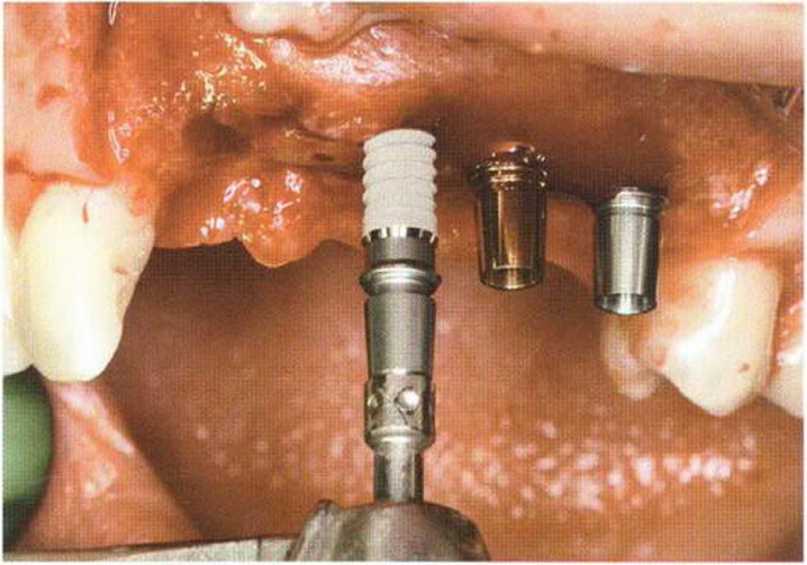
Рис. 6-8f. Установка имплантатов разного диаметра в области передних зубов
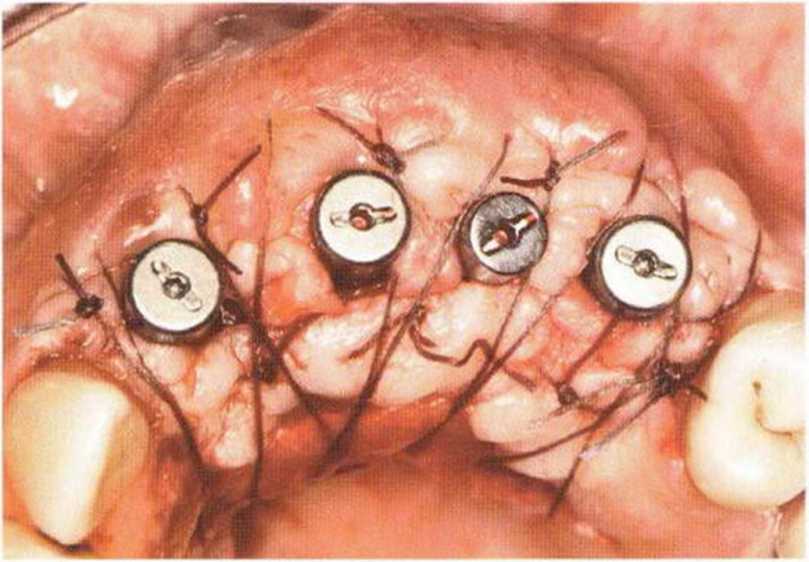
Рис. 6-8д. Раскрытие имплантатов через 3 мес с апикальным смещением лоскута
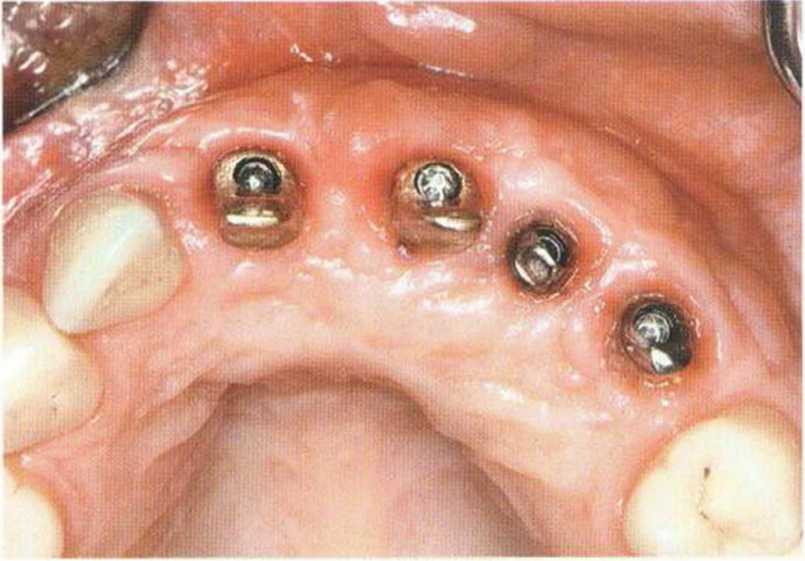
Рис. 6-8h. Состояние после заживления мягких тканей на этапе протезирования
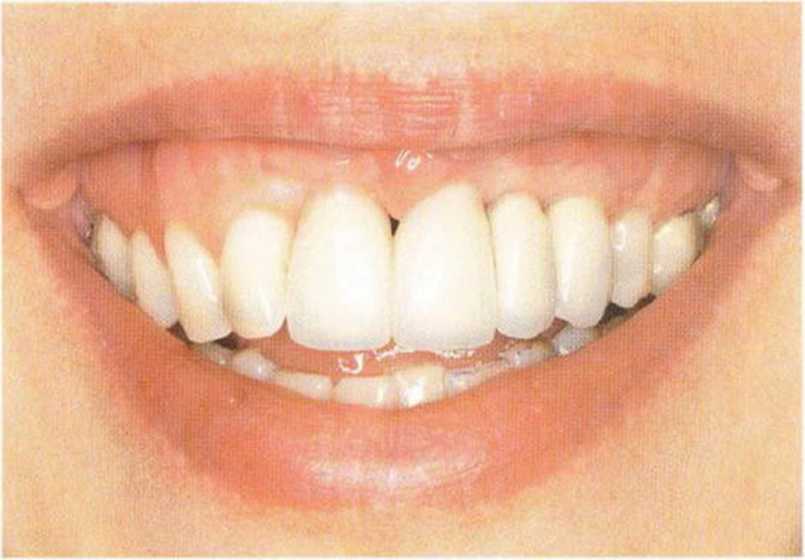
Рис. 6-8i. Вид одиночных коронок через 2 "ода после протезирования
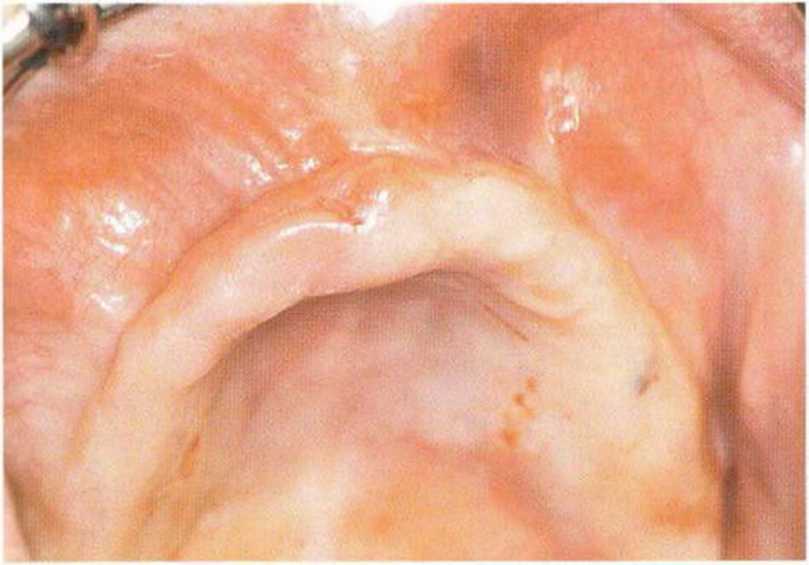
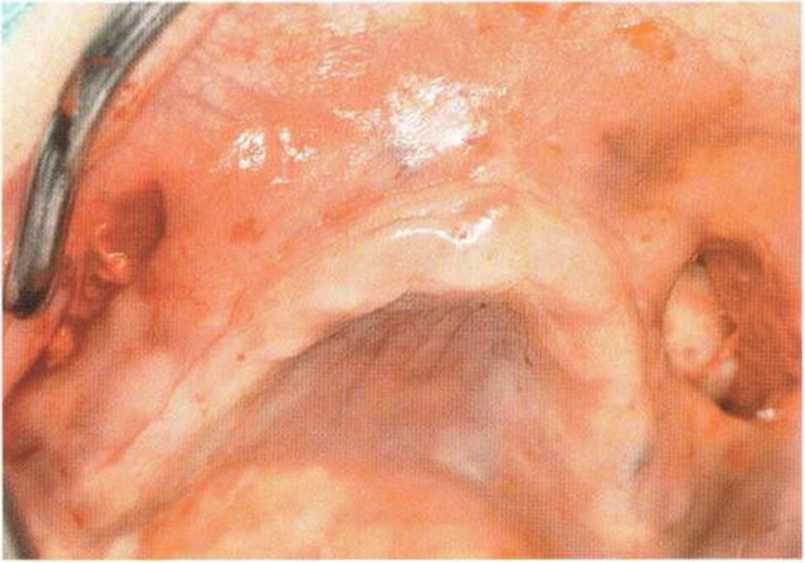
Рис. 6-9Ь. Два горизонтальных разреза в области премоляров обеспечивают доступ для синус-лифтинга и увеличения высоты альвеолярного отростка
Рис. 6-9а. Выраженная атрофия верхней челюсти
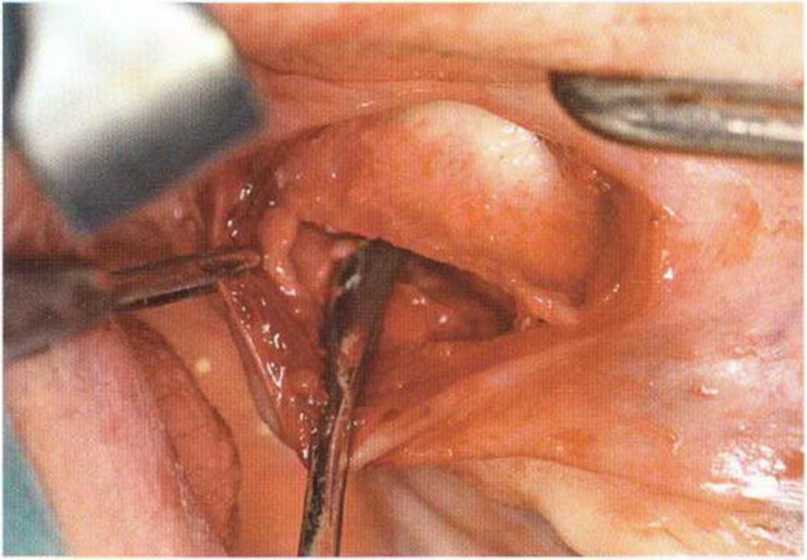
Рис. 6-9с. Тоннельный доступ к дефекту альвеолярного отростка
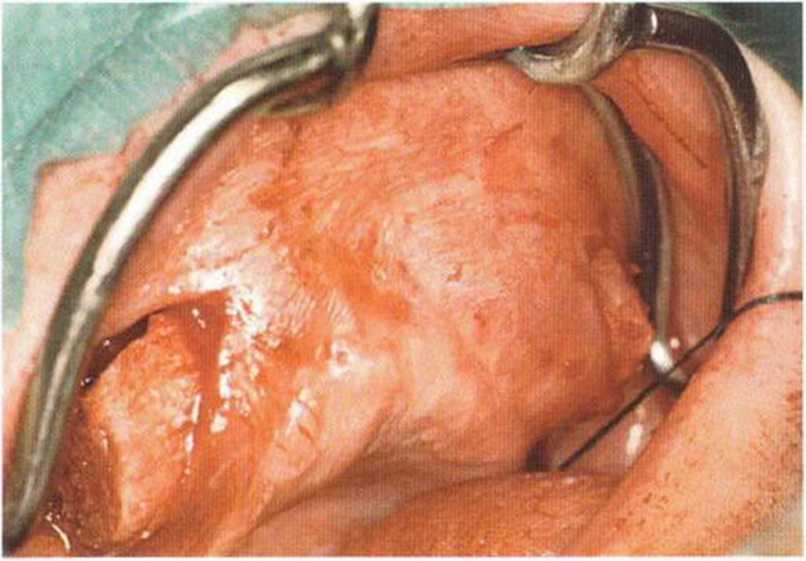
Рис. 6-9d. Костный блок смещается под лоскут в передней области и фиксируется винтами
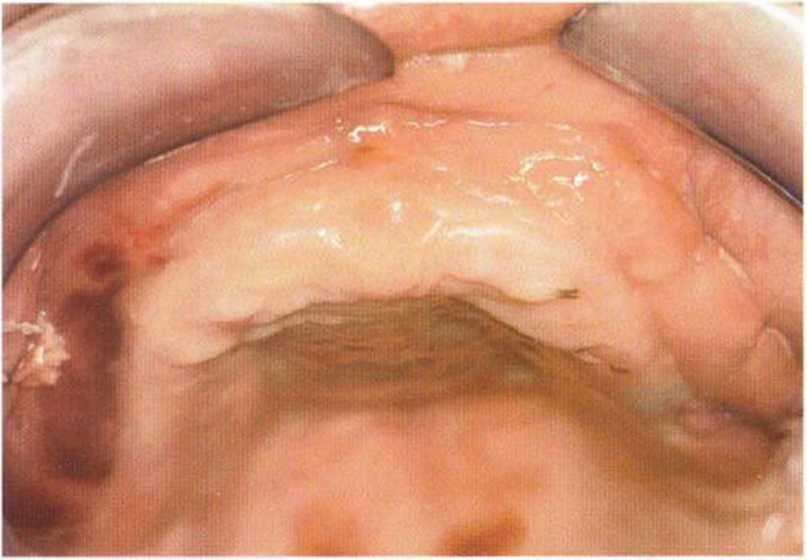
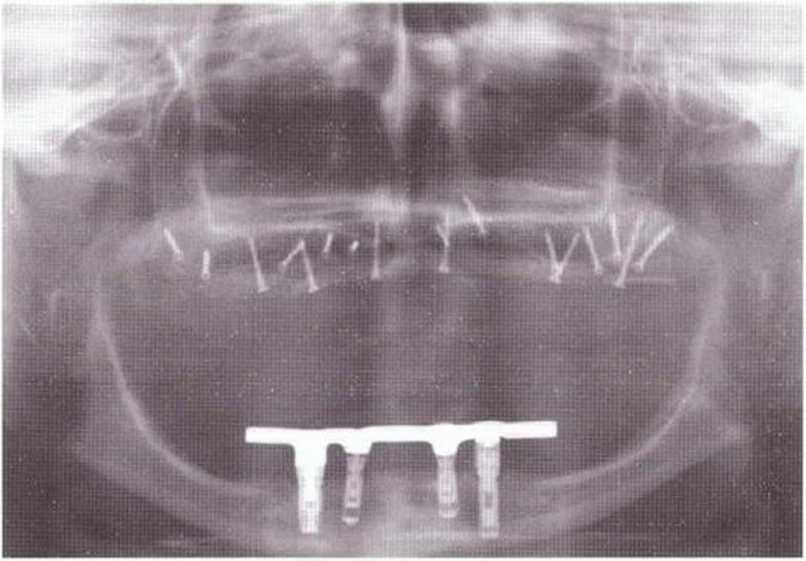
Рис. 6-9е. Удовлетворительное состояние раны после завершения регенеративного вмешательства на верхней челюсти.
Рис. 6-9f. Контрольная рентгенограмма после операции
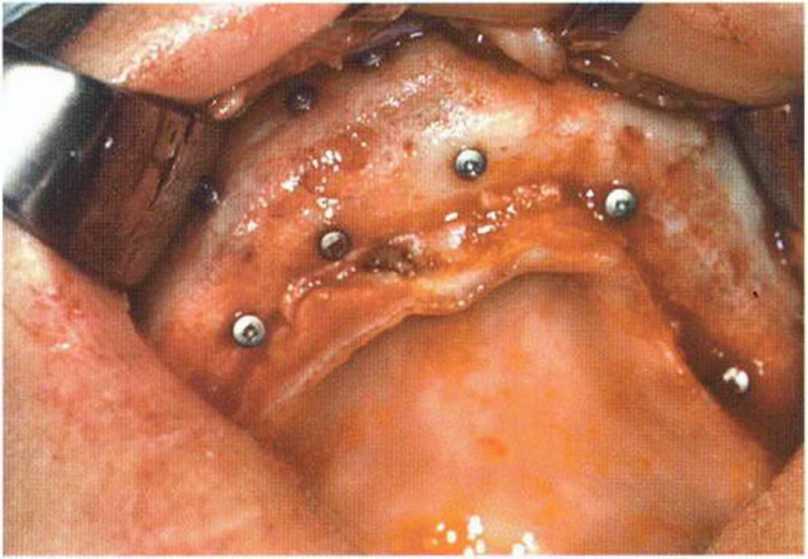
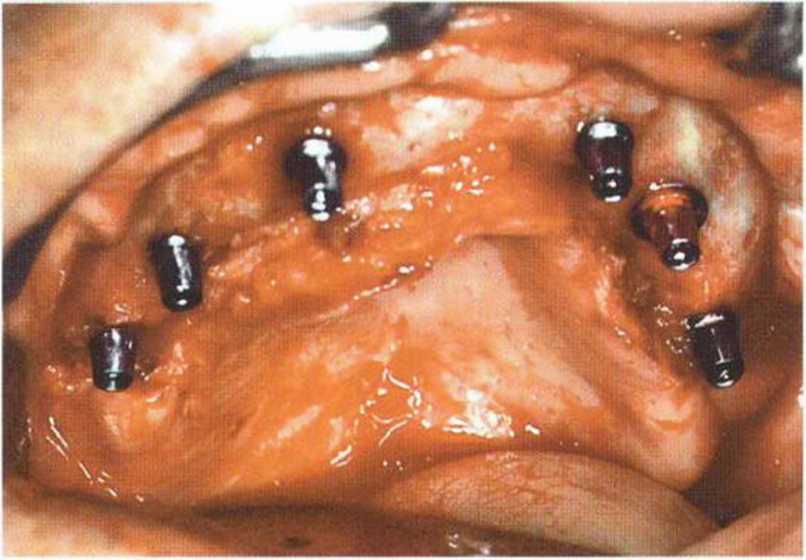
Рис. 6-9h. Состояние после установки шести имплантатов в области трансплантации
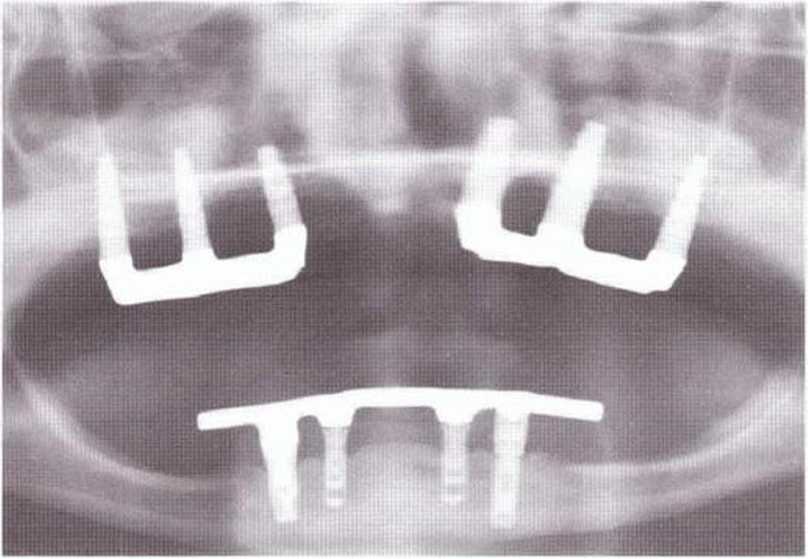
Рис. 6-9i. Контрольная рентгенограмма через 3 года после операции.
Сквозные дефекты верхней челюсти.
Полное отсутствие сегмента альвеолярного отростка верхней челюсти представляет собой особую клиническую проблему. Обычно такие дефекты возникают в результате резекции опухоли, при генетически обусловленном несращении губы, челюсти и нёбной занавески (рис. 6-1 Оа и 6-1ОЬ), а также при выраженной костной атрофии вследствие полной утраты зубов в раннем возрасте или несостоятельности имплантатов. Состояние нередко усугубляется сообщением полости рта и носа, что значительно нарушает прием пищи и дикцию. Кроме того, в таких случаях фиксация съемного зубного протеза затруднена и часто ассоциируется с рецидивирующим кандидозом полости рта.
Для устранения дефекта мягких тканей на верхней челюсти можно использовать кожно-фасциальный лучевой лоскут на сосудистой ножке, который присоединяется к одному из шейных сосудов (рис. 6-1 Ос). Благодаря самостоятельному кровоснабжению данный лоскут позволяет покрывать даже более крупные структуры или ткани с выраженными рубцовыми изменениями. Трансплантат ушивают двухслойно для одновременного формирования нового дна носовой полости и эпителиальной выстилки полости рта. После приживления тканей через 3-4 мес в образовавшемся кожном кармане устанавливают трансплантат из гребня подвздошной кости, который фиксируют к кости в области трансплантации (рис. 6-10d). Через 4 мес после пересадки достигается достаточное приживление костного трансплантата для установки имплантатов (рис. 6-1 Ое - 6-1 Од).
На этапе консолидации в течение 4 мес пациентам чаще всего бывает необходимо протезирование для улучшения внешнего вида и дикции во избежание ограничения социальной активности и психологического дискомфорта. В зависимости от показаний и тяжести их состояния одновременно с регенеративным вмешательством, как правило, устанавливают временные имплантаты. Следует помнить, что немедленное протезирование возможно только при условии достаточной первичной стабильности временных имплантатов в резидуальной кости. В тот же визит фиксируют провизорный протез, защищающий трансплантат от окклюзионной нагрузки (см. главу 8).
При лечении без установки временных имплантатов нужно провести перебазировку имеющегося съемного протеза мягкой прокладкой в области регенеративного вмешательства. Протез разрешается использовать не ранее чем через 3 недели после операции. Во избежание резорбции трансплантата временный протез должен опираться только на мягкие ткани вне области операции. Чтобы края раны не разошлись, нужно регулярно проводить клиническое обследование для выявления точек избыточного давления протеза на слизистую.
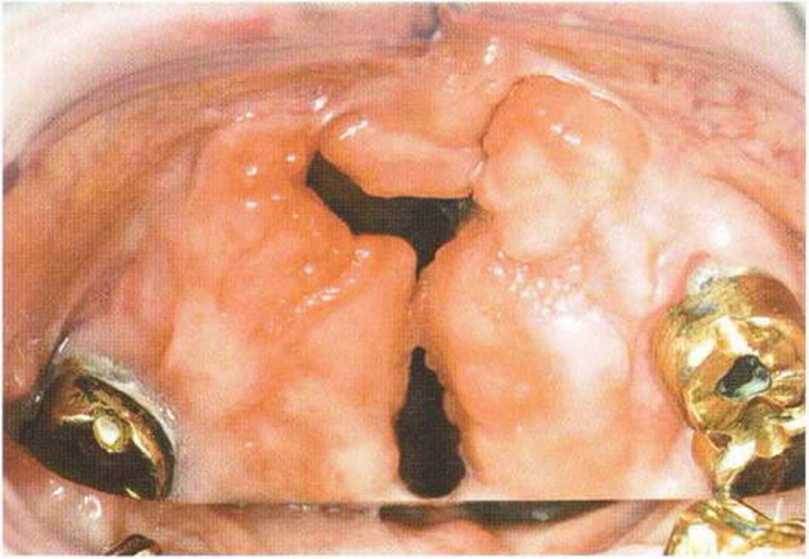
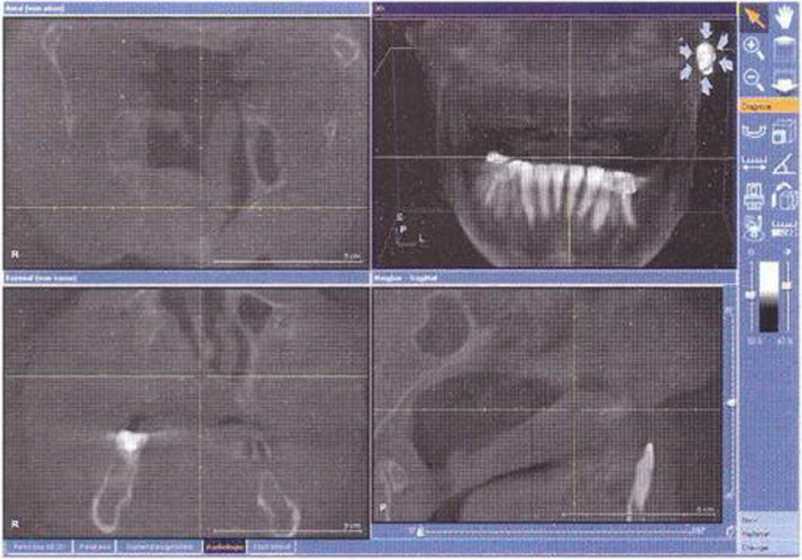
Рис. 6-1 ОЬ. Трехмерная пластика с визуализацией сквозного дефекта нёба
Рис. 6-1 Оа. Пациент 58 лет с ранее оперированной двухсторонней расщелиной губы, челюсти и нёба; показано удаление зубов
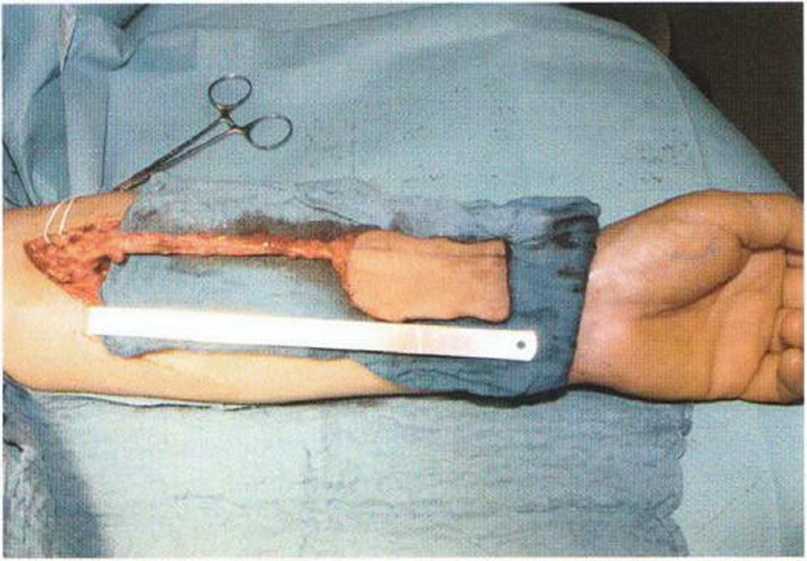
Рис. 6-1 Ос. Препарирование свободного лоскута на ножке с лучевой артерией и веной для вторичной реконструкции нёба
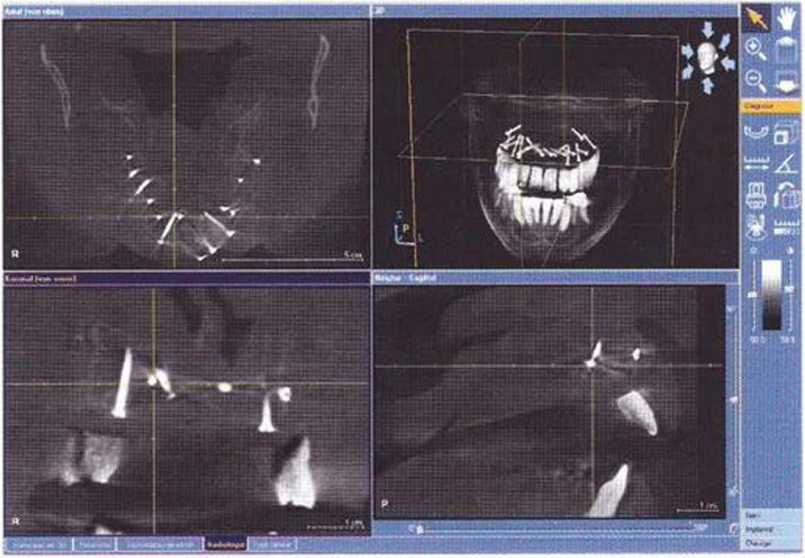
Рис. 6-1 Od. Пластика дефекта и синус-лифтинг с помощью трансплантата из гребня подвздошной кости
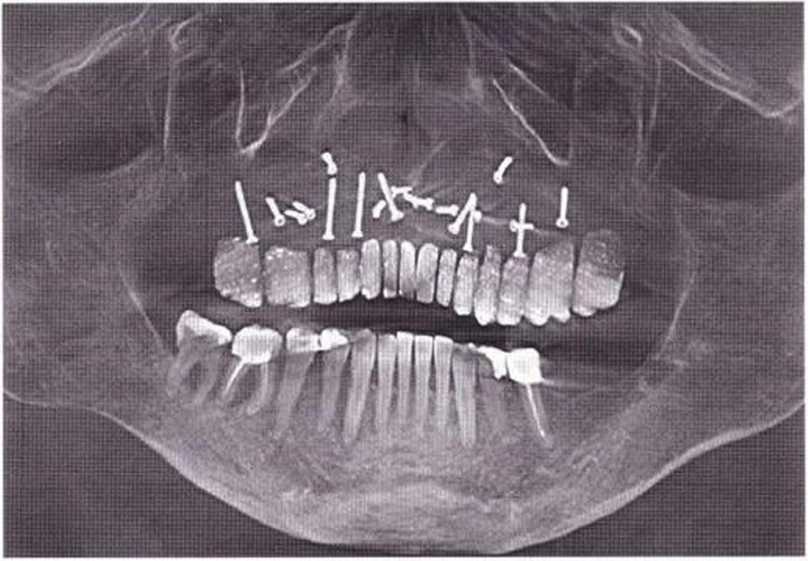
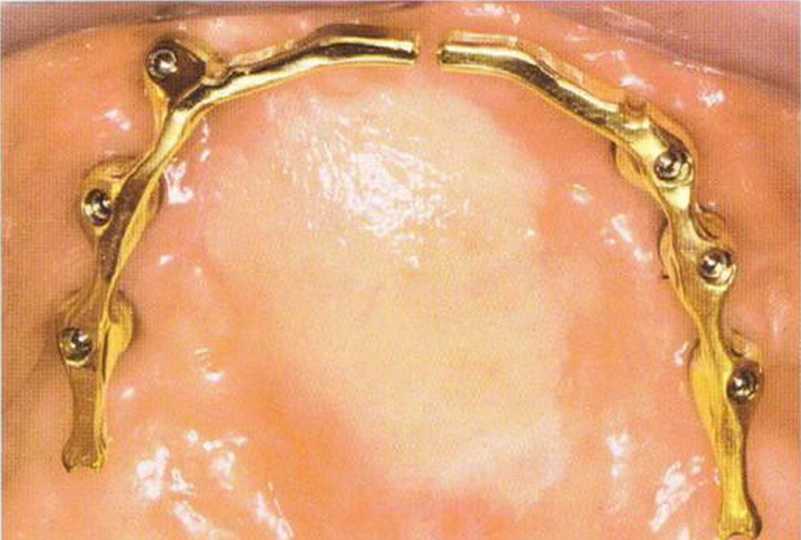
Рис. 6-1 Ое. КЛКТ с искусственными зубами, контрастирован-ными сульфатом бария, при планировании имплантологического лечения.
Рис. 6-1 Of. Балка и микрососудистый лоскут предплечья в центральной части нёба
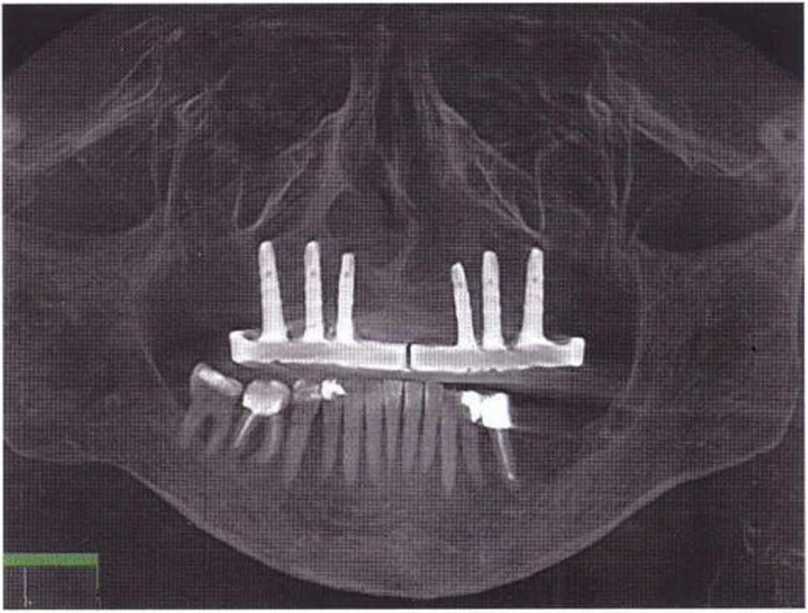
Резорбция.
Степень резорбции трансплантата из гребня подвздошной кости можно оценить при сравнении положения шляпок винтов сразу после регенеративного вмешательства и в момент установки имплантатов. В идеале резорбция трансплантата должна быть минимальной, однако при высокой окклюзионной нагрузке, например в случае использования съемного протеза, или при расхождении краев раны над трансплантатом может произойти частичная или даже полная резорбция трансплантата. В дальнейшем после установки имплантатов уровень костного гребня остается стабильным.
При сравнительном изучении ортопантомограмм максимальная резорбция через 36 мес после имплантации составляла 12 %.
Немедленное протезирование.
При установке имплантатов в область пересадки монокортикальных костных трансплантатов с прессованным губчатым слоем отмечается плотная костная структура, соответствующая типу D2 или D3 по Мишу (Misch). Создание ложа меньшего диаметра, чем у имплантата, обеспечивает последнему лучшую первичную стабильность, которая может быть достаточна для немедленного протезирования.’ При планировании немедленного протезирования с опорой на имплантаты в атрофированной кости переднего отдела нижней челюсти необходимо осторожно препарировать ложе. При сверлении четко определяется переход от новообразованной костной ткани или трансплантата к резидуальной кости. Нужно избегать перенагрева-ния кортикальной кости. Установка имплантатов, задействуя резидуальную кость, повышает их первичную стабильность. При этом следует отметить, что надежность фиксации обусловлена не только этим. Во избежание избыточной нагрузки на костное ложе уже установленный имплантат нужно вывинтить на пол-оборота. При надежной фиксации одновременно в новообразованной и резидуальной кости обеспечивается достаточная биомеханическая стабилизация для немедленного протезирования (рис. 6-6j-6-6n).
При оценке результатов пересадки трансплантата из гребня подвздошной кости следует учитывать осложнения, которые могут возникать не только в принимающем ложе, но и в донорской области.
По данным исследований, наиболее частым послеоперационным осложнением со стороны донорских участков являются ограничения подвижности, которые обусловлены гематомой или травмой мышечной ткани в ходе вмешательства. В редких случаях возможны переломы гребня подвздошной кости. В принимающем лсже наблюдаются следующие осложнения, ухудшающие костную регенерацию: расхождение краев раны вследствие давления протеза, окклюзионная травма зубов противоположной челюсти, резорбция из-за дефицита кератинизированной десны.
Послеоперационная гематома.
Наиболее частым осложнением после забора трансплантата из гребня подвздошной кости являются гематомы, которые образуются в толще мышц.
Кроме того, около 8 % пациентов после пересадки монокортикальных трансплантатов из гребня подвздошной кости по описанной методике более 2 недель при ходьбе вынуждены были пользоваться вспомогательными средствами, но 82 % пациентов такие средства не требовались. Причиной повторных кровотечений помимо недостаточного первичного гемостаза также может быть слишком ранняя и избыточная физическая нагрузка. Однако установлено, что при слишком длительной иммобилизации у пациентов дольше восстанавливалась нормальная подвижность. Таким образом, пациентам показан щадящий двигательный режим в течение первых дней после операции, но от иммобилизации со строгим постельным режимом следует отказаться. Со второго дня после операции следует начинать делать лечебную гимнастику, которую дополняют движениями, совершаемыми при повседневной деятельности. Возобновление спортивной нагрузки возможно не раньше чем через 2-3 недели. Как правило, полная подвижность восстанавливается через 4 недели.
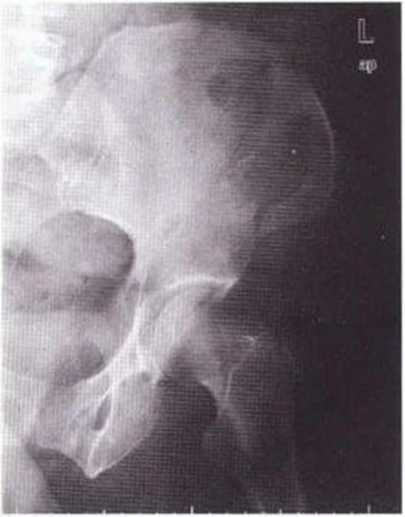
Рис. 6-11Ь. Почти полная регенерация гребня подвздошной кости на контрольной рентгенограмме, полученной на этапе имплантации через 3 мес после забора трансплантата и через 10 недель после перелома
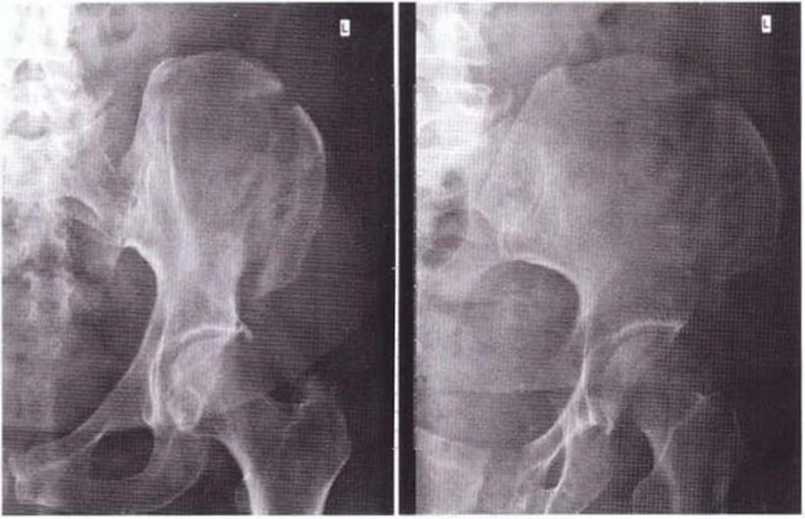
Рис. 6-11а. На рентгенограмме костей таза определяется перелом переднего подвздошного гребня
Переломы гребня подвздошной кости.
При получении большого костного трансплантата (особенно из наружной части) возможно снижение прочности гребня подвздошной кости. В таких случаях в первые 6 недель нужно избегать высокой физической нагрузки на тазовую область, например при занятиях боевыми искусствами и другими контактными видами спорта. Относительно высокий риск перелома гребня подвздошной кости отмечается и у пациентов с избыточной массой тела. Переломы (3 из 323 случаев получения трансплантата из гребня подвздошной кости) лечили консервативными методами без хирургического вмешательства. При этом пациенты к моменту установки имплантатов никаких жалоб не предъявляли (рис. 6-11а и 6-11Ь).
Расхождение краев раны.
При применении СМН-лоскута края раны расходятся крайне редко. Данное осложнение возникает главным образом при недостаточно глубоком проведении разреза в преддверии полости рта, а также при нарушении трофики мягких тканей в результате рубцовых изменений или курения.
При расхождении краев раны применяют местные антисептики, например Braunol и перекись водорода. Относительно недавно дезинфекцию раневой поверхности начали проводить с помощью фотодинамического воздействия, заключающегося в окрашивании микроорганизмов тиазином, вызывающим фотосенсибилизацию бактерий. После окрашивания в течение 60 секунд удаляют избыток препарата и засвечивают участок холодным светом. Считается, что помимо бактериостатического действия это оказывает благоприятный фотобио-логический эффект.
Нагрузка от съемного протеза.
После увеличения объема альвеолярного гребня стабильность положения костных трансплантатов обеспечивается только благодаря фиксирующим их винтам. Непосредственная нагрузка на костный блок со стороны съемного зубного протеза может привести к мобилизации и, следовательно, утрате трансплантата. Следует также помнить, что чувствительность слизистой в области операции снижена настолько, что давление протеза часто не ощущается вплоть до обнажения поверхности трансплантата. На более позднем этапе давление протеза на область регенеративного вмешательства может приводить к резорбции новообразованной костной ткани.
Пациентам следует принимать только мягкую пищу. В идеале область регенеративного вмешательства должна быть полностью защищена от давления съемного зубного протеза. Это относится также к последующему протезированию, которое рекомендуется проводить с опорой на имплантаты.
При отсутствии протеза межокклюзионное расстояние постепенно уменьшается, что может приводить к повреждению мягких тканей на участке адентии зубами противоположной челюсти. Таким образом, изготовление временного протеза без нагрузки на область регенеративного вмешательства показано не только по эстетическим, но и по функциональным причинам.
Аутогенный трансплантат из гребня подвздошной кости считается золотым стандартом при реконструкции альвеолярной части нижней и альвеолярного отростка верхней челюстей.--- В данной главе описано получение монокортикальных костных блоков для эффективного увеличения объема альвеолярного гребня с целью последующей установки имплантатов.
Получение трансплантата из гребня подвздошной кости с отслаиванием мышц во многих случаях ассоциируется с болью и дискомфортом, а также ограничением подвижности в послеоперационном периоде.- Альтернативный доступ к гребню подвздошной кости позволяет избежать отслаивания мышц и сухожилий, поэтому пациенты испытывают лишь незначительные ограничения или болезненность при ходьбе. В зависимости от числа взятых трансплантатов средняя продолжительность госпитализации составляет 3-4 дня (максимум 10 дней), что сопоставимо с таковой при других методах получения губчатого вещества из гребня подвздошной кости.- В связи с отсутствием значительных.
ограничений и низким риском серьезных осложнений лечение по представленной методике требует кратковременного пребывания в стационаре.
Установка подковообразного костного трансплантата для восстановления альвеолярного гребня кажется простой,’ однако требует более широкого доступа и продолжительного вмешательства для получения и припасовки костного блока, а также подготовки костного ложа. Применение монокортикальных костных блоков сокращает время между получением и фиксацией трансплантатов в принимающем ложе и продолжительность операции в целом. Размещение трансплантатов в соответствии с контурами альвеолярного гребня ассоциируется с минимальной резорбцией новообразованной кости. По сути, кортикальные пластинки играют роль жестких мембран и защищают подлежащую стружку от рассасывания. Многие методы трансплантации костной ткани позволяют восстановить альвеолярный гребень с целью последующей установки имплантатов. Оставшиеся свободные пространства заполняют стружкой аутогенной губчатой кости. Описанный протокол позволяет добиться относительно быстрого новообразования костной ткани приемлемого качества для установки имплантатов уже через 4 мес после регенеративного вмешательства. В итоге сокращается продолжительность лечения в целом. Возможность получения большого объема костного трансплантата с внутренней стороны гребня подвздошной кости устраняет необходимость применения ксеногенных, аллогенных или аллопластиче-ских материалов.