- кость в области ложа еще не достигает окончательной плотности, облегчается препарирование нового ложа, снижается риск перегревания;.
- кость в области ложа остается незрелой, т.е. достаточно мягкой, что снижает риск ее компрессии в процессе установки имплантата;.
- еще не завершившийся процесс заживления раны стимулирует реваскуляризацию и, таким образом, способствует остеоинтеграции;.
- сокращается период ожидания до повторной имплантации, что положительно воспринимается пациентом.
Использование коротких имплантатов (длиной 7 мм) в кости I типа, для которых коэффициент неудач составляет 25 %, легло в основу модифицированной стратегии имплантации - эндо-стальной стимуляции.
Эндостальная стимуляция.
■ Принцип.
Кость 1 типа плохо васкуляризована и имеет выраженный кортикальный слой.
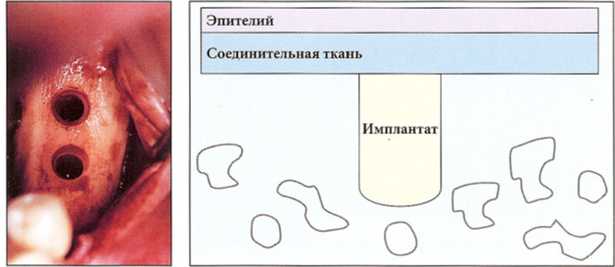
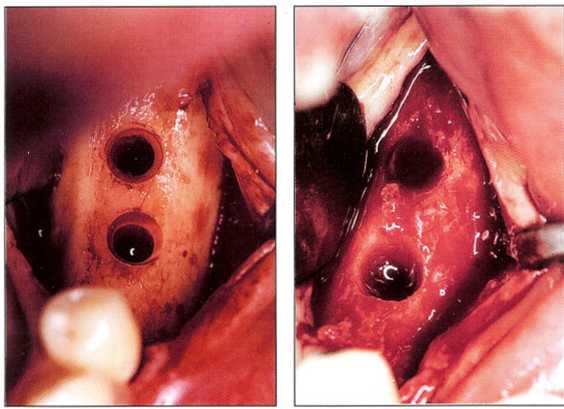
Рис. 6-24 и 6-25. Имплантат, установленный в кости I типа, легко повреждает стенки ложа в результате компрессии кости при его установке
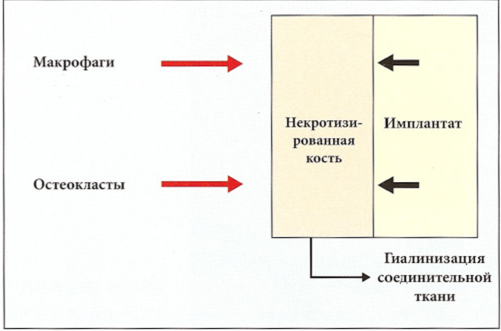
Рис. 6-26. В утилизации поврежденной кости участвуют только остеокласты и макрофаги, поступающие из крови. Поскольку кортикальная кость крайне бедна сосудами, то удаление некротизированной ткани происходит в недостаточной степени и очень медленно. Это приводит к формированию гиалинового слоя, способствующего соединительнотканной инкапсуляции имплантата.
Ряд авторов (Bert, Itic и Serfaty) рекомендуют проведение реваскуляризации до установки имплантатов. Методика заключается в препарировании полноценного ложа для имплантата, однако рану ушивают без установки имплантата.
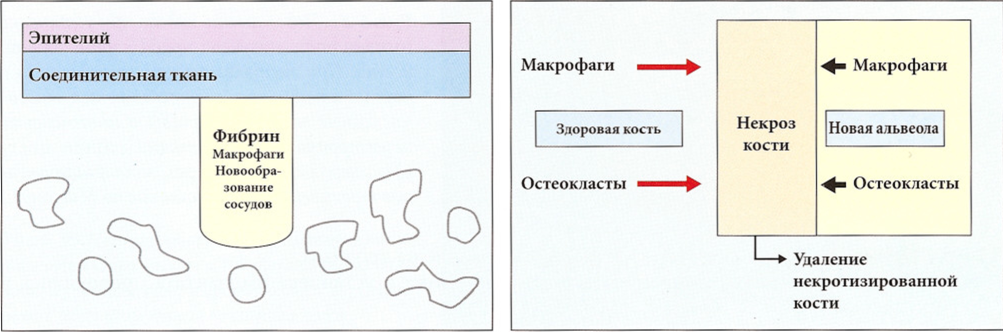
Рис. 6-27 и 6-28. В пустом ложе быстро формируется кровяной сгусток и постепенно начинается реваскуля-ризация. Имеющиеся в сгустке макрофаги и остеокласты быстро утилизируют поврежденную при препарировании кость. После травмы в результате препарирования происходит классическая реакция заживления раны, и через несколько недель исходно кортикальная кость становится богато васкуляризованной. По данным гистологических исследований, новообразование сосудов достигает максимума через шесть недель.
Для установки коротких имплантатов в кости I типа рекомендуется следующий протокол:
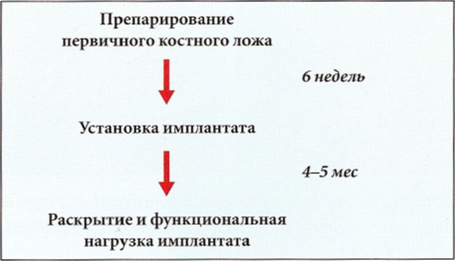
Рис. 6-29 и 6-30. Через шесть недель заметны изменения кости. По кровотечению, возникающему после повторного препарирования ложа, видно, что область имплантации богато васкуляризована.
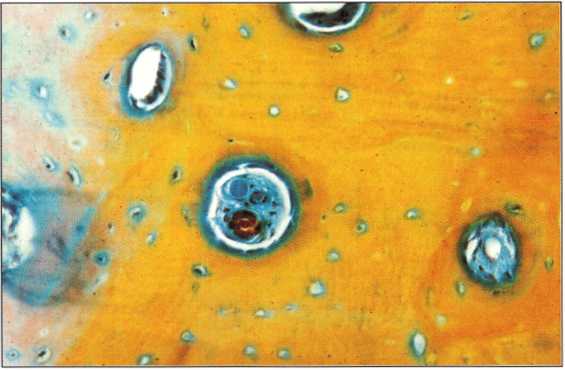
Рис. 6-31. Через шесть недель при установке имплантата получена проба кортикальной кости. При гистологическом исследовании в кортикальной кости определяются многочисленные гаверсовы каналы и интенсивная перестройка костной ткани (синий цвет) (деминерализованный срез, модифицированное трехцветное окрашивание по Массону)
В 1995 г. Ogisso и соавт. провели аналогичное исследование на кроликах.
- Стандартная методика: препарирование костного ложа и установка имплантата проводились в одно посещение.
- Отсроченная методика: имплантат был установлен через две недели после препарирования костного ложа.
Результат исследования показал:.
«При отсроченной методике в костной полости образуются очень тонкие костные трабекулы и многочисленные капилляры. При немедленной установке имплантата этого не происходит».
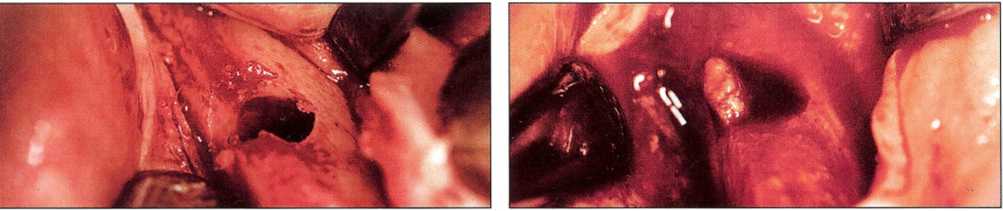
Рис. 6-32 и 6-33. Клиническая картина при препарировании кортикальной кости на глубину 7мм. Отсутствие сосудов сменяется их интенсивным новообразованием. Из этого ложа получена проба ткани для гистологического исследования.
Рис. 6-34. На поперечном срезе препарата определяются три зоны: центральная, промежуточная и латеральная (погружение в парафин, распил, трехцветное окрашивание по Массону).
Рис. 6-35. Центральная зона не имеет четкой тканевой структуры и представлена кровяным сгустком, сформировавшимся в результате препарирования костного ложа
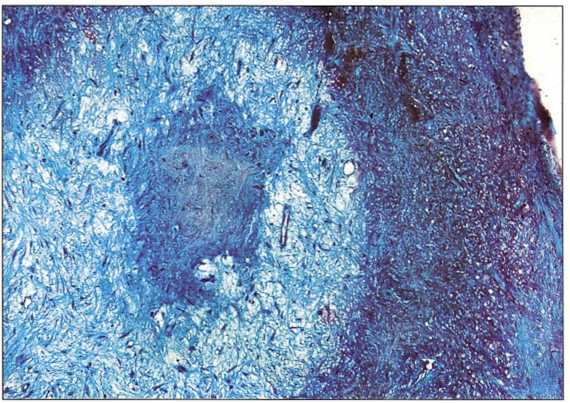
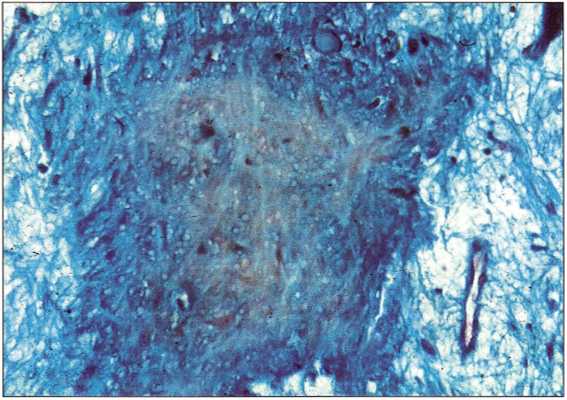
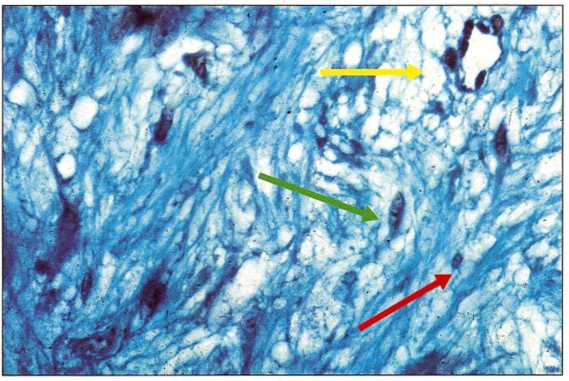
Рис. 6-36. Промежуточная зона представляет больший интерес. Определяются начало кровеносного сосуда (желтая стрелка) и два типа клеток:.
-многоядерные стволовые клетки с низкой активностью: недифференцированные мезенхимальные клетки (зеленая стрелка);.
- образующие коллаген клетки с очень активными ядрами (красная стрелка).
Это клетки-предшественники, способные к дифференциации в фибробласты или остеобласты. В зависимости от дальнейшего развития коллаген может остаться неизмененным (фибробласты) или минерализоваться (остеобласты).
Рис. 6-37. В латеральной зоне (в области контакта с альвеолярной стенкой) определяется минерализация коллагеновых волокон, что является характерным признаком остеоидной ткани. По периферии видна значительно более минерализованная зрелая костная ткань (желтые стрелки). Ее толщина составляет около 0,5 мм, т.е. слой новообразованной зрелой костной ткани на поперечном разрезе составляет 1 мм