Реакция окружающих имплантат тканей на присутствие оппортунистических патогенных бактерий стала предметом многочисленных клинических исследований и экспериментов. В большинстве исследований применялись протоколы, используемые в пародонтологии. Была предпринята попытка сравнить этиопатогенез пародонтита и периимплантита.
Мукозит в области имплантата.
Pontoriero и соавт. (1994) в клиническом исследовании изучали воспаление вокруг имплантатов на экспериментальной модели гингивита у 20 добровольцев. Оказалось, что накапливание бактериального налета более трех недель вызывает воспаление тканей вокруг имплантатов, аналогичное гингивиту вокруг естественных зубов.
Ericsson и соавт. (1992) в эксперименте на собаках сравнили воспалительную реакцию мягких тканей, окружающих имплантаты и зубы, на накапливание налета в течение трех недель и трех месяцев. Оказалось, что количество и состав образовавшегося налета на имплантатах и зубах были идентичны. Десна одинаково реагировала на колонизацию бактерий с развитием воспаления и формированием воспалительного инфильтрата в соединительной ткани. Через три месяца поражения вокруг имплантатов были более обширными и быстрее распространялись апикально. Воспаленная десна вокруг имплантатов содержит меньше фибробласгов, чем воспаленная десна, окружающая зубы. Отсюда можно сделать вывод о том, что эффективность регенеративных вмешательств в области имплантатов значительно ниже. Меньшее количество фибробластов означает снижение выработки коллагена, что способствует распространению воспалительной инфильтрации.
Мукозит и гингивит являются обратимыми заболеваниями (Pontoriero et al., 1994). В настоящее время отсутствуют доказательства того, что при отсутствии лечения мукозит обязательно приведет к периимплантиту.
Периимплантит.
По аналогии с экспериментальным пародонтитом Lindhe и соавт. (1992) разработали экспериментальную модель периимплантита у собак и исследовали тканевую реакцию на продолжительное отложение налета на зубах и имплантатах.
Наложение лигатур в десневую борозду привело к быстрому образованию кармана. Происходило активное культивирование поддесневой бактериальной флоры, сформировались обширные воспалительные поражения. На контрольной рентгенограмме через шесть недель определялись идентичные дефекты кости вокруг зубов и имплантатов. Обнаруженная в карманах бактериальная флора также была идентична, с преобладанием грамотрицательных анаэробов.
Однако при гистопатологическом анализе полученных препаратов установлено четкое отличие в распространении и локализации воспалительных поражений (Berglundt et al., 2004). У зубов пародон-тальные дефекты были отграничены от здоровой кости зоной неинфильтрированной соединительной ткани толщиной около 1 мм, в то время как воспалительное поражение вокруг имплантатов распространялось до костно-мозговых пространств альвеолярной кости. На основании этого можно заключить, что бактериальная инвазия в области имплантата происходит более агрессивно.
По данным гистологического исследования 230 несостоятельных имплантатов окружающая их соединительная ткань характеризовалась наличием воспалительного инфильтрата (Piatelli et al., 1998), включающего в себя большое количество макрофагов, лимфоцитов и плазмоцитов. Инфильтрат распространялся до наиболее апикальной границы кармана и проникал непосредственно в костную ткань.
Указанные выше данные подтверждают особый характер поражений при периимплантите. Отсутствие инкапсуляции и близость воспалительного инфильтрата к маргинальной кости объясняют высокую агрессивность поражения тканей и быстрое развитие несостоятельности причинного имплантата.
Воспалительные поражения окружающих имплантаты тканей обусловлены инфекцией.
Мукозит является обратимым воспалительным заболеванием мягких тканей и не всегда ведет к периимплантиту. Периимплантит является воспалительным поражением мягких тканей и костной деструкцией. Данное состояние быстро распространяется и приводит к дезинтеграции имплантата.
В настоящее время авторам книги неизвестно ни об одном клиническом исследовании, точно определяющем коэффициент неудач имплантации после проведения протезирования. В большинстве долгосрочных исследований, посвященных оценке эффективности имплантологического лечения, первичные и вторичные неудачи не различаются.
Используя доступную литературу, с большой осторожностью можно указать долю мукозитов в области имплантатов в пределах 8-44 % (Adell et al., 1986; Lekholm et al., 1986,1999; Smedberg et al., 1993; van Steenberghe et al., 1993; Jepsen et al., 1996; Behneke et al., 1997). Распространение периимплантита варьируется от 1 до 19 % (van Steenberghe et al., 1993; Weber et al., 1992; Smedberg et al., 1993; Lekholm et al., 1999). Такие отличия обусловлены сложностью определения указанных клинических состояний и длительностью закрытого этапа имплантации.
Таким образом, можно уверенно предположить, что 10 % остеоинтегрированных имплантатов утрачивается при жизни пациентов (Wilson, 1996). Утрата имплантатов после протезирования может быть обусловлена механическими или инфекционными факторами, которые нередко сочетаются. Механически обусловленная дезинтеграция может способствовать присоединению инфекции (Rosenberg et al., 1991). Следует отметить, что пациенты чаще всего обращаются за помощью уже на этапе сочетанного поражения. В таких случаях рентгенологическое исследование способствует проведению дифференциальной диагностики (рис. 9-2).
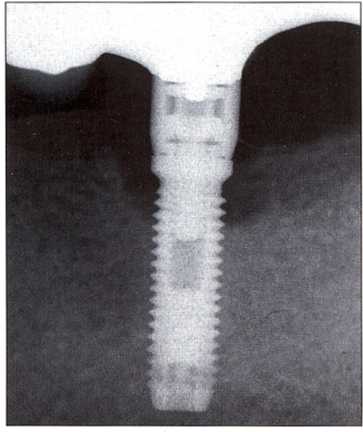
Рис. 9-2. Вторичное осложнение, обусловленное переломом имплантата. Перелом был обнаружен при очередном контрольном осмотре. Резорбция кости вызвана суперинфекцией после перелома имплантата (документация: д-р F. Renouard).
Факторы риска развития инфекции.
Факторами риска инфицирования считаются все состояния, повышающие восприимчивость пациента к развитию инфекции вокруг имплантата.
Общие факторы риска развития инфекции.
Пациент, который уже пережил одну неудачную имплантацию, по определению относится к группе риска. Факт утраты первого имплантата повышает вероятность неудачи следующей имплантации на 30 % (Weyant и Burt, 1993). Важно определить профиль риска для каждого потенциального пациента.
■ Соматические факторы.
Как и в пародонтологии, при планировании имплантологического лечения следует учитывать общее состояние пациента, поскольку различные соматические заболевания могут влиять на результат имплантации. В научной литературе наиболее часто отмечается значение сахарного диабета (Shernoff et al., 1994), иммуносупрессивных состояний, гормональных нарушений и приема некоторых лекарственных препаратов.
■ Кофакторы.
При анализе риска нужно учитывать степень сотрудничества пациента в процессе лечения и его готовность соблюдать рекомендации стоматолога. Долгосрочный результат имплантологического лечения зависит от эффективности ежедневной самостоятельной (рис. 9-3) и регулярной профессиональной гигиены полости рта.
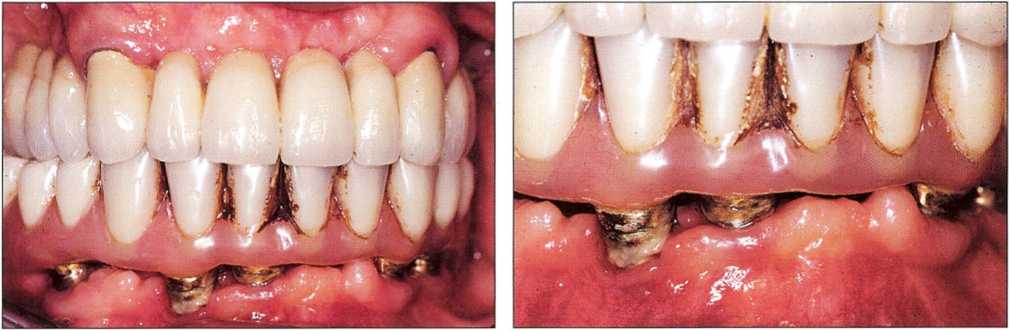
Рис. 9-3. Форма протеза с опорой на имплантаты и неспособность пациента осуществлять адекватную гигиену полости рта привели к отложению налета и зубного камня вокруг имплантатов. Четко определяется воспалительная реакция мягких тканей, т.е. мукозит.
Несмотря на отсутствие специального исследования по этой теме, на основании имеющихся данных долгосрочных исследований можно утверждать, что неудовлетворительная самостоятельная гигиена полости рта увеличивает риск утраты имплантата (van Steenberghe et al., 1993) и вероятность воспалительного поражения тканей вокруг имплантатов (Weyant, 1994).
Курение, злоупотребление алкоголем, стресс, биологические факторы, способные повлиять на реакцию организма на инфекцию, также относятся к кофакторам и должны учитываться при организации поддерживающего лечения.
■ Табакокурение.
В пародонтологии табакокурение считается одним из основных факторов риска возникновения паро-донтологических заболеваний и нарушений заживления раны. Помимо многочисленных неблагоприятных эффектов на ткани полости рта, курение оказывает отрицательное влияние на шммунную систему, подавляя реакцию на инфекцию. В имплантологии табакокурение является причиной большого числа ранних неудач (см. рис. 9-7), поскольку нарушает обмен веществ в костной ткани (de Bruyn и Collaert, 1994).
На основании пародонтологических исследований и четкой аналогии между пародонтитом и периимплантитом можно сделать вывод о влиянии табакокурения на реакцию организма в ответ на микробную инвазию в области функционирующего имплантата.
Lindquist и соавт. (1997) сравнили атрофию костного гребня вокруг имплантатов через 10 лет у 45 курильщиков и некурящих пациентов с полной адентией и мостовидными протезами с опорой на имплантаты на нижней челюсти. Оказалось, что у курильщиков атрофия кости возникала намного чаще, также костная деструкция была еще выше при курении и неудовлетворительной самостоятельной гигиене полости рта. Таким образом, сочетание курения с неудовлетворительной гигиеной полости рта ассоциируется со значительной атрофией кости гребня.
■ Тип адентии.
При сравнении бактериальной флоры вокруг имплантатов при полной и частичной адентии в первом случае встречается меньше спирохет, подвижных палочек и патогенных бактерий (Apse et al., 1989). При утрате всех зубов из полости рта исчезает основная часть патогенных бактерий (Danser et al., 1994).
При частичной адентии сохранившиеся зубы являются резервуаром для бактерий (Quirynen и Listgarten, 1990). Феномен транслокации бактерий обеспечивает колонизацию десневой борозды имплантатов микроорганизмами из других экосистем, например из ротоглотки, и особенно из паро-донтальных карманов.
Следует помнить, что риск инфицирования в области имплантатов при частичной адентии выше по сравнению с полной адентией, а наличие пародонтита оказывает неблагоприятное влияние на состояние имплантатов.
■ Состояние пародонта.
У большинства пациентов с полной адентией зубы были утрачены в результате пародонтита. В таких случаях наличие пародонтита в анамнезе практически не влияет на остеоинтеграцию. Однако при частичной адентии при наличии пародонтита (даже после адекватного лечения) сохраняется риск инфицирования тканей вокруг имплантата. Особенно это справедливо в случае рецидива пародонтита.
Quirynen и соавт. (1996) исследовали бактериальную флору вокруг имплантатов у трех групп пациентов: со здоровым пародонтом, хроническим пародонтитом и рефракторным пародонтитом. Грамотрицательные анаэробы в самых глубоких карманах вокруг имплантатов были обнаружены у многих пациентов с хроническим пародонтитом и у всех пациентов с рефракторным пародонтитом. Данные этого микробиологического исследования подтверждают, что пародонтальные карманы являются резервуаром для бактерий и источником возможной контаминации имплантатов в результате транслокации бактерий.
Однако результаты клинических исследований, посвященных данной теме, очень противоречивы. Некоторые авторы считают рефракторный пародонтит угрожающим состоянием, приводящим к утрате имплантатов (Malmstrom et al., 1990; Fardal et al., 1999). По мнению других, напротив, тяжелая форма пародонтита не является противопоказанием к имплантации независимо от поражения тканей в области сохранившихся зубов или результата пародонгологического лечения (Nevins и Langer, 1995).
Только результаты долгосрочных клинических исследований позволят получить окончательную информацию о риске развития периимплантита у пациентов, имеющих пародонтит в анамнезе.
Quirynen и соавт. (2001) через пять лет после установки имплантатов Бронемарка сравнили состояние костной ткани вокруг зубов и имплантатов. Оказалось, что у имплантатов потеря прикрепления была меньше, чем у зубов.
Ellegard и соавт. (1997) проанализировали собственные пятилетние наблюдения пациентов, которым были установлены имплантаты Астра и ITI на этапе поддерживающего пародонтологического лечения. В области 45 % имплантатов атрофия кости превышала 1,5 мм, вокруг 30 % имплантатов глубина карманов превышала 6 мм.
На основании этих исследований можно заключить, что у пациентов с пародонтитом состояние окружающих имплантаты тканей страдает меньше, чем пародонт имеющихся зубов, но наличие пародонтита является существенным фактором риска для имплантатов.
Таким образом, при частичной адентии следует регулярно проводить пародонтологическое обследование и при обнаружении поражения пародонта своевременно проводить соответствующие терапевтические мероприятия. Максимальное внимание следует уделять пациентам с пародонтитом тяжелой степени. Во избежание угрозы имплантатам, рекомендуется своевременно проводить стратегическую экстракцию зубов, не поддающихся адекватному пародонтологическому лечению.
Факторы риска развития локальной инфекции