Негативное влияние на внедрение в практику стоматологической имплантации оказали те неблагоприятные результаты, которые были обусловлены грубыми врачебными ошибками, особенно в тех случаях, когда съемные конструкции протезов превращались в несъемные (рис. 46).
Глубокие научные исследования в области стоматологической имплантологии (СИ) впервые в России были проделаны в начале 1990-х 1г. и связаны с именем Н.Н.Знаменского. «Второе дыхание» стоматологическая имплантология в нашей стране получила в 1950-х 1г. и связана с именами Э.Я.Вареса, В.Г.Елисеева. Однако лишь в 1986 г. МЗ СССР официально сняло свой запрет на применение СИ. Это событие было связано с появлением приказа МЗ СССР № 310 от 4.03.1986 г. «О мерах по внедрению в практику метода ортопедического лечения с использованием имплантатов». Определенную положительную роль в появлении этого приказа сыграли сотрудники ЦНИИС и Каунасской экспериментальной лаборатории зубной имплантации и протезирования.
Достижению современного уровня СИ в нашей стране способствовали также Г.Б.Брахман (1956), С.П.Мудрый (1956), Г.М.Иващенко (1957), В.ВЛось (1985), В.Н.Олесова (1986, 1993), А.С.Черникис (1988), И.В.Балуда (1990), АИ.Матвеева, А.И.Агеенко, О.Н.Суров (1987, 1993), М.З.Миргазизов (1993), А.Васильев, К.Вураки, А.Несмеянов (1993), АИ.Матвеева (1993), М.Д.Перова (1999), ААВаулин (2000) и многие другие ученые и клиницисты.
М.Д.Перова (1999) указывает, что в настоящее время СИ являются объектом повышенного внимания не только потому, что метод имплантации искусственных опор быстро и широко внедряется в клиническую практику, но и потому, что количество неудач при его использовании не уменьшается, осложнения носят в основном деструктивный характер, что приводит к потере костного объема в дентоальвеолярной области и влияет на состояние общего здоровья.
Учитывая, что СИ сформировались на стыке ортопедии, хирургии, биологии, биомеханики и материаловедения, зубной имплантат рассматривают как конструкцию с определенными биотолерантными и механическими свойства-
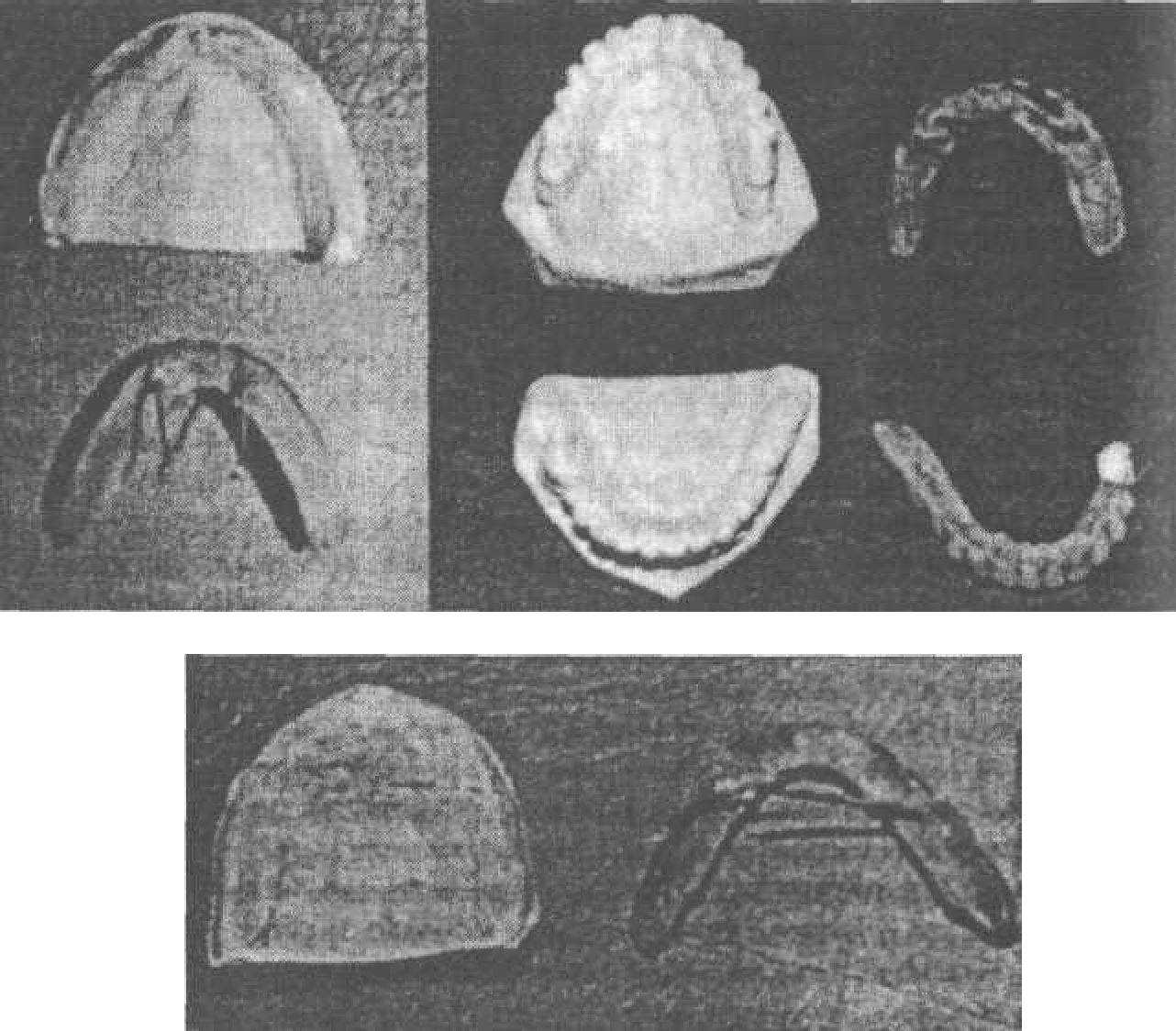
Рис. 46. Зубные протезы на «имплантатах», удаленные у больных в связи с развитием остеомиелитов челюстей и околочелюстных флегмон
ми, рассчитанную на определенный срок службы в качестве опоры зубных протезов [О.Н.Суров, 1993].
Устанавливать СИ должны специально подготовленные специалисты — врачи-имплантологи, которые прошли соответствующую специализацию и получили лицензию на этот вид оказания медицинской помощи. Вместе с тем врачи-стоматологи-ортопеды часто сталкиваются в своей практическойдеятельности с пациентами, которые имеют желание восстановить целостность жевательного аппарата с применением СИ. Поэтому мы считаем, что каждый врач-стоматолог должен знать основные современные представления о видах СИ, а также о показаниях и противопоказаниях к ортопедическому возмещению дефектов зубных рядов с применением имплантатов.
Услуги на установку СИ носят коммерческий характер. Появилось медицинское страхование — это побудило придавать важное значение в клинике стоматологической имплантологии юридическому аспекту проблемы и правовым отношениям между медицинской организацией, врачом и пациентом. В лоне этого аспекта необходимо, чтобы имеющаяся правовая база и документация обеспечивали взаимную защиту интересов и прав врача-стоматолога и пациента.
Применение СИ возможно:.
1) при наличии концевых (двухсторонних или односторонних) дефектов зубного ряда;.
2) при наличии включенных дефектов зубного ряда, как правило, протяженностью три зуба и более;.
3) при отсутствии одного зуба в интактном зубном ряду;.
4) при полном отсутствии естественных зубов на одной или обеих челюстях.
Эти показания обычно относят к специальным.
О.Н.Суров (1993) к этим показаниям относит также непереносимость съемных протезов вследствие повышенной чувствительности к акрилатам или наличие выраженного рвотного рефлекса, а также случаи заболеваний желудочно-кишечного тракта, обусловленные утратой зубов и нарушением пережевывания пищи, так как СИ являются одним из моментов патогенетического лечения. А.И.Матвеева, Л.М.Агеенко, ВАКанатов и ВА.Вигдерович (1989) рекомендуют проведение СИ при значительном повреждении области расположения съемного протеза, которое настолько нарушает фиксацию съемных протезов, что отсутствует даже минимум жевательной функции, при слабой координации жевательной и мимической мускулатуры, низкой толерантности слизистой оболочки полости рта и при наличии у пациента психологического неприятия съемного протеза.
Кроме того, эти авторы подчеркивают, что при определении показаний к СИ слелует учитывать и другие факторы: наличие макроглоссии или чрезмерной подвижности языка, не позволяющих добиться должной фиксации съемных протезов, а также профессию пациента (актеры, певцы, дикторы, музыканты, играющие на духовых инструментах и др.), у которых применение съемных протезов может привести к профессиональной непригодности или резко затруднить выполнение профессиональных обязанностей.
Среди общих показаний к СИ относят хорошее здоровье пациента, хорошие качественные и количественные характеристики костной ткани в области расположения СИ; достаточную толщину слизистой оболочки полости рта в области СИ; заботу пациента о тщательной гигиене полости рта, понимание им проблем имплантологии и обязательное выполнение всех указаний лечащего врача [АИ.Матвеева и соавт., 1989].
Противопоказания к стоматологической имплантации большинство специалистов разделяют на общие и местные. О.Н.Суров (1993) выделяет абсолютные и относительные противопоказания к дентальной имплантации.
К общим противопоказаниям следует отнести наличие у пациента хронических заболеваний, снижающих иммунологическую реактивность и неспецифическую резистентность организма, эндокринных заболеваний, заболеваний опорно-двигательного аппарата, сопровождаемых остеопорозом и другими остеопатиями, заболеваний крови и кроветворных органов, хронических интоксикаций (алкоголизм, наркомания и т.п.), злокачественных новообразований, психических заболеваний. Противопоказано выполнение дентальных имплантаций в первые четыре и последний месяц беременности. Некоторые специалисты к противопоказаниям относят наличие у пациентов аллергических и венерических заболеваний, заболеваний периферической нервной системы, а также ранее установленных металлических эндопротезов. Считается, что нежелательно выполнять СИ у пациентов старше 55 лет.
К местным противопоказаниям относят воспалительные заболевания пародонта, аномалии прикуса и деформации жевательного аппарата, парафункции жевательных мышц (бруксизм и др.), микозы, макроглоссию, заболевания височно-нижнечелюстного сустава, хронические часто рецидивирующие и предраковые заболевания органов и тканей полости рта, ранее проводившееся облучение головы и шеи по поводу злокачественных новообразований, остеомиелиты и кисты челюстей, гаймориты, общее лучевое воздействие на организм человека, большое межальвеолярное расстояние, низкий уровень индивидуальной гигиены полости рта, а также неудовлетворительные анатомические условия, обусловленные строением челюстей и др.
О.Н.Суров (1993) к абсолютным противопоказаниям относит хронические заболевания организма (туберкулез, ревматическая болезнь, сахарный диабет, стоматиты и др.); болезни кроветворных органов; заболевания костной системы, снижающие регенерационную способность; заболевания центральной и периферической нервной системы; злокачественные опухоли.
Пародонтит, патологический прикус, неудовлетворительное состояние гигиены полости рта, предраковые заболевания, наличие металлических имплантатов в других органах (спица Киршнера, искусственные суставы, клапаны, стимуляторы), заболевания ВНЧС, бруксизм являются, по мнению O.H.Сурова (1993), относительными противопоказаниями к зубной имплантации.
Некоторые из относительных противопоказаний могут быть временными, так как после устранения какого-либо патологического или физиологического процесса, изменения анатомической формы альвеолярных дуг челюстей, перевода ряда заболеваний из декомпенсированной в компенсированную форму и т.п. выполнение дентальной имплантации возможно.
При оценке показаний и противопоказаний к дентальной имплантации также необходим индивидуальный подход. Так, например, уже определены позитивные тенденции при функционировании искусственных опор, ригидно связанных с естественными зубами. Успешно интегрированные с костью дентальные имплантаты способны повышать выносливость тканей пародонта в компромиссных ситуациях без появления взаимоповреждающих эффектов [М.Д.Перова, 1999].
В то же время М.Д.Перова (1999) считает в дооперационном периоде приоритетным радикальное лечение заболеваний пародонта, так как остаточные пародонтальные карманы способны инфицировать зону имплантодесневой бороздки с разрушением мягкотканной манжетки.
В социальном плане имплантация противопоказана больным, небрежно относящимся к своему здоровью, а также тем лицам, которые употребляют в больших количествах кофе, что нарушает соотношение кальция и фосфора в крови.
и их усвоение костной тканью [О.Н.Суров, 1993]. Кроме того, имплантация должна с осторожностью назначаться людям, занимающимся тяжелым физическим трудом, поскольку во время работы могут возникать парафункции жевательных мышц в виде частого бессознательного смыкания зубных рядов с большой силой [А.И.Матвеева, АМ.Агеенко, ВАКанатов, ВАВигдерович, 1989].
Выявление показаний и противопоказаний к СИ проводится в ходе опроса и осмотра пациента, в том числе с применением лабораторно-инструментальных и специальных методов обследования (определение индекса гигиены полости рта, пробы Шиллера-Писарева, определение глубины зубодесневых карманов, рентгенография (ортопантомография), компьютерная томография, миотонометрия, гнатодинамометрия, цифровая радиовизиография, изучение диагностических моделей челюстей и др.). Ряд специалистов проводит «моделирование» условий установки имплантата в беззубый участок челюсти [ААКураскуа, Т.ЭАнакидзе, 2000].
Особое внимание обращают на состояние слизистой оболочки полости рта (тонкая, толстая; подвижная, неподвижная), расположение ее прикрепленной и неприкрепленной зоны, а также на анатомическое строение челюстей, величину и структуру их костной ткани, топографическое расположение анатомических образований. Как правило, именно характер дефекта зубного ряда, высота и ширина сохранившейся костной ткани челюсти в месте дефекта определяют выбор той или иной конструкции зубного имплантата и вида имплантации.
Следует согласиться с М.Д.Перовой (1998), что комплекс реабилитационных мероприятий должен разрабатываться руководителем бригады, владеющим всеми разделами клинической стоматологии, путем индивидуальной оценки каждой потенциальной имплантации. В рабочую бригаду рекомендуется включать хирурга, пародонтолога, ортопеда-стоматолога и зубного техника. Учитывая, что среди пациентов, обращающихся для операции стоматологической имплантации, здоровый пародонт диагностируется в 6-13%, у каждого пятого пациента обнаруживается хронический катаральный гингивит, 58% имеют начальные проявления, а 16% — развившуюся стадию пародонтита [М.Д.Перова, 1999], следует весьма рациональным признать участие пародонтолога как в доимплантационный период, так и в фазе динамического наблюдения.
Важным моментом при обследовании пациента является анализ лично им заполненной анкеты-анамнеза, а при решении вопроса о выполнении дентальной имплантации необходимо упорядочить объем медицинской помощи и заполнить всю необходимую документацию. Специальные документы для клиники дентальной имплантологии были предложены В.И.Пьянзиным, А.М.Агеенко, Й.Р.Ризваковым и Г.Н.Корякиным (1997) и М.Д.Перовой (1998). Такие документы создают юридическую основу и определяют взаимную ответственность сторон — пациента и медицинского учреждения, так называемое информированное согласие. Выделяют следующие виды стоматологической имплантации: /.По времениустановки имплантата смоментаудаления зуба или его корня: 1 — непосредственная (иммедиат) имплантация, при которой стоматологическая имплантация проводится одновременно с операцией удаления зуба, то есть имплантат вводится в лунку зуба непосредственно после удаления зуба;.
2 — отсроченная имплантация, при которой дентальные имплантаты плотно устанавливаются в создаваемое ложе в интактной костной ткани, когда на рентгенограмме челюсти не прослеживаются лунки ранее удаленных зубов, то есть зубы или их корни были удалены около года тому назад.
//.По признаку сообщения дентального имплантата (его части) с полостью рта на период его «приживления»:.
1 — одномоментная имплантация, при которой дентальный имплантат устанавливается в один этап;.
2 — двухэтапная имплантация, при которой в первый этап устанавливают тело имплантата и его «приживление» происходит подслизисто-надкостничным лоскутом альвеолярной дуги челюсти, так как после введения в костную ткань челюсти корневой части имплантата мягкие ткани над ним ушивают. Во второй этап, после «приживления» тела имплантата (около 3-6 мес), устанавливают его головку (внеальвеолярную часть СИ).
Ряд специалистов связывает с этими видами СИ возможные характеристики контакта и интеграции имплантата с костной тканью челюсти, которые условно разделяют на фиброостеоинтеграцию и остеоинтеграцию. В.Лясников и соавт. (1998) дают следующую характеристику этим методам.
Фиброостеоинтеграционный метод предусматривает помещение имплантата в подготовленное неглубокое ложе с небольшим натягом при наличии поверхностных пор и сквозных отверстий в его внутрикостной части. В последующем в процессе заживления идет прорастание костной ткани в поры и отверстия имплантата, происходит фиброкапсуляция его внутрикорневой части. Образующаяся фиброзная прослойка смягчает жевательные нагрузки, приближая свойства имплантата к натуральному корню зуба. Способы фиброостеоинтеграции используют при удовлетворительном состоянии альвеолярной дуги челюсти, они также создают возможность микроперемещений имплантата, ограничивая его устойчивость при повышенных перегрузках.
Остеоинтегративный метод отличается установкой имплантата в более глубокое, точно подготовленное ложе с повышенным натягом. Сплошная поверхность его внутриальвеолярной части при точной плотной посадке в костное ложе получает оппозицию костной ткани, чем достигается жесткое устойчивое положение имплантата. Амортизацию жевательной нагрузки должна обеспечивать система зубного протеза и супраконструкции имплантата. Остеоинтегративные способы целесообразны при значительной атрофии альвеолярных дуг челюстей, но требуют снятия жевательной нагрузки на имплантат в течение шести месяцев для завершения процессов его приживления [В.Лясников, К.Бутовский, А.Лепилин, И.Фомин, 1998].
III. По взаимоотношению имплантата смягкими итвердыми тканямиорганизма (рис. 47):.
1) внутрислизистая (инсерт) имплантация;.
2) подслизистая (субмукозная) имплантация;.
3) поднадкостничная (субпериостальная) имплантация;.
4) внутрикостно-поднадкостничная (эндооссально-субпериостальная) имплантация;
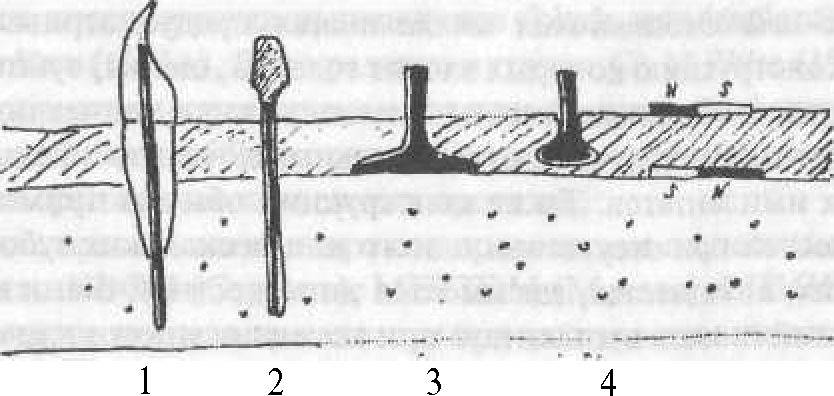
Рис. 47. Виды имплантации: 1 — эндодонто-эндоссальная; 2 — эндооссальная; 3 — субпериостальная; 4 — инсертимплантация (по О.Сурову)
5) внутризубно-внутрикостная (эндодонто-эндооссальная) имплантация;.
6) внутрикостная (эндооссальная) имплантация;.
7) чрескостная (трансоссальная) имплантация.
Инсертимплантация обычно применяется для улучшения фиксации съемных протезов (14/0) на верхней челюсти, для чего используют металлические имплантаты в виде кнопок.
Субмукозная имплантация предполагает использование магнитов, расположенных под слизистой оболочкой, и применяется для улучшения фиксации и стабилизации съемных протезов (14/14) верхней и нижней челюстей. Один магнит располагается в области переходной складки, другой (противоположной полярности) устанавливается в базисе протеза, напротив имплантированного.
Поднадкостничная имплантация предусматривает изготовление индивидуального имплантата. На первом этапе получают слепок с кости (во время операции). Затем изготавливают имплантат из КХС методом литья. На втором этапе (во время операции) устанавливают под слизисто-надкостничный слой заранее изготовленный имплантат. Такие имплантаты обьино используются при выраженной атрофии верхней и нижней челюстей при частичном или полном отсутствии зубов и позволяют затем использовать различные виды протезов.
Таблица17.
Соответствие структуры кости и вида дентального имплантата [В.П.Попельных, 1999]
Внутрикостно-поднадкостничная имплантацияпредусматривает установку имплантатов, в конструкцию которых входят головка, шейка, субпериостальная и эндооссальная части. Эти имплантаты имеют сложную геометрию и сочетают в себе положительные и исключают отрицательные моменты поднадкостничных и внутрикостных имплантатов. Такие конструкции обычно применяют в переднем отделе челюстей при отсутствии одного или нескольких зубов, а также на беззубых челюстях, в тех местах, где имеется запас костной ткани и необходима максимальная устойчивость имплантата при всех движениях нижней челюсти.
Внутризубно-внутрикостная имплантация применяетсядля устранения или профилактики возникновения патологической подвижности зубов при заболеваниях пародонта (пародонтит, пародонтоз) или сильном разрушении его коронковой части, а также зубов с резецированной верхушкой их корня. Такие имплантаты представляют собой металлические штифты с разными элементами для их механической ретенции и применяются главным образом в передних участках челюстей.
Внутрикостная имплантация предусматривает введение имплантата различной формы (пластинка, цилиндр, конус и др.) через слизисто-надкостничный лоскут в костную ткань челюсти.
В.П.Пепельных (1999) предлагает следующее соответствие структуры кости и вида дентального имплантата (табл. 17), ориентируясь в основном на имплантаты немецкой фирмы Friadent (Friatec до мая 1999 г.) системы Frialit-2 и IMX Twin Plus.
Таблица18.
Сравнительные характеристики пластинчатых и винтовых имплантатов (Ch.M.Weiss, 1992)
Концепция пластинчатых имплантатов (blade-yent implant), предложенная в 1967 г. L.Linkow (США), была развита в трудах Ch.M.Weiss (1986-1992). Пластиночные имплантаты чаще применяют при концевых дефектах зубных рядов, включенных дефектах зубных рядов большой протяженности при наличии у больного непереносимости съемных протезов.
В настоящее время нашли широкое применение отечественные пластинчатые имплантаты КВС-1 (Саратов), МЕТТЭМ (Москва), ВНИИИМТ (Москва).
Винтовые имплантаты менее сложны при техническом изготовлении и их легче устанавливать, чем пластинчатые, а в случае возникновения периимплантита резорбция кости альвеолярной дуги челюсти при наличии винтового имплантата выражена менее, чем при пластинчатом имплантате [ААКураскуа, 2000].
Винтовые имплантаты чаще применяют при необходимости возместить дефект зубного ряда протяженностью в один зуб, при изготовлении полных съемных зубных протезов (overdenture), при концевых дефектах зубного ряда в тех случаях, когда пациент отказывается от одонтопрепарирования имеющихся в полости рта зубов, реже — при полной адентии для фиксации несъемных протезов [А.И.Сидельников, 1998].
Сейчас широко используют винтовые имплантаты ITI (Германия), КОНМЕТ (Москва), Контраст (Санкт-Петербург), Fiialit-2 (Германия) и другие.
Наиболее полную сравнительную характеристику пластинчатым и винтовым имплантатам дал Ch.MWeiss (1992). Эти данные представлены в табл. 18.
Ряд специалистов при сравнении указанных конструкций внутрикостных имплантатов указывают на возможность соединения с помощью протеза только пластинчатых имплантатов с естественными зубами [АИЖусев, 1998 и др.]. Нам представляется, что этот вопрос должен решаться индивидуально в зависимости от клинической ситуации, состояния органов и тканей жевательного аппарата.
Изучение и анализ сравнительных характеристик различных видов внутрикостных имплантатов должны выполняться в уточняющем и дополняющем аспектах. Как справедливо указывает А.И.Сидельников (1998), пластинчатые и винтовые имплантаты должны не конкурировать, а дополнять друг друга. По-видимому, это наиболее конструктивная точка зрения, полезная для теории и практики стоматологической имплантологии.
Имплантаты определенной формы могут быть использованы в одной клинической ситуации и не могут быть применены в других. Именно поэтому имплантологи стремятся приобретать те имплантационные системы, которые позволяют устанавливать дентальные имплантаты в наиболее часто встречающихся клинических ситуациях. Важно иметь оптимальные их ассортименты (по диаметру, длине и др.).
Чрескостные имплантаты используют редко, чаще для фиксации съемных протезов на нижней челюсти.
Подчеркиваем, что эндооссальная имплантация в настоящее время является наиболее широко применяемой и перспективной [В.Лясников и соавт., 1998; М.Д.Перова, 1999 и др.], обеспечивая наилучшую результативность при удовлетворительном состоянии альвеолярных дуг челюстей. По данным Ю.Ласкина (1999), уровень успешного лечения составляет при этом виде имплантации от 95,6% — для винтовых имплантатов до 96,9% — для пластинчатых имплантатов системы «RADIX». Этот результат соответствует критерию эффективности, принятому Гарвардской конференцией (1978 г.), когда доля отличных и хороших данных при наблюдении в течение пяти лет должна составлять не менее 85%. В то же время можно полностью согласиться с утверждением М.Д.Перовой (1999), что попытку представления суммарных данных эффективности внутрикостной дентальной имплантации по разным имплантационным системам следует признать несостоятельной и ведущей к существенным ошибкам в стоматологической статистике, так как различные эндооссальные имплантационные системы могут предусматривать полярные варианты соединения искусственных опор с тканевым субстратом. По данным М.Д.Перовой (1999), отмечено, что непогруженные пластинчатые дентальные имплантаты отличаются наиболее неблагоприятным поведением в полости рта и демонстрируют низкий процент ус пеха (21,6%) в сроки до восьми лет, в то время как при использовании имплантационных систем ITI-Bonefit, типа Branemark положительный клинический результат был зарегистрирован автором в 91,5% и 95,3% соответственно.
D.E.Smith, GAZarb (1989) предлагают следующие критерии успеха дентальной имплантации и условия для ее применения.
Критерииуспеха:.
1.
Неподвижность отдельного неприкрепленного имплантата при клиническом исследовании.
2.
Отсутствие данных о разрежении вокруг имплантата при оценке неискаженной рентгенограммы.
3.
Средняя величина потери костной ткани по вертикали менее 0,2 мм в течение 2-го года наблюдений.
4.
Конструкция имплантата не должна препятствовать наложению коронки или зубного протеза, внешний вид последних должен удовлетворять пациента и врача.
5.
Отсутствие болевых ощущений, дискомфорта или инфекции, связанной с имплантатом.
6.
Минимальный уровень успеха к концу 5-летнего периода наблюдений 85%, к концу 10-летнего периода — 80%.
Условия для применения критериев:.
1.
С помощью этих критериев должны оцениваться только остеоинтегриро ванные имплантаты.
2.
Они применимы к отдельным внутрикостным имплантатам.
3.
Ко времени тестирования имплантаты должны быть под функциональной нагрузкой и в окклюзии.
4.
Имплантаты, которые находятся под слизистой оболочкой и в состоянии заживления относительно окружающей костной ткани, лучше включть в оценку, о них следует сообщать при наличии осложнений.
5.
Осложнения ятрогенной природы, которые не могут быть отнесены к проблеме выбора материала или конструкции, должны рассматриваться.
отдельно, когда определяется процентное выражение успеха. К ним относятся нарушение нижнечелюстного канала, проникновение в синус и носовую полость.
М.Д.Перовой (1999) прослежено влияние геометрии и текстуры эндооссальной части дентальных имплантатов на уровень маргинальной потери кости. Превышение допустимых значений этого показателя было характерно для пористых имплантатов с токарно обработанной поверхностью. Пескоструйная или плазмонапыленная обработка эндооссальной поверхности искусственных опор способствовала достоверному снижению уровня потери кости в корональном отделе. Изучение тканевых реакций на различные внутрикостные дентальные имплантаты в раннем и отдаленном периодах позволили М.Д.Перовой (1999) разработать новую текстуру эндооссальной части остеоинтегрируемого зубного имплантата и функционального вторичного элемента искусственной опоры.
Сами дентальные имплантаты классифицируют: 1 — по форме: цилиндрические сплошные или полые; винтообразные; пластинчатые (листовидные); конусовидные; в форме корня естественного зуба; 2 — по материалу, из которого они изготовлены: металлические; керамические; ситалловые; пластмассовые (в чистом виде не используются); комбинированные; 3 — по структуре материала: беспористые; поверхностнопористые; перфорированные; комбинированные.
В зависимости от типа поверхности имплантата выделяют три основных типа поверхностей: титан-плазменное напыление (TPS), напыление гидроксилапатита (НА) и собственно титан (коммерчески чистый или сплав), обработанный по специальной технологии [А.Островский, 1999]. Хотя имеются и другие виды поверхностей имплантатов.
Цилиндрический остеоинтегрируемый зубной имплантат (ОЗИ) М.Д.Перовой имеет полусферический апикальный конец, а по своей поверхности внутрикостной части несет глухие углубления (300 мкм) в форме четырехгранных пирамид — элементы макроретенции, плюс вся поверхность дополнительно обработана пескоструйным методом, в то время как корональный участок в виде кольца выполнен гладким. Благодаря увеличению поверхности соприкосновения с костью, за счет макротекстуры на 30% и дополнительной микротопографии, а также простоты установки искусственной опоры в кость без первичной компрессии стало возможным уменьшить величину маргинальной костной потери в 1,5 раза, до 0,94 ± 0,056 мм. Средний размер трабекулы, измеренный М.Д.Перовой (1999) в структуре первичной спонгиозы при изучении раннего неоостеогенеза, составил 223,14 ± 48,66 мкм, что и явилось обосновывающей величиной для элементов макротекстуры. Клиническая апробация автором предложенного имплантата показала его высокую эффективность в раннем периоде (97,6%) и через три года функционирования (95,3%).
Для стоматолога-ортопеда важно также и то, что предложенная М.Д.Перовой в ОЗИ опорная головка — супраструктура, включающая полированную до состояния зеркального блеска шейку, демонстрирующая низкие значения индекса налета, обусловливает небольшое число деструктивных осложнений при ее использовании в течение трех лет — 4%. Предусмотренная разработчиком платформа для прецизионного краевого прилежания искусственной коронки способствует герметизации ортопедической работы и предотвращает развитие микробных осложнений. Имеющаяся дополнительная возможность механической корректировки посадочного места будущей конструкции соответственно герметичной линии десны и возможность придания опоре искомой формы делает супраструктуру более универсальной, а готовую работу — естественной, без нарушения функционального равновесия в мягкотканной манжетке. Это позволяет нивелировать такие недостатки ортопедического лечения, как негерметичность краев искусственных коронок из-за недоработки головок-супраструктур, окклюзионные нарушения в основном за счет запредельного смещения аксиальных осей искусственных опор, снижение уровня прикрепленной десны и появление подвижности околоимплантатной слизистой оболочки полости рта.
Учитывая, что в некоторых клинических ситуациях зубы имеют угол до 15° между клинической коронкой и корнем (особенно передние), необходимо наличие угловых абатментов, без которых невозможно осуществить качественное протезирование зубов на имплантатах. Хотя слишком большой угол между центральной осью имплантата и абатментом снижает эффективность и сроки функционирования зубопротезных конструкций. Также необходим некоторый ассортимент абатментов по высоте и диаметру.
Важно также отметить, что материалы, из которых могут изготавливаться дентальные имплантаты, разделяют на основании их биосовместимых свойств на:.
1 — биотолерантные (КХС, нержавеющая сталь);.
2 — биоинертные (титан, алюмооксидная керамика и др.);.
3 — биоактивные (гидроксилапатит, трикальцийфосфат и др.).
Механизм соединения имплантата с костной тканью связан главным образом с типом реакции ткани на поверхность материала [L.L.Hench, E.C.Elbridgе, 1982]. В табл. 19 представлены типы ответной реакции «имплантат-ткань» по Л.Хенчу(1998).
Показанием для выбора вида имплантации, формы, размеров имплантата служат топография дефекта зубного ряда, толщина и высота имеющейся костной ткани в месте имплантации, топографо-анатомические особенности строения челюсти и многие другие.
М.Д.Перова (1999) показала, что имеется определенная тенденция к разрушению околоимплантатных тканевых структур, зависящая от локализации имплантатов: наиболее неблагоприятными для их установки являлись участки вторых и третьих моляров нижней челюсти, зона бугров верхней челюсти и область первых резцов верхней челюсти. Эти данные в основном согласуются с результатами статистического исследования PASchnitman, J.F.Rubenstein, P.S.Whozle, J.D.Dasilva, G.G.Koch (1988), показавшими, что спустя два года в переднем отделе нижней челюсти сохранилось 100% имплантатов, в боковых — 92,5%, в переднем отделе верхней челюсти — 93,3%, в боковых — 78,3% имплантатов. Такие данные связывают с анатомическим строением и особенностями кровоснабжения. В то же время М.Д.Перовой (1999) именно в этих зонах выявлено повышенное скопление зубного налета, а применение ангулярных супраструктур.
в переднем отделе верхней челюсти повышало окклюзионную нагрузку на ее альвеолярную дугу.
Чаще всего атрофия костной ткани челюстей идет в области шейки имплантата. Нам представляется, что возникновение и прогрессирование этого процесса может зависеть от операционной травмы, окклюзионных нарушений, неграмотного изготовления покрывной конструкции, а также от гигиенического состояния тканей и конструкций в этой области.
Разработаны методы СИ, предусматривающие помещение имплантатов в лунку «свежеудаленного» зуба с использованием коллагеновых мембран [J.J.Sevoi, R.Meffeit, 1992], установкой имплантата в области подбородочного отверстия с перемещением нижнеальвеолярного нерва [B.Rosenquist, 1992], одновременным использованием гребня подвздошной кости (для увеличения высоты альвеолярной дуги нижней челюсти) и внутрикостных имплантатов [E.E.Keller, D.E.Tolman, 1992], после частичной резекции верхней челюсти по поводу онкологических заболеваний [Ф.Такехиро, НАтсухи, У.Минору, 1999], при наращивании стенки верхнечелюстной пазухи с применением разнообразных материалов (гидроксилапатит, аутогенные костные трансплантаты, деминерализованная костная ткань) и др.
Таблица 19.
Типы ответной реакции «имплантат-ткань» (Л.Хенч, 1998).
Если материал токсичен, то окружающая ткань мертва.
Если материал не токсичен, а почти инертен, то вокруг формируются волокнистые фиброкапсулы различной толщины.
Если материал нетоксичен, биоактивен, то образуется контактная связь Если материал нетоксичен и растворяется, то ткань замещает его.
Методики установки различных видов дентальных имплантатов детально описаны в монографии О.Н.Сурова (1993).
Исход СИ в основном будет определяться грамотным «подбором» пациента, качеством имплантата, атравматичностыо операции, рациональным зубным протезированием и соблюдением пациентом индивидуальной гигиены полости рта. Патологические процессы (травматические, язвенные, резорбтивные и др.) в зоне расположения имплантата называют периимплантитом. Считается, что возникновение раннего периимплантита, особенно при одномоментной стоматологической имплантации, чаще связывается с неудовлетворительной индивидуальной гигиеной полости рта. Поздний периимплантит также протекает на фоне микробной контаминации поверхности искусственной опоры [М.Д.Перова, ВАКозлов, 1999].
Причем среди осложнений операции стоматологической имплантации (внутрикостной) доля деструктивных процессов составляет 86% [М.Д.Перова, 1999]. С целью профилактики и (или) лечения ранней маргинальной костной потери разработаны способы детоксикации очага планируемой регенерации и поверхности пораженной искусственной опоры электрохимически полученным.
0,1% раствором гипохлорита натрия и др., а негативные реакции покрывных мягких тканей при использовании двухэтапной имплантации в период заживления можно использовать в качестве прогностического критерия возможной маргинальной костной потери [М.Д.Перова, 1997].
Потеря искусственных опор в результате разрушения кости приводит к снижению высоты альвеолярных дуг челюстей (верхняя челюсть — с 10,2+0,273 мм до 4,0+0,1167 мм, нижняя челюсть — с 11,6+0,406 до 6,3+0,123 мм) и определенным трудностям реимплантации [М.Д.Перова, 1999].
Основными же принципиальными причинами потери дентального имплантата называют инфекцию и окклюзионную нагрузку [M.G.Newman, T.F.Flemming, 1988].
Каждой стоматологической имплантационной системе соответствуют определенные конструкции зубных протезов и методики их изготовления. Вместе с тем в отечественной и зарубежной литературе крайне мало внимания уделяется протетическому аспекту стоматологической имплантологии. Как справедливо утверждают I.Finger (1980), О.Н.Суров (1993), литература по СИ в основном отражает хирургические аспекты, а проблемы протезирования освещаются недостаточно, хотя выполнение дефектов зубных рядов является конечной целью СИ. Неслучайно H.Grafelman (1974) свидетельствует, что около 60% неблагоприятных исходов внутрикостной имплантации обусловливаются именно отсутствием четкого представления о методиках имплантологической ортопедии, так как последние требуют по-настоящему другого, более высокого уровня качества [C.A.Babbush,1977].
Остановимся на основных клинических особенностях протезирования зубов при выполнении стоматологической имплантации.
При восстановлении целостности зубных рядов на дентальных имплантатах с целью профилактики перегрузки последних изготавливают одновременно зубные протезы для верхней и нижней челюстей.
При протезировании возможно изготовление как съемных, так и несъемных зубных протезов или их комбинаций, однако нецелесообразно использовать консольные протезы, укрепляемые на имплантатах.
Подготовка полости рта к протезированию выполняется до установки имплантатов и включает удаление из полости рта пломб из амальгамы и ранее из готовленных протезов из разнородных металлов с целью профилактики гальванизма и деструктивных процессов в костной ткани альвеолярных дуг челюстей, обусловленных асептическим воспалением.
J.E.Lemons (1988), D.E.Smith (1988, 1991) подчеркивают, что использование сплавов на основе никеля для несъемных зубных протезов, опирающихся на имплантаты из титана или титановых сплавов, может приводить к возникновению электрохимических потенциалов, которые являются причиной коррозии сплавов на основе никеля. Поэтому использование металлов, стоящих далеко друг от друга в электрохимическом ряду, в одной конструкции нежелательно.
До установки стоматологических имплантатов необходимо составить план зубного протезирования, используемые конструкционные материалы, что обусловливается конструкцией имплантатов и применяемой методикой СИ, а также анатомофизиологическими условиями жевательного аппарата.
О.Н.Суров (`1993) описывает четыре возможные ситуации после операции имплантации,связанные с нагрузкойна имплантат:.
1) находящийся под слизисто-надкостничным лоскутом;.
2) свободно стоящий без нагрузки;.
3) свободно стоящий с нагрузкой;.
4) шинированный.
В 1-м случае имплантат ставится под нагрузку по истечении 3-4 мес. До этого времени пациент использует временный съемный протез.
Во 2-м случае в полости рта остается только площадка с резьбой или винтом для крепления головки или протеза, а сам имплантат не испытывает нагрузки и абсолютных показаний к изготовлению временных протезов нет.
В 3-м случае О.Н.Суров рекомендует к концу 3-й недели после имплантации установить постоянные протезы, которые выполняют шинирующую функцию и функцию жевания. При этом необходимости изготовления временных протезов нет.
В 4-м случае временные протезы должны быть изготовлены до операции СИ и фиксироваться сразу после нее [О.Н.Суров, 1993].
Вместе с тем следует заметить, что временные протезы (съемные или несъемные) следует изготавливать в зависимости от клинической ситуации. В основном их используют для сохранения высоты прикуса, нивелирования подвижности имплантата, а также по эстетическим соображениям. Иногда временные протезы изготавливают при парафункции языка, гипертонусе мягких тканей подъязычной области или при заживлении операционной раны вторичным натяжением. Одонтопрепарирование для изготовления несъемных протезов выполняют за несколько дней до операции СИ.
О.Н.Суров (1993) рекомендует для переднего участка зубного ряда изготавливать временные протезы из пластмассы, а для боковых отделов - металлические. При условии использования временных пластмассовых протезов более 1 -3 мес автор рекомендует их армировать стекловолокном или ортодонтической проволокой.
Несъемные зубные протезы следует изготавливать из однородных материалов лишь в тех случаях, когда клинически имеется оптимальное соотношение количества опор и искусственных зубов, а именно 1:1 — 1:1,5, атакже соблюдать соотношение жевательной и опорной площадей в области жевательных зубов 1:6. Это позволяет придать системе более физиологическое положение за счет сохранения рефлекторной регуляции жевательного давления с участием периодонтомускулярного рефлекса [И.С.Рубинов, 1970]. Для обеспечения параллельности опор иногда на головку имплантата приходится дополнительно изготавливать «выводные» коронки. Избежать этой работы можно, если во время установки имплантата перед ушиванием раны специалист четко убедился в правильности установки головки имплантата при центральном соотношении челюстей.
При планировании конструкций зубных протезов необходимо стремиться к обеспечению парасагиттальной стабилизации или стабилизации по дуге, а также обязательной передаче жевательного давления на имплантат строго по его вертикальной оси для исключения миграции имплантатов.
При конструировании несъемного протеза следует стремиться моделировать жевательную поверхность коронок на 1/3 меньше площади естественных зубов при умеренно выраженном экваторе [M.L.Perel, 1977], промежуточную часть мостовидного протеза создавать сердцеобразной или пулеобразной формы [C.M.Weiss, 1986], без выраженных бугров и бороздок на жевательной поверхности для профилактики чрезмерных нагрузок, воспалительных реакций тканей протезного поля под телом мостовидного протеза, а также для исключения расшатывающих перегрузок из-за блокирования движений нижней челюсти.
Оптимальной в имплантологическом отношении считают комбинированную жевательную поверхность несъемных протезов, где моделируют металлическими только окклюзионные площадки на местах передачи вертикальной нагрузки на имплантат. Это позволяет сохранить высоту прикуса и облегчить притирание жевательных поверхностей зубных рядов [О. Н. Суров, 1993]. В то же время P.I.Branemark, B.O.Hansson, RAdell et all. (1977), RAdell, V.Lekholm, B.Rockier, P.I.Branemark (1981); Branemark (1983) и другие поддерживают использование акриловой пластмассы на окклюзионной поверхности, a S.D.Jones, F.RJones (1988), S.K.Rhodes (1988) поддерживают использование керамики. D.D.Davis, RRimzott, GAZarb (1988) обнаружили, что при ударных воздействиях акриловая пластмасса уменьшает нагрузку на каркас протеза и имплантат, в то время как при статических или неударных состояниях, таких как скрежетание зубами или сильное сжимание челюстей, фарфор уменьшает давление на каркас и имплантаты.
На наш взгляд, наиболее физиологичным следует признать использование зубных протезов, изготовленнах из артгласса или сигнума.
При конструировании соединений имплантата с зубным протезом отдают предпочтение амортизаторам и разъемным соединительным элементам с винтовой или замковой фиксацией, а также применению мостовидных протезов типа «Бруклин» [М.З.Миргазизов, 1993; О.Н.Суров, 1993].
Перед фиксацией несъемных протезов необходимо оценить качество их полировки, что важно для поддержания хорошего самоочищения и эффективности мероприятий по индивидуальной гигиене полости рта.
Так, В.Н.Олесова, А.П.Перевезенцев, Ю.Р.Илевич, Т.Т.Долидзе и соавт. (2000) научно обосновали возможность применения несъемного протеза с опорой на внутрикостные имплантаты при полном отсутствии зубов на нижней челюсти, доказав, что величина напряжений в челюсти под несъемным протезом на имплантатах сопоставима с напряжениями при функционировании естественного зубного ряда.
Говоря о протетической реабилитации пациента после СИ, обычно внутри костной или инсертимплантации с применением съемных протезов следует подчеркнуть, что ряд имплантологов указывают на большую безопасность этого вида протезирования как для врача-стоматолога, так и пациента [D.Swanberg, 1975]. По мнению О.Н. Сурова (1993), пользование двумя съемными частичными или полными зубными протезами тяжело переносится больными любого возраста. Поэтому он рекомендует освободить больного хотя бы от одного съемного протеза, обеспечить их достаточную стабилизацию, а создание СИ, несъемных и съемных протезов считает оптимальным вариантом.
Разновидностью съемного протеза служат съемные мостовидные протезы, которые можно изготавливать на внутрикостные поднадкостничные имплантаты и фиксировать с помощью защелок типа «Nelson-Lock», помещаемых со стороны протезного ложа в базисе на уровне премоляров. Такие защелки гигиеничны, надежны, благодаря своей простой конструкции позволяют пациенту легко пользоваться таким протезом. Кроме этого, съемные мостовидные протезы могут фиксироваться на другие жесткие или эластичные замковые крепления или магнитные системы и внутренние кламмеры. Из магнитов для указанных целей наибольшее применение нашли неодим-железоборные и самарий-кобальтовые. Пара магнитов величиной с копейку может развивать притяжение до 250 г.
В заключение главы отметим, что для облегчения планирования СИ и протетических реабилитационных мероприятий можно пользоваться схемой оптимальных вариантов зубного протезирования с применением имплантатов (О.Н.Сурова, 1993), подробное объяснение которой представлено в его монографии.