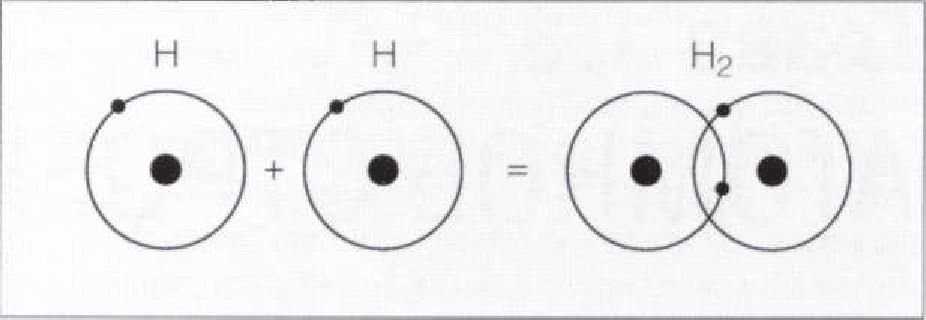
такой связи между двумя атомами водорода изображено на Рис. 1.3.2.
По мере сближения двух атомов и совмещения их электронных орбит, образуется общая молекулярная орбита, на которой два электрона принадлежат двум ядрам одновременно. Поскольку эти электроны большее время находятся в области совмещения или перекрытия орбит, связь между ними является высоко поляризованной.
Ионная связь.
Такие атомы, как натрий, легко теряют свой единственный валентный электрон. Благодаря этому их электронное строение становится подобным строению неона. Однако такой атом не сможет отдать свой электрон до тех пор, пока рядом не окажется другой атом, который сможет с готовностью принять отдаваемый электрон.
Существуют и другие элементы, способные приобрести электронное строение инертного газа после принятия одного дополнительного электрона. Этими элементами являются фтор, хлор, бром и йод, известные под названием галогенов. Таким образом, если обеспечить взаимодействие атомов натрия и хлора, то произойдет полный переход валентного электрона от атома натрия к атому хлора. Оба этих атома приобретут структуру инертного газа, при этом натрий будет иметь положительный заряд, так как он отдал свой отрицательно заряженный электрон хлору, а хлор приобретет отрицательный заряд за счет принятия дополнительного электрона от натрия. Эти два иона будут притягиваться один к другому за счет взаимодействия противоположных электрических зарядов, при этом их полная энергия снизится. Рассмотренная модель связи представлена на Рис. 1.3.3. — такие связи между атомами называются ионными.
Важнейшее отличие ковалентной связи от ионной заключается в том, что ионная связь не является поляризованной. Отсутствие поляризации объясняется тем, что ионные связи возникают в результате взаимодействия электростатических полей, окружающих ионы, и эти поля находятся во взаимодействии с полями соседних ионов.
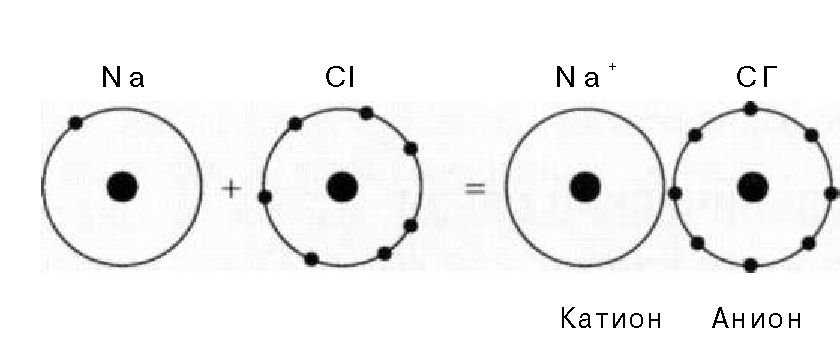
Рис. 1.3.3. Образование ионной связи между атомами натрия и хлора
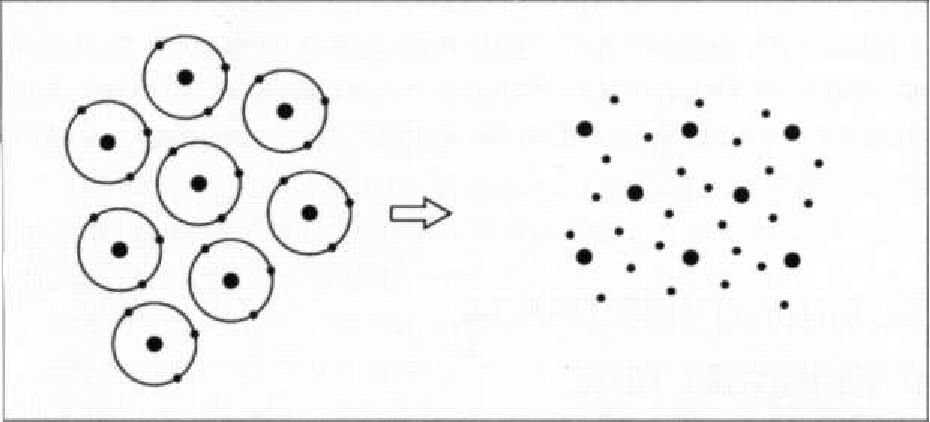
Рис. 1.3.4. Образование металлической связи с электронным облаком вокруг атомных ядер
Металлическая связь.
Третьим видом первичной связи является металлическая связь. Она возникает при сильном сближении атомов, обычно в твердых телах, которые легко отдают электроны со своих валентных электронных оболочек. В таких случаях, электроны могут достаточно свободно перемещаться в структуре твердого тела. Электронные орбиты в металлической связи обладают более низкой энергией по сравнению с электронными орбитами отдельных атомов. Это объясняется тем, что электроны внешних электронных оболочек всегда находятся на более близком расстоянии от того или иного ядра, чем находились бы в случае изолированного атома. Атомы, представленные на Рис. 1.3.4, окружены облаком электронов. Подобно ионной, металлическая связь не поляризована.
Энергия связи.
Важнейшей характеристикой связи является энергия связи. Энергия связи — это количество энергии, которое должно быть приложено для разделения двух атомов. Как показано на Рис. 1.3.1. энергия связи равна 2Е
а
-Е
т
. В Таблице 1.3.1 представлены типичные значения энергии связи для каждого из трех ее видов межатомных связей.
Общая особенность, которую нетрудно заметить при рассмотрении величин и энергии связи, состоит в том, что ковалентные связи являются самыми прочными, за ними следуют ионные связи, и, наконец, металлические. Энергия металлической связи изменяется в широких пределах — в некоторых случаях ее величина близко подходит к значениям энергий ионной связи, а в других — является крайне низкой. Ртуть обладает очень низкой энергией связи до такой степени, что не способна удержать атомы на месте даже при комнатной температуре, в результате чего она существует в этих условиях в жидком состоянии.