Осложнения, развивающиеся в ходе хирургического вмешательства или в раннем послеоперационном периоде, отличаются от осложнений, которые отмечаются в период функционирования имплантатов. Аналогично таковым при любых стоматологических вмешательствах осложнения могут быть местными (кровотечения, отек, боль или инфицирование) и общими (например, обострения имеющихся общих заболеваний).-1ю21.иг.
Осложнения способны замедлить заживление раны, привести к полной неудаче лечения или даже усугубить состояние по сравнению с исходной ситуацией.
В ходе диагностики и планирования нужно выявить имеющиеся факторы риска и определить возможность их компенсации или полного устранения.
В специальной литературе достаточно подробно описаны абсолютные и относительные противопоказания к имплантологическому лечению," которые, однако, за последние годы значительно сократились. При вмешательствах на костной ткани различают общие и местные факторы риска.
Помимо анатомических условий и состояния костной и мягких тканей важную роль в обеспечении успеха лечения играет правильный выбор пациентов.
Обширная ортопедическая реконструкция может затруднять эффективную гигиену полости рта и требует соответствующей мотивации пациента.
Кроме того, благодаря еысокой свободной поверхностной энергии титан аккумулирует больше зубного налета, чем естественный зуб. В связи с этим отсутствие готовности к сотрудничеству (в том числе вызванное сопутствующими факторами, например наркотической зависимостью) повышает вероятность неудачного исхода имплантологического лечения.
Хорошо известно, что курение является значительным фактором риска при дентальной имплантации, особенно при проведении регенеративных вмешательств. Курение ухудшает васкуляризацию и микроциркуляцию в мягких тканях, что повышает риск некроза лоскутов и образования щелевидных костных дефектов с обнажением костных трансплантатов, прежде всего при увеличении высоты альвеолярного гребня. Обширные гематомы, выраженные отеки, воспаление и кратковременные парестезии возникают у 50 % курильщиков, в то время как у некурящих указанные осложнения развиваются в 23,1 % случаев.В гистологических препаратах животных при поступлении никотина отмечалось снижение остеогенной активности в области ложа трансплантата, а также усиленное образование грануляционной ткани. Новообразованная кость содержала меньше костных клеток и отличалась худшим кровоснабжением. По данным гистометрических исследований, под влиянием никотина значительно ухудшается костеобразование. В эксперименте на животных показано, что этот алкалоид замедляет процесс приживления аутогенных костных трансплантатов, однако не препятствует ему. Обнажение или подвижность трансплантата наблюдаются у трети курящих и только у 7,7 % некурящих пациентов. Наш собственный опыт подтверждает эти данные (рис. 9-1 а—9-1 с).
Будучи фактором риска, курение не оказывает заметного влияния на результаты синус-лифтинга.
Более того, в одном исследовании не удалось обнаружить взаимосвязь между курением и осложнениями после синус-лифтинга, однако долгосрочные исследования демонстрируют статистически значимую разницу выживаемости имплантатов, установленных в области пазухи после синус-лифтинга, у курильщиков и некурящих пациентов. По данным литературного обзора, выживаемость имплантатов после синус-лифтинга и регенеративных вмешательств через 3-5 лет составляла 46-82,9 % у курящих и 93-100 % у некурящих.
Для минимизации риска осложнений при регенеративных вмешательствах на костной ткани у курильщиков рекомендуется применение определенных хирургических приемов, например двухслойное закрытие раны с помощью соединительнотканных или надкостничных лоскутов на питающей ножке, а также подготовка тоннельного ложа (рис. 9-2а-9-2д, см. главу 4).
Считается, что сахарный диабет повышает риск осложнений после внутрикостной имплантации, особенно в сочетании с регенеративными вмешательствами на костной ткани. Данное состояние нередко сопровождается вазопатией, что ассоциируется с высоким риском ряда осложнений, в частности интенсивных кровотечений в послеоперационном периоде, гематомы, инфицирования и нарушения заживления раны. При пересадке костных трансплантатов нарушение кровоснабжения в области вмешательства может стать непосредственной причиной неудачного исхода лечения. На фоне сахарного диабета после протезирования высока вероятность развития пе-риимплантита.
Прежде всего инсулинозависимый сахарный диабет и другие состояния, связанные со значительным нарушением обмена веществ, считаются абсолютными или как минимум относительными противопоказаниями. В течение первых 5 лет после имплантации при инсулинозависимом диабете либо длительном течении заболевания отмечается более выраженная убыль костной ткани вокруг имплантатов, которая в среднем составляет 1,3 мм по сравнению с 1 мм у пациентов без нарушений обмена веществ.
По данным 5-летнего контролируемого исследования, осложнения у диабетиков наблюдались в 2 раза чаще, чем у пациентов, не страдающих диабетом. При этом прежде всего отмечались расхождение швов и гиперпластические изменения. Статистически значимая разница показателей успеха и выживаемости имплантатов, а также клинические параметры, такие, как экссудация из десневой борозды, глубина зондирования и уровень прикрепления, обнаружены не были.
В другом 5-летнем исследовании выживаемость имплантатов у пациентов с сахарным диабетом составила 94,4-97,3 %, а корреляция между утратой имплантатов и уровнем глюкозы не определялась. Влияние этого заболевания на приживление костных трансплантатов предполагается, но пока не имеет четкого подтверждения.
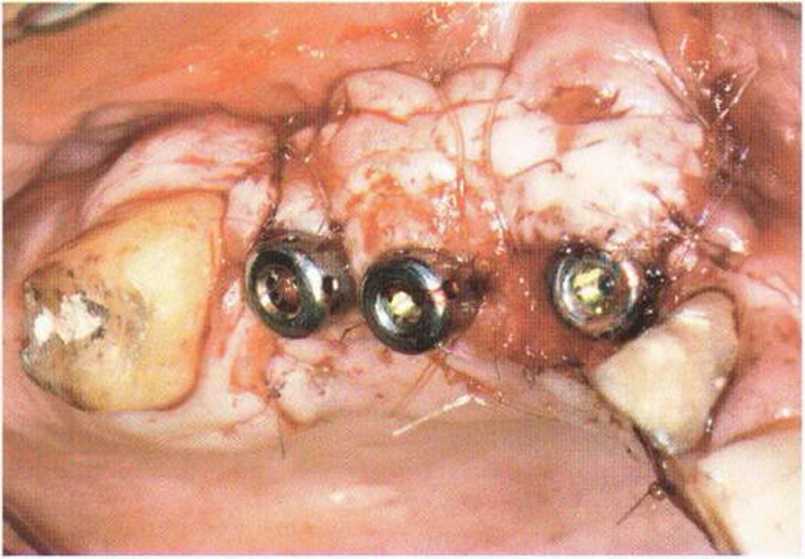
Рис. 9-1 а. Раскрытие имплантатов с апикапьным перемещением лоскута после пересадки костного блока и имплантации у злостного курильщика (25 сигарет в день)
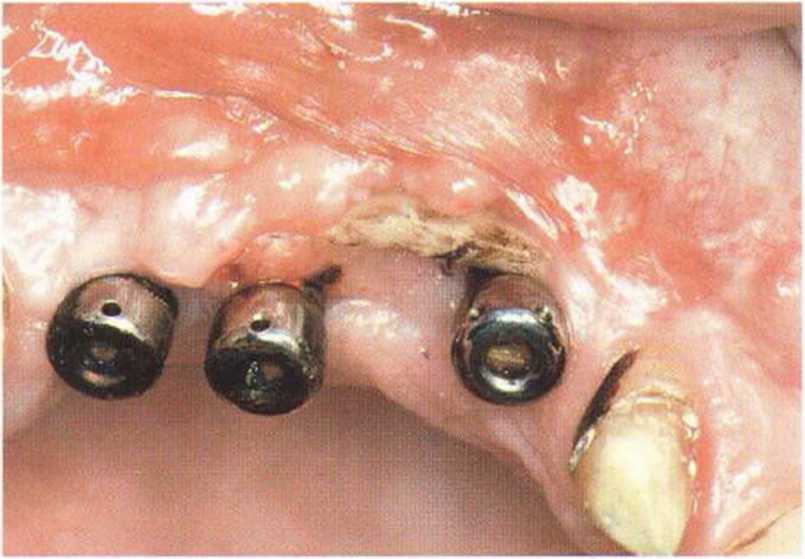
Рис. 9-1Ь. Частичный некроз лоскута с вторичным обнажением костного блока
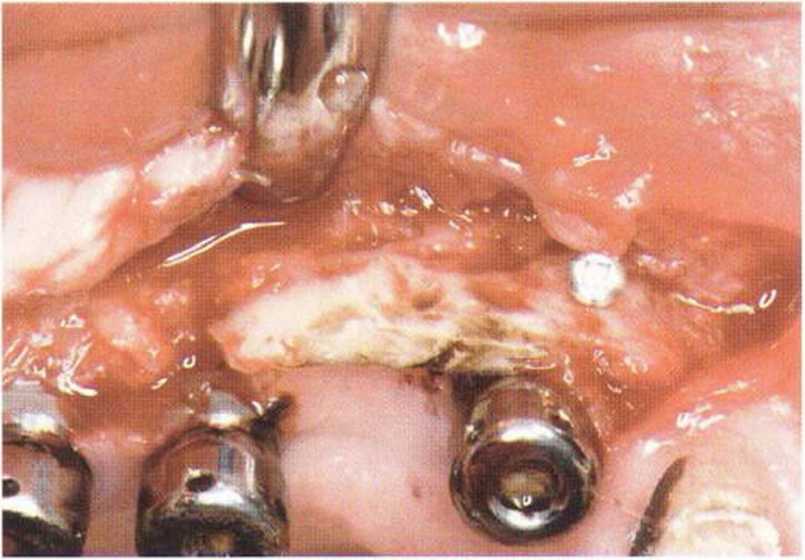
Рис. 9-1 с. Отложение никотина и табачной смолы на обнаженной поверхности кости
Рис. 9-2а. Вертикальный костный дефект с левой стороны верхней челюсти у курильщика
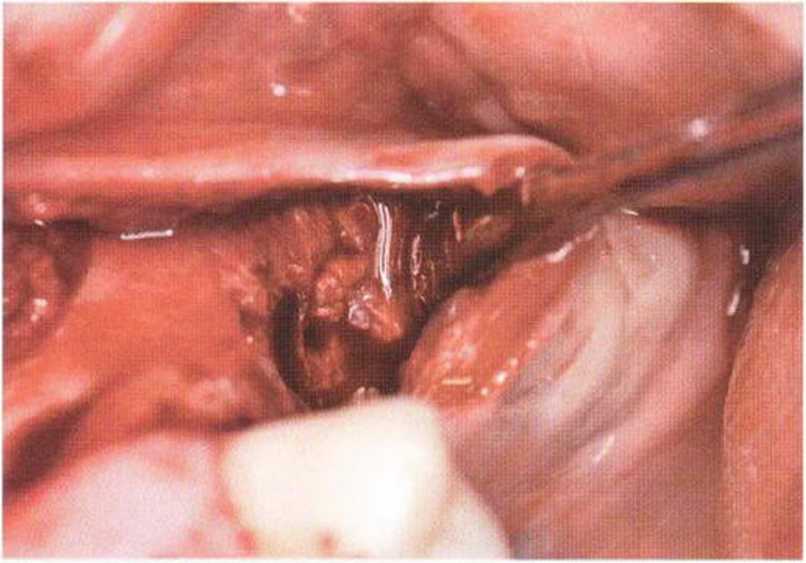
Рис. 9-2Ь. Тоннельное препарирование с визуализацией костного дефекта на верхней челюсти слева
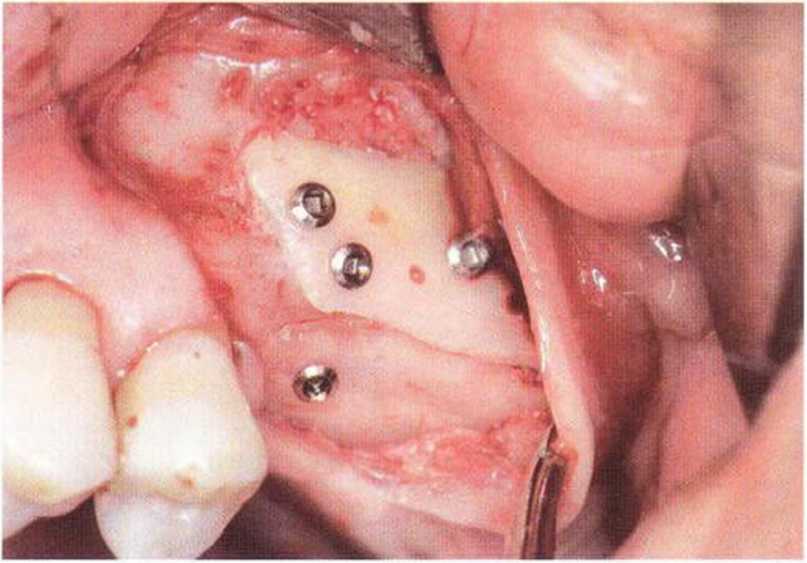
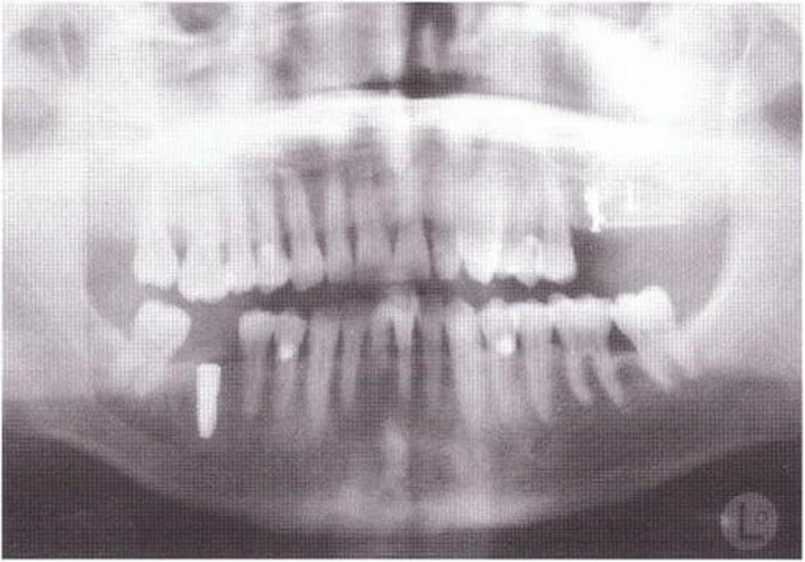
Рис. 9-2с. Трехмерная пластика с пересадкой костного блока из правой ретромолярной области нижней челюсти.
Рис. 9-2d. Контрольная рентгенограмма области регенеративного вмешательства
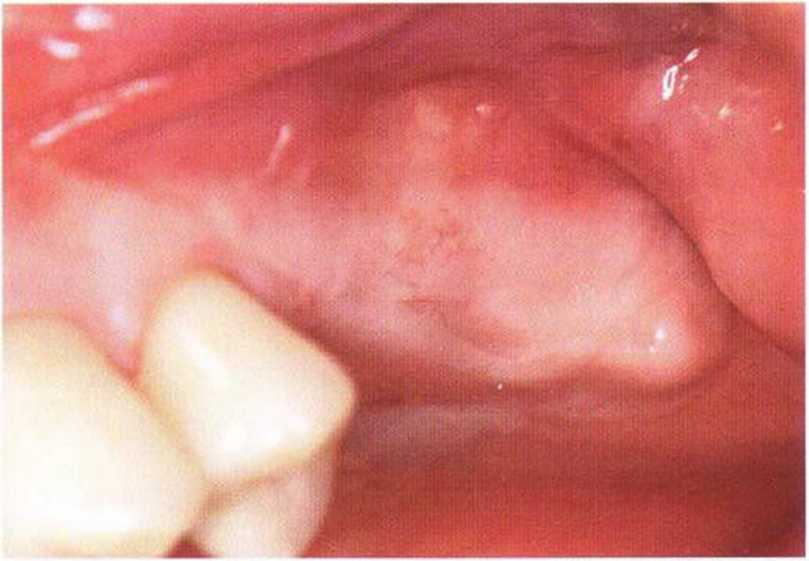
Рис. 9-2е. Отсутствие патологических изменений в области раны через 4 мес после операции
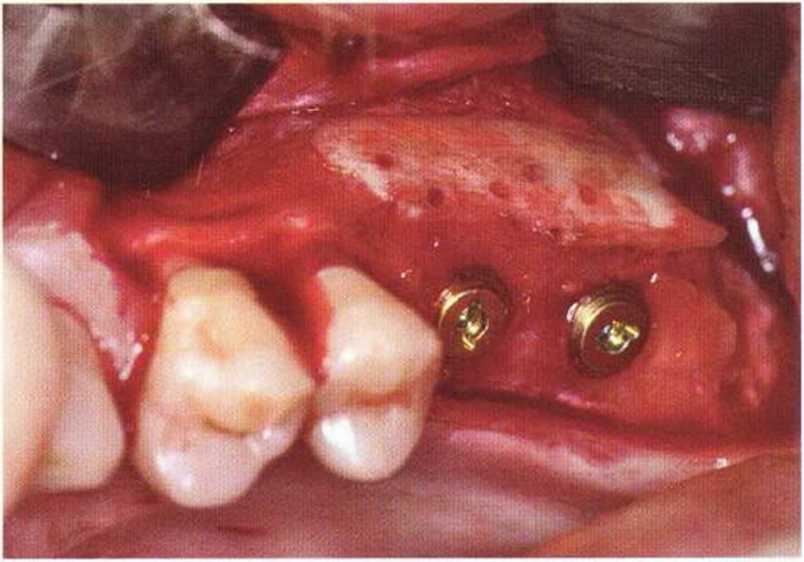
Рис. 9-2f. Установка двух имплантатов в области регенеративного вмешательства
Имплантологическое лечение все чаще проводят пациентам, которые принимают различные лекарственные препараты. К сожалению, в настоящее время четких клинических рекомендаций нет, поэтому многие вопросы в отношении предоперационного ведения и последующего наблюдения остаются открытыми.
Хорошо известно, что длительный прием глюкокортикоидов индуцирует остеопороз и повышает угрозу перелома костей из-за снижения плотности костной ткани, что является одной из причин замещения этих лекарств бисфосфонатами.-.
Стероидный остеопороз развивается преимущественно в костях опорного скелета и в меньшей степени в костях челюстей. По данным исследований, введение стероидов не приводило к значительным изменениям вращающего момента при выкручивании остеоинтегрированных имплантатов из нижней челюсти.
Длительный прием кортикостероидов подавляет иммунитет организма и замедляет заживление тканей, поэтому таких пациентов относят к группе риска,- однако в ряде исследований не отмечалось статистически значимое снижение выживаемости имплантатов на фоне стероидной терапии.-- Из-за подавления иммунитета и связанного с этим высокого риска инфицирования регенеративные вмешательства у таких пациентов
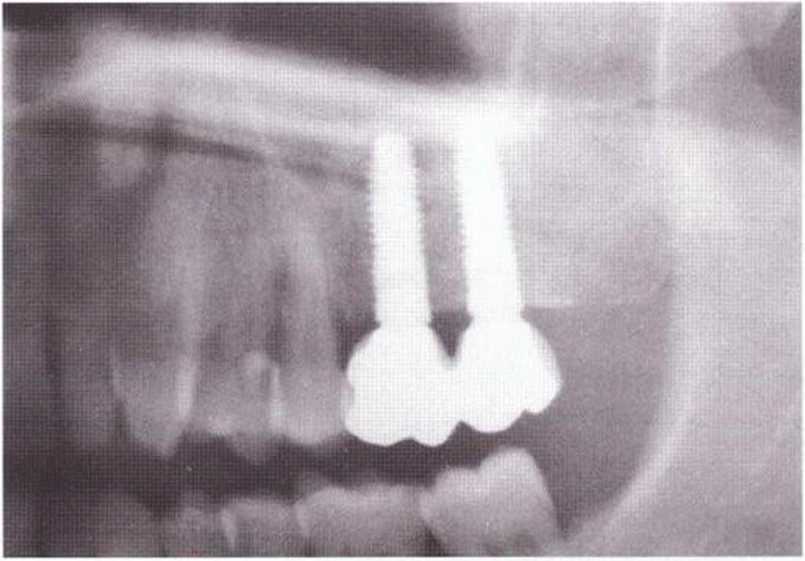
Рис. 9-2д. На ортопантомограмме через 3 года после операции определяется стабильное состояние костной ткани рекомендуется проводить не ранее чем через 3 мес после отмены кортикостероидных препаратов.
Краткосрочное назначение высоких доз кортикостероидов (250 мг) перед операцией для профилактики отека при обширных регенеративных вмешательствах на костной ткани, вероятно, не оказывает отрицательного влияния на заживление раны.
При синус-лифтинге некоторые авторы рекомендуют системное назначение антибиотиков и глюкокортикоидов.
Бисфосфонаты были предложены для альтернативного лечения остеопороза, костных опухолей, болезни Педжета и гиперкальциемии около 10 лет назад, однако сегодня доказано, что их внутривенное назначение может вызывать болезненное обнажение и остеонекроз костей челюстей, преимущественно нижней. Несмотря на редкое развитие этого осложнения, оно встречается у пациентов, принимающих бисфосфонаты, после хирургических вмешательств в полости рта, в том числе установки имплантатов.
В настоящее время считается, что механизм индуцированного бисфосфонатами ос1еонекро-за заключается в угнетении активности остеокластов и метаболизма костной ткани на фоне длительного приема этих препаратов. Нужно отметить, что в таких случаях естественные репаративные механизмы несостоятельны даже при минимальных травмах и тем более при имплантации, поэтому удаление зубов и другие хирургические вмешательства в полости рта, в том числе установку имплантатов, проводят до лечения бисфосфонатами.
Многочисленные случаи остеонекроза челюсти, вызванного бисфосфонатами, описаны как при внутривенном введении, так и при пероральном приеме этих препаратов, но большинство случаев относится к внутривенному введению. По данным Grant и соавт., выживаемость имплантатов при пероральном приеме бисфосфонатов снижается незначительно, однако известны случаи остеонекроза после установки имплантатов. Поражения нередко наблюдаются у пациентов старше 55 лет с сопутствующими заболеваниями. В литературном обзоре за 1966-2006 гг. определялась взаи-.
%.
мосвязь между развитием остеонекроза челюсти и пероральным приемом бисфосфонатов, алендро-новой кислоты, ибандроната, этидроната, клодро-ната или памидроната, назначавшихся для лечения остеопороза. Более 70 % случаев остеонекроза отмечалось на нижней челюсти, около 80 % пациентов были старше 60 лет, среди них всего 13 % мужчин. В 80 % случаев пусковым фактором стало хирургическое вмешательство в полости рта. Четкая взаимосвязь между продолжительностью приема препарата и остеонекрозом челюстей не установлена. По нашему мнению, распространенность остеонекроза с учетом миллионов случаев приема бисфосфонатов для лечения остеопороза относительно низка.
Воздействие бисфосфонатов может быть различным. Безаминовый бисфосфонат клодронат подавляет ремоделирование костной ткани иначе, чем аминовые бисфосфонаты, что объясняет малое число случаев остеонекроза челюсти даже при многолетнем приеме клодроната. Экспериментальные исследования подтверждают, что аминовые бисфосфонаты изменяют активность остеокластов, уменьшают резорбцию альвеолярной кости и могут оказывать противовоспалительное и антибактериальное действие при пародонтите.-.
Перед хирургическими вмешательствами в полости рта обязательно следует проинформировать пациентов о возможных осложнениях.
К сожалению, в настоящее время простых и эффективных методов устранения описанных осложнений нет. Болезненное обнажение костной поверхности может сохраняться многие годы, что сильно затрудняет прием пищи и нередко сопровождается значительной потерей массы тела. Нарушение заживления после установки имплантатов в единственном известном случае было успешно ликвидировано с помощью местной (тетрациклин) и системной антибиотикотерапии, обработки раны антисептиками и пересадки костного трансплантата.
Системные заболевания костной ткани также отрицательно влияют на остеоинтеграцию внутрикостных имплантатов и их выживаемость.
В настоящее время результаты долгосрочных исследований не подтверждают оправданность отказа от имплантации при остеопорозе.- По некоторым данным, при этом заболевании регенеративные вмешательства ассоциируются с более высоким риском резорбции или недостаточного приживления трансплантата, а также утраты имплантатов, однако при этом остеопороз не считается абсолютным противопоказанием к имплантации. С большей вероятностью осложнения вызваны побочными эффектами приема кортикостероидов или бисфосфонатов для лечения остеопороза. Другие авторы отмечают отсутствие изменений в костях челюстей, несмотря на поражение костей опорного скелета.’.
Тем не менее при некоторых системных поражениях костной ткани с нарушениями циркуляции и снижением перфузии кости, например болезни Альберса-Шёнберга и болезни Педжета, регенеративные вмешательства на костной ткани и имплантация противопоказаны.-
Проведение любых хирургических вмешательств, в том числе стоматологических, на фоне антикоагулянтной терапии всегда повышает риск кровотечения. Традиционный подход предполагает отмену антикоагулянта перед операцией, но это увеличивает вероятность угрожающей жизни тромбоэмболии. В последние годы при приеме кумарина, ацетилсалициловой кислоты или гепарина некоторые специалисты не прерывают антикоагулянтную терапию, а прибегают к местным методам остановки кровотечения.-- В одном из исследований при максимальном значении МНО 5,5 кровотечение развивалось в 1,96 % случаев. В другой работе существенные различия между пациентами с показателем МНО в пределах 1,5-1,99 и выше 3,5 не были выявлены. Перед установкой имплантатов следует оценить объем предполагаемого вмешательства, риск кровотечения, опыт хирурга и оснащение операционной, а также учесть общее состояние пациента. В некоторых случаях вмешательство очень целесообразно проводить в условиях стационара. Более того, регенеративные манипуляции на костной ткани, особенно при увеличении толщины и высоты альвеолярного гребня и необходимости значительной мобилизации лоскута для ушивания раны без натяжения, рекомендуется осуществлять в стационаре. При этом кумарин или ацетилсалициловую кислоту заменяют гепарином, концентрацию которого легче контролировать. Кроме того, в ходе операции следует отказаться от проводниковой анестезии. Вместо этого рекомендуются методы местного гемостаза, например биполярная коагуляция сосудов, костное блокирование, а также применение коллагенового полотна или фибринового клея. При вмешательствах на нёбе могут быть эффективны защитные каппы.
Состояние после лучевой терапии считается противопоказанием к имплантации, однако именно пациенты онкологического профиля после обширных резекций и изменения анатомических контуров челюстей и лица часто нуждаются в изготовлении зубных протезов с опорой на имплантаты.
Считается, что успех имплантации в облученной челюсти зависит от лучевой нагрузки, при этом общая доза не должна превышать 60 Гр (малыми порциями по 4-5 Гр) в течение нескольких недель, а пациент должен проходить лечение с использованием гипербарической оксигенации, но и при выполнении этих условий прогноз имплантации на нижней челюсти является более благоприятным, чем на верхней. Таким образом, при определенных предпосылках положительные результаты возможны даже в указанной проблемной группе.- Донорская область для получения костных трансплантатов должна находиться на удалении от зоны облучения (например, гребень подвздошной кости).
В настоящее время имплантация является стандартным методом замещения зубов, а число пациентов, которым было проведено имплантологическое лечение, постоянно увеличивается. При этом, несмотря на улучшение долгосрочных результатов имплантации, сохраняется проблема воспаления тканей вокруг имплантатов.
Микробиологические исследования показали, что при утрате имплантатов вокруг них выявляются типичные для пародонтита патогенные бактерии, в частности некоторые виды бактероидов и фу-зобактерий, а также большое количество грам-отрицательных палочек, A. actinomycetemcomitans, Capnocytophaga и веретенообразные бактерии.Известно, что изменения при периимплантите клинически и микробиологически аналогичны таковым при пародонтите." Кроме того, в литературе отмечена взаимосвязь между быстро прогрессирующим пародонтитом и несостоятельностью имплантатов.
У пациентов с пародонтитом в анамнезе после пародонтологического лечения в первый год после протезирования с опорой на имплантаты не развиваются какие-либо грозные осложнения, а краткосрочная выживаемость имплантатов не отличается от таковой у пациентов без пародонтита. Более того, 5-летняя выживаемость имплантатов примерно одинакова вне зависимости от причины утраты зубов. Нужно отметить, что успех имплантологического лечения повышается при достаточной мотивации и обучении пациентов методам эффективной самостоятельной гигиены полости рта. В идеале, соответствующий инструктаж пациентов нужно провести еще до установки имплантатов.
Как бы то ни было, отмечается тесная взаимосвязь между несостоятельностью имплантатов и пародонтитом при немедленном замещении пораженных зубов имплантатами (немедленная имплантация). Кроме того, при утрате зубов вследствие пародонтита отмечается значительное повышение риска периимплантита..
Тяжелый пародонтит, как правило, сопровождается выраженной костной деструкцией. При убыли костной ткани в области зубов, прилегающих к зоне регенеративного вмешательства, возможность увеличения высоты альвеолярного гребня сильно ограничена, так как восстановление утраченного пародонта крайне затруднено (рис. 9-За-9-Зс). В таких случаях для улучшения прогноза регенеративного вмешательства может быть целесообразно удаление зубов, непосредственно прилегающих к костному дефекту.
Возможность протезирования с опорой на имплантаты определяется объемом альвеолярного гребня. Главным условием успешной остеоинтегроции внутрикостных имплантатов является их первичная стабильность, которая ззвисит, в том числе, от качества и количества костной ткани в области ложа имплантата.
По качеству Lekholm и Zarb различают четыре типа костной ткани:.
• тип I: гомогенная компактная кость;.
• тип II: широкий компактный слой окружает узкопетлистую губчатую кость;.
• тип III: тонкий кортикальный слой окружает плотную губчатую кость;.
• тип IV: тонкий кортикальный слой окружает рыхлую губчатую кость.
Помимо ряда качественных параметров кости клинически выделяются определенные варианты формы челюсти. Различают пять классов атрофии верхней и нижней челюсти:.
• класс А: почти полностью сохранившийся альвеолярный гребень;.
• класс В: незначительная резорбция альвеолярного гребня;.
• класс С: выраженная резорбция альвеолярного гребня до базальной дуги;.
• класс D: начальная резорбция тела челюсти;.
• класс Е: крайняя степень резорбции тела челюсти.
Для конкретных сочетаний типов и степени атрофии кости рекомендуются определенные варианты протезирования с опорой на имплантаты.
Клинически классы В и С верхней и нижней челюстей в сочетании с II или III типом кости обычно не создают каких-либо проблем, поскольку в этих случаях, как правило, легко обеспечивается высокая первичная стабильность имплантатов. Напротив, при резорбции класса А и IV типе кости сложно добиться достаточно высокой первичной стабильности имплантатов без дополнительных манипуляций, направленных на улучшение ее качества, например конденсации с применением остеотомов.
В области нижней челюсти резорбция классов D или Е в сочетании с костью I и II типа считается наиболее сложной для имплантации. В резулыа-те очень высокой плотности кортикального слоя перегревание костной ткани при создании ложа и установке имплантата может привести к развитию так называемого синдрома сожженной кости (см.
раздел 9.5). Кроме того, в таких случаях иногда возможна установка только коротких имплантатов, что ведет к неблагоприятному соотношению длины имплантата и высоты коронки.
При избыточной нагрузке на имплантат на прилегающей костной поверхности не исключается образование трещин, в которые могут проникать клетки соединительной ткани, что в дальнейшем приводит к утрате остеоинтеграции и увеличению подвижности имплантатов. Это может объяснять относительно большее число неудач при установке коротких имплантатов. В области верхней челюсти клинические сложности возникают при резорбции классов D и Е, поскольку вследствие вертикальной резорбции кости значительно труднее добиться высокого эстетического результата и обеспечить пациенту нормальную дикцию. Имплантологическое лечение в этих случаях становится более затратным, поскольку требуются обширные регенеративные вмешательства.
Аналогичные правила касаются толщины альвеолярного гребня. После установки имплантат должен быть окружен костной пластинкой толщиной не менее 1-2 мм, иначе в результате неизбежного ремоделирования костной ткани в области шейки имплантата уже в течение короткого времени возможно обнажение его поверхности.
При отсутствии указанных условий перед препарированием ложа имплантата показано проведение соответствующих регенеративных вмешательств, направленных на увеличение толщины альвеолярного гребня, например расщепление или расширение костного гребня, пересадка костных блоков или направленная костная регенерация.
Выживаемость трансплантата всегда определяется качеством и интенсивностью реваскуляризации.- Регенерация костной ткани улучшается при быстром восстановлении кровоснабжения, что во многом зависит от регенеративного потенциала принимающего ложа.
Чем больше костных стенок у принимающего ложа, тем с большей костной поверхностью контактирует трансплантат. При увеличении толщины альвеолярного гребня наименее приемлема одностеночная форма ложа. Кроме того, сложнее добиться значительной регенерации костной ткани при обнажении корней соседних зубов, что часто встречается после травм и при пародонтите.
Потенциал регенерации принимающего ложа сильно снижается после неудачных регенеративных вмешательств с использованием костных материалов. Это происходит в результате сохранения на поверхности костного ложа не-резорбированных частиц костного материала, которые интегрируются в ложе и препятствуют реваскуляризации трансплантата (рис. 9-4а). В такой ситуации показано как можно более полное удаление биоматериала л создание множественных точечных перфораций в принимающем ложе (рис. 9-4Ь).
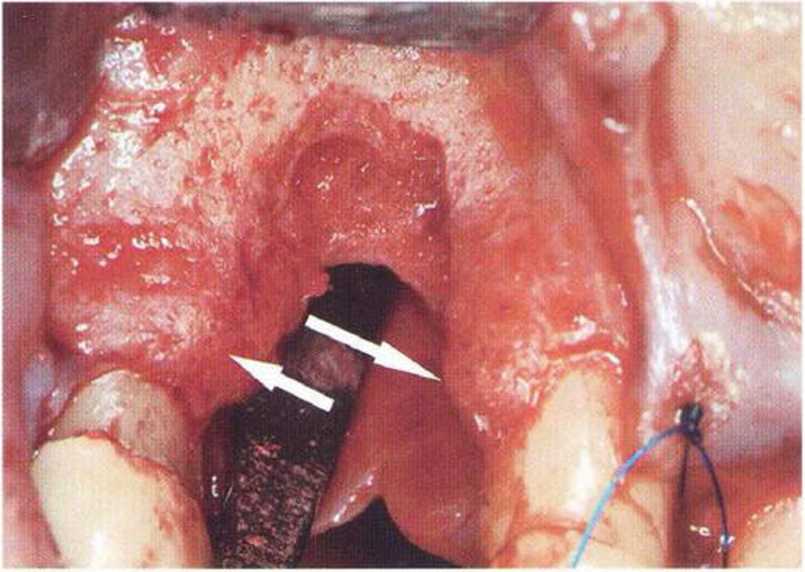
Рис. 9-За. Важной предпосылкой для успешного устранения вертикальных костных дефектов является интактный пародонт соседних зубов
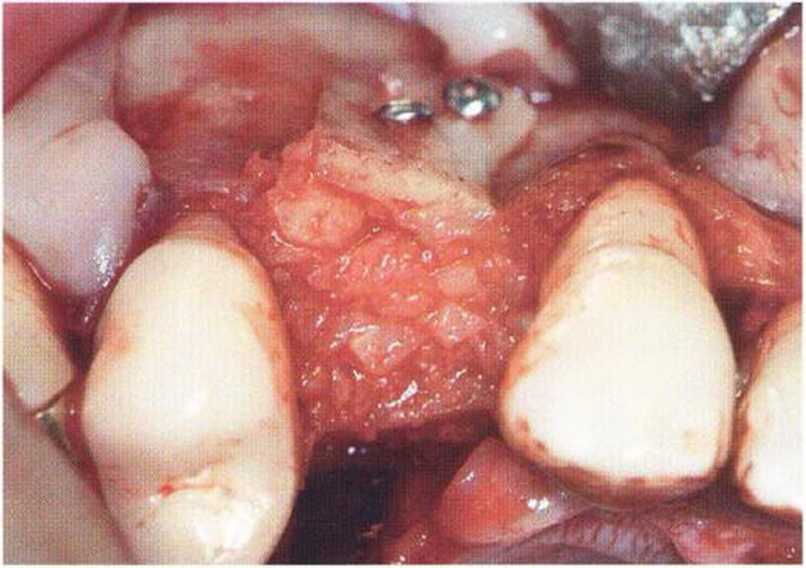
Рис. 9-ЗЬ. Увеличение высоты гребня в области зуба 14: костные трансплантаты контактируют с костью базально и латерально в области соседних зубов
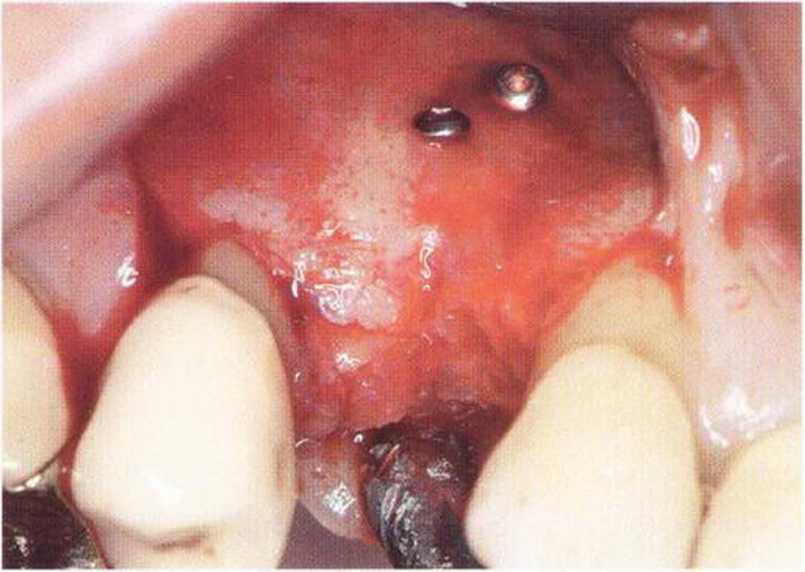
Рис. 9-Зс. Через 4 мес после операции отмечается полноценная регенерации кости
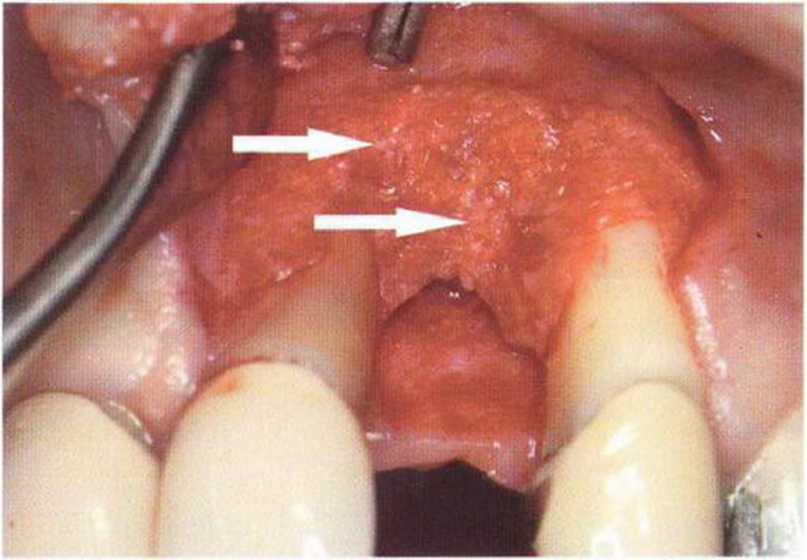
Рис. 9-4а. Состояние после неудачи регенеративного вмешательства с применением ксеногенного материала. Частицы биоматериала снижают эффективность трансплантации, поскольку играют роль непроницаемого барьера, препятствующего васкуляризации трансплантата
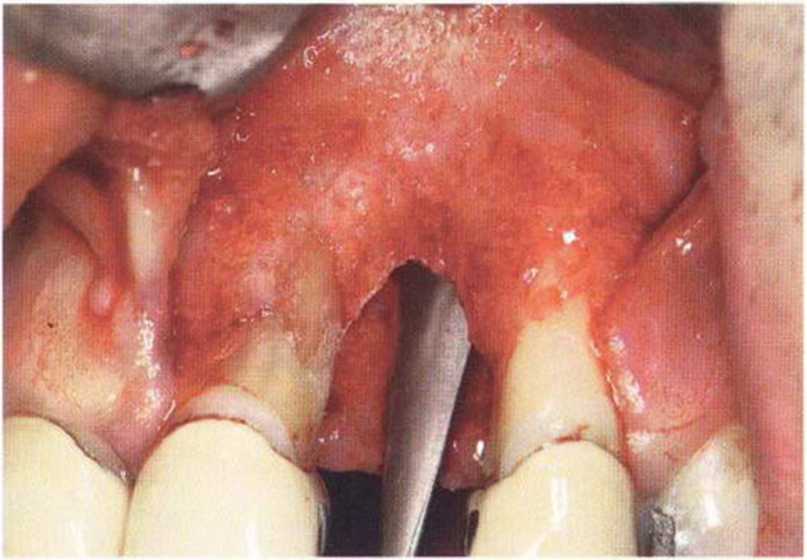
Рис. 9-4Ь. После удаления биоматериала и механической обработки возможна пересадка костного трансплантата. Однако в данном случае эффективность трансплантации ограничена из-за обнажения корней соседних зубов
Состояние мягких тканей имеет огромное значение для успеха имплантологического лечения, поэтому перед хирургическим вмешательством нужно провести их тщательное обследование, чтобы убедиться в наличии соответствующих условий для операции. Во-первых, для закрытого приживления имплантатов и особенно при регенеративных вмешательствах на костной ткани необходимо полное перекрывание области операции лоскутом без натяжения. Во-вторых, условием долгосрочного успеха имплантации считается достаточно широкая зона кератинизированной прикрепленной десны или просто прикрепленной слизистой. На нижней челюсти нередко проводят вестибулопла-стику для создания вокруг имплантатов толстого слоя мягких тканей, сохраняющего стабильность в течение длительного периода. На этапе раскрытия имплантатов можно применять специальные методы, направленные на улучшение состояния мягких тканей.
После травм или нескольких зубосохраняющих операций нередко происходит выраженное рубцевание слизистой (рис. 9-5а-9-5с). Состояние мягких тканей может значительно ухудшаться после резекции опухолей и реконструктивных вмешательств с пересадкой кожных трансплантатов.Рубцы снижают эластичность лоскута и затрудняют его адаптацию после установки имплантата или регенеративных вмешательств на костной ткани.
Ухудшение кровоснабжения лоскута и рубцевание надкостницы, в свою очередь, снижают интенсивность костной регенерации со стороны надкостницы (рис. 9-6а). После неудачных операций с применением костных материалов нередко происходит рубцевание и ухудшается кровоснабжение десны (рис. 9-6Ь).
Применение мембран может быть особенно неблагоприятно, поскольку они представляют собой дополнительное инородное тело, что еще более повышает риск расхождения краев раны и ее инфицирования.
Основная проблема современной имплантологии заключается в достижении благоприятного внешнего вида десны в эстетически значимой зоне. Перед вмешательством следует оценить эстетические возможности лечения и сопоставить их с ожиданиями пациента. Помимо структуры десны и сосочков также необходимо учитывать степень обнажения зубов при улыбке. При этом важную роль играет толщина десны, поскольку успешный исход ряда хирургических методов возможен только при достаточно толстом слое мягких тканей.
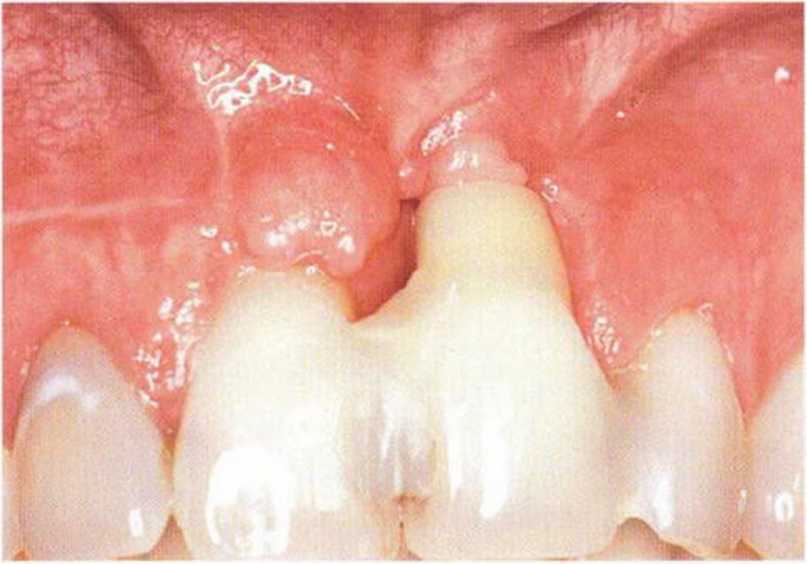
Рис. 9-5а. Значительный дефицит костной и мягких тканей с выраженным рубцеванием после предшествовавших операций.
Перед регенеративным вмешательством необходимо улучшить состояние мягких тканей
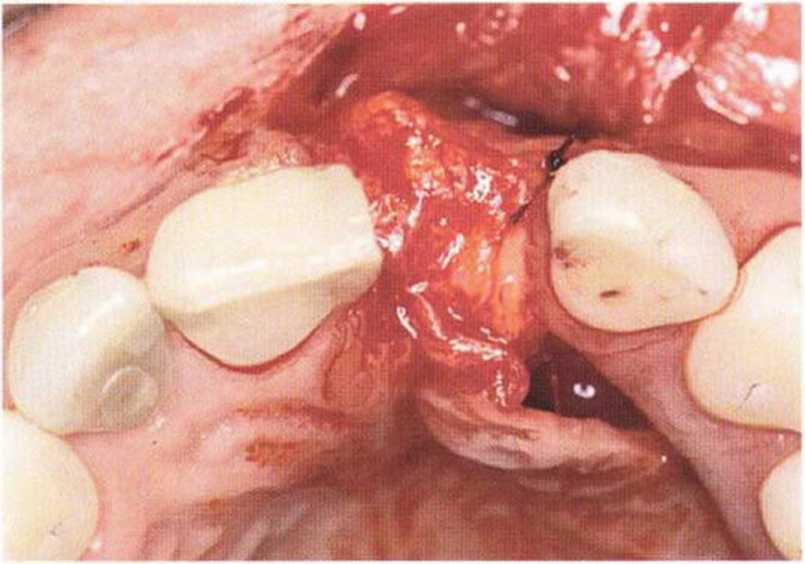
Рис. 9-5Ь. Увеличение объема десны с помощью нёбного соединительнотканного лоскута на питающей ножке
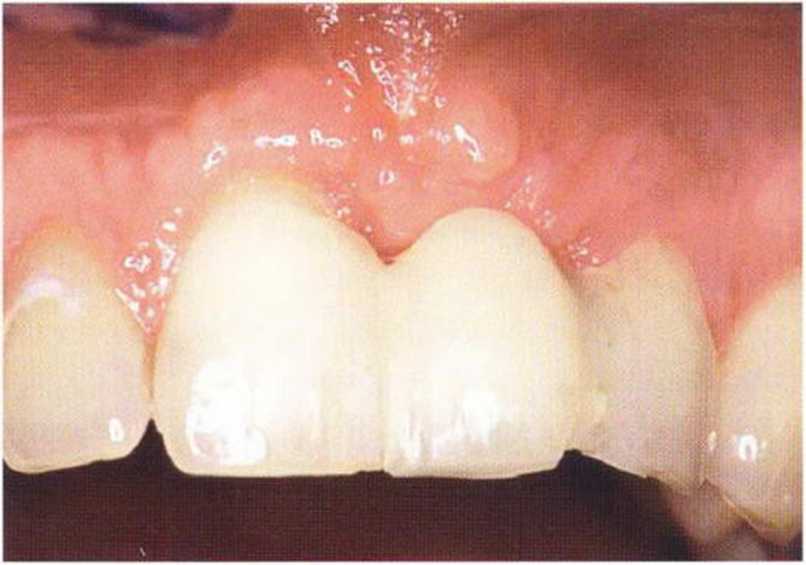
Рис. 9-5с. После установки провизорного протеза клинически определяется значительное улучшение состояния мягких тканей
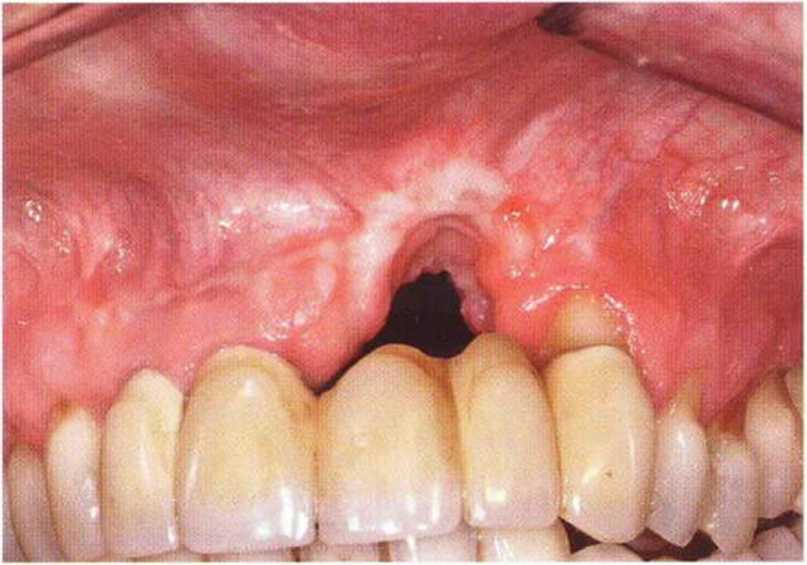
Рис. 9-6а. Значительный дефицит кости и десны с интенсивным рубцеванием после нескольких неудачных регенеративных вмешательств с использованием биоматериалов
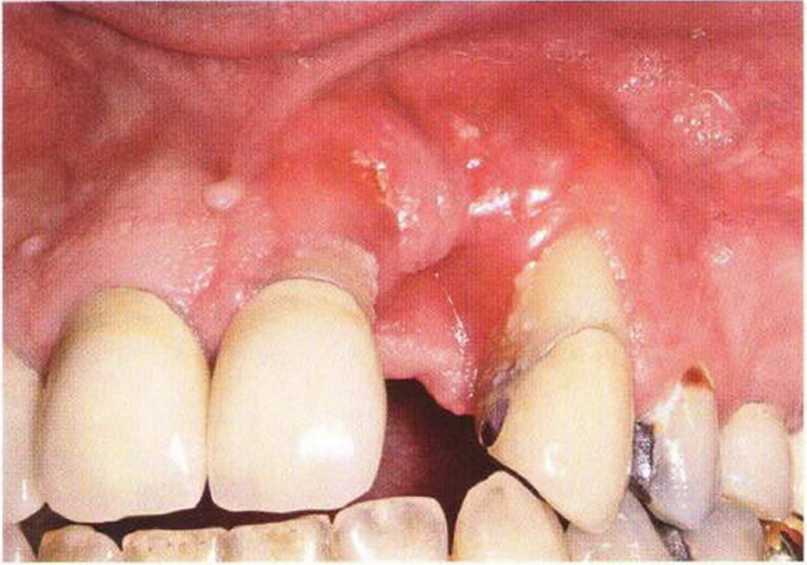
Рис. 9-6Ь. Крайне неблагоприятное состояние мягких тканей. Рецессия десны в области соседних зубов после неудачного регенеративного вмешательства с использованием ксеногенного костного материала
Приведенные выше факторы риска указывают на высокую значимость профилактических мероприятий в рамках оперативного вмешательства не только из-за юридических последствий.
Отказ от антибиотикопрофилактики значительно повышает риск инфицирования раны после пересадки костных трансплантатов с внутриро-товых донорских участков, поэтому в настоящее время антимикробная профилактика при трансплантации кости считается обязательной.Антимикробные препараты вводят внутривенно или принимают перорально. Пероральный прием антибиотиков назначают как минимум за 1 час до операции. Внутривенные антибиотики вводят непосредственно перед вмешательством до инфильтрации области операции анестетиком с вазоконстриктором, т.е. при сохранении достаточной тканевой проницаемости. Антибиотикопрофилактика продолжается 7-10 дней после операции.
При стандартной установке имплантатов или регенеративных вмешательствах назначают пенициллин G или пенициллин V (10 ME 3 раза вдень), при синус-лифтинге рекомендуется прием амок-сициллина (2 г/день). При аллергии к пенициллину при всех вмешательствах назначают клиндами-цин (1,2 г/день).
Перед операцией пациент должен прополоскать рот 0,1 % раствором хлоргексидина глюконата, что значительно сокращает число микроорганизмов.Эффективность такого пэиема для замедления образования зубного налета при применении в течение 2-3 недель после вмешательства хорошо известна на примере методов направленной тканевой регенерации, поэтому полоскание рта хлор-гексидинсодержащими растворами рекомендуется после пересадки костных трансплантатов.
9.5 Факторы риска и осложнения при получении внутриротовых трансплантатов костной ткани.
Внутриротовые донорские источники костных трансплантатов имеют ряд преимуществ над вне-ротовыми.’ В полости рта костную ткань можно получить на верхней и нижней челюстях.
При этом следует учитывать локализацию важных анатомических образований, например корней зубов, кровеносных сосудов или нервов.
Донорскими участками губчатых трансплантатов малого объема являются бугры или участки, прилегающие к грушевидному отверстию, а также экзостозы верхней и нижней челюстей.
Для увеличения толщины и (или) высоты альвеолярного гребня, как правило, можно получить достаточный объем костной ткани на нижней челюсти,бв.бмш.тз
частности в ретромолярной области, на подбородке или на участках адентии, например под промежуточной частью мостовидного протеза.71.Э..41 q области нижней челюсти получают преимущественно кортикальные и кортикально-губчатые трансплантаты. Риск осложнений определяется локализацией донорского участка. В любом случае важными преимуществами внутриротовых источников костной ткани над вне-ротовыми являются отсутствие второго операционного поля и меньшая инвазивность вмешательства, которое в большинстве случаев проводят в амбулаторных условиях. Трансплантация кости из внутриротовых источников ассоциируется с меньшим дискомфортом и исключает вероятность образования внеротовых рубцов. Кроме того, костная ткань нижней челюсти плотнее, чем ткань гребня подвздошной кости.
Предоперационная диагностика играет основополагающую роль в профилактике осложнений. Состояние потенциального донорского участка определяют методом пальпации костных структур.Наряду с этим необходимо тщательно обследовать мягкие ткани полости рта. Рубцовые изменения затрудняют доступ к операционному полю и ушивание раны, а также замедляют ее заживление.-.
Стандартные методы лучевой диагностики начинаются с ортопантомограммы, с помощью которой определяют положение нервов, подбородочных отверстий и корней зубов. При необходимости дополнительно делают прицельные рентгеновские снимки, телерентгенограммы головы в боковой проекции, проводят компьютерную томографию или конусно-лучевую компьютерную томографию.
О плотности костной ткани можно судить по ее рентгеноконтрастности.
Для получения аутогенной кости в процессе препарирования ложа имплантатов могут быть эффективны тонкие трепаны. Полученные костные фрагменты можно измельчить и применять для устранения относительно мелких костных дефектов в области имплантатов. Трепаны используют вместо первого (пилотного) сверла при обильной ирригации. Во избежание перегревания костной ткани движения трепана должны быть прерывистыми. Особенно велика опасность ожога кости при прохождении трепаном через кортикальный слой нижней челюсти. По данным наблюдений, такое поражение наблюдается преимущественно при установке длинных винтовых имплантатов (длина 13, 15 и 18 мм). Для синдрома сожженной кости характерен ряд симптомов, к которым относятся устойчивая болезненность (дольше месяца), рецидивирующие отеки и боль при пальпации. Рентгенологически через 8 недель после установки имплантатов определяются четко ограниченные зоны разрежения костной ткани в апикальной их части (рис. 9-6с-9-6е). Лечение данного осложнения заключается в назначении антибиотиков широкого спектра действия (амоксициллин 2 г/сут и метрони-дазол 750 мг/сут в течение 7 дней), также возможна резекция апикальной верхушки имплантата. При нарастании жалоб, которые могут сопровождаться рецидивирующими абсцессами и цианозом вестибулярной слизистой, а также формированием кожного свища, вплоть до развития хронического остеомиелита, показано удаление имплантата (рис. 9-6f-9-6h).
Кроме трепанов аутогенную кость при препарировании ложа имплантата можно получить обычными спиральными сверлами, вращающимися на малой скорости без ирригации, однако при этом следует учитывать риск ожога кости.
При препарировании ложа имплантата необходимо избегать повреждения смежных анатомических структур и перфорации альвеолярного гребня в области поднутрений или верхнечелюстной пазухи. При подозрении на перфорацию альвеолярного гребня следует изменить направление препарирования ложа имплантата, если это допускает конструкция протеза. Альтернативный вариант - установка более короткого имплантата.
.
Рис. 9-6d. Через 1 неделю после появления жалоб на дискомфорт в области установленного имплантата с правой стороны нижней челюсти сформировался свищевой ход, открывающийся на кожу лица. Перед рентгенологическим исследованием в свищевой ход ввели зонд
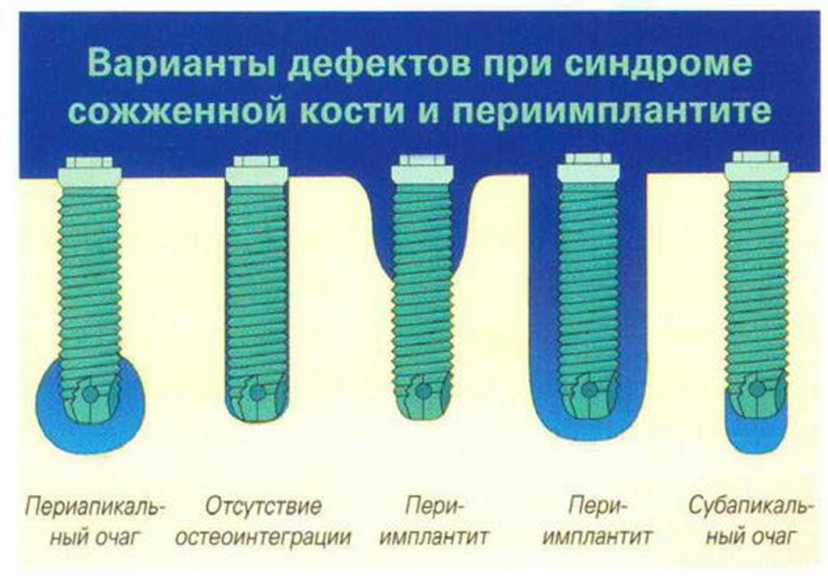
Рис. 9-6с. Синдром сожженной кости рентгенологически характеризуется наличием периапикального остеолиза
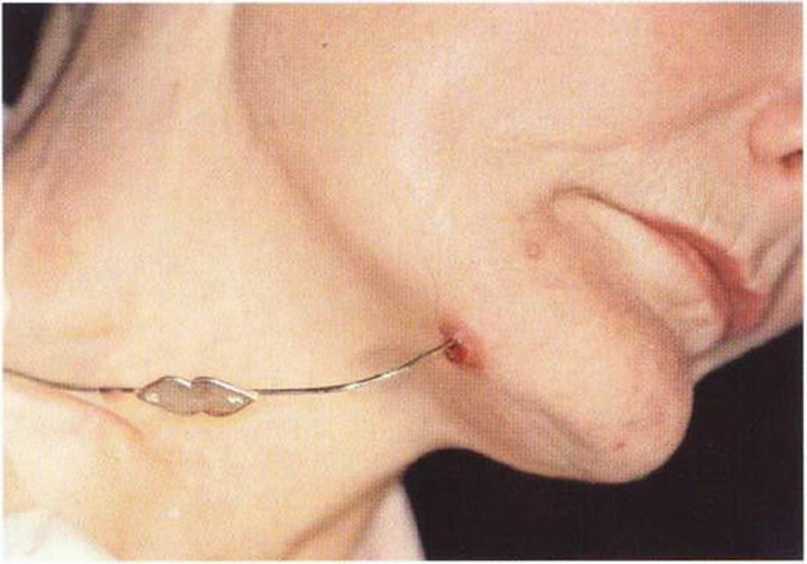
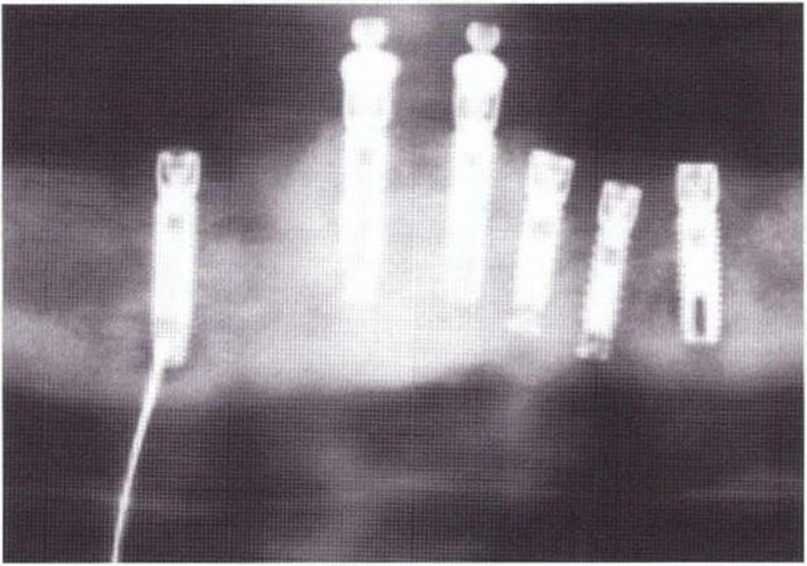
Рис. 9-6е. На ортопантомограмме с введенным зондом определяется периапикальный остеолиз вокруг имплантата.
Рис. 9-6f. Для минимально травматичного удаления имплантата и ревизии очага поражения создали вестибулярный костный доступ
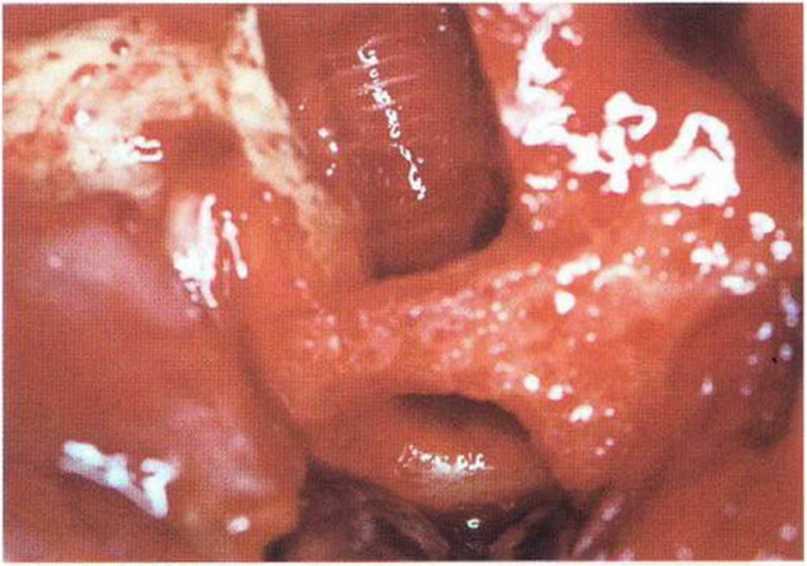
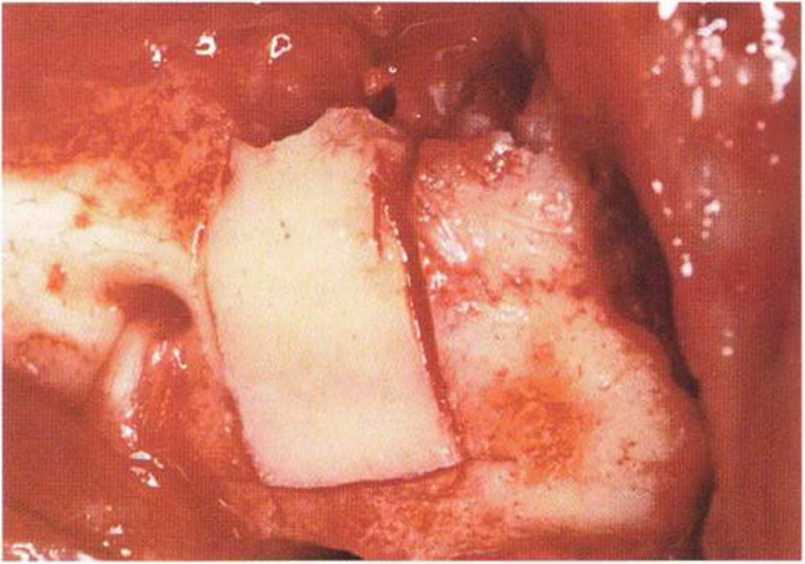
Рис. 9-6g. После отделения костного фрагмента имплантат удален без затруднений. В апикальной области после удаления грануляционной ткани определяется деструкция наружного кортикального слоя.
Рис. 9-6h. Реплантация костного фрагмента на завершающем этапе операции
Для оценки состояния потенциального донорского участка перед получением костных трансплантатов в ретромолярной области нужно пропаль-пировать соответствующие костные структуры и определить выраженность косой линии и тела нижней челюсти.
Стандартные методы лучевой диагностики начинают с ортопантомограммы, с помощью которой определяют положение нижнечелюстных каналов, подбородочного отверстия и корней зубов. Выраженная косая линия легко пальпируется клинически и определяется на ОПГ.
В донорской области проводят только инфиль-трационную анестезию (без проводниковой) для сохранения остаточной чувствительности нижнего альвеолярного нерва. Доступ к ретромолярной области формируют с помощью скошенного околобо-роздкового разреза, который всегда проводят до контакта с костью, чтобы исключить повреждение язычного нерва и крупных кровеносных сосудов.
При возникновении сильного кровотечения сначала осуществляют тампонаду области кровотечения, а затем накладывают давящие швы или проводят электрокоагуляцию.
С помощью пилы MicroSaw (Dentsply Friadent) выпиливание костной ткани из данной области происходит быстро и безопасно, защитный кожух препятствует повреждению мягких тканей (рис. 9-7а).
Представленный в главе 5 протокол значительно сокращает риск повреждения нижнечелюстного нерва.
В среднем высота кости над нижнеальвеолярным нервом составляет 11 мм, а толщина 14 мм.’Среднее расстояние от нижнечелюстного канала до вестибулярной наружной поверхности нижней челюсти в области первого и второго моляров достигает 5,4 мм и уменьшается до 4,6 мм в области третьего моляра и ретромолярной области.-Как правило, в проекции моляров нерв располагается ближе к язычному кортикальному слою (рис. 9-7Ь). Мезиально донорский участок ограничен последним моляром, однако костные блоки также могут быть получены с вестибулярной стороны моляров, иногда до мезиального края первого моляра, если позволяет выраженная наружная косая линия. В этой области повреждение нерва алмазным диском встречается крайне редко, так как при максимальной глубине погружения 3,2 мм нижнечелюстной канал остается недоступным для инструмента (рис. 9-7с). Только дистально в области восходящей ветви нижнечелюстной канал может располагаться более поверхностно (рис. 9-7d и 9-7е). Вскрытие нерва возможно при слабо выраженной наружной косой линии и препарировании костного блока ниже уровня самого нерва, но даже в этом случае он труднодоступен для диска, если донорский участок ограничивается ретромолярной областью (рис. 9-7f и 9-7д). При вероятности обнажения нерва следует исключить его повреждение острыми костными краями или компрессию. Угроза повреждения нерва значительно возрастает при проведении дистального вертикального распила на восходящей ветви нижней челюсти, поскольку нижний альвеолярный нерв здесь нередко располагается близко к вестибулярному кортикальному слою, а затем входит в тело нижней челюсти с язычной стороны (рис. 9-7h и 9-7к). В этих случаях при проведении дистального вертикального и дистального горизонтального распилов алмазный диск целесообразно погружать не на полную глубину, а максимум на 2 мм (ширина алмазного края 1 мм).
В качестве альтернативы возможно получение первого костного блока выше уровня нерва с промежуточной оценкой костных структур и последующим более апикальным выпиливанием второго блока.
Костный блок медленно и осторожно отделяют, аккуратно отслаивая от него нерв (рис. 9-7i). Случаи продолжительного пребывания нерва в открытом состоянии неизвестны, но предполагается, что это может вызвать временное нарушение чувствительности. Повреждения нервов при получении костных трансплантатов из ретромолярной области возможны при применении других инструментов, например при грубой работе долотом, поэтому рекомендуется строго соблюдать протокол получения трансплантата с помощью пилы MicroSaw (см.
главу 5) и отделения костного блока вследствие внутреннего напряжения, что исключает риск повреждения нерва долотом.
При затруднении отделения костного блока после 3-4 контролируемых ударов молоточком следует проверить линии распилов и убедиться в их перекрещивании (рис. 9-7т). У мезиального края нередко наблюдается неполное перекрещивание вертикального и горизонтального распилов. Распилы должны проходить параллельно или конически, но без образования поднутрений. При выраженной наружной косой линии и плотном кортикальном слое распил выполняют, погружая алмазный диск на достаточную глубину для последующего отделения блока. На исходной рентгенограмме нередко обнаруживаются склеротические изменения костной ткани (рис. 9-7п). Верхний горизонтальный ряд перфораций должен располагаться над губчатыми пространствами вне пределов вестибулярного кортикального слоя. Долото располагают параллельно вестибулярной стенке нижней челюсти, и откалывание проводят только сверху над перфорациями.
Во избежание повреждения нерва при отделении блока долото не следует погружать глубоко в толщу кости. При объединении долотом перфораций возникает напряжение, способствующее вестибулярному откалыванию блока без глубокого введения инструмента до губчатого пространства.
Отделение костного блока облегчается при объединении перфораций от дистальной к мезиальной.
При затруднении отделения костного блока, несмотря на соответствующее препарирование, нужно провести вертикальный распил для разделения блока на два фрагмента (рис. 9-7о).
По данным наблюдения, после 968 операций с взятием костного блока из ретромолярной области в одном случае произошел перелом язычной костной стенки. Фрагмент фиксировали винтом, окончательное заживление раны проходило без особенностей (рис. 9-8а и 9-8Ь). В двух случаях на нижней челюсти клинически были обнаружены микротрещины, которые не визуализировались на рентгенограммах. Через 2 недели отмечалось полноценное заживление. Переломы также описаны в случаях других регенеративных вмешательств на нижней челюсти. Пациентов, которым проводят пересадку относительно больших костных трансплантатов из нижней челюсти, следует информировать о необходимости приема только мягкой пищи в течение не менее 6 недель, чтобы снизить риск перелома этой челюсти. Развитие данного осложнения наиболее вероятно через 2-3 недели после операции, когда после спадения отека и вынужденного ограничения в диете пациент получает возможность нормально принимать пищу (рис. 9-8с-9-8е).
При получении костной ткани из ретромоляр-ной области отмечается низкий уровень осложнений. Даже при инфицировании (0,5 %) или гематоме в донорской области повреждения нерва или нарушение чувствительности наблюдаются очень редко. При инфицировании коллагеновой губки и экссудации в период заживления раневую поверхность следует регулярно промывать раствором хлоргексидина.
После получения костного блока обнажается губчатая кость, что повышает вероятность послеоперационного кровотечения или гематомы. Для предупреждения указанных осложнений и стабилизации кровяного сгустка дефект на донорском участке заполняют лиофилизированной аллогенной матрицей (Resorba).
Развитие отеков и гематом можно предотвратить с помощью холодных компрессов, которые накладывают на кожу лица в проекции проведенных вмешательств. При развитии выраженного отека показана антибиотикопрофилактика по протоколу, рекомендованному для регенеративных вмешательств. Гепариновые мази или гели ускоряют рассасывание гематом.
По объему хирургического вмешательства и степени послеоперационного дискомфорта получение костного трансплантата в ретромолярной области соответствует удалению ретинированного третьего моляра. Кроме того, пациенты отмечают меньшую интенсивность послеоперационной боли в донорской области по сравнению с принимающим участком.
Таким образом, ретромолярная область является оптимальным донорским участком для получения костных блоков среднего размера с незначительными затратами времени, минимальным дискомфортом и низким риском осложнений.
Рис. 9-7а. Безопасный забор костного блока из ретромолярной области с помощью пилы MicroSaw. Защитный кожух предохраняет мягкие ткани от повреждения
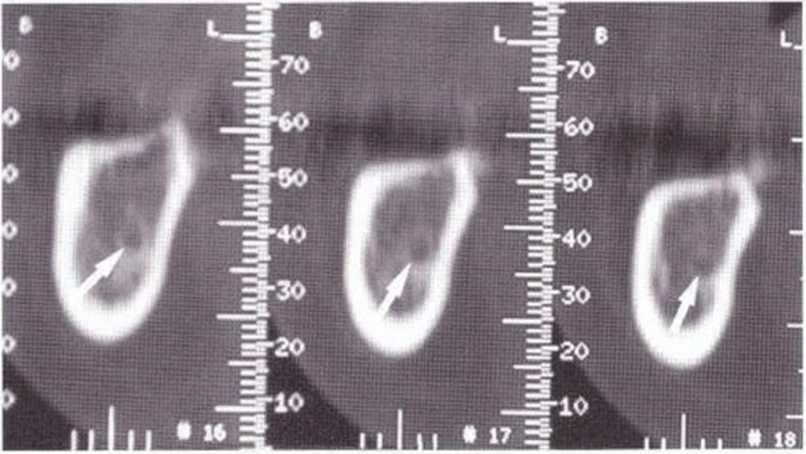

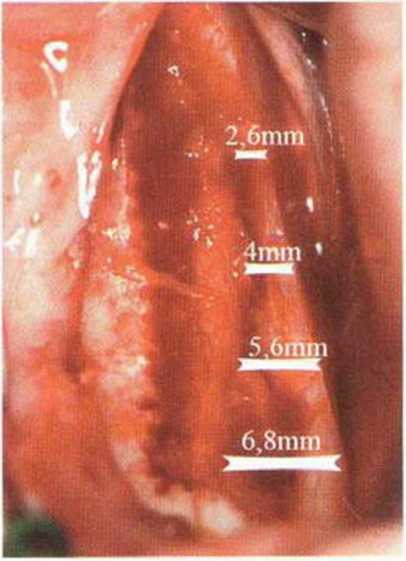
Рис. 9-7Ь. На КТ отмечается язычное положение нижнечелюстного канала.
Рис. 9-7d. Широкое раскрытие нижнечелюстного канала. Максимальное удаление нижнечелюстного канала от наружного кортикального слоя отмечается в области первого и второго моляров.
В ретромолярной области расстояние составляет не менее 4 мм. В области восходящей ветви толщина слоя не превышает 3 мм.
Рис. 9-7с. Максимальная глубина погружения алмазного диска составляет 3,2 мм
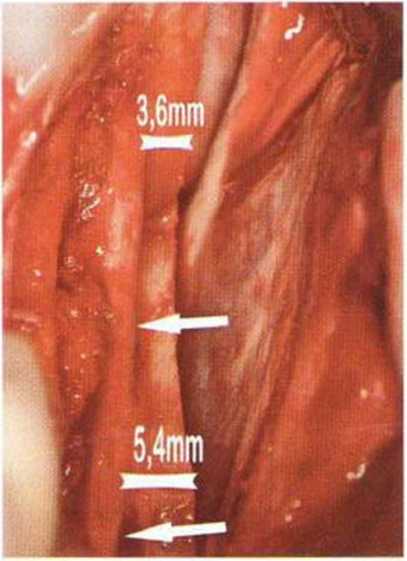
Рис. 9-7f. Получение кости в ретромолярной области ниже нижнечелюстного канала с широким раскрытием сосудисто-нервного пучка.
Обнажение не представляет угрозы для сосудисто-нервного пучка, поскольку донорский участок ограничен ретромолярной областью
Рис. 9-7е. Толщина костного блока в области восходящей ветви составляет около 3 мм
Рис. 9-7h. Высокое положение нижнечелюстного канала в восходящей ветви
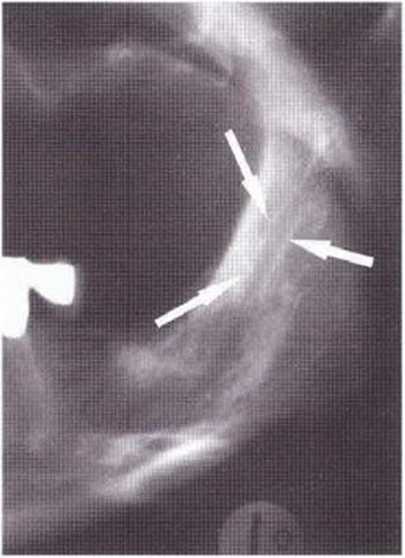
Рис. 9-7д. Полученный костный блок с отпечатком нижнечелюстного канала
Рис. 9-7j. Соответствующий костный блок с тонким кортикальным слоем
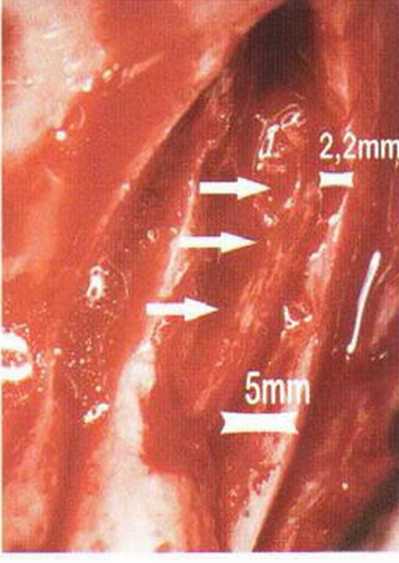
Рис. 9-7i. Сосудисто-нервный пучок в области восходящей ветви располагается более поверхностно.
Рис. 9-7к. На панорамной рентгенограмме отмечается дистальный распил на восходящей ветви.
Рис. 9-71. При отщеплении трансплантата произошло ущемление нижнего альвеолярного нерва в переднем отделе костного блока. Во избежание повреждения нерза нужно осторожно отделить от него блок
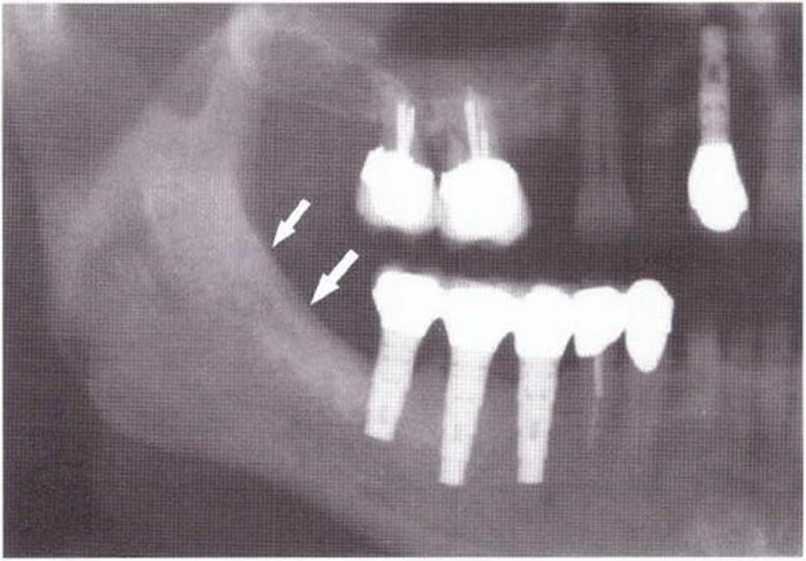
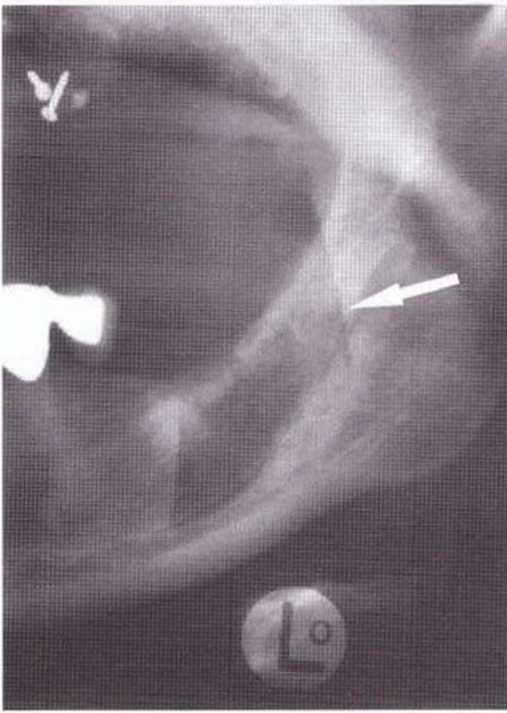
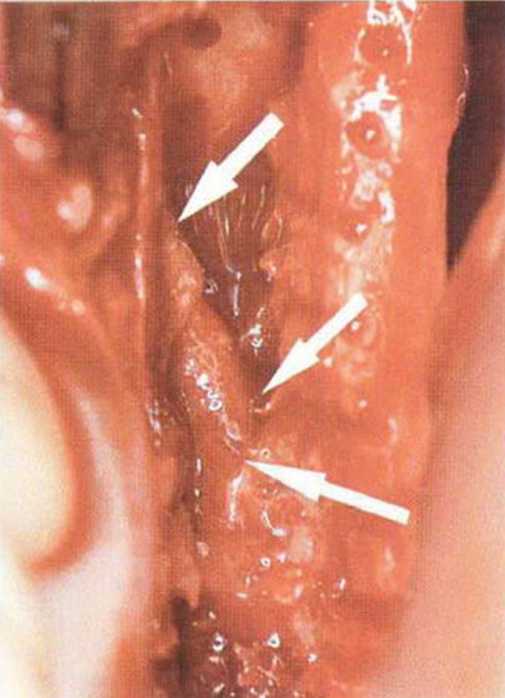
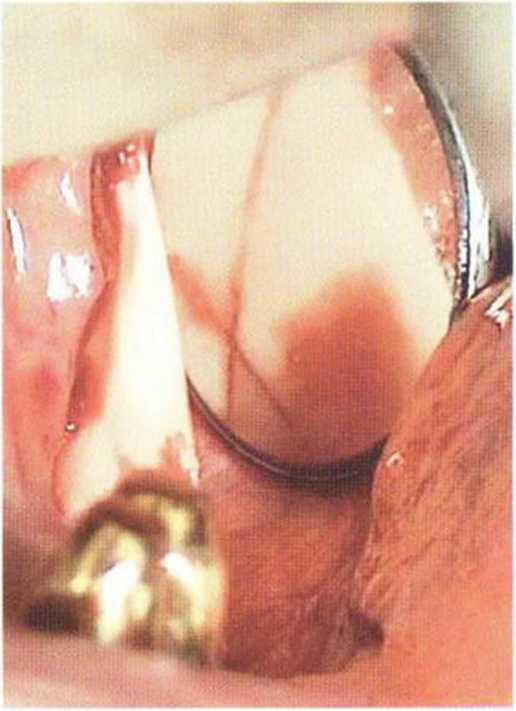
Рис. 9-7т. Перед отщеплением блока следует убедиться в пересечении распилов
Рис. 9-7п. Сплошной слой кортикальной кости без губчатого вещества затрудняет получение костного блока. На рентгенограмме эту ситуацию можно предположить при выраженном склерозировании костной ткани ретромолярной области

Рис. 9-7о. При отделении блок распиливают на две части, что значительно облегчает манипуляцию
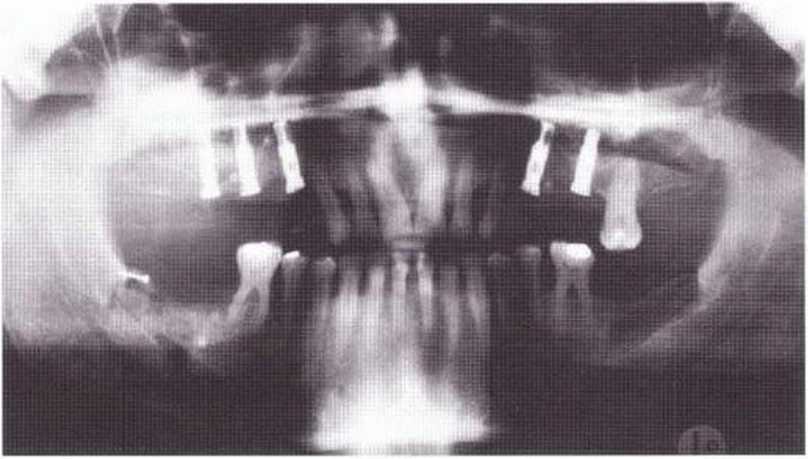
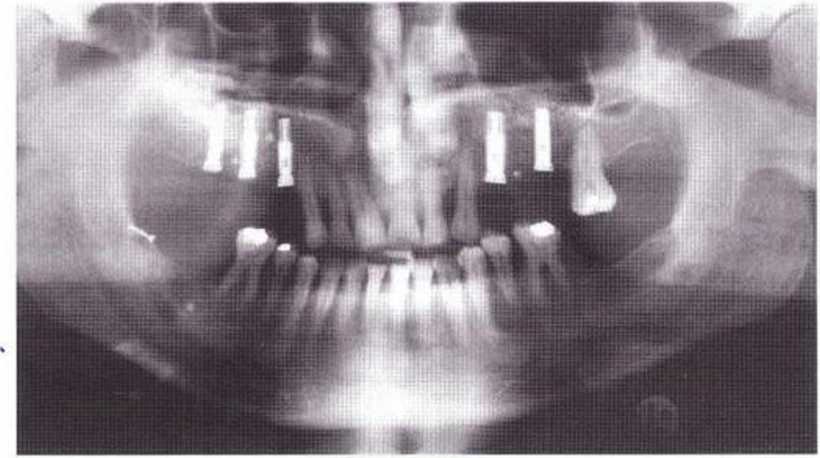
Рис. 9-8а. Для двухстороннего регенеративного вмешательства на верхней челюсти костные трансплантаты получили в области зубов 38 и 48. При заборе блока в области зуба 48 произошел перелом язычной кортикальной пластинки, которую фиксировали винтом.
Рис. 9-8Ь. На контрольной ортопантомограмме через 5 мес после операции отмечается удовлетворительное заживление кости
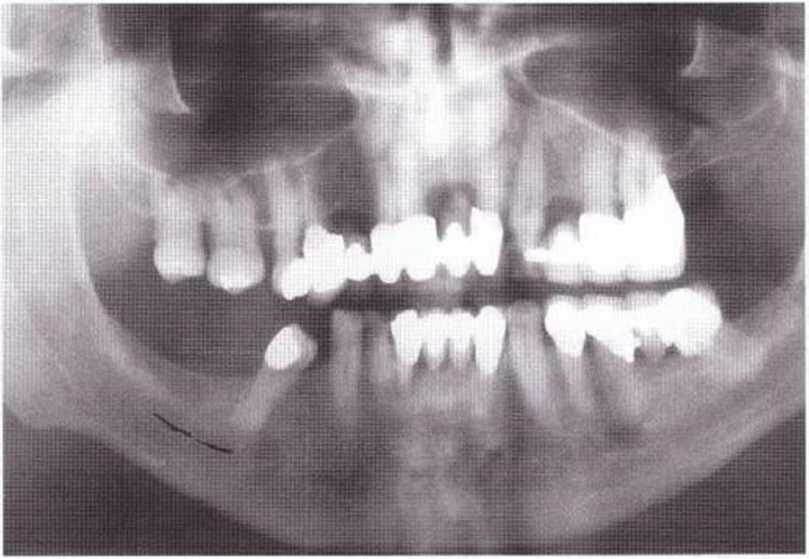
Рис. 9-8с. Ортопантомограмма перед получением костного блока в области зуба 48 для реконструкции нижней челюсти справа
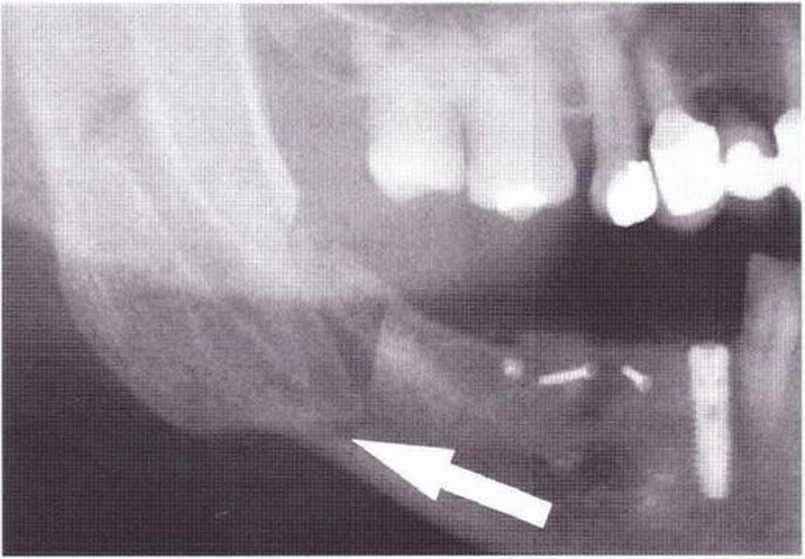
Рис. 9-8d. Через 2 недели после операции произошел перелом нижней челюсти в области зуба 48
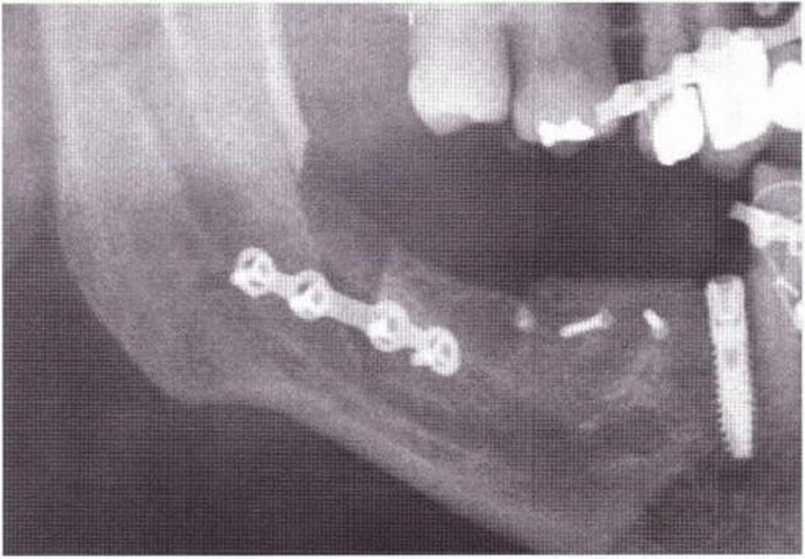
Рис. 9-8е. Состояние после стабилизации перелома с помощью остеосинтеза
В рамках предоперационной диагностики перед получением костного блока проводят пальпацию подбородка для определения выраженности подбородочного выступа.
Положение нижнечелюстных каналов, подбородочных отверстий и корней зубов определяют с помощью ортопантомограммы. Дополнительно делают телерентгенограмму головы в боковой проекции для оценки качества и количества кости, толщины вертикального кортикального слоя, а также определения наклона и локализации корней передних зубов нижней челюсти.
В соответствии с протоколом, описанным в главе 5, перед выпиливанием костного блока нужно визуализировать оба подбородочных нерва. При соблюдении минимального расстояния 3-5 мм до верхушек корней или альвеолярного гребня у беззубых пациентов и 3 мм до базального края нижней челюсти выпиливают монокортикальный костный блок. Дистально костный блок ограничен подбородочными отверстиями, при этом нужно учитывать ретроградный ход (петлю) нижнего альвеолярного нерва.
Объем костных блоков из подбородочной области составляет в среднем 2,6 см (максимум 4 см). Такие костные блоки состоят из кортикального и губчатого слоев.
Самый большой интраоперационный риск при получении трансплантата в подбородочной области заключается в повреждении корней или нервов передних зубов, что ведет к утрате чувствительности зубов (рис. 9-Эа), а также изменениям чувствительности слизистой или кожи подбородка и губы.- Типичные послеоперационные нарушения чувствительности локализуются в области подбородка. При получении костного блока происходит частичный разрыв чувствительных нервных волокон, иннервирующих передние зубы нижней челюсти (нижние зубные ветви нижнего альвеолярного нерва), поэтому у 7 % пациентов послеоперационные нарушения чувствительности в области передних зубов нижней челюсти отмечаются в течение 6 мес. По данным других исследований, нарушения чувствительности нижних резцов встречаются в 29 % случаев, и в 10 % наблюдается временная парестезия в области подбородка, которая прекращается в течение 6 мес. Жалобы на боль могут сохраняться до 3 мес после вмешательства, а анестезия нижних резцов может продолжаться 12 мес. По другим данным, через 19 мес после забора костной ткани в подбородочной области у 15 из 29 пациентов сохранялось стойкое снижение чувствительности зубов.
Типичными послеоперационными осложнениями при получении костной ткани в подбородочной области являются расхождение краев и инфицирование раны, которые встречаются в 2,5-10 % случаев.--- Герметичное ушивание раны без натяжения - обязательное условие ее нормального заживления. По этой причине настоятельно рекомендуется двухслойное закрытие раны. При наличии передних зубов нижней челюсти мягкие ткани (после инфильтрационной анестезии) разрезают по линии слизисто-десневого соединения под острым углом - это способствует созданию широкой раневой поверхности, что облегчает двухслойное ушивание. Подслизистые швы накладывают исключительно резорбируемым шовным материалом.
При отсутствии зубов и одновременной имплантации на нижней челюсти в переднем отделе разрез проводят по альвеолярному гребню. Донорский участок визуализируется после отслаивания слизисто-надкостничного лоскута. Надежное ушивание раны возможно с одновременной вестибуло-пластикой по Казанджяну.
Угроза расхождения краев раны в донорской области возрастает при использовании мембраны или костного материала. При раннем расхождении мягких тканей над нерезорбируемыми мембранами (например, титановыми) раневую поверхность следует обрабатывать раствором или гелем с хлоргексидином. Эту манипуляцию пациент может проводить самостоятельно каждый день в течение 3-4 недель, до удаления мембраны. При обнажении или инфицировании в позднем послеоперационном периоде мембрану удаляют сразу.
Инфекционные осложнения могут проявляться образованием абсцессов и ухудшают регенерацию костной ткани в донорской области. При заборе трансплантатов вблизи верхушек корней нижних клыков возможен некроз пульпы этих зубов, поэтому, как уже отмечалось, следует отступать на безопасное расстояние 3-5 мм от корней зубов, подбородочных отверстий и края нижней челюсти, который служит основой для костной регенерации.
Риск указанных осложнений при пересадке трансплантатов из подбородочной области отсутствует только при адентии нижней челюсти. Изменения контура лица при получении трансплантатов из подбородочной области не наблюдаются.
По данным одного исследования, после 594 случаев получения костных трансплантатов из подбородочной области только в одном случае произошел перелом тела нижней челюсти, однако у этого пациента к моменту перелома костные трансплантаты из одного донорского участка получали трижды в течение 4 лет (рис. 9Ь и 9с).
Несмотря на относительно простой доступ и больший объем трансплантата из подбородочной области, ушивание раны сопряжено с трудностями.
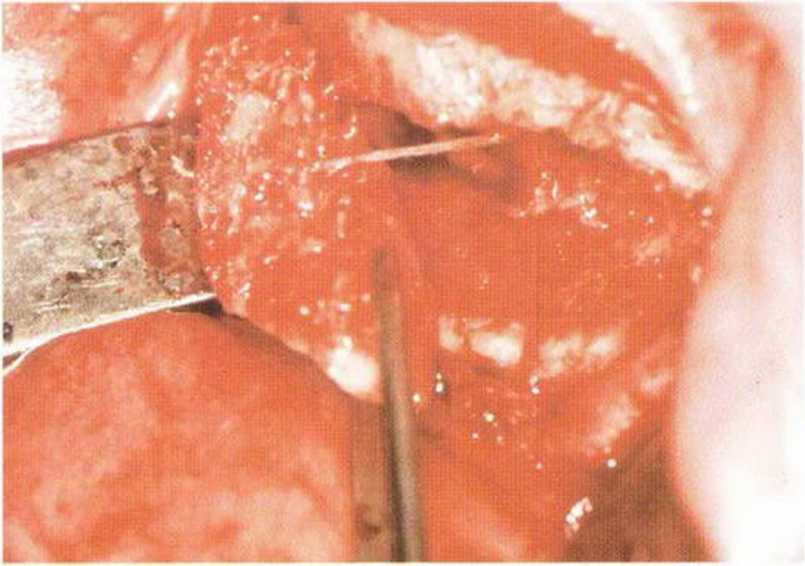
Рис. 9-9а. При получении трансплантата из подбородочной области повреждаются разветвления нижних зубных нервов
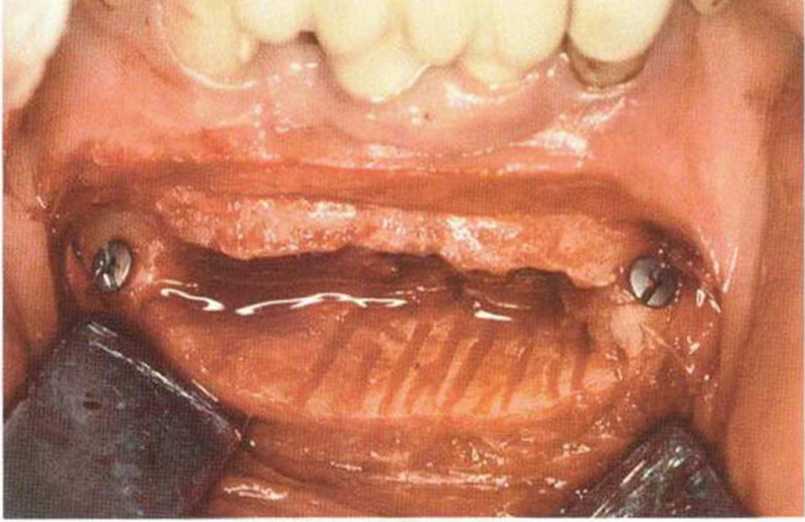
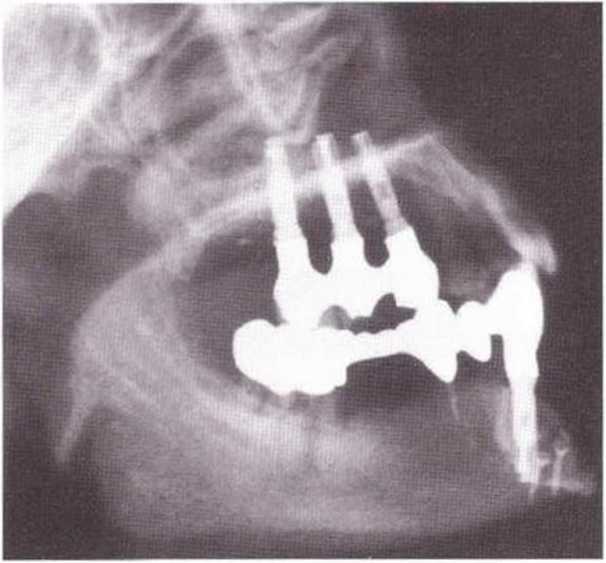
Рис. 9-9с. Телерентгенограмма после заживления перелома
Рис. 9-9Ь. Перелом тела нижней челюсти после получения кости из области подбородка стабилизирован с помощью остеосинтеза.
Кроме того, на этом участке чаще развиваются послеоперационные осложнения, а боль значительно сильнее, чем при трансплантации костной ткани из ретромолярной области.
Методики расширения или расщепления кости позволяют устанавливать имплантаты даже при наличии узкого альвеолярного гребня. При препарировании ложа имплантата костную ткань вместо иссечения фрезой смещают латерально и сохраняют.
Наиболее частое интраоперационное осложнение расширения или расщепления гребня заключается в переломе вестибулярной либо язычной костной стенки с полным или частичным смещением фрагмента кости (рис. 9-1 Оа—9-1 Ос). В таком,случае вмешательство напоминает трансплантацию костного блока, а фрагмент должен быть фиксирован винтами (рис. 9-1 Od и 9-1 Ое). При откалывании относительно мелких фрагментов их стабилизация возможна с помощью мембраны (рис. 9-1 Of—9-1 Oj).
Для предупреждения подобного осложнения не следует отслаивать надкостницу от вестибулярной костной стенки. При этом после вестибулярного смещения сохранение костной ткани обеспечивается прикрепленной надкостницей. Наряду с этим стабилизация подвижной вестибулярной стенки возможна с помощью простого надкостничного шва от вестибулярной поверхности к язычной (рис. 9-10k-9-10m).
При работе долотом и остеотомом можно повредить корни соседних зубов, кровеносные сосуды и нервы.- В процессе синус-лифтинга есть вероятность полного перелома альвеолярного отростка с перфорацией слизистой верхнечелюстной пазухи, что представляет угрозу для успешного исхода имплантации. Кроме того, под влиянием высокой механической нагрузки при переломе могут случайно обнажиться кровеносные сосуды и нервы.
Во избежание этого перед расщеплением нужно провести соответствующие распилы, задающие линию перелома. Излишнее усилие при применении долота или остеотома на верхней челюсти вызывает большой дискомфорт у пациентов и может быть причиной некоторых послеоперационных осложнений, от головных болей и нарушения координации до сотрясения головного мозга.
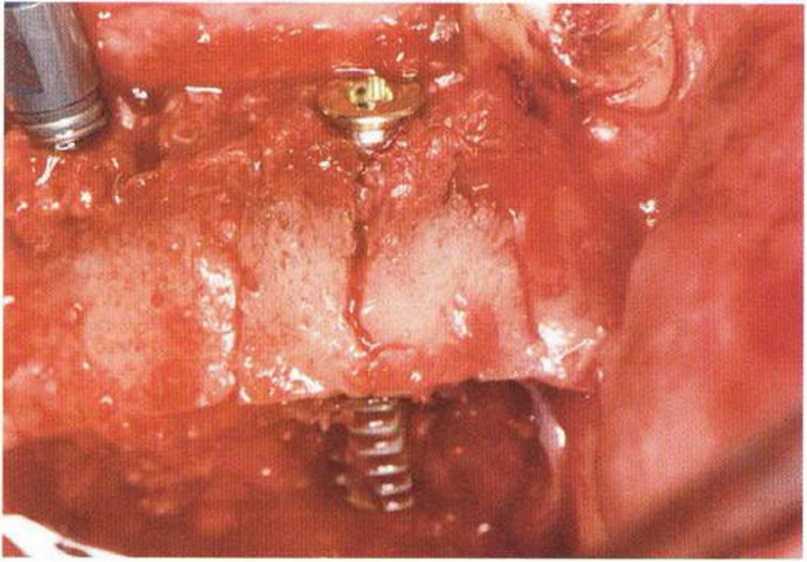
Рис. 9-1 Оа. Перелом вестибулярной стенки после расщепления кости и имплантации в переднем отделе нижней челюсти после получения блока из подбородочной области
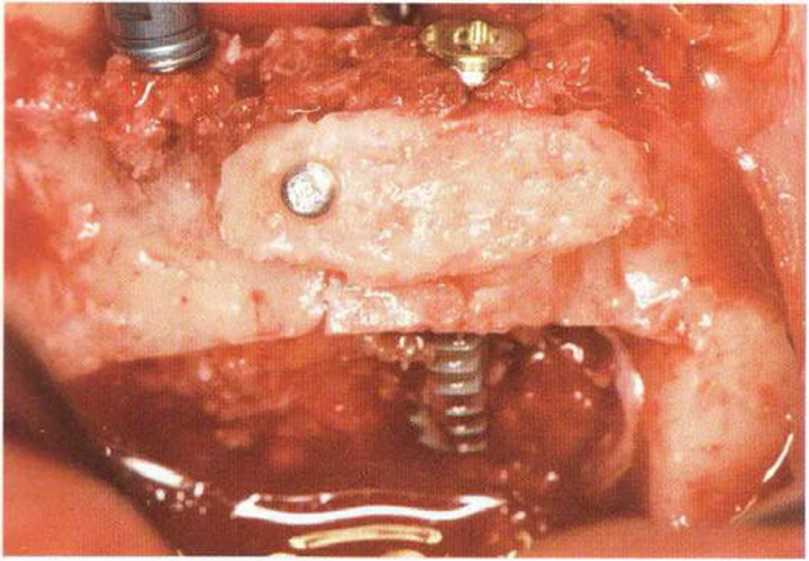
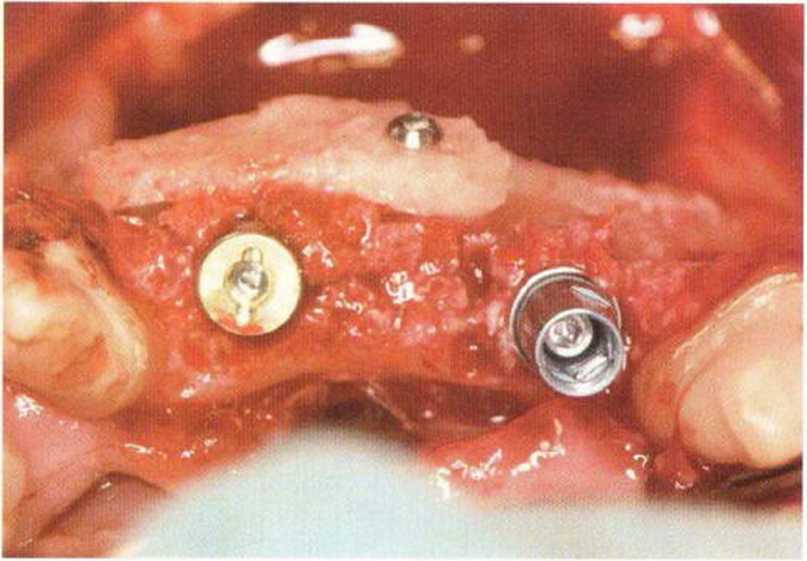
Рис. 9-1ОЬ. Стабилизация нижней челюсти латеральным костным блоком в области перелома
Рис. 9-1 Ос. Окклюзионный вид области вмешательства
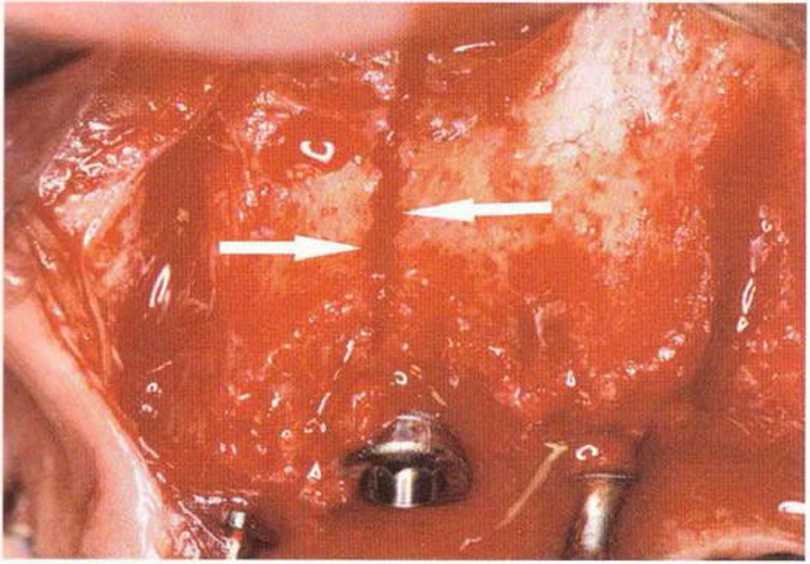
Рис. 9-1 Od. Сквозная линия перелома от альвеолярного отростка до тела верхней челюсти вследствие расширения кости
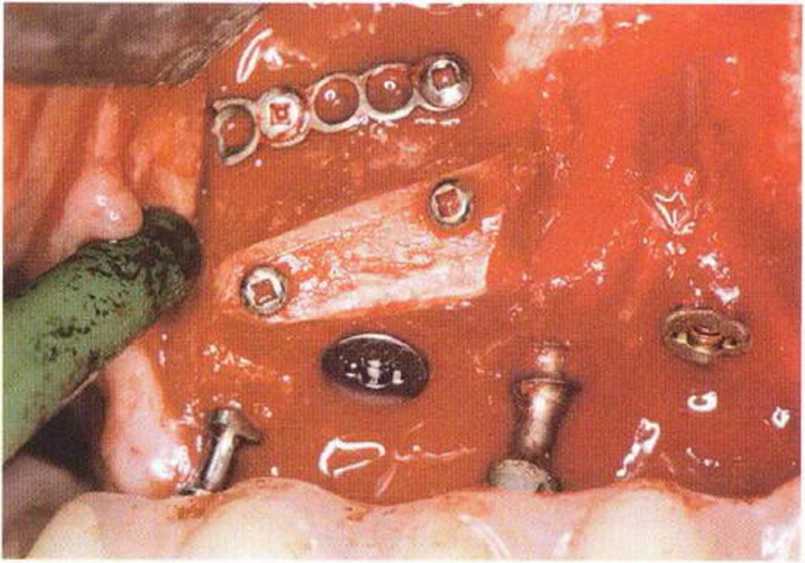
Рис. 9-1 Ое. Стабилизация альвеолярного отростка в области перелома костным блоком и в апикальном отделе пластинкой
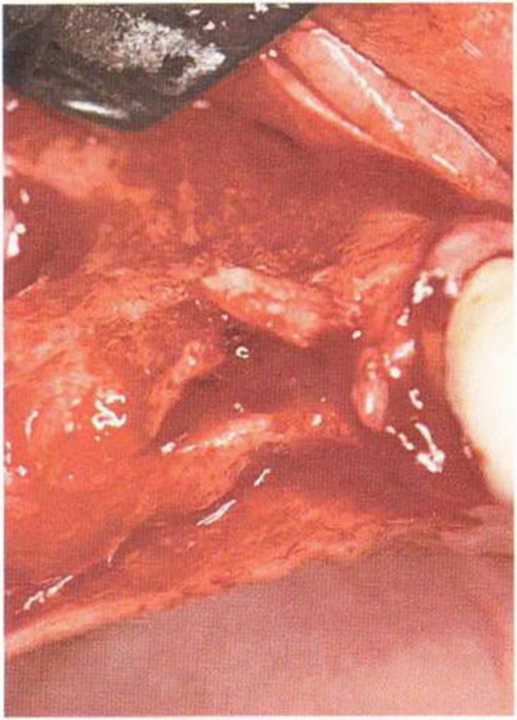
Рис. 9-1 Of. Ограниченный перелом вестибулярной костной стенки в результате расширения кости
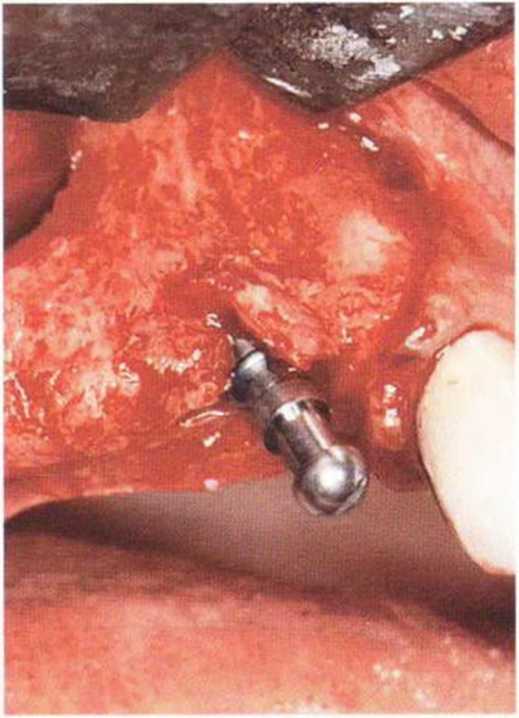
Рис. 9-10д. Установка имплантата в области вмешательства
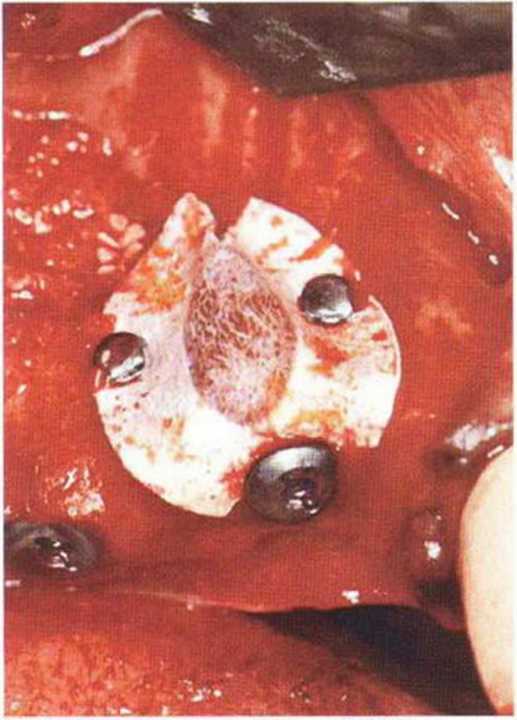
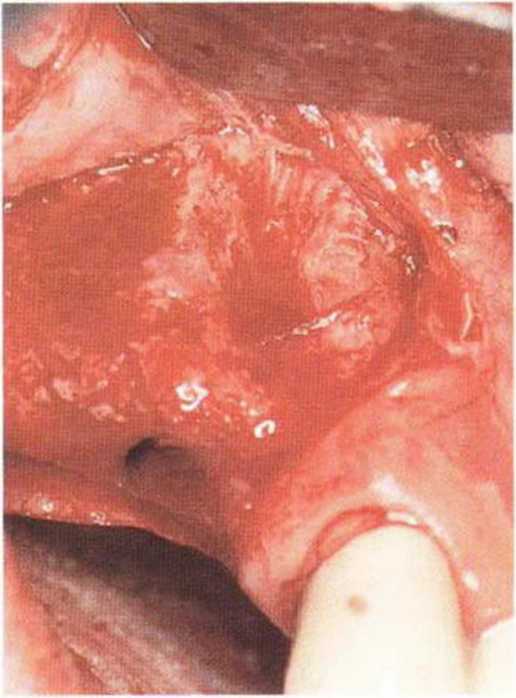
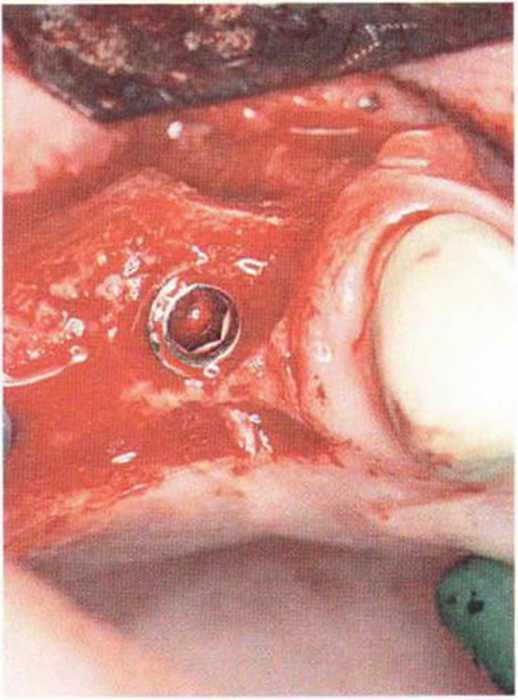
Рис. 9-1 Oh. Установка нерезорбируемой мембраны в области перелома.
Рис. 9-1 Oi. Через 4 мес после операции отмечается удовлетворительное заживление.
Рис. 9-1 Oj. Окклюзионный вид после заживления перелома.
Рис. 9-1 Ok. Расщепление кости в переднем отделе верхней челюсти
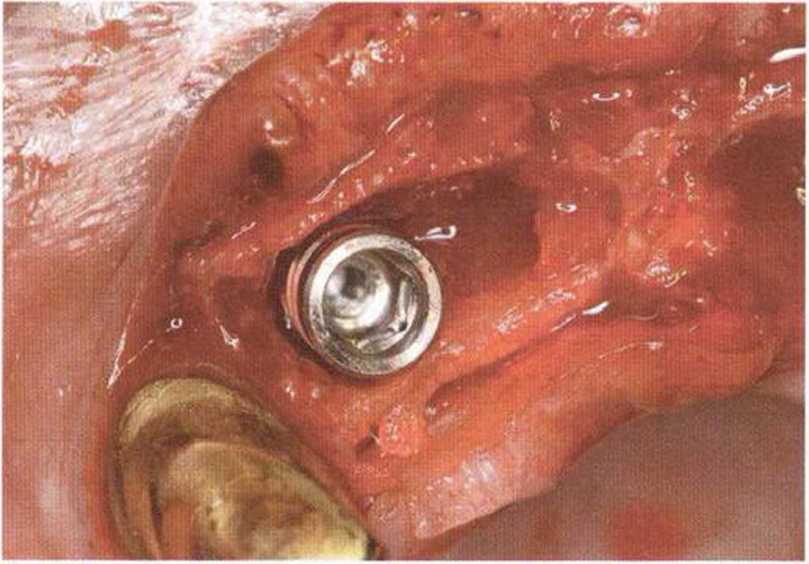
Рис. 9-101. Установка имплантата в области вмешательства. Сохраняется подвижность вестибулярной костной стенки
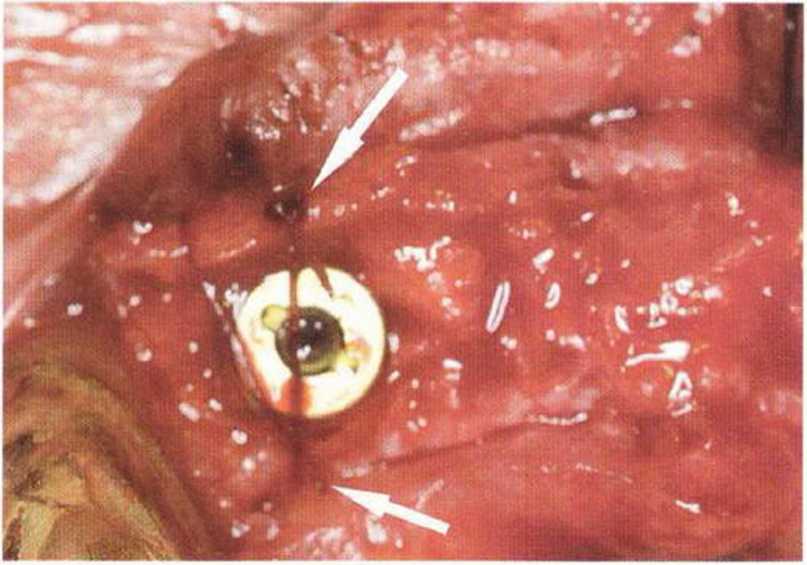
Рис. 9-1 От. Стабилизация вестибулярной костной стенки с помощью наложения швов между вестибулярной и нёбной надкостницей
Для профилактики осложнений в процессе синус-лифтинга хирург обязан досконально знать анатомические особенности верхнечелюстной пазухи. Напомним, что верхнечелюстная пазуха выстлана надкостницей, покрытой респираторным эпителием, и сообщается со средним носовым ходом через верхнечелюстное отверстие.
Костные перегородки разделяют пазуху на несколько камер. Число и выраженность перегородок очень вариабельны. Для выявления таких перегородок используют панорамные томограммы (рис. 9-11а), KJ1KT и КТ. Богатое кровоснабжение слизистой и стенок верхнечелюстной пазухи обеспечивают ветви задней верхней альвеолярной и подглазничной артерий.
При подготовке к операции нужно провести рентгенологическое исследование для выявления факторов риска и потенциальных осложнений и принять соответствующие меры для их профилактики или устранения.-‘- Во избежание инфекционных осложнений рекомендуется профилактическое назначение антибактериальных препаратов и применение местных средств для устранения отека.
Кровоснабжение альвеолярного отростка и верхнечелюстной пазухи (в частности, ее вестибулярной стенки) осуществляется задней верхней альвеолярной и подглазничной артериями. Оба сосуда связаны внутрикостными артериальными анастомозами, однако у 44 % людей встречаются внекостные вестибулярные анастомозы этих артерий. При создании костного окна пазухи хирург может обнаружить сосуды среднего размера (рис. 9-11Ь), препарирование которых занимает много времени, а повреждение вызывает обильное кровотечение. При подозрении на близкое расположение такого сосуда локализацию костного окна по возможности следует изменить. В противном случае препарирование нужно проводить осторожно, предпочтительно с помощью алмазных боров (рис. 9-11с и 9-11 d). После достаточного обнажения сосудов их рекомендуется перевязать или коагулировать (рис. 9-11 е и 9-11 f), затем можно продолжить препарирование доступа и отслаивание слизистой верхнечелюстной пазухи.
Получение костной ткани в области вестибулярной стенки верхнечелюстной пазухи позволяет отказаться от вмешательств на других донорских участках, однако операция может сопровождаться повреждением нескольких сосудов с интенсивным кровотечением в ходе вмешательства и образованием массивной гематомы.
Слизистая пазухи также хорошо кровоснабжа-ется, и при ее повреждении возможны массивные кровотечения. Остановка такого кровотечения с помощью давящей повязки затруднена, поскольку в результате отслаивания и препарирования костного окна жесткая костная основа почти всегда отсутствует. Артериальное кровотечение можно остановить с помощью кисетных швов или электрокоагуляции. Тем не менее хорошее кровоснабжение слизистой пазухи способствует ее заживлению при повреждениях.
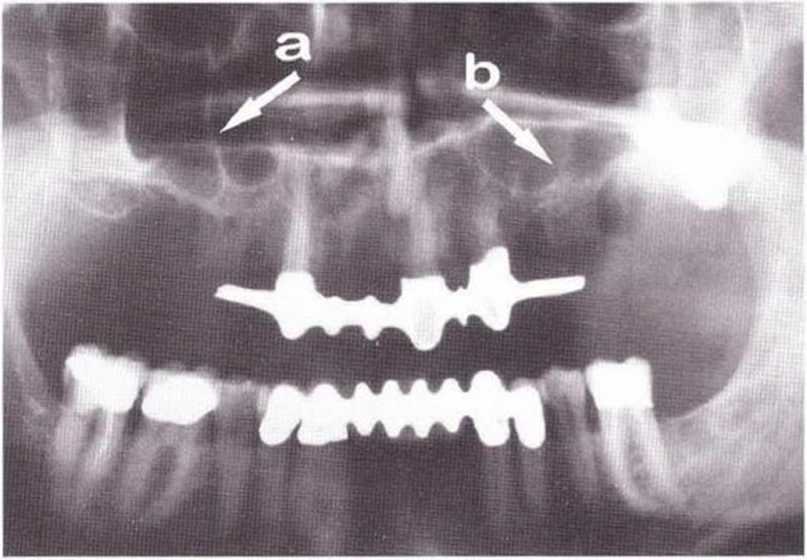
Рис. 9-11а. Варианты костных перегородок на ортопантомограмме.
Рис. 9-11Ь. Внутрикостные кровеносные сосуды среднего размера в области костного окна пазухи

Рис. 9-11с. Препарирование кровеносного сосуда с помощью тонкого алмазного бора. Кровеносный сосуд открыт
Рис. 9-1 Id. Отделение кровеносного сосуда от слизистой верхнечелюстной пазухи
Рис. 9-11 е. Коагуляция кровеносного сосуда
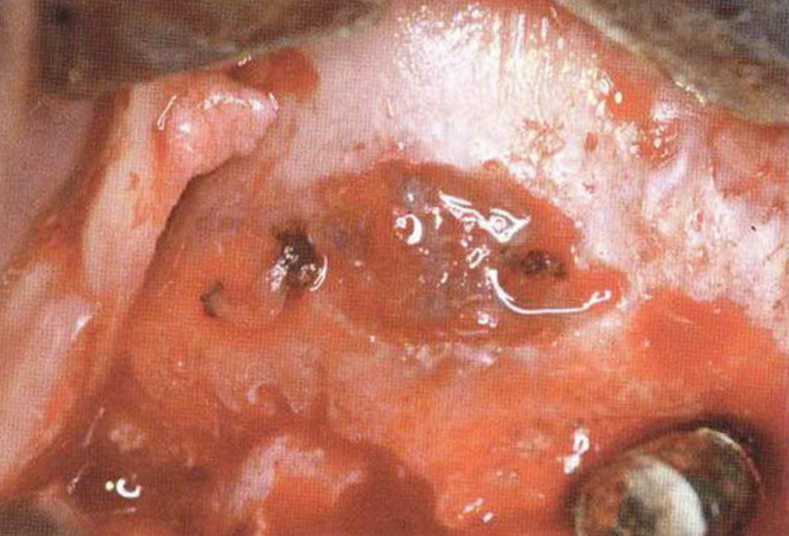
Рис. 9-1 If. Два коагулированных конца кровеносного сосуда
Разрывы очень тонкой и легко перфорируемой слизистой верхнечелюстной пазухи наблюдаются в 10-35 % случаев.--’-- Рубцовые изменения, обусловленные хроническим воспалением, еще больше усложняют ситуацию и значительно повышают риск перфораций, в том числе из-за плотного прикрепления тонкой слизистой к кости, но такое хроническое воспаление верхнечелюстной пазухи может приводить к уплотнению слизистой, что облегчает отслаивание последней от костных стенок.
При перфорации необходимо продолжить операцию и полностью отслоить слизистую от дна верхнечелюстной пазухи, чтобы снять напряжение в слизистой и одновременно добиться большей площади ее поверхности. В результате естественное образование складок и слипание слизистой приводят к устранению перфораций. Внимательность и аккуратность при работе позволяют избежать увеличения перфорации, поэтому очень важно увеличить костное окно для создания оптимального доступа к ее области. Доступ увеличивают алмазными борами или костными кусачками Люера.
Независимо от размера перфорации необходимо механически адаптировать края разрыва, чтобы избежать миграции костной стружки и костных материалов в пазуху. В противном случае повышается риск воспаления пазухи и инфицирования материала. Края перфорации сближают тонким резорбируемым шовным материалом толщиной 6-0 или 7-0 (например, Serafit, Serag-Wiessner) (рис. 9-12а-9-12с). При локализации перфорации вблизи костной стенки слизистую можно подшить к ее маленьким отверстиям (рис. 9-12d и 9-12е).
Перфорации слизистой в дистальном отделе верхнечелюстной пазухи, ушить которые невозможно из-за недостаточного доступа, заклеивают фибриновым клеем, например Берипласт (Центеон) (рис. 9-12f-9-12k). После закрытия перфорации прочность области наложения швов, а также слабых или тонких участков слизистой пазухи можно увеличить с помощью адаптации коллагеновой мембраны, которую, в свою очередь, фиксируют фибриновым клеем.
Закрывать перфорацию слизистой пазухи с помощью одной только резорбируемой коллагеновой мембраны довольно рискованно, поскольку мембрана нередко соскальзывает в пазуху вместе с костным материалом. Наряду с этим существует довольно высокий риск контаминации мембраны микрофлорой пазухи, которая, кроме всего прочего, может инфицировать костный материал и привести к гаймориту. По данным ретроспективного долгосрочного исследования, закрытие перфораций слизистой верхнечелюстной пазухи в процессе синус-лифтинга резорбируемыми коллагеновыми мембранами повышает риск неудачи вмешательства и утраты имплантатов. При больших перфорациях, которые не могут быть закрыты указанным выше способом, запланированное регенеративное вмешательство следует прервать и повторно провести синус-лифтинг не ранее чем через 3 мес (рис. 9-121-9-12и).
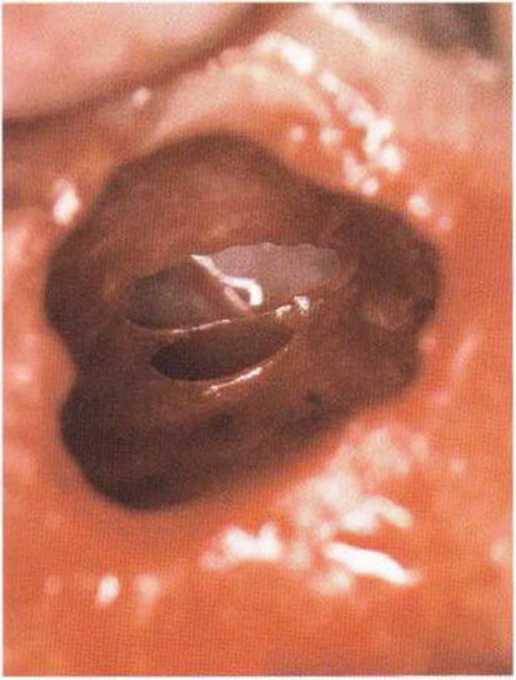
Рис. 9-12а. Средняя перфорация слизистой пазухи
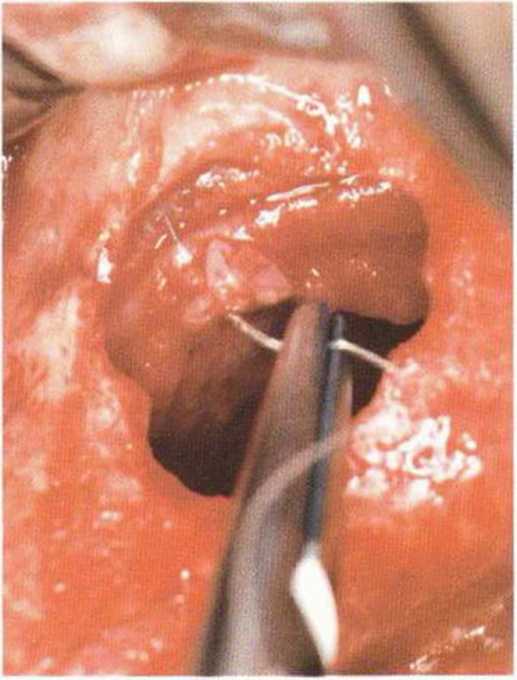
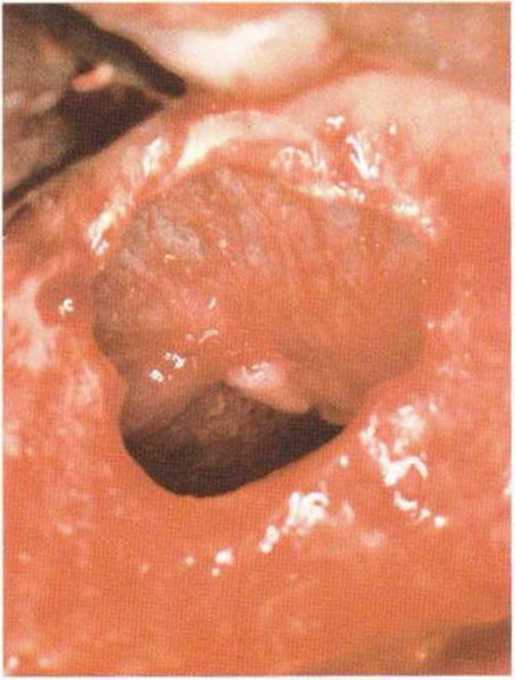
Рис. 9-12b. Ушивание перфорации резор-бируемым шовным материалом (6-0).
Рис. 9-12с. Перфорация полностью закрыта
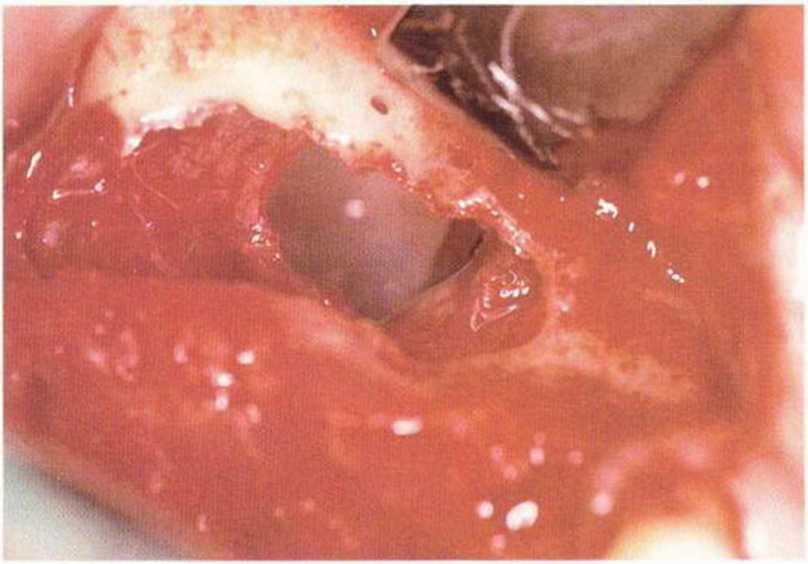
Рис. 9-12d. Большая перфорация слизистой верхнечелюстной пазухи вблизи костной стенки. Для стабилизации шва созданы два отверстия в стенке пазухи
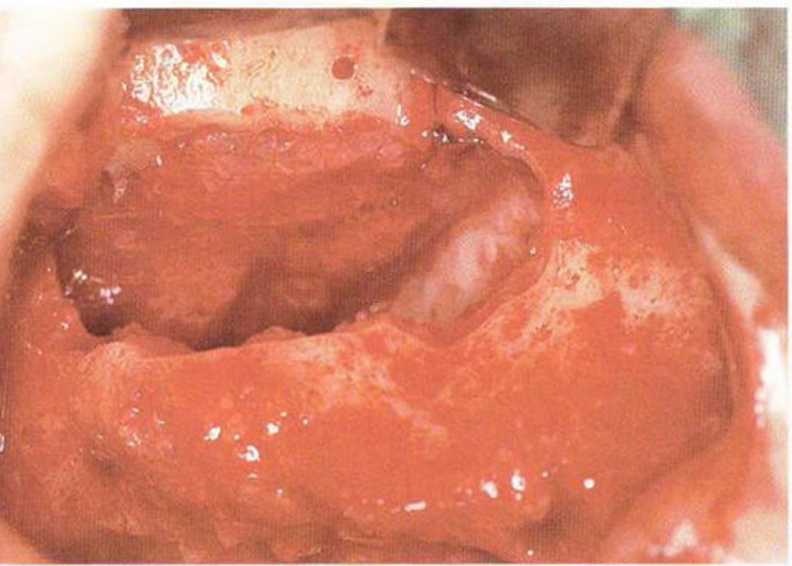
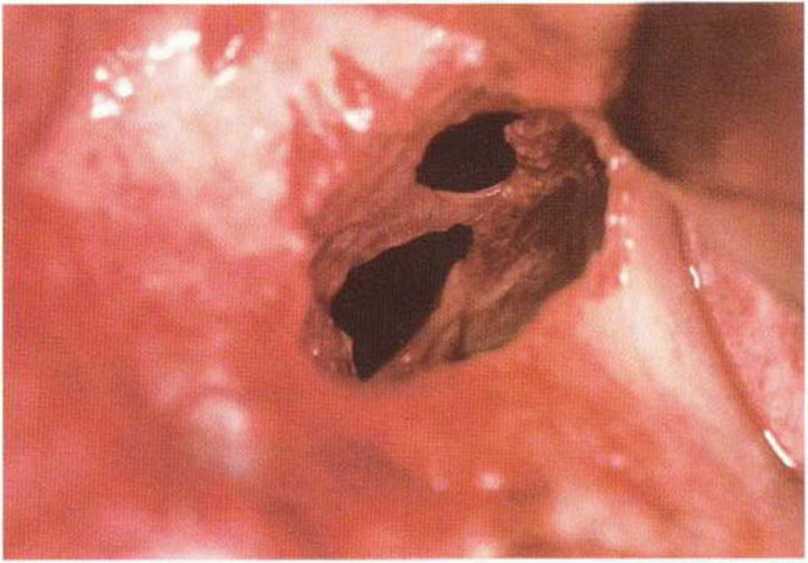
Рис. 9-12е. После обширной перфорации слизистой верхнечелюстной пазухи медиальный край перфорации фиксировали швами к костной стенке через подготовленные отверстия
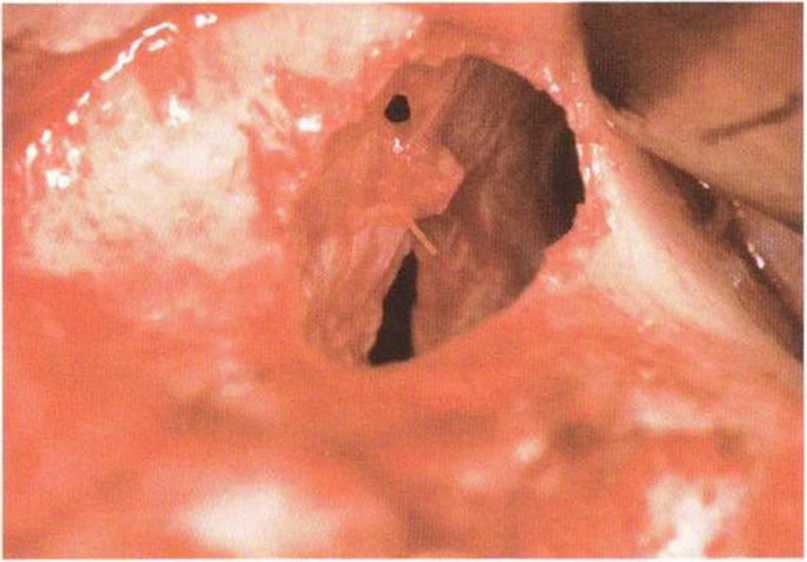
Рис. 9-12f. Две большие перфорации слизистой пазухи
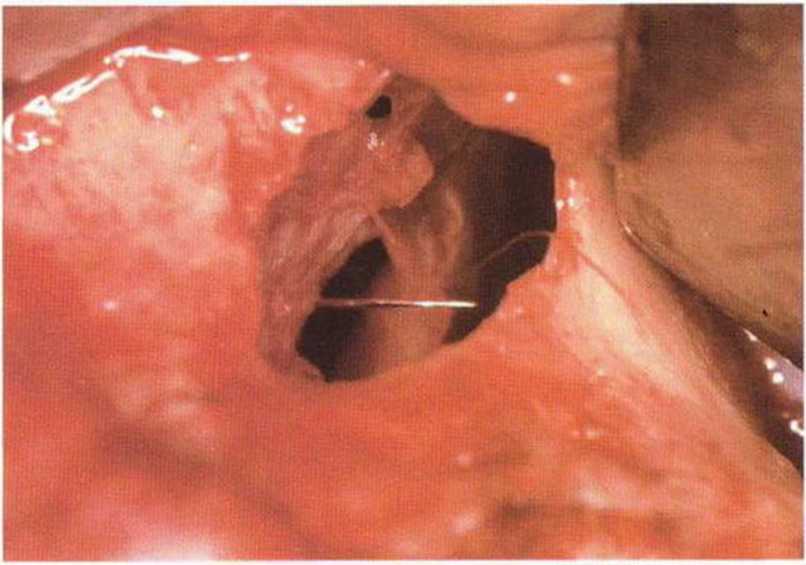
Рис. 9-12д. Первый шов наложен без натяжения для уменьшения перфорации
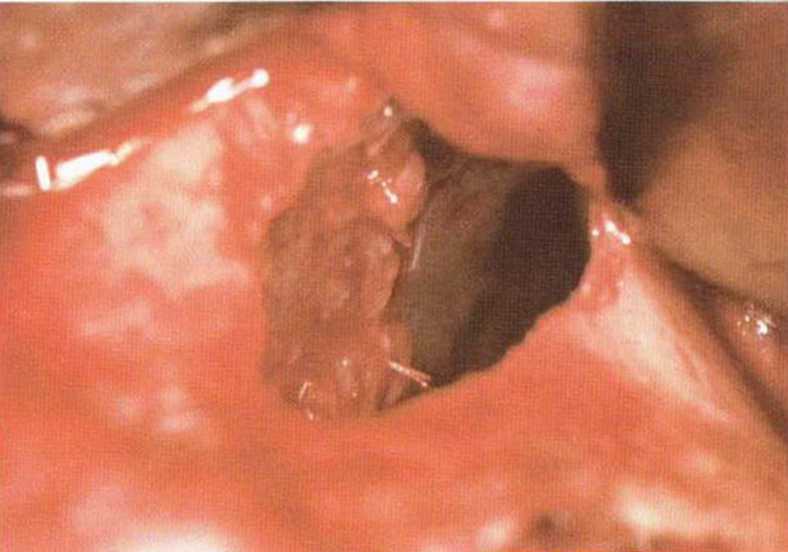
Рис. 9-12i. Перфорация полностью закрыта
Рис. 9-12j. Фибриновый клей
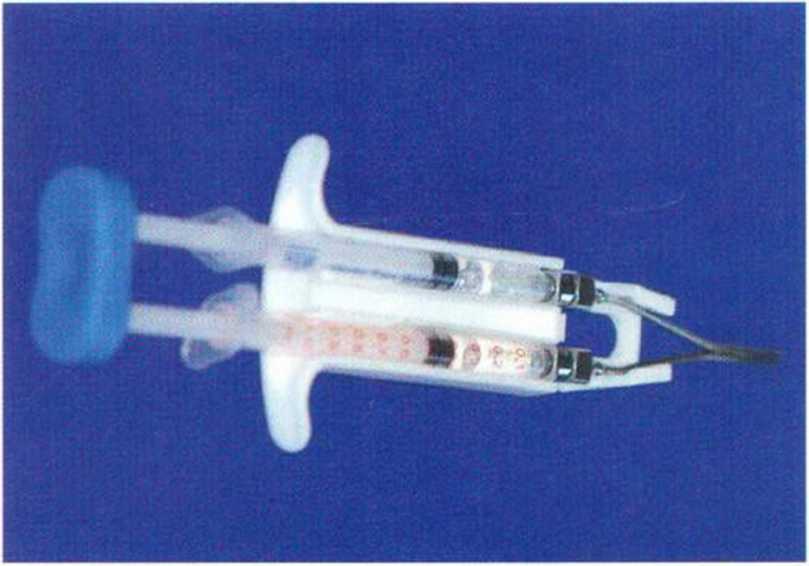
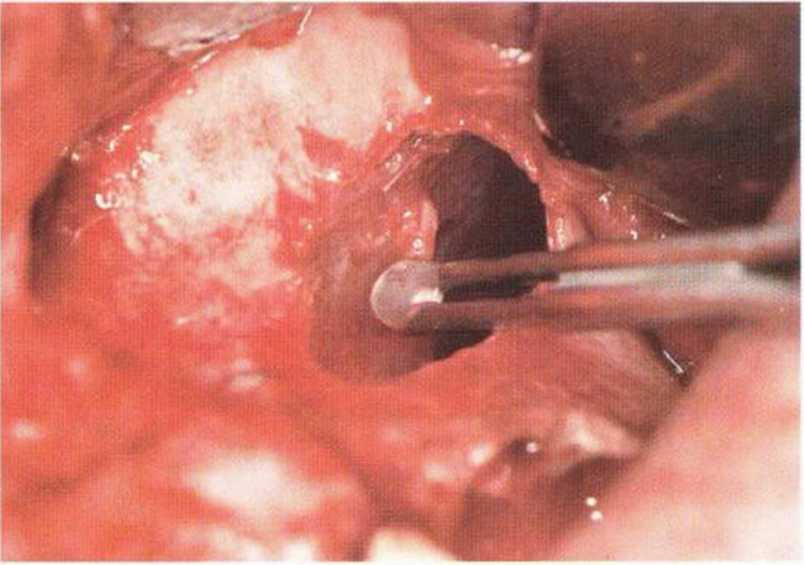
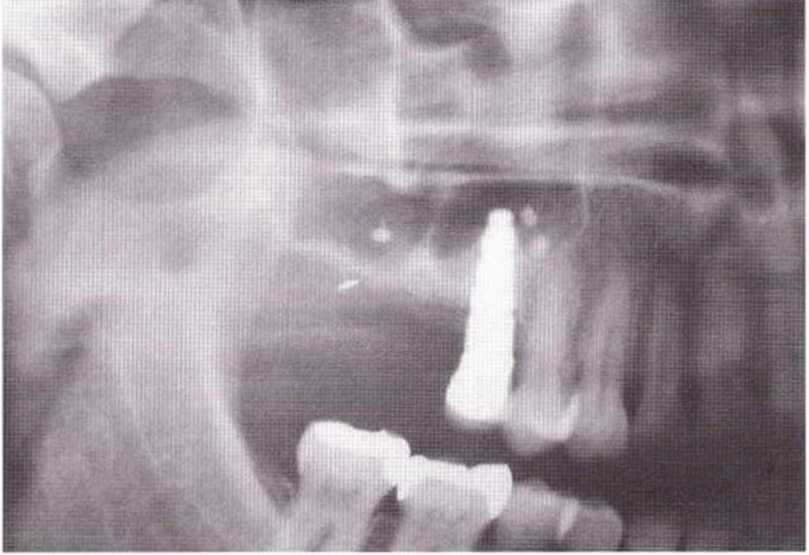
Рис. 9-121. Состояние после широкого разрыва слизистой верхнечелюстной пазухи. Перфорация вызвана острым краем перегородки. Вестибулярная стенка верхнечелюстной пазухи покрыта резорбируемой мембраной
Рис. 9-12к. Для лучшего закрытия после наложения швов наносят дополнительный слой фибринового клея
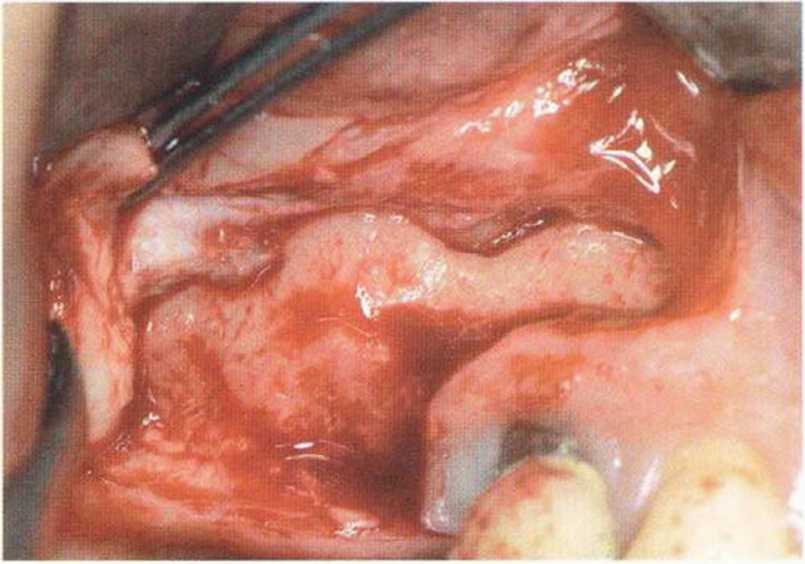
Рис. 9-12т. Повторная визуализация вестибулярной стенки верхнечелюстной пазухи через 1 год после операции. Оба окна сохранены. Несмотря на установку резорбируемой мембраны, произошло сращение слизистой верхнечелюстной пазухи с вестибулярной надкостницей
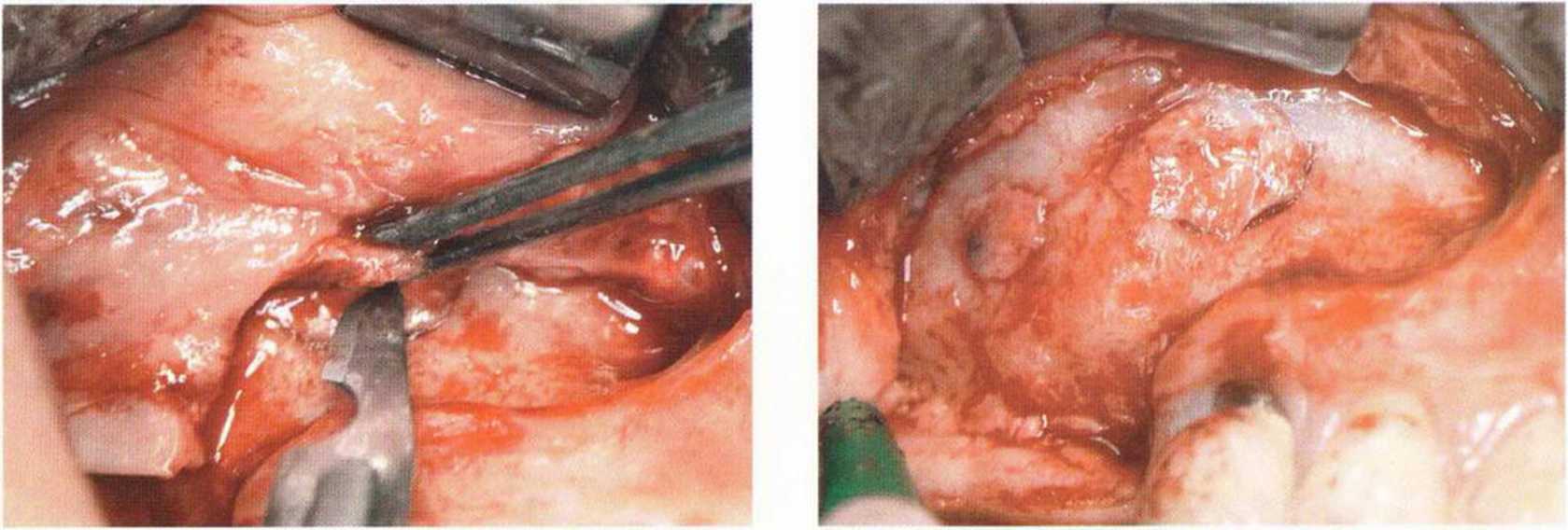
Рис. 9-12о. Часть надкостницы сознательно оставлена на слизи стой верхнечелюстной пазухи. В результате слизистая пазухи в этой области значительно утолщается
Рис. 9-12п. Острое отделение слизистой пазухи от вестибулярной десны
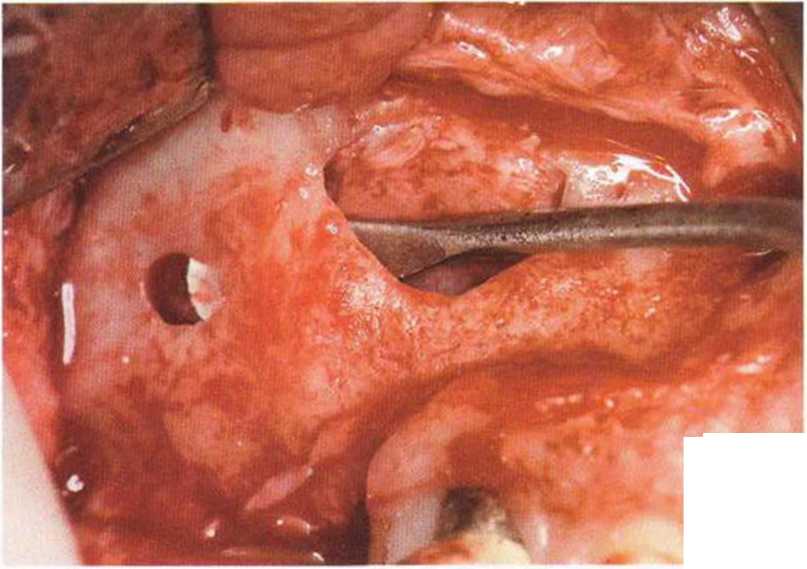
Рис. 9-12р. Отслаивание слизистой верхнечелюстной пазухи от костного основания
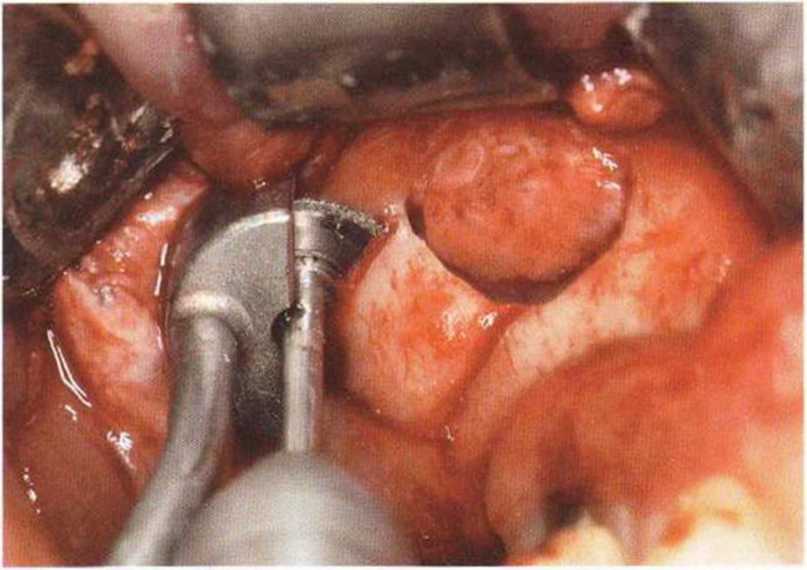
Рис. 9-12q. Для лучшей визуализации перегородки костный мостик между двумя окнами иссекли пилой MicroSaw
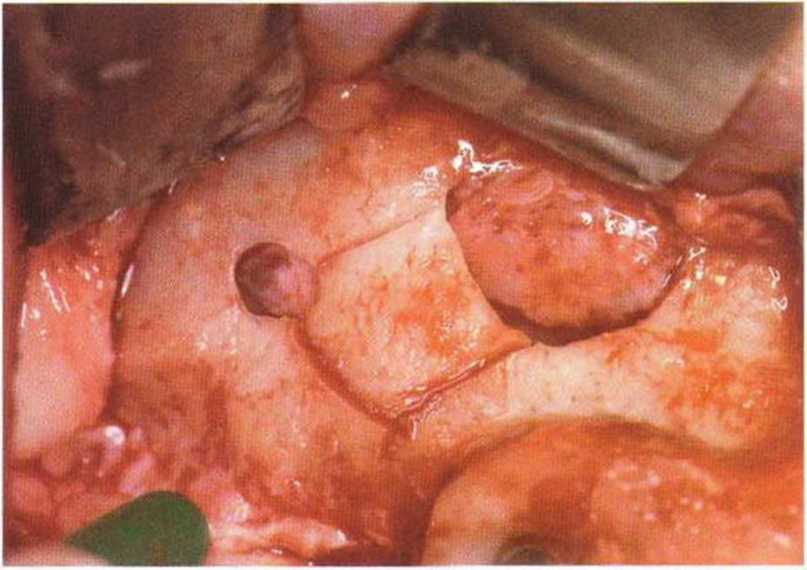
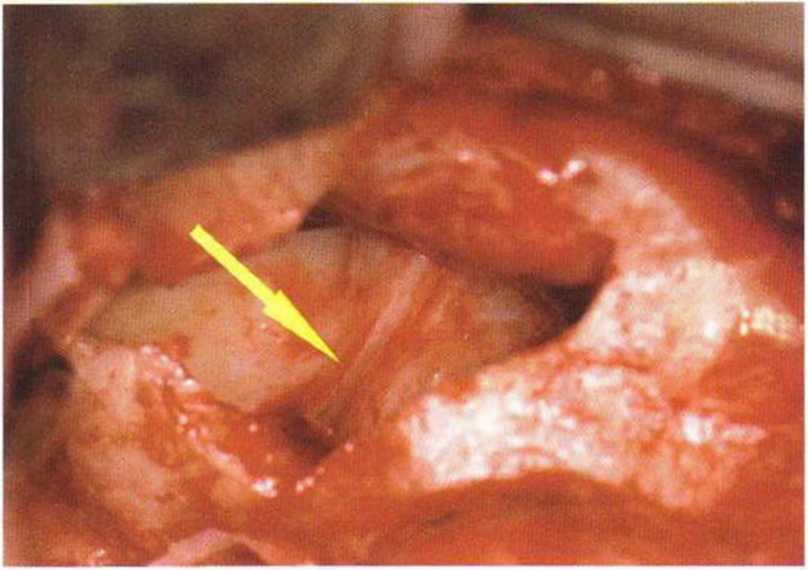
Рис. 9-12г. Выпиливание костного фрагмента
Рис. 9-12s. После удаления костного фрагмента и отслаивания слизистой визуализируется острая перегородка
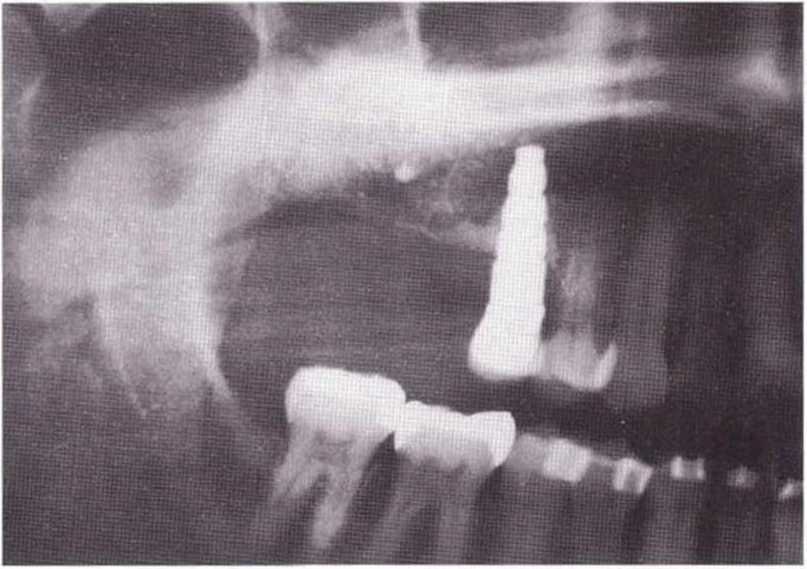
Рис. 9-12t. Состояние после регенеративного вмешательства в области дна верхнечелюстной пазухи.
Рис. 9-12и. Послеоперационная рентгенограмма
Встречаются самые разные варианты костных перегородок верхнечелюстной пазухи (рис. 9-1 За-9-13d). Перегородки могут быть первичными, как вариант анатомического строения, например в многоячеистой верхнечелюстной пазухе с несколькими камерами (рис. 9-1 Зе), а также вторичными, которые возникают в результате рубцевания после травм или хирургических вмешательств. Иногда слой кортикальной кости, ограничивающий корни верхних премоляров и моляров, выступает в просвет верхнечелюстной пазухи. Наличие таких перегородок в верхнечелюстной пазухе повышает риск перфорации ее слизистой и затрудняет регенеративные вмешательства и последующий синус-лифтинг.-При слабо выраженной перегородке слизистую можно отслоить с нёбной или вестибулярной стороны от перегородки, а также над перегородкой, однако при этом следует учитывать, что именно в области перегородки прикрепление слизистой может быть более плотным и для ее отслаивания потребуется больше времени. Если перегородка высокая, потребуются дополнительные хирургические этапы для соответствующего отслаивания слизистой. В пазухе можно препарировать два окна - по одному спереди и сзади перегородки, через которые отслаивают слизистую (рис. 9-13f и 9-1 Зд).
В качестве альтернативы можно отсечь перегородку у ее основания. Для этого слизистую пазухи сначала отслаивают от мезиальной стенки перегородки. Затем перегородку у ее основания с помощью широких перфораторов или остеотомов (диаметром 3,8 и 4,5 мм) отламывают в дистальном направлении. После этого продолжают дистальное отслаивание слизистой, для чего нередко требуется улучшение доступа с помощью расширения костного окна. Тем не менее перегородки могут обеспечивать преимущество, поскольку после отслаивания слизистой пазухи имплантаты можно установить непосредственно в них. В таких случаях достигается достаточно высокая первичная стабильность имплантатов для использования одноэтапной имплантации (рис. 9-14а-9-14с).
Рис. 9-13а. Поперечное расположение перегородки
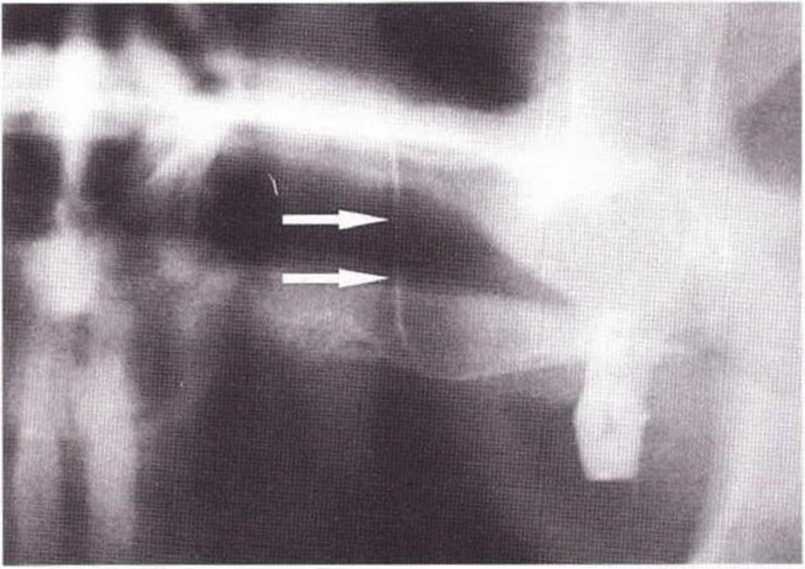
Рис. 9-13Ь. Очень тонкая и длинная перегородка
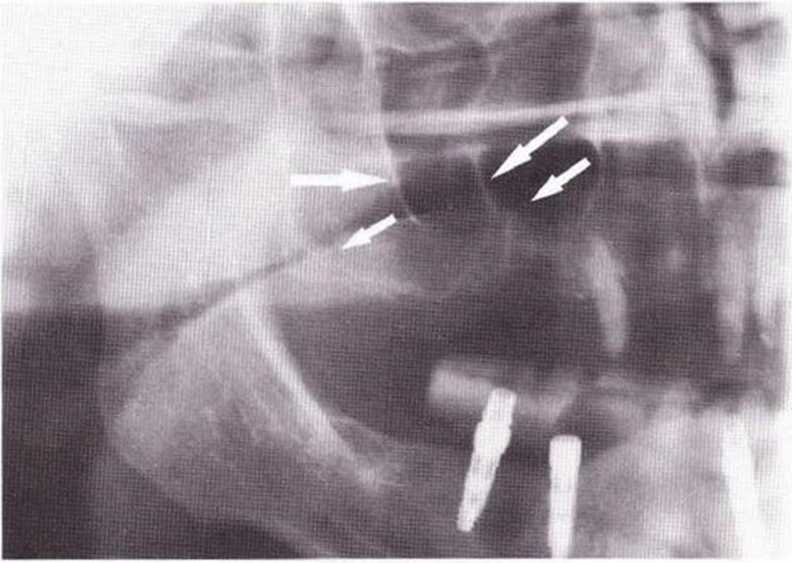
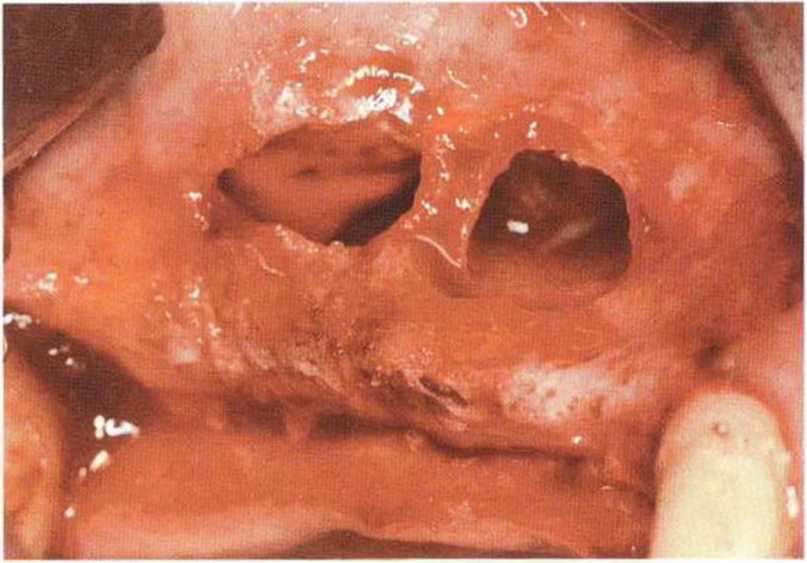
Рис. 9-13f. Два окна вокруг широкой перегородки
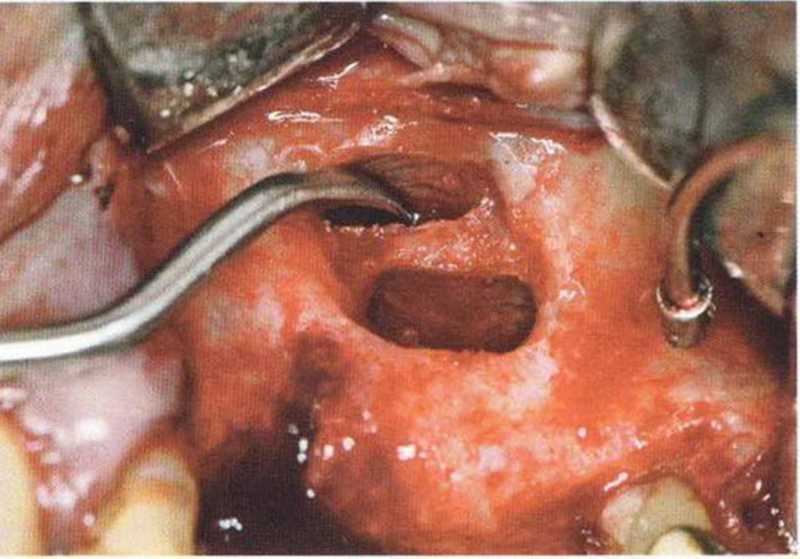
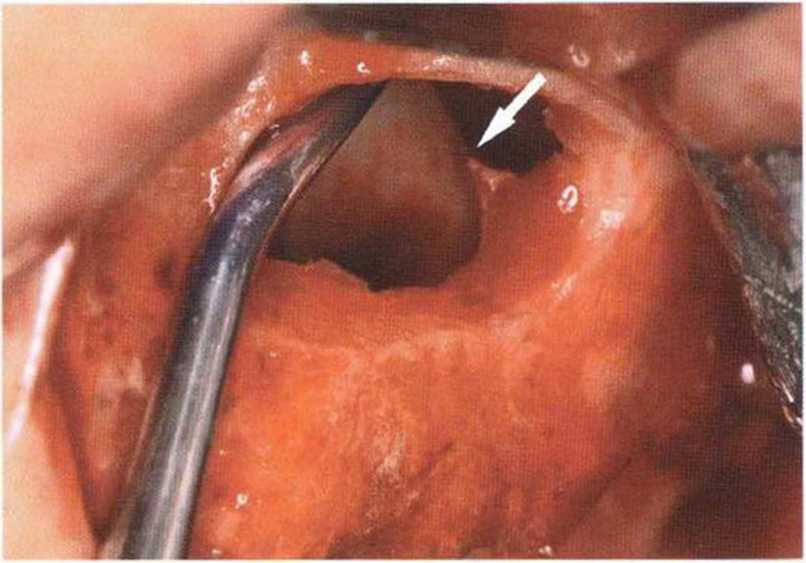
Рис. 9-13с. Горизонтальная перегородка
Рис. 9-13d. Узкая и короткая перегородка
Рис. 9-1 Зе. На фрагменте ортопантомограммы, как правило, хорошо определяются костные перегородки пазухи. В данном случае визуализируются множественные перегородки
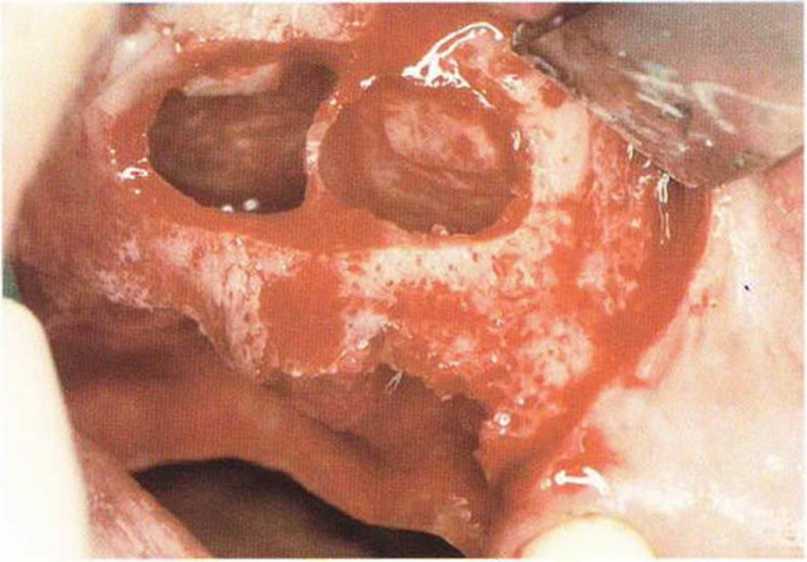
Рис. 9-1 Зд. Два окна - спереди и сзади от перегородки - позволяют минимально травматично отслоить слизистую пазухи
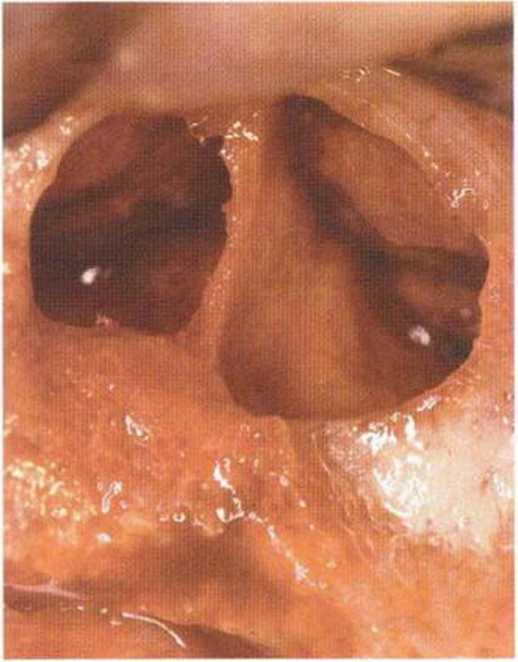
Рис. 9-14а. Высокая перегородка с широким основанием
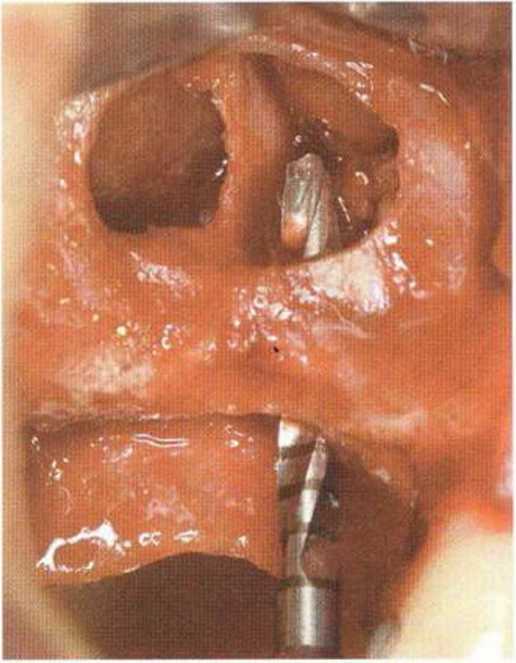
Рис. 9-14Ь. Препарирование ложа имплантата в области перегородки
Рис. 9-14с. Несмотря на незначительную высоту альвеолярного гребня, два имплантата установлены благодаря дополнительной стабилизации в перегородке
В некоторых ситуациях слизистая верхнечелюстной пазухи, несмотря на достаточное отслаивание от костного дна, приподнимается незначительно.
Это происходит по ряду причин. Прежде всего, в верхнечелюстной пазухе при дыхании возникают значительные перепады давления. При каждом выдохе слизистая прижимается ко дну пазухи, что затрудняет манипуляцию. Данное препятствие легко преодолеть, если отслоить слизистую до бугра.
В таком случае можно относительно свободно поместить в пазуху костный материал, который обеспечит поддержку слизистой.
Обширные мукоцеле также оказывают значительное сопротивление при смещении слизистой верхнечелюстной пазухи вверх. В таких ситуациях рекомендуются пункция и аспирация мукоцеле через тонкую иглу.
При блокировании естественного верхнечелюстного соустья интубационной трубкой при проведении операции под общей анестезией давление в пазухе повышается, что затрудняет отслаивание слизистой, повышает риск ее перфорации и препятствует введению костного материала. В связи с этим при операциях под интубационным наркозом следует избегать закупоривания верхнечелюстного соустья, вводя трубку на противоположной стороне носового хода.
Обструкция верхнечелюстного отверстия также повышает риск инфицирования пазухи в послеоперационном периоде. Любая блокада отверстия и нарушение функции реснитчатого эпителия препятствуют выведению секрета и бактерий из верхнечелюстной пазухи. У пациентов, страдающих заболеваниями верхнечелюстной пазухи, сначала следует устранить обструкцию пазухи. Кроме того, при риске закупоривания соустья после синус-лифтинга можно дополнительно назначить сосудосуживающие назальные капли.
После синус-лифтинга недиагностированные перфорации слизистой с пенетрацией костного материала в верхнечелюстную пазуху и выраженная гематома с последующим инфицированием могут приводить к развитию абсцесса. При открытом синус-лифтинге инфицирование может произойти в результате миграции костного материала под действием перепадов давления в пазухе и повреждения раны в период заживления, поэтому окно пазухи рекомендуется закрывать мембраной. Абсцессы чаще встречаются у курильщиков и при синус-лифтинге в сочетании с трансплантацией костных блоков длн увеличения высоты альвеолярного гребня. К развитию абсцессов также может привести контаминация мембраны. Как правило, такое инфицирование развивается через 2-3 недели после отмены антибиотиков. В таких случаях после снятия острой симптоматики после начала приема амоксицил-лина или клиндамицина (возможно в сочетании с метронидазолом) проводят ревизию раны и удаляют трансплантат и (или) костный материал.
Повторное регенеративное вмешательство следует проводить не ранее чем через 3 мес после заживления.
Как уже отмечалось, регенеративные вмешательства, направленные на увеличение объема костной ткани, нередко ассоциируются с осложнениями со стороны мягких тканей (например, при перфорации слизистой пазухи костный материал проникает в пазуху и вызывает инфицирование). В таких.
случаях нужно избегать резких перепадов давления в пазухе. Пациенту не следует сморкаться и пить жидкость через соломинку, при чихании рот должен быть максимально открыт. При сморкании возникает риск развития эмфиземы тканей лица, разрыва кровеносных сосудов и инфицирования пазухи. Для профилактики инфекционных осложнений в раннем послеоперационном периоде назначают антибиотикотерапию и местные препараты для устранения отека.
Вероятность недиагностированной перфорации слизистой верхнечелюстной пазухи и пенетрации костного материала через операционный доступ наиболее характерна для так называемого закрытого синус-лифтинга. При возникновении перфорации слизистой пазухи в процессе такого синус-лифтинга целесообразно сформировать латеральный доступ для отслаивания слизистой под визуальным контролем. Весь костный материал, оказавшийся в пазухе, необходимо удалить.
При развитии острой инфекции показано внутривенное введение амоксициллина или клиндамицина (при необходимости в сочетании с метронидазолом). Средства для снятия отека позволяют удерживать верхнечелюстное отверстие открытым. При сообщении пазухи с полостью рта проводят ирригацию пазухи ротовым доступом до стихания острой симптоматики. Затем, как правило, необходима ревизия верхнечелюстной пазухи с расширением соустья с носовым ходом.
При двухэтапном протоколе имплантации возможна недостаточная первичная стабильность имплантатов вследствие неполноценной регенерации костной ткани. На процесс и сроки заживления, а также качество регенерации влияет тип использованного костного материала. Аутогенные трансплантаты отличаются высоким остеогенным и остеоиндуктивным потенциалом, в то время как иные костные материалы обладают в лучшем случае только остеокондуктивной активностью, что объясняет недостаточную регенерацию костной ткани при низком регенеративном потенциале принимающего ложа.
В ряде случаев при препарировании ложа имплантата вместо высверливания костной ткани рекомендуется применять остеотомы. Полученную с помощью трепанов на других участках аутогенную кость можно ввести в ложе имплантата. Это позволяет улучшить качество костной ткани и увеличить площадь контакта имплантата с окружающей костью.
При отсроченном протоколе с пересадкой аутогенной кости и костного материала имплантацию проводят через 4 мес после синус-лифтинга. В процессе заживления происходит резорбция трансплантата и уменьшается высота альвеолярного гребня. Во избежание перфорации пазухи перед имплантацией нужно определить оптимальную длину имплантатов с помощью рентгенограмм.
Для щадящего препарирования костного ложа имплантатов и снижения риска прободения пазухи рекомендуется применять соответствующие остеотомы. При обнаружении перфорации во время подготовки костного ложа следует установить относительно короткий имплантат. В таких случаях заживление перфорации происходит при организации кровяного сгустка. Риск недиагностированной боковой перфорации слизистой верхнечелюстной пазухи повышается при отсутствии достаточного нёбного препарирования слизистой во время первого вмешательства. Возникающие при этом полости могут определяться только на КТ (рис. 9-14d), но не на панорамных томограммах.
Установка имплантатов без отслаивания слизистой верхнечелюстной пазухи вовсе не обязательно приводит к синуситу, но ассоциируется с уплотнением прилегающей слизистой пазухи.
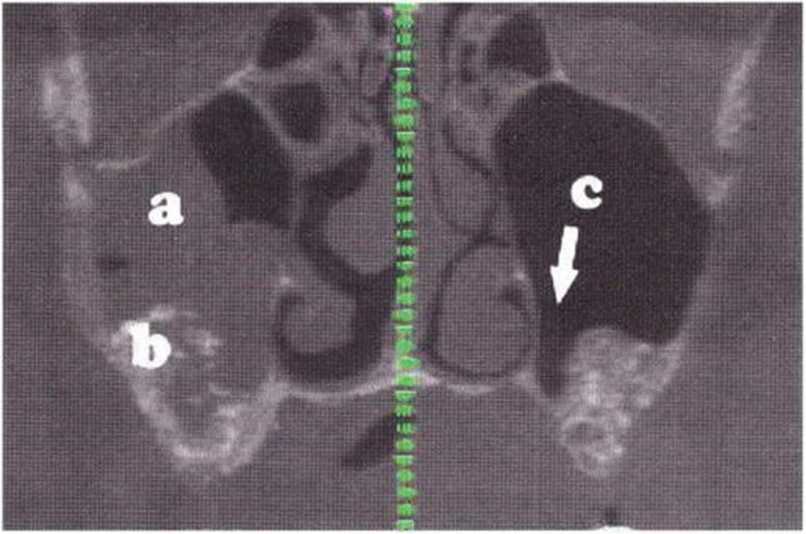
Рис. 9-14d. (а) Картина гайморита справа вследствие широкой перфорации слизистой верхнечелюстной пазухи. (Ы Значительное изменение слизистой правой пазухи (по сравнению с левой), лизис негомогенного трансплантата, (с) В левой верхнечелюстной пазухе отмечается недостаточное отслаивание слизистой. В результате при последующей имплантации возможна недиагностированная перфорация слизистой
Осложнения в донорской области не влияют на успех регенеративного вмешательства, однако осложнения в зоне трансплантации могут привести к полной неудаче лечения.
Трансплантацию костных блоков обычно проводят для увеличения толщины и (или) высоты альвеолярного гребня в сочетании с костной стружкой (см.
главу 5). При этом костный блок фиксируют винтами к принимающему ложу, стараясь обеспечить плотный и стабильный контакт между поверхностями кости. Достаточное число и стратегически правильное распределение винтов гарантирует абсолютную неподвижность костных блоков в процессе приживления.
Нередко в ходе регенеративного вмешательства трудно удержать костные блоки пинцетом,а мягкая кость ложа или временные имплантаты затрудняют фиксацию трансплантата винтами.Облегчить проведение манипуляции можно с помощью системы винтов разной длины и диаметра.
Специальные зажимы упрощают стабилизацию блока во время привинчивания (рис. 9-15а—9-15d).
Использование винтов диаметром более 1,2 мм может привести к раскалыванию тонких костных блоков. В таких случаях фрагменты костного блока привинчивают по отдельности или заклинивают между собой.
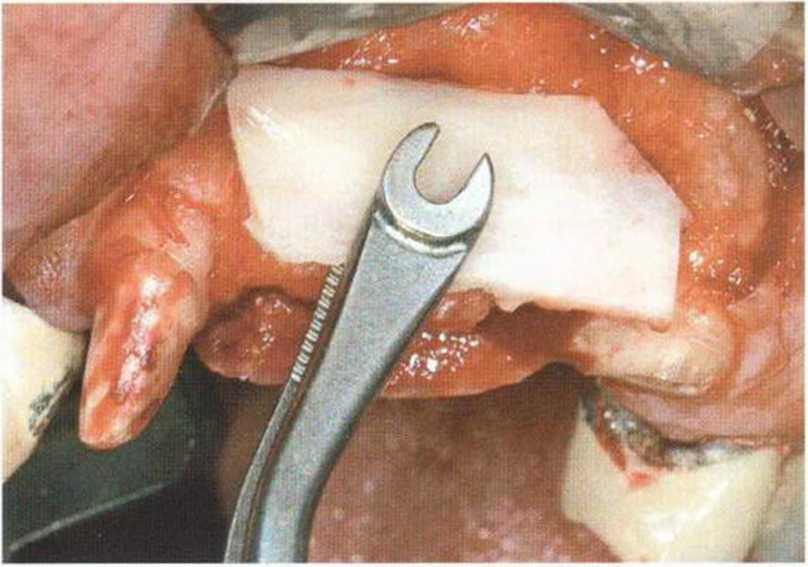
Рис. 9-15а. Специальный удерживающий пинцет (Stoma) для стабилизации костного блока на расстоянии в процессе фиксации
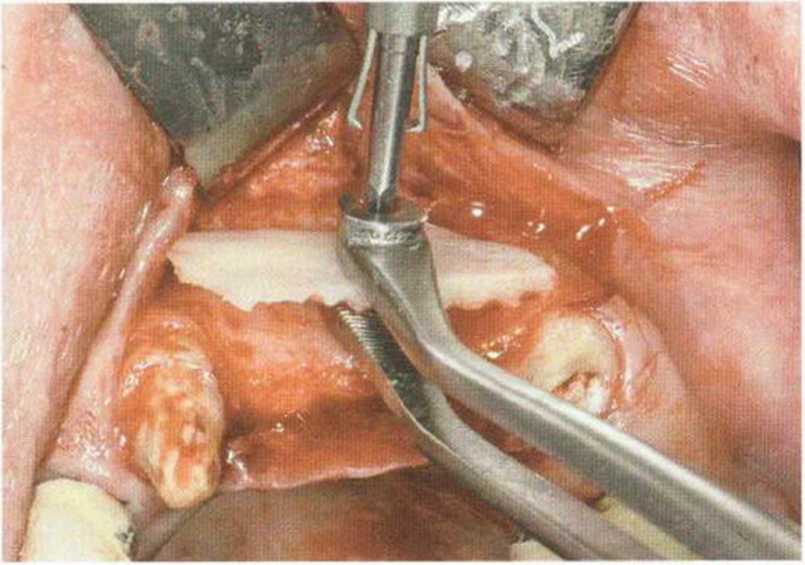
Рис. 9-15Ь. При сверлении и привинчивании блок удерживают пинцетом
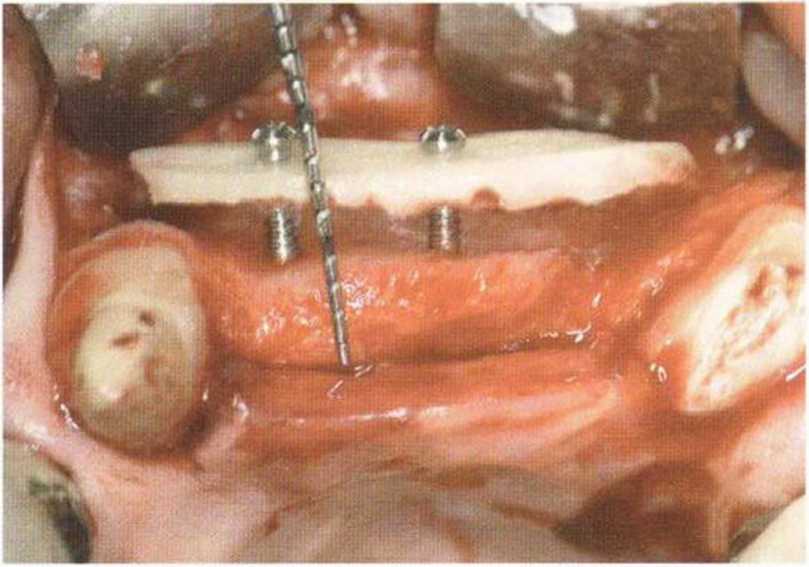
Рис. 9-15с. Фиксированный костный блок
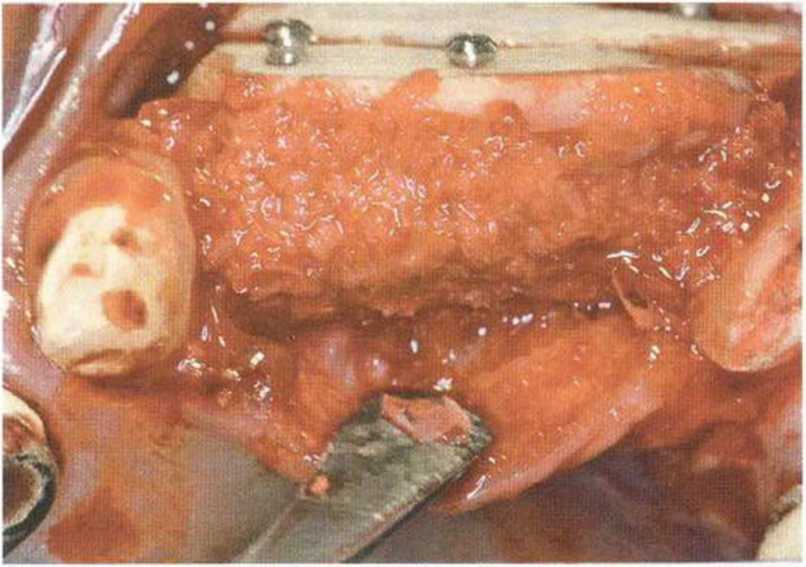
Рис. 9-15d. Состояние после заполнения свободного пространства костной стружкой
Купирование боли после регенеративных вмешательств на костной ткани аналогично таковому при других хирургических вмешательствах в полости рта, например удалении ретинированного третьего моляра. Обычно для кратковременного и долгосрочного устранения боли назначают анальгетики сразу после операции, т.е. еще до появления первых болевых ощущений после ослабления анестезии. Анестетики длительного действия, например артикаин А % с адреналином 1:100000 (ультракаин ДС Форте), оказывают обезболивающий эффект до 4 часов после вмешательства. Накануне операции можно принять противовоспалительный препарат, в частности ибупрофен (400 мг). Нестероидные противовоспалительные средства ингибируют образование простагландинов, которые стимулируют выделение других веществ, усиливающих болевые ощущения. В некоторых случаях проводят предоперационную седацию с парентеральным введением метамизола (новаминсульфон-ратиофарм 2,5), что позволяет предотвратить возникновение боли или существенно сократить продолжительность болевого синдрома. Обычно боль сохраняется в течение ночи и следующего дня после операции, поэтому пациентам рекомендуют принимать обезболивающие препараты еще 2-3 дня после вмешательства, вне зависимости от выраженности болевых ощущений.
Кровотечение в послеоперационном периоде возникает довольно редко, но является серьезным и тревожным для пациента осложнением. Кровотечения в большинстве случаев возникают после вестибулярного рассечения надкостницы, формирования нёбного соединительнотканного лоскута на питающей ножке или свободного соединительнотканного трансплантата, а также из открытой.
раневой поверхности после вестибулопластики по Казанджяну. Для остановки кровотечения можно применять стерильные тампоны, пропитанные стерильным физиологическим раствором. Легкое надавливание в течение 30 минут на кровоточащий участок нарушает микроциркуляцию и способствует начальной коагуляции. Кроме того, пациент должен держать холодный компресс на коже лица в соответствующей области. Чтобы предупредить или остановить кровотечение на нёбе, рекомендуется наложить нёбную защитную пластинку, которая также оказывает давление на донорскую область. Пациенту нужно дать устные и письменные рекомендации. Запрещается прием вазоактивных веществ, например кофе или алкоголя. Плотное ушивание раны является важным условием профилактики кровотечений в раннем послеоперационном периоде. Нужно помнить, что преждевременное удаление швов может спровоцировать кровотечение в позднем послеоперационном периоде.
Отеки являются обычным следствием любого хирургического вмешательства в полости рта, но часто вызывают большое беспокойство у пациентов, поэтому их необходимо заранее информировать о большой вероятности отека лица и мягких тканей полости рта. Пациент должен понимать, что интенсивность отека не влияет на успех или неудачу вмешательства и не зависит от сложности операции. Отек обусловлен послеоперационным кровоизлиянием и имеет мягкую консистенцию при пальпации. Пациенту рекомендуют в течение 2 дней прикладывать холодный компресс к коже лица в соответствующей области. Также возможно пред- или периоперационное внутривенное введение глюкокортикостероидов, например преднизо-лона (250 мг) или дексаметазона (8 мг). Препараты вводят ударной дозой, особенно при вмешательствах в области дна полости рта, чтобы обеспечить свободу дыхательных путей.
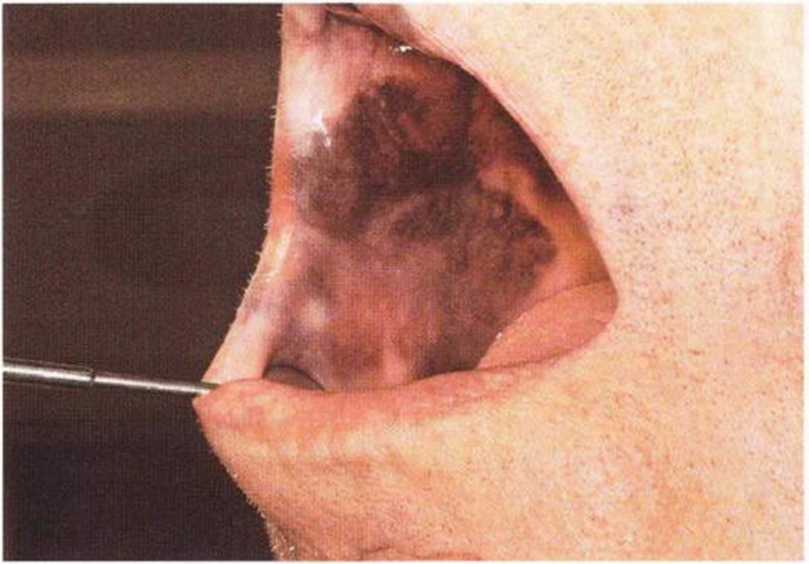
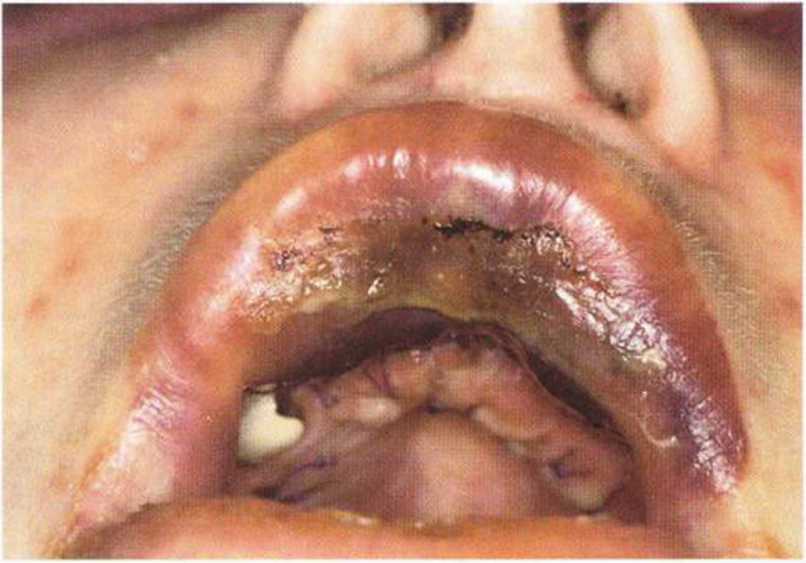
Рис. 9-16Ь. Экхимозы и гематома после регенеративного вмешательства в переднем отделе верхней челюсти
Рис. 9-16а. Кровоизлияние в ткани щеки
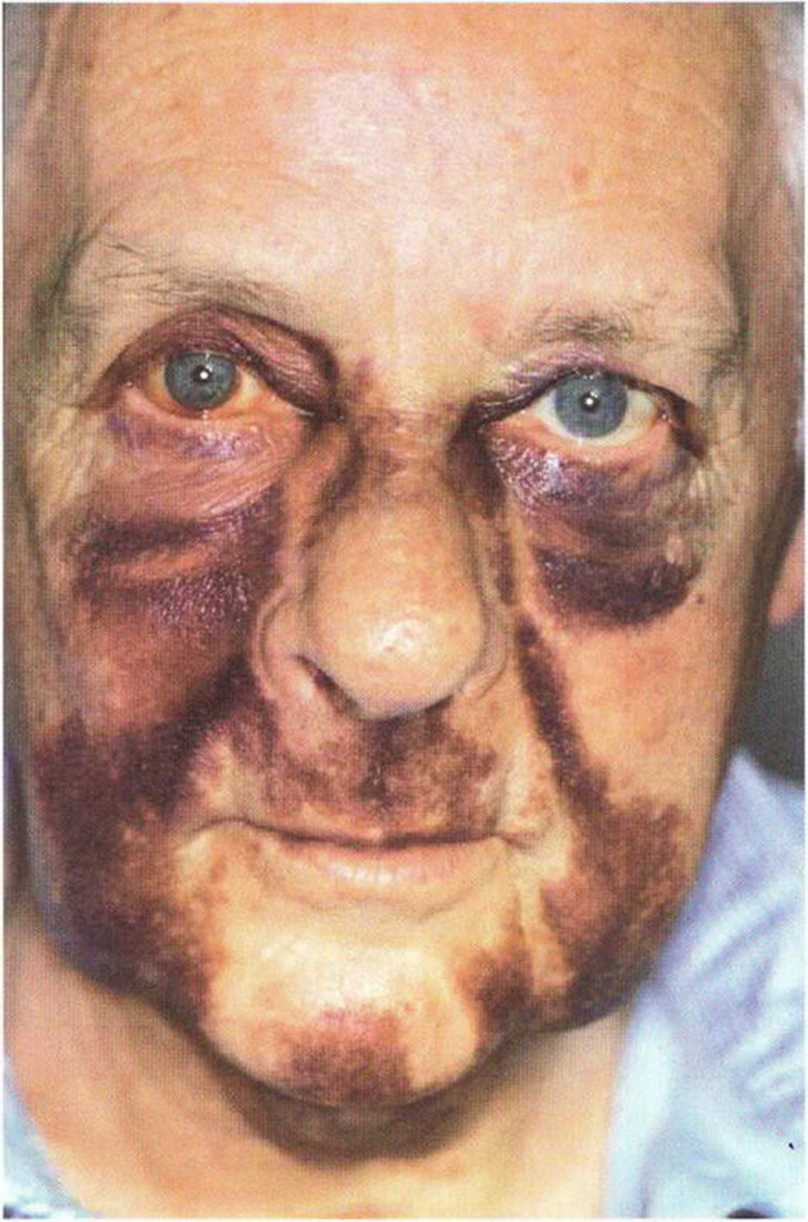
Рис. 9-16с. Отек, экхимозы и гематома через 7 дней после увеличения объема костной ткани и синус-лифтинга
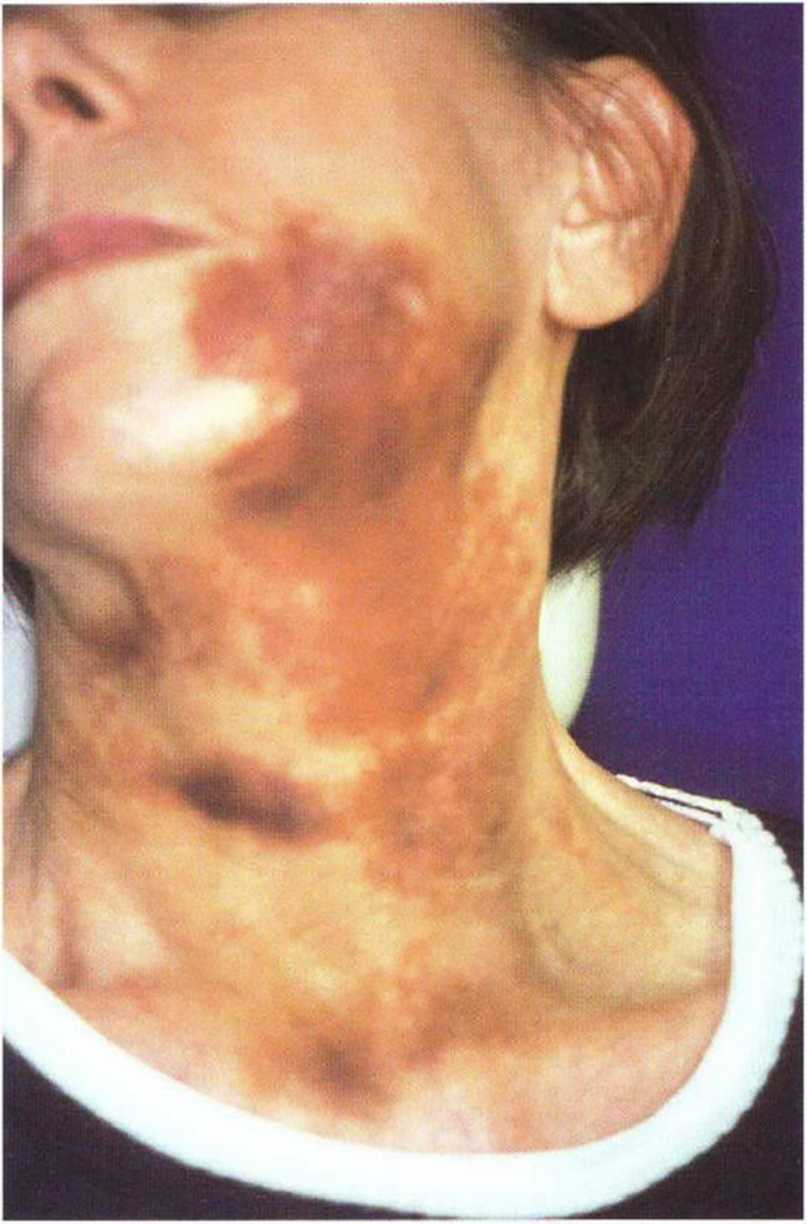
Рис. 9-16d. Гематома через 7 дней после забора костного блока в левой ретромолярной области нижней челюсти
Гематомы - несменяемые, болезненные при надавливании синюшные уплотнения - могут затруднять и задерживать послеоперационное заживление раны. При выраженных отеках требуется антибактериальная профилактика. Кожные кровоизлияния представляют прежде всего эстетическую проблему. Окрашивание мягких тканей лица и полости рта происходит вследствие выхода элементов крови из сосудов в подкожную ткань (рис. 9-16а—9-16с). Экхимозы возникают преимущественно у светлокожих и пожилых пациентов с хрупкими капиллярами. При этом происходит в основном интерстициальное скопление крови, которое постепенно рассасывается (рис. 9-16d). Для ускорения этого процесса применяют гепариновый гель (60000 ME).
В редких случаях в поздние сроки после операции на некоторых участках полости рта, преимущественно в области щек и языка, на слизистой оболочке появляется белый, легко удаляемый налет (рис. 9-16е и 9-16f). Данные изменения обусловлены кандидозом, вызванным грибом Candida albicans, и возникают при длительном приеме антибиотиков в результате изменения нормальной микрофлоры и роста резистентных возбудителей. Терапия заключается в отмене антибиотика, введении в диету молочнокислых продуктов и назначении комплекса витаминов группы В или поливитаминов, а также местном (в виде пастилок для сосания) или системном применении противогрибковых препаратов (нистатин). Инфекция, как правило, устраняется в течение 1 недели (рис. 9-16д).
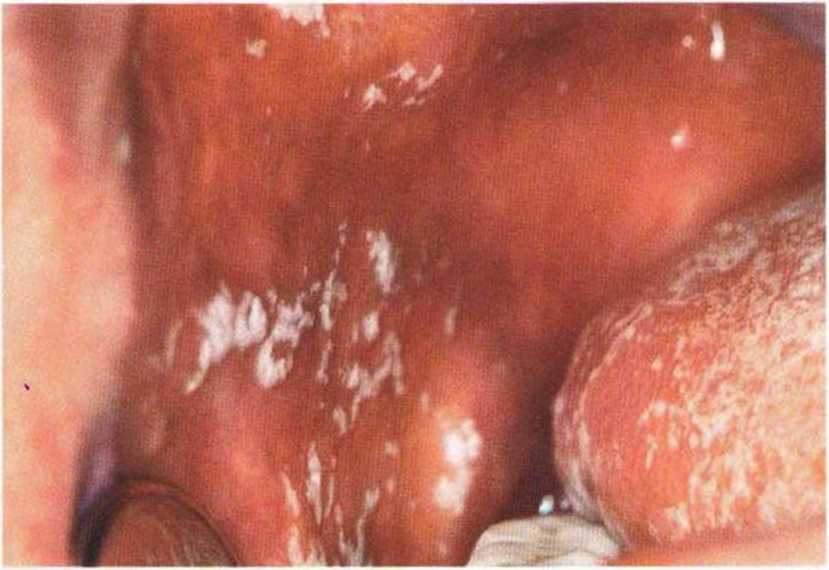
Рис. 9-16е. Белый, слабо прикрепленный налет на слизистой левой щеки. Через 10 дней после операции еще сохраняется гематома
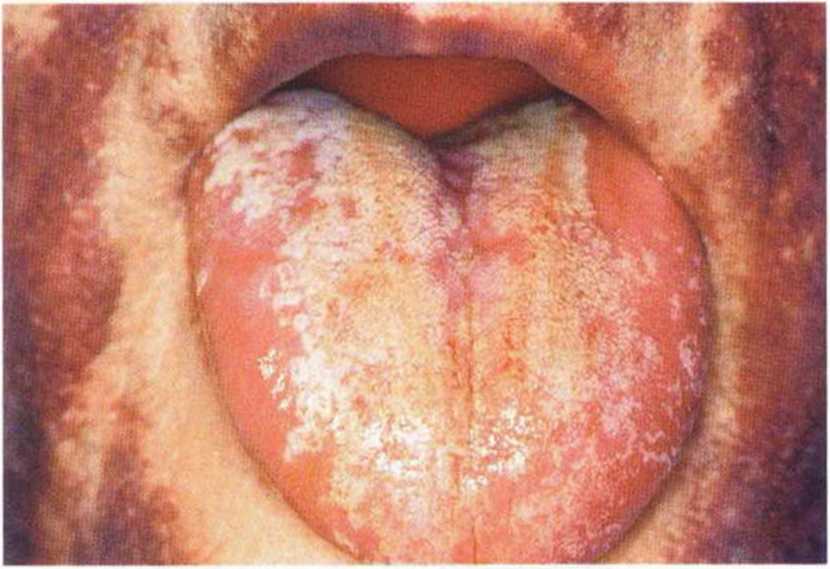
Рис. 9-16f. Аналогичное состояние в области языка
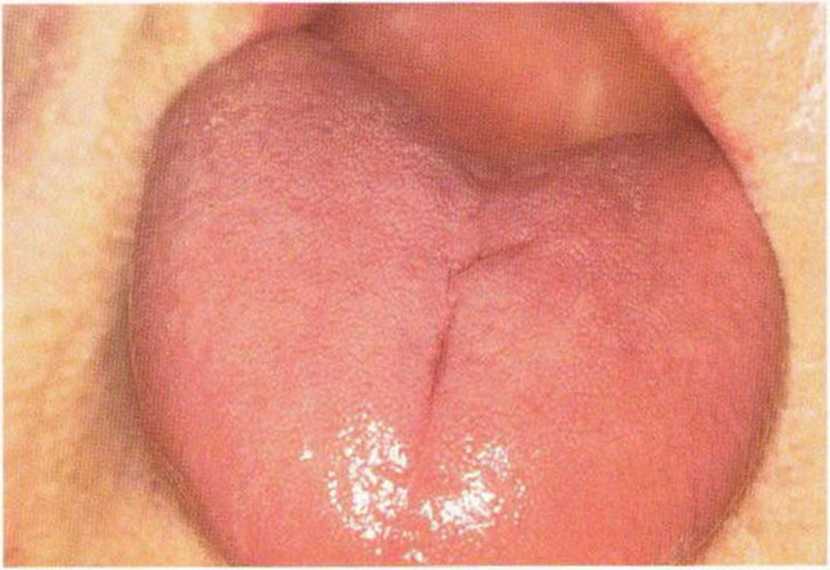
Рис. 9-16д. Клиническое состояние через 1 неделю после местной и системной противогрибковой терапии
Нередко осложнения при пересадке костных блоков связаны с мягкими тканями. Помимо стандартных требований при лоскутных операциях (полноценное кровоснабжение, оптимальный визуальный контроль, сохранение важных анатомических структур), проведение разреза и формирование лоскута в реконструктивной хирургии отличается рядом особенностей. Резорбция подлежащей кости нередко возникает из-за недостаточного перекрывания области вмешательства мягкими тканями, некроза лоскутов и расхождения краев раны. Курение и некоторые общие заболевания (например, сахарный диабет) значительно ухудшают заживление раны. Тонкий биотип, рубцовые и иные патологические изменения слизистой затрудняют герметичное ушивание лоскутов без натяжения. Увеличение объема альвеолярного гребня при пересадке костных трансплантатов нередко требует дополнительных послабляющих разрезов При трансплантации костных блоков наиболее частыми осложнениями являются расхождения краев раны вследствие ретракции лоскута или некроз лоскута с последующим инфицированием трансплантата.
Ушивание раны без натяжения - обязательное условие успеха регенеративных вмешательств.
Для мобилизации лоскута обычно рассекают надкостницу, однако при значительном ее рассечении возможно избыточное истончение или растяжение лоскута, что повышает риск его перфорации и некроза поверх костных трансплантатов.--Костный блок должен быть перекрыт полнослойным лоскутом, послабляющий разрез надкостницы проводят в основании лоскута вне области трансплантации. Расхождение краев раны также возникает из-за несостоятельности швов при неоптимальном ушивании раны или натяжении лоскута. Ретракция лоскута обычно встречается при мелком преддверии полости рта или высоком прикреплении мышц, поэтому при планировании операции очень важно тщательно обследовать мягкие ткани в области предполагаемого вмешательства. После нескольких предшествующих резекций верхушки корня мягкие ткани подвергаются значительному рубцеванию. Отсутствие эластичности тканей затрудняет закрывание дефекта. В таких условиях применение мембран повышает риск расхождения краев раны. Помимо плотного ушивания раны без натяжения показана антибактериальная профилактика.
Указанные проблемы можно предотвратить с помощью двухслойного ушивания раны, создания тоннельного ложа или пересадки соединительнотканных трансплантатов на питающей ножке.Огромное значение для успеха лечения имеют правильный выбор метода пластики мягких тканей и использование микрохирургической техники. Обширный некроз лоскута с экспозицией трансплантата может происходить из-за давления съемного протеза, при увеличении отека под несъемным провизорным протезом с недостаточно сошлифо-ванной придесневой поверхностью или при окклюзионной травме зубов противоположной челюсти (рис. 9-16а и 9-16Ь).
При расхождении краев раны вследствие ретракции или некроза лоскута происходит контаминация и инфицирование области вмешательства и собственно трансплантата микроорганизмами полости рта. Лечение при преждевременном обнажении костного трансплантата обычно имеет неблагоприятный прогноз, поскольку современные методы не позволяют эффективно устранять это осложнение. При немедленной попытке повторного ушивания возможно еще большее увеличение обнаженной поверхности трансплантата из-за усугубления некроза лоскута. Хирургически закрывать рану целесообразно только после завершения ранней фазы заживления мягких тканей. Биомеханические особенности, микроанатомическая структура и нарушение кровоснабжения при неполной регенерации мягких тканей препятствуют последующему заживлению раны, поэтому следует дождаться завершения регенеративных процессов. В течение этого срока рекомендуется снижение бактериальной инфильтрации - регулярная обработка области вмешательства хлоргексидинсодержащим раствором или гелем. Эффективна фотодинамическая терапия (HELBO Photodynamic Systems). Повторное хирургическое закрывание раны проводят не ранее чем через 4 недели после сокращения объема трансплантата (рис. 9-17а—9-17д). Обнаженная поверхность трансплантатов считается контаминиро-ванной, поэтому ее рекомендуется сошлифовывать борами. Обнаженные костные фрагменты нужно удалить, а обнаженные и контаминированные винты заменить новыми на других участках. Показана дополнительная деконтаминация всей операционной области с помощью фотодинамического воздействия. В такой ситуации повторное ушивание нередко затруднено. В идеале следует проводить двухслойное ушивание раны соединительнотканным или слизистым лоскутом на питающей ножке с прилегающего участка. Перед ушиванием рекомендуется деэпителизация краев раны. Обязательную антибактериальную профилактику проводят перорально за 1 час до операции или внутривенно непосредственно перед вмешательством.
Тем не менее, несмотря на все усилия, вероятность сохранения всего трансплантата или даже его части очень мала (рис. 18а). При неудачной попытке ушивания мягких тканей в течение первых 2 недель весь трансплантат следует удалить (рис. 9-186).
Рис. 9-17а. Обнажение трансплантата вследствие окклюзионной травмы
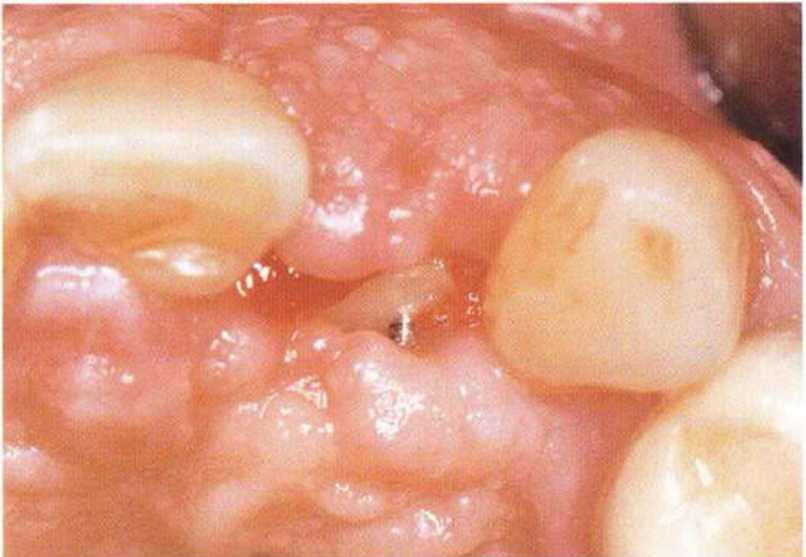
Рис. 9-17Ь. Обнажение трансплантата в результате травмы
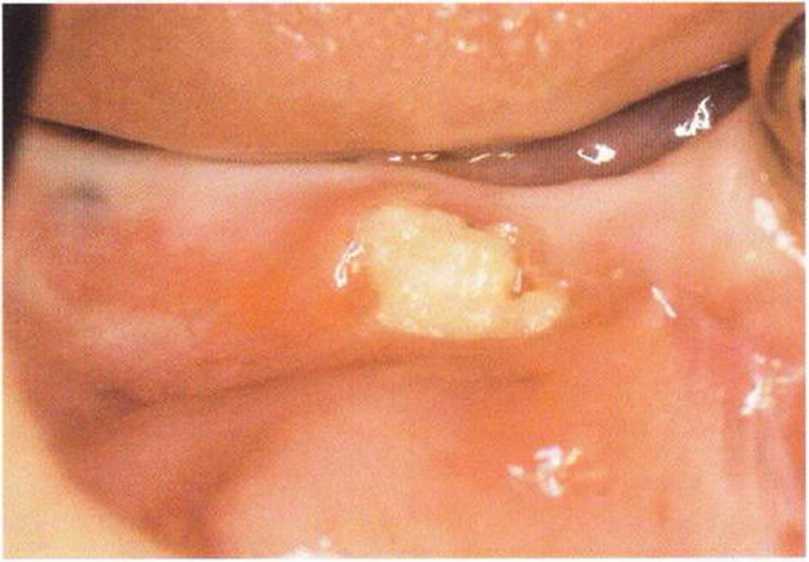
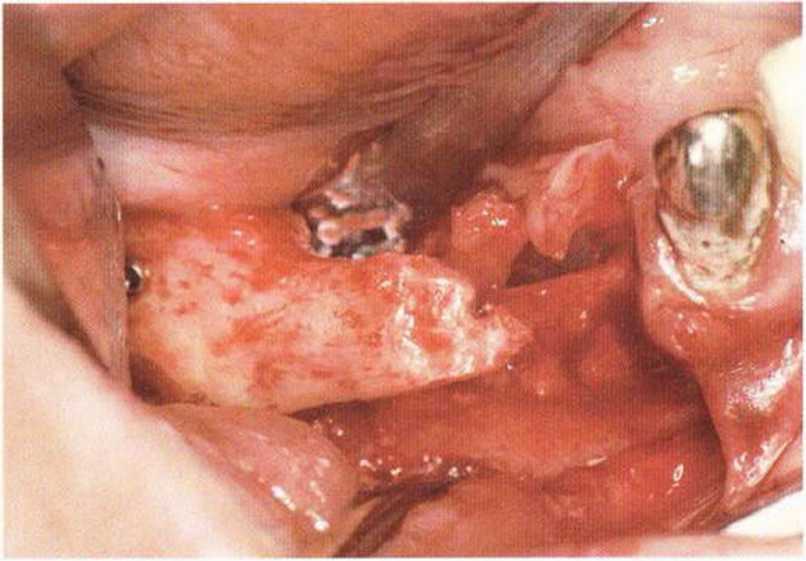
Рис. 9-17с. Обнажение костного трансплантата под давлением протеза через 6 недель после вмешательства.
Рис. 9-17d. Удовлетворительное приживление дистальной части трансплантата, несмотря на некроз и инфицирование обнаженного фрагмента
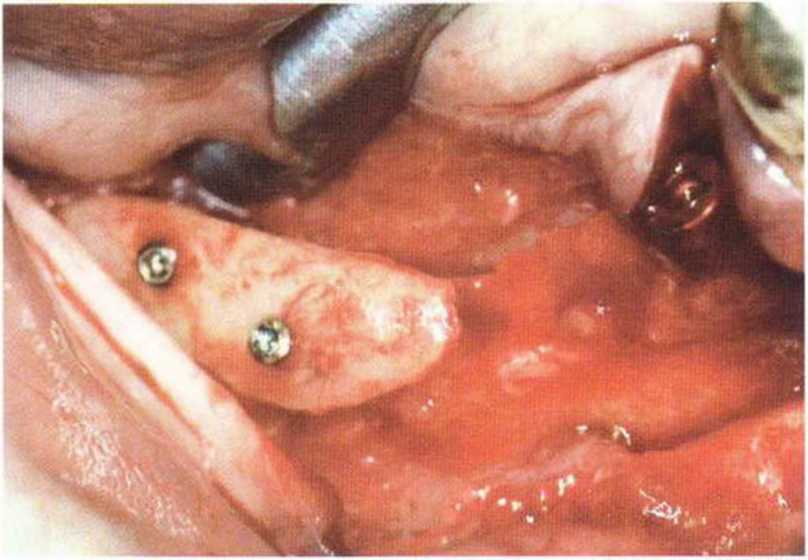
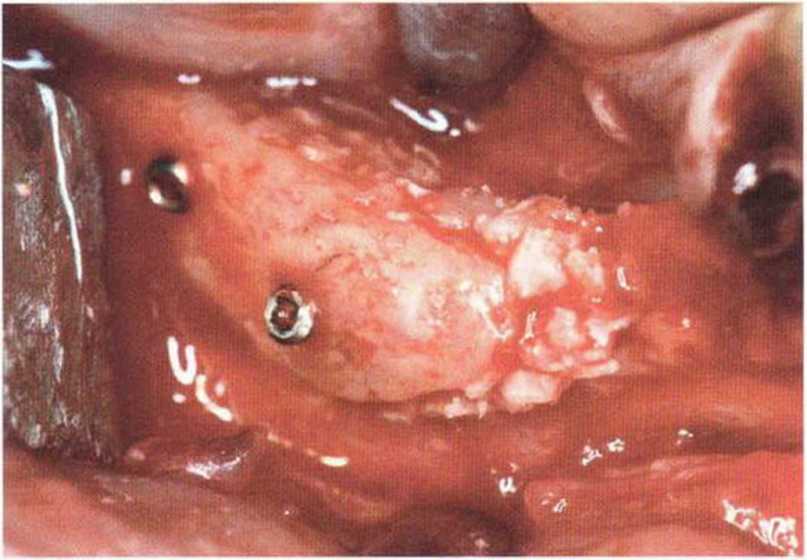
Рис. 9-17f. Пространство между трансплантатом и принимающим ложем заполняется костной стружкой
Рис. 9-17е. Удаление мезиальной части трансплантата и грануляционной ткани между трансплантатом и принимающим ложем
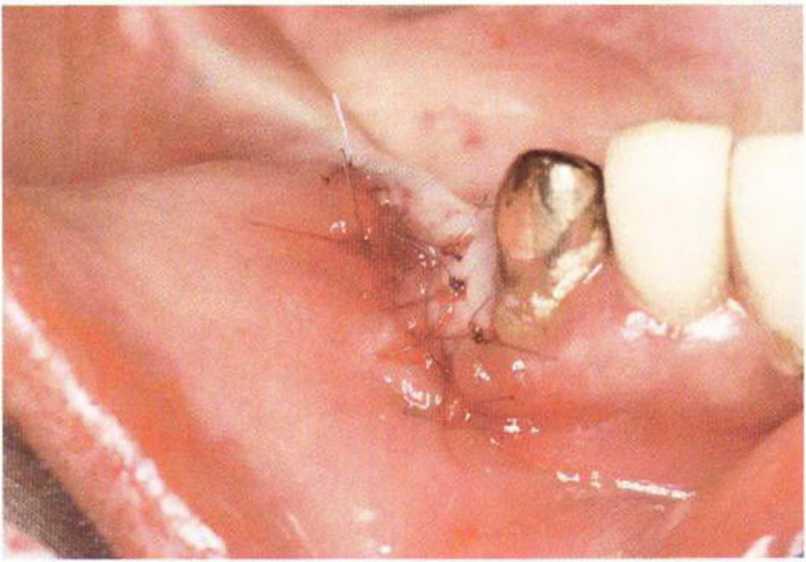
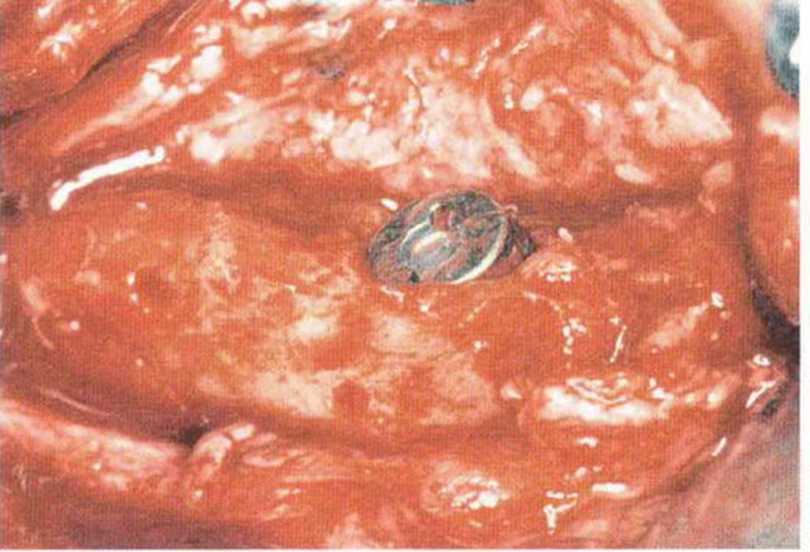
Рис. 9-17g. Герметичное ушивание раны без натяжения.
Рис. 9-17И. Установка имплантата через 3 мес после трансплантации
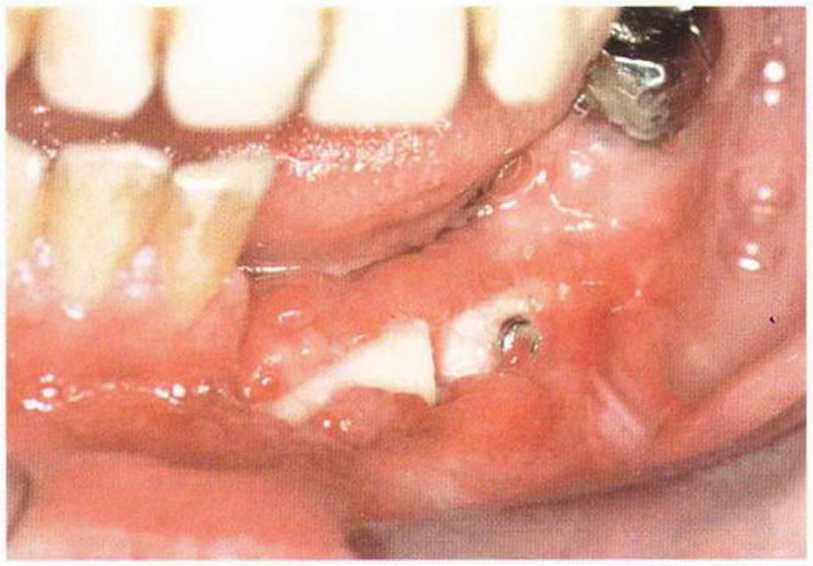
Рис. 9-18а. Показано удаление костных трансплантатов после нескольких неудачных попыток их перекрывания
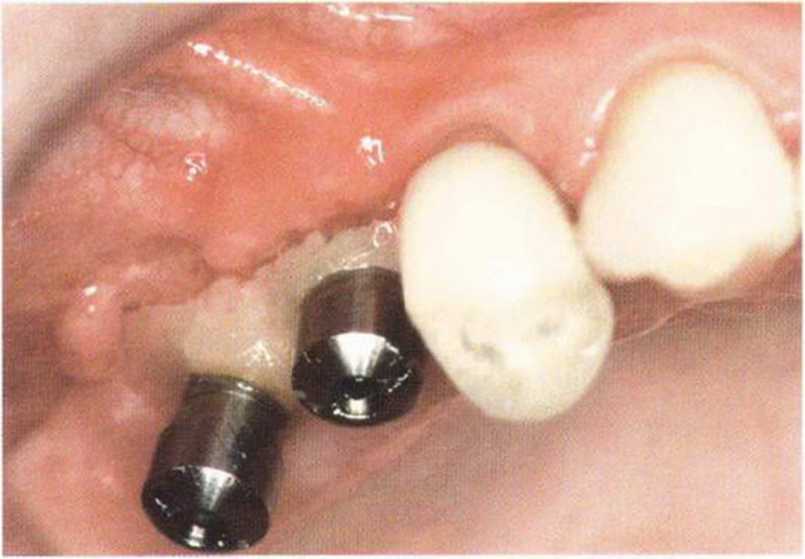
Рис. 9-18Ь. Обнажение и эксфолиация костного трансплантата на верхней челюсти. После эпителизации щели между трансплантатом и принимающим ложем трансплантат должен быть удален
Свободные аутогенные костные трансплантаты во время приживления не должны испытывать нагрузку со стороны съемного протеза или антагонистов. В противном случае повышается риск обнажения и (или) резорбции трансплантата. При увеличении высоты альвеолярного гребня в эстетически значимой области рекомендуется изготовление провизорного несъемного протеза с опорой на зубы или временные имплантаты. Острые края трансплантата или винтов могут повреждать ткани, приводить к их перфорации и расхождению краев раны (рис. 9-19a-9-19d). Такие осложнения возникают преимущественно у курильщиков или диабетиков. Прогноз при данных осложнениях несколько лучше, чем при ранней экспозиции. В таких случаях утрачивается только часть трансплантата (рис. 9-20a-9-20d). Ранее описанный биологический принцип пересадки костного блока предполагает возможность частичного удаления обнаженного кортикального слоя. В области костной стружки или губчатой части трансплантата на данном этапе реваскуляризация, как правило, уже завершена. Лучшее кровоснабжение также облегчает ушивание лоскутов (рис. 9-21 а—9-211, 9-22a-9-22t и 9-23a-9-23k).
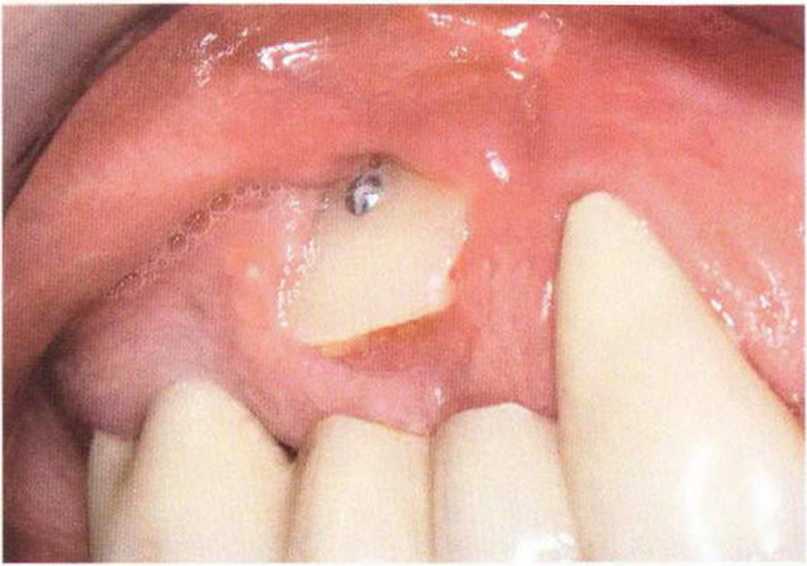
Рис. 9-19а. Из-за острого края произошло обнажение костного блока через 6 недель после регенеративного вмешательства
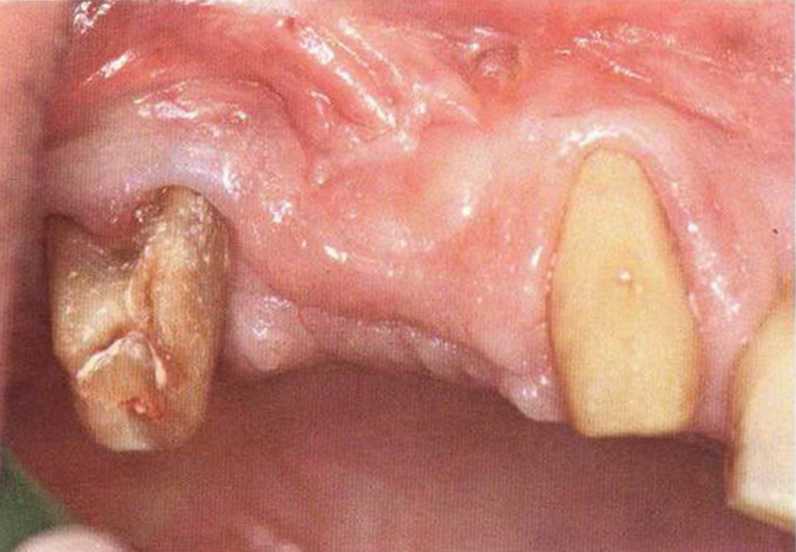
Рис. 9-19Ь. Удовлетворительное заживление после сглаживания острого костного края и ушивания мягких тканей с дистальным смещением лоскута
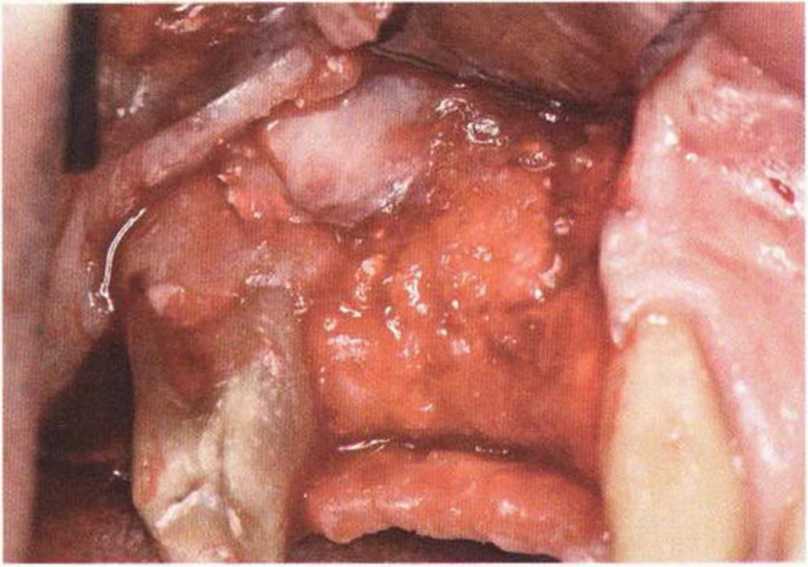
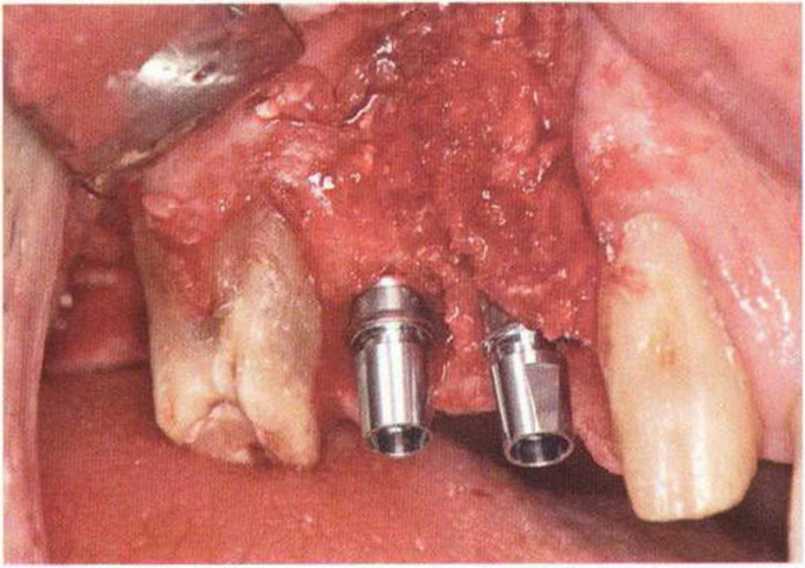
Рис. 9-19d. Установка двух имплантатов в области трансплантации
Рис. 9-19с. Повторное вмешательство через 4 мес после операции. Отмечается полноценное приживление оставшейся части трансплантата
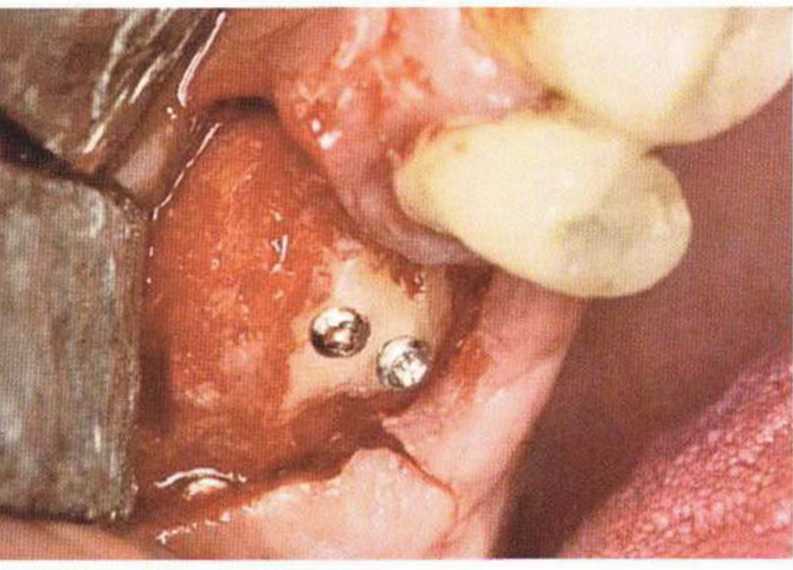
Рис. 9-20с. Значительное уменьшение объема блока ограничено зоной реваскуляризации
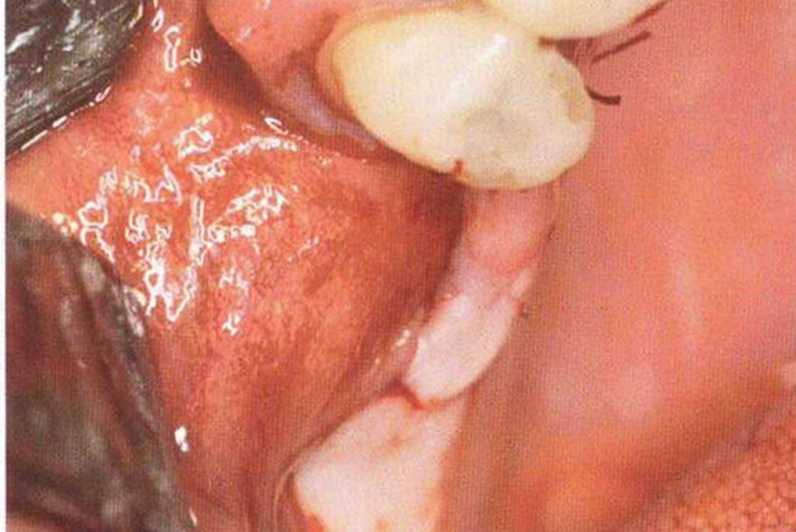
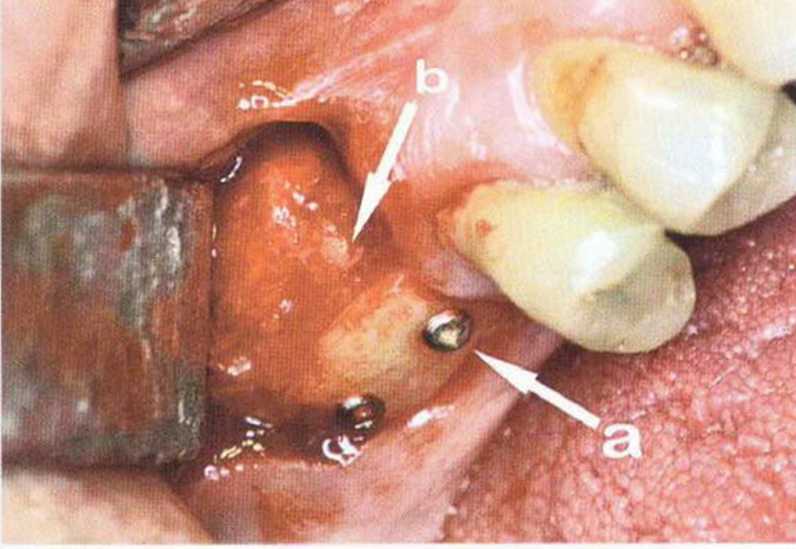
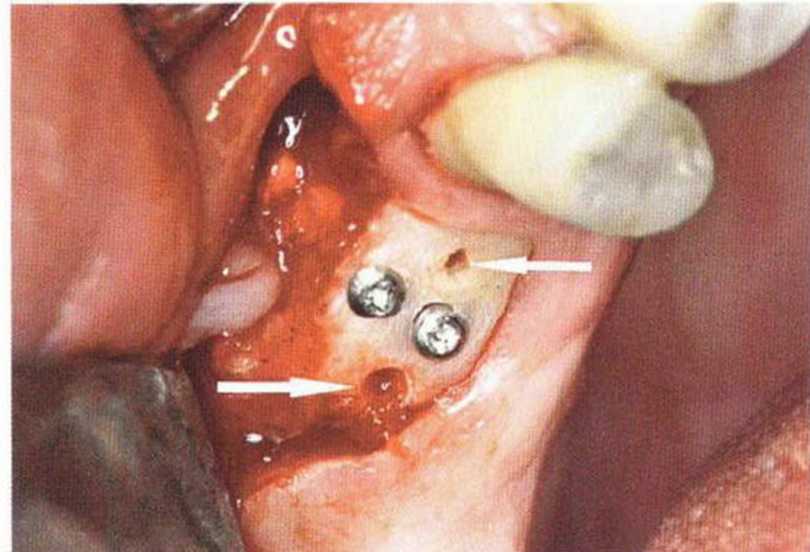
Рис. 9-20а. Ревизия после обнажения окклюзионной части блока через 8 недель после трансплантации. Обнаженная часть тонкого кортикального блока (а) рядом с уже интегрированной костной стружкой (Ь)
Рис. 9-20b. Замена всех контаминированных винтов новыми (стрелки: старое положение винтов)
Рис. 9-20d. Смещение части весибулярного лоскута на нёбную слизистую после ее деэпителизации и рассечения надкостницы
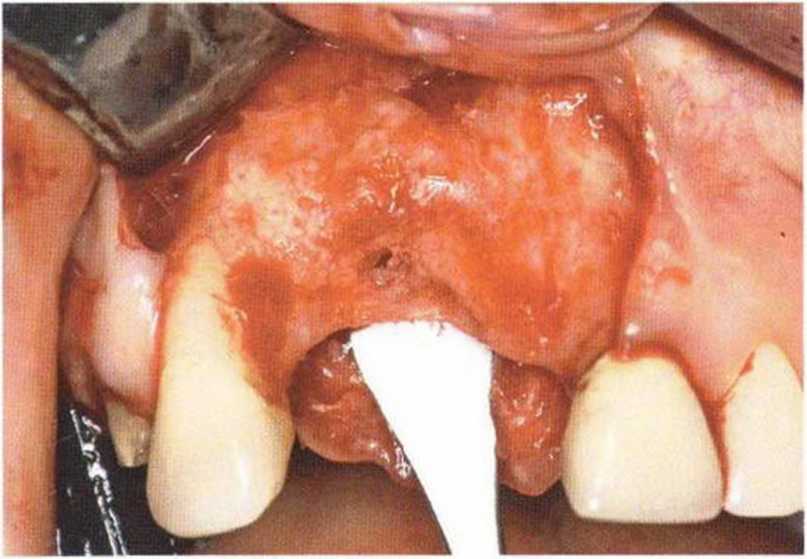
Рис. 9-21 а. Трехмерный костный дефект в переднем отделе верхней челюсти
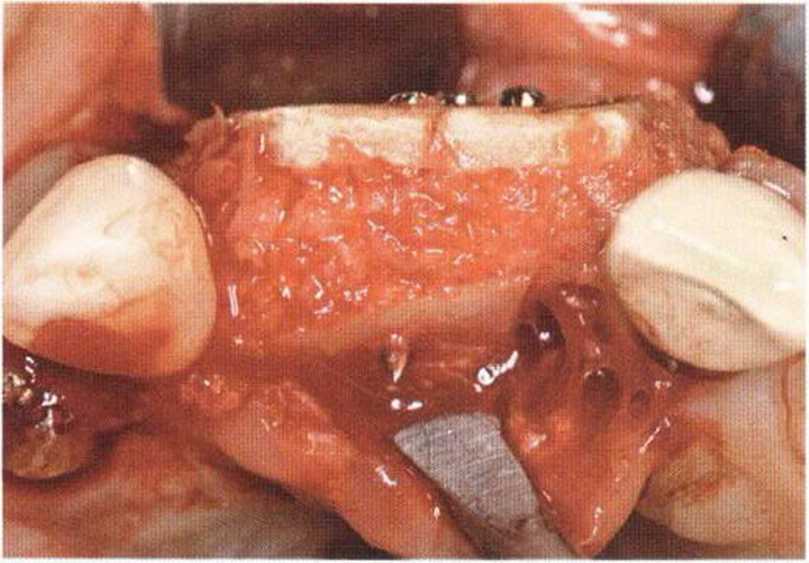
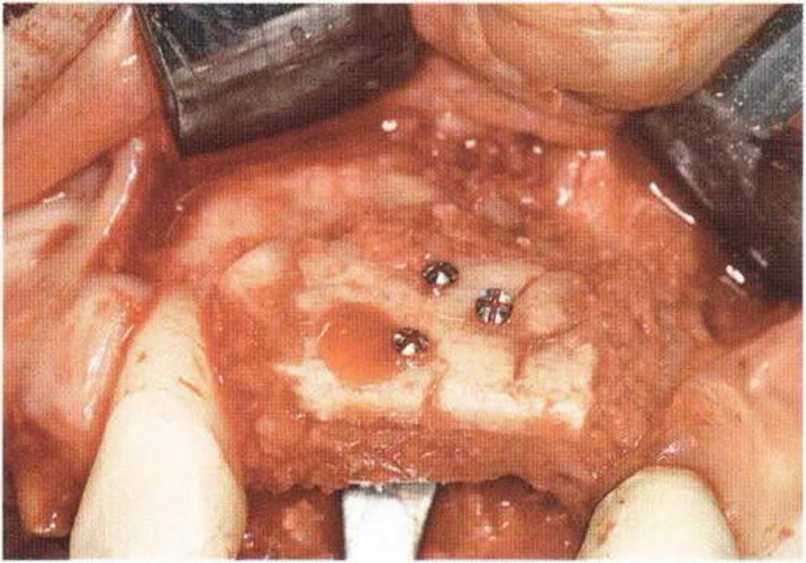
Рис. 9-21Ь. Трехмерная пластика с пересадкой костных трансплантатов из нижней челюсти
Рис. 9-21с. Вестибулярный вид
Рис. 9-21 d. Ортопантомограмма после нескольких операций: трехмерной пластики в переднем отделе верхней челюсти и в области зуба 25 (с синус-лифтингом), а также имплантации с синус-лифтингом и пересадкой латерального костного блока в области зуба 15. Костный трансплантат получен в области зуба 38
Рис. 9-21 е. Вестибулярная экспозиция костного трансплантата через 6 недель после операции
Рис. 9-21f. Незаживающая рана с экспозицией кости также в области зуба 15.
Рис. 9-21 д. Удаление титановой фольги, перекрывающей окно пазухи
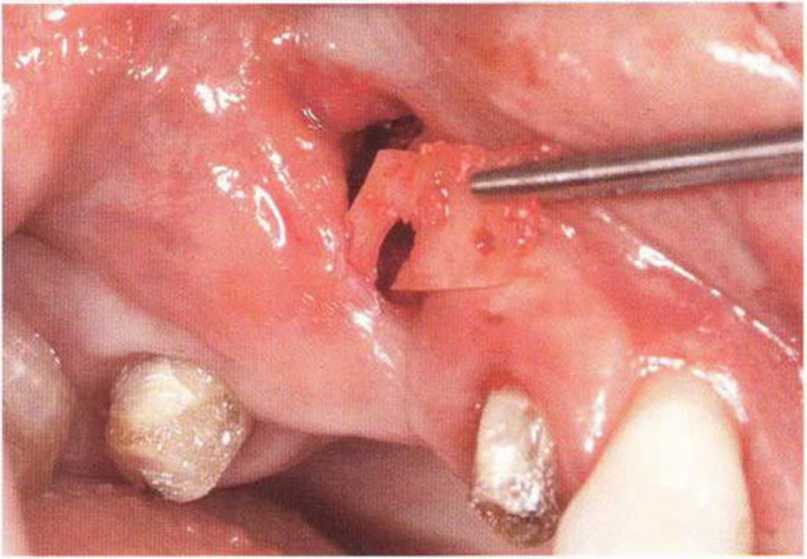
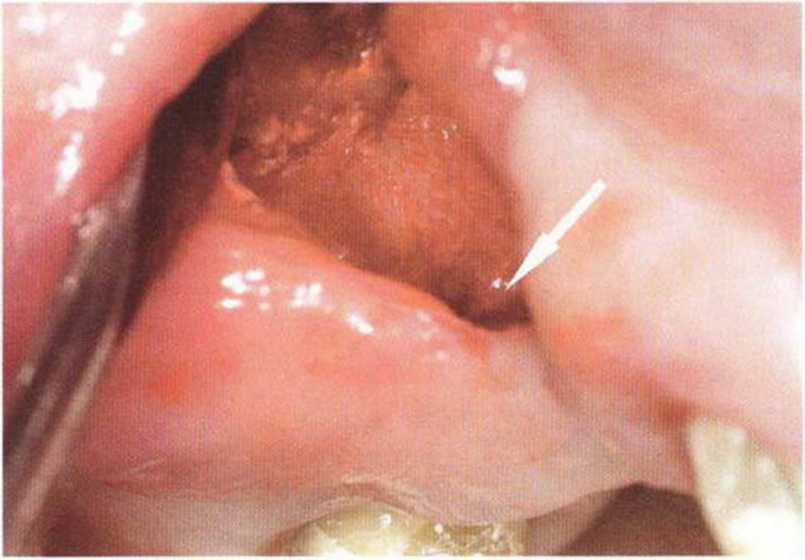
Рис. 9-21 h. Удаление обнаженного костного блока
Рис. 9-21 i. После удаления тонкого блока отмечаются хорошее приживление и кровоснабжение кости
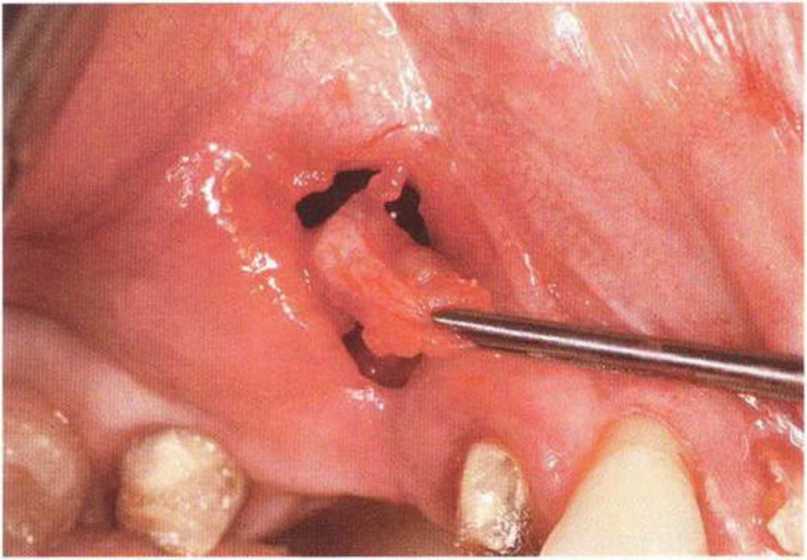
Рис. 9-21 j. Формирование лоскута на питающей ножке из дистальной надкостницы для покрывания обнаженного участка
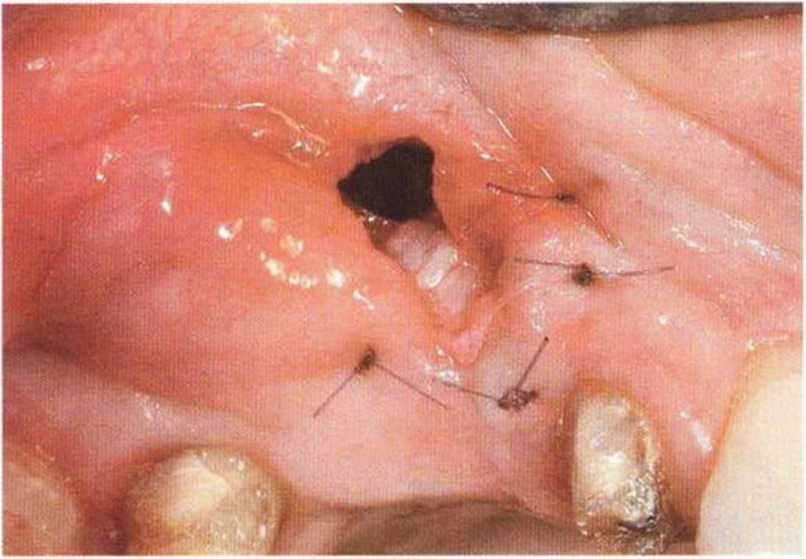
Рис. 9-21 к. Надкостничный лоскут фиксируется резорбируемыми швами (5-0)

Рис. 9-211. Двухслойное закрытие раны
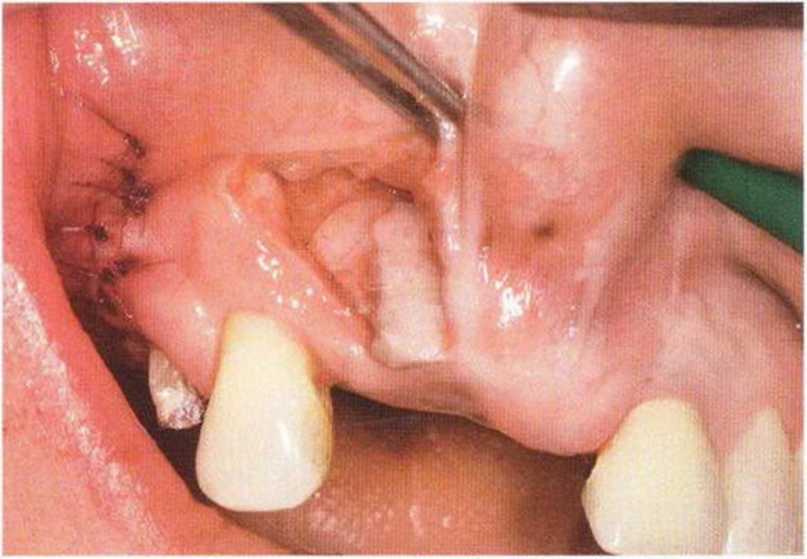
Рис. 9-21 т. Обнаженный фрагмент трансплантата в переднем отделе
Рис. 9-21 п. Укорочение вестибулярного блока
Рис. 9-21 о. Сглаживание острых краев
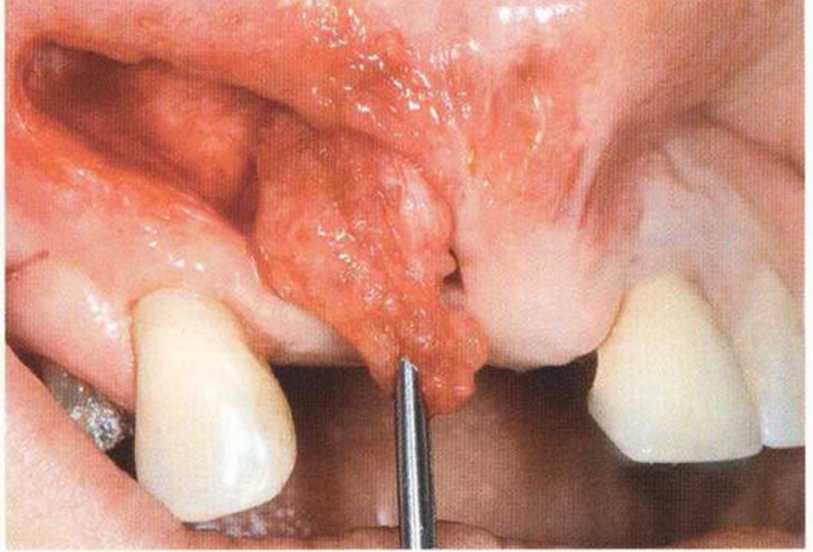
Рис. 9-21 р. Удовлетворительная интеграция оставшейся части трансплантата.
Рис. 9-21q. Отслаивание надкостничного лоскута на ножке из апикальной области
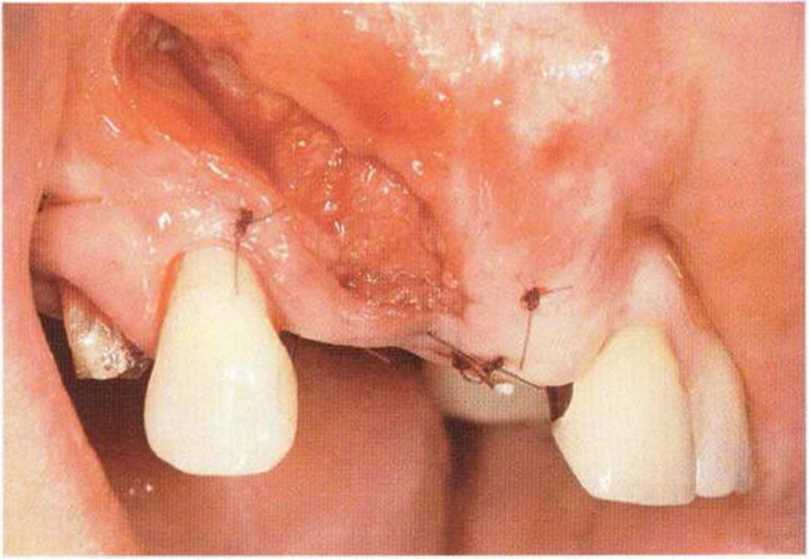
Рис. 9-21 г. Стабилизация надкостничного лоскута над областью обнажения
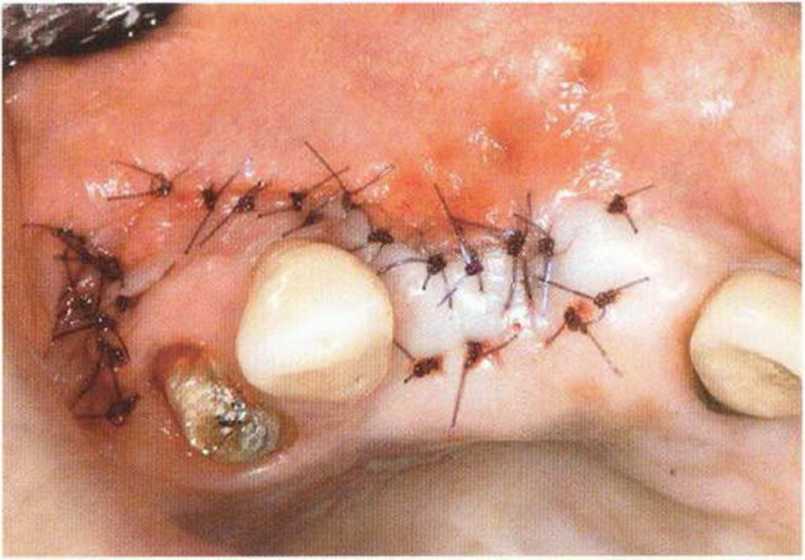
Рис. 9-21 s. Двухслойное закрытие раны
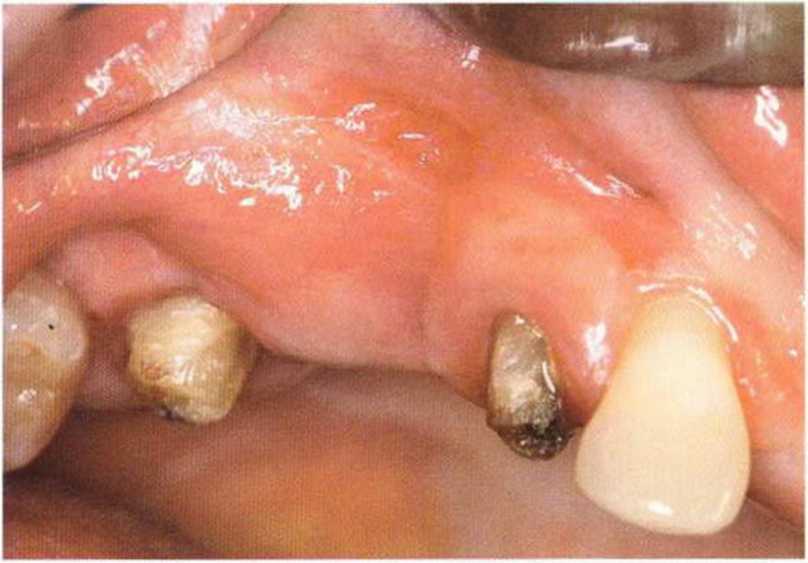
Рис. 9-22а. Удовлетворительное заживление раны в области зуба 15
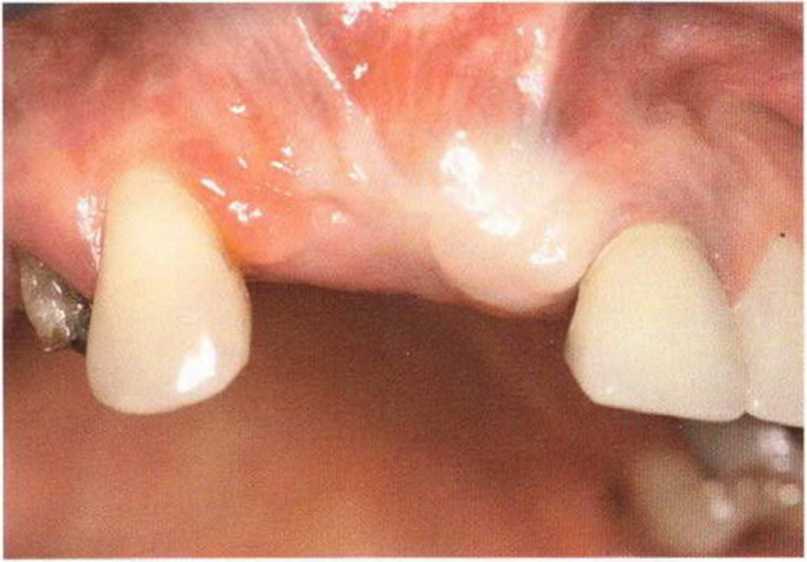
Рис. 9-22Ь. Удовлетворительное заживление раны в переднем отделе
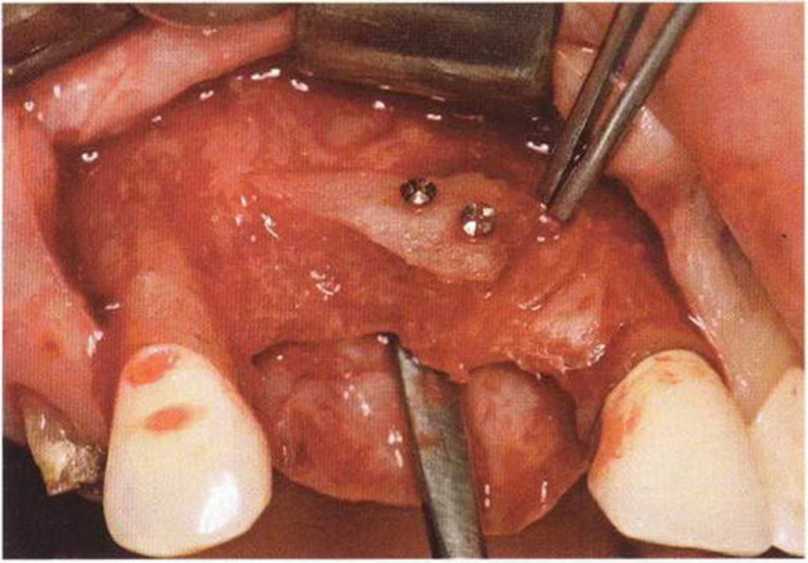
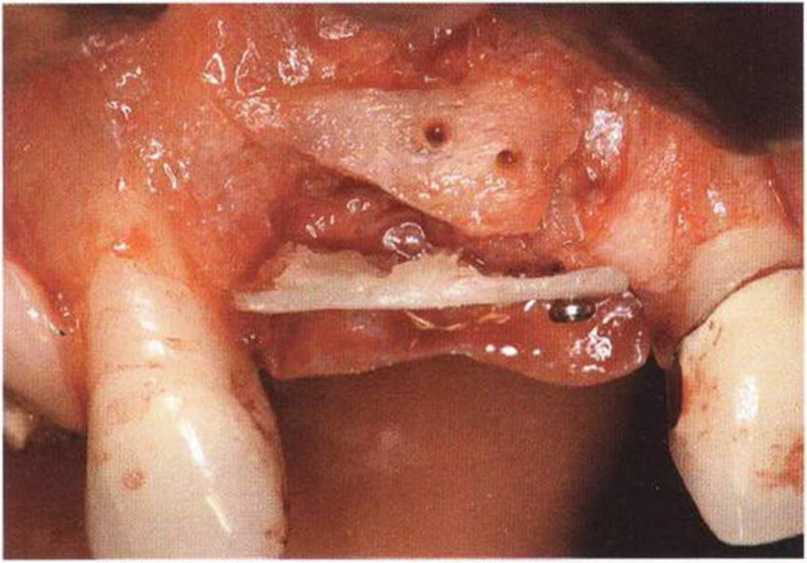
Рис. 9-22с. Объем регенерации недостаточен для оптимальной имплантации.
Рис. 9-22d. Удаление вестибулярных винтов и стабилизация тонкого нёбного костного блока
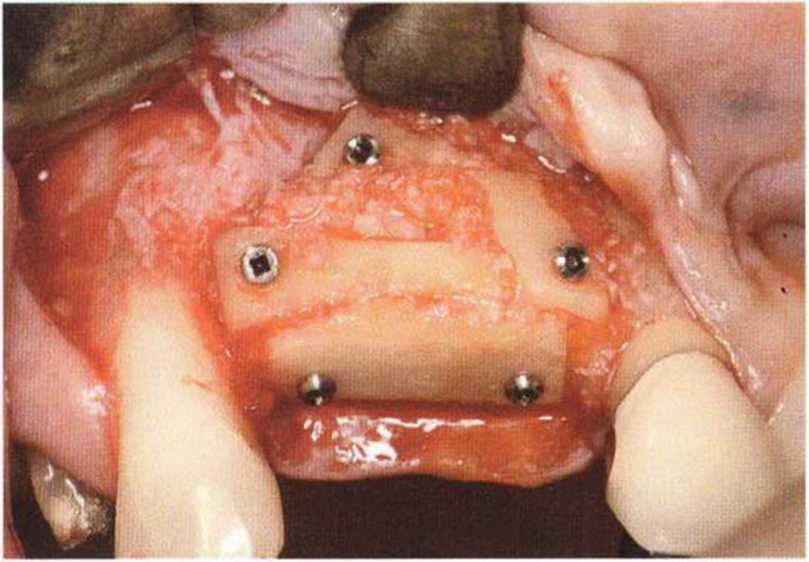
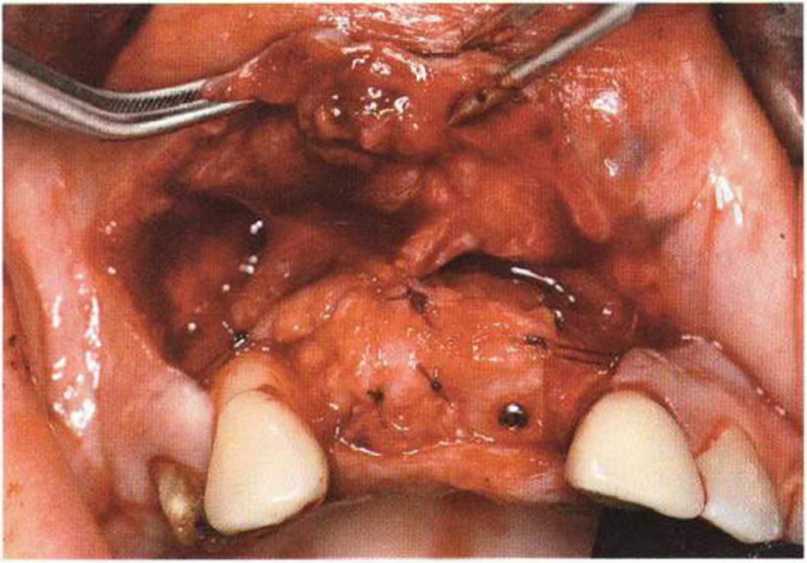
Рис. 9-22f. При перекрывании трансплантатов в качестве первого слоя применяется передний надкостничный лоскут на ножке
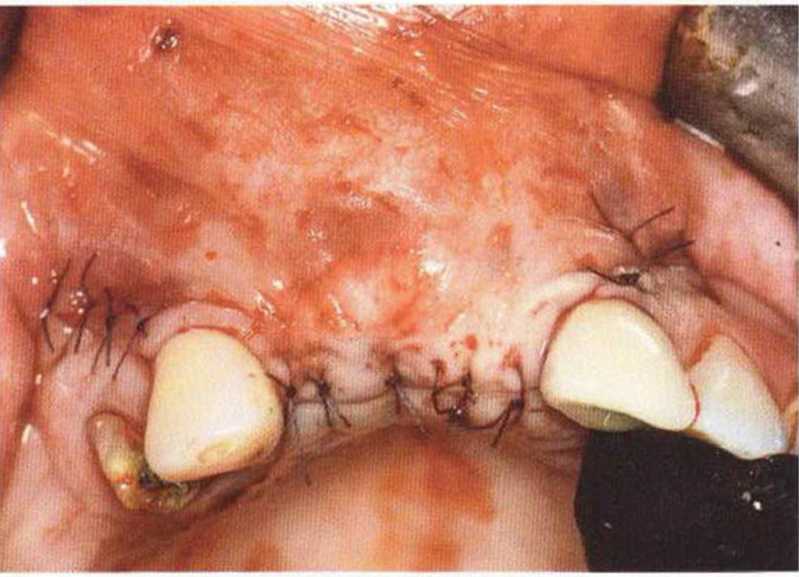
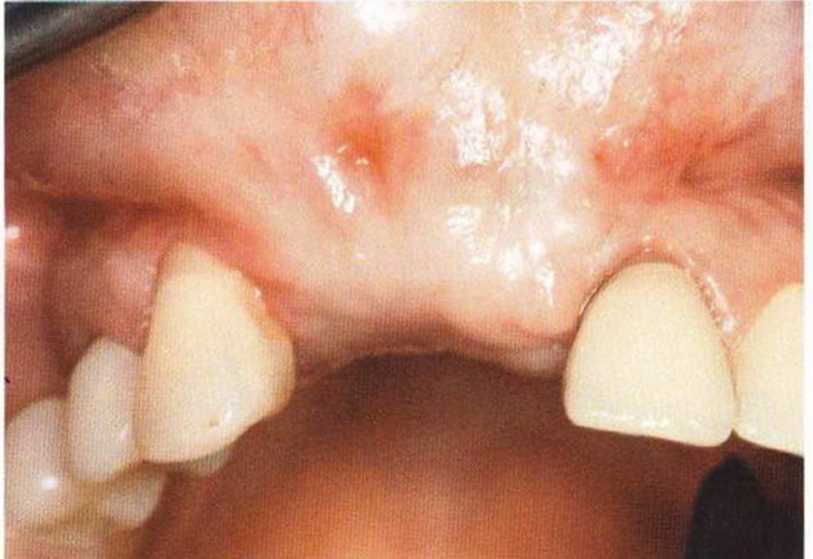
Рис. 9-22g. Двухслойное закрытие раны
Рис. 9-22И. Клиническая ситуация через 3 мэс после операции
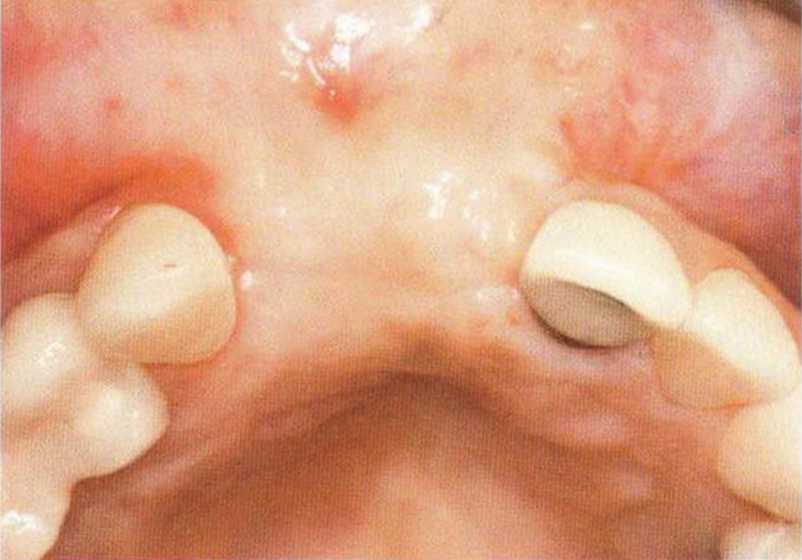
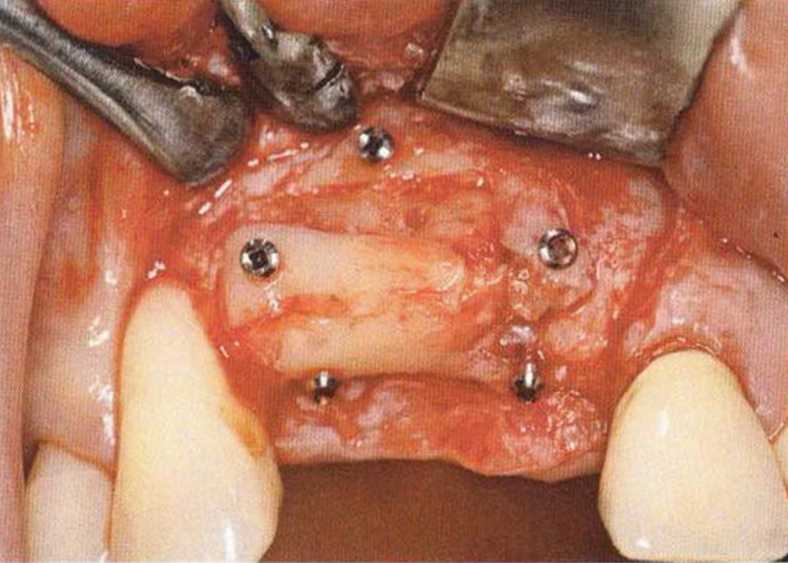
Рис. 9-22i. Окклюзионный вид
Рис. 9-22j. Область регенеративного вмешательства
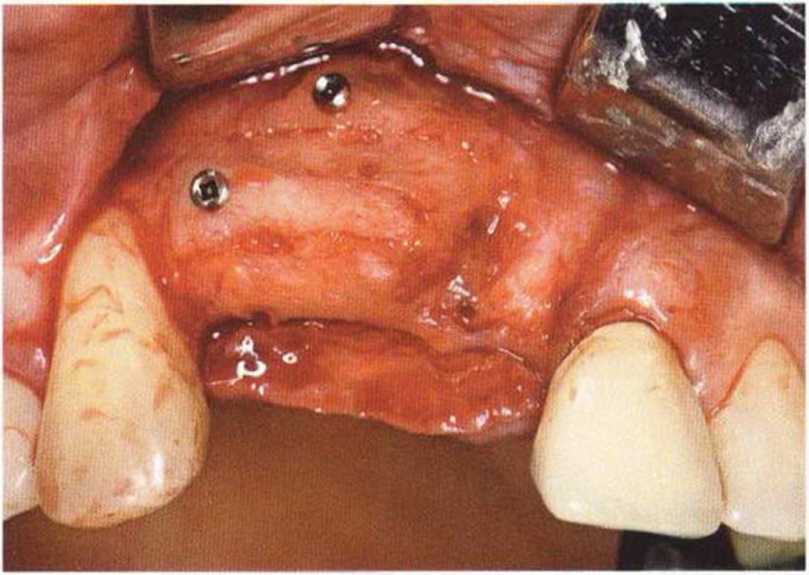
Рис. 9-22к. Неполная регенерация в мезиальной области
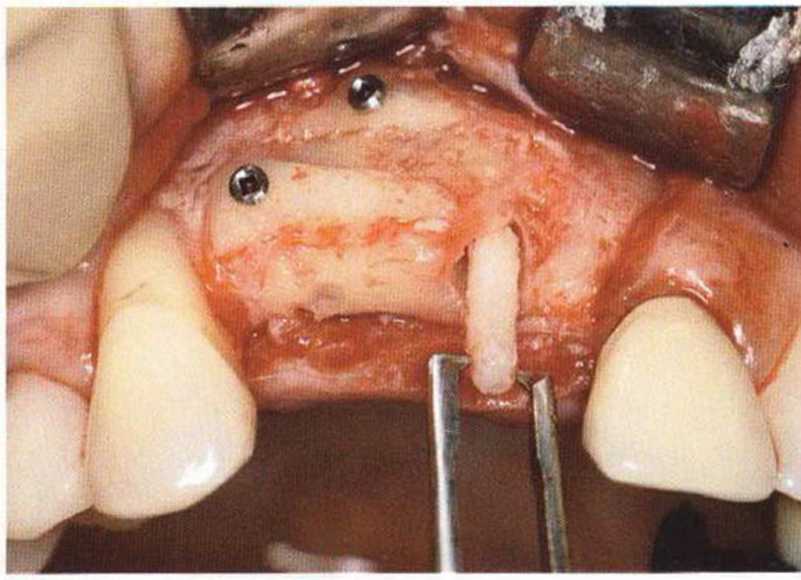
Рис. 9-221. Получение костной ткани с помощью трепана
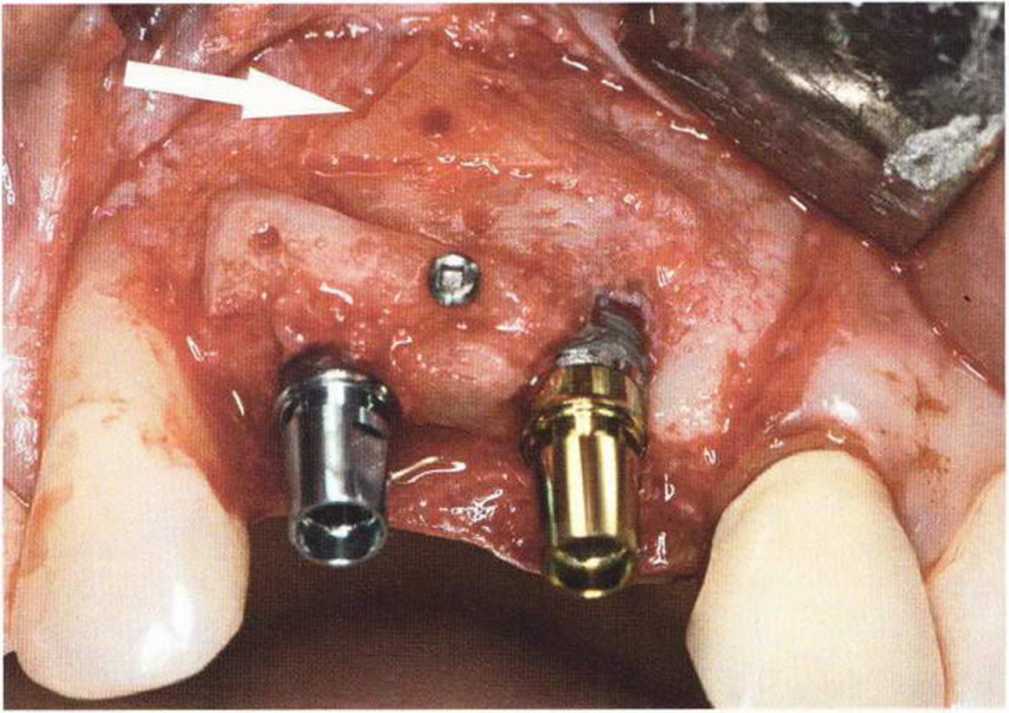
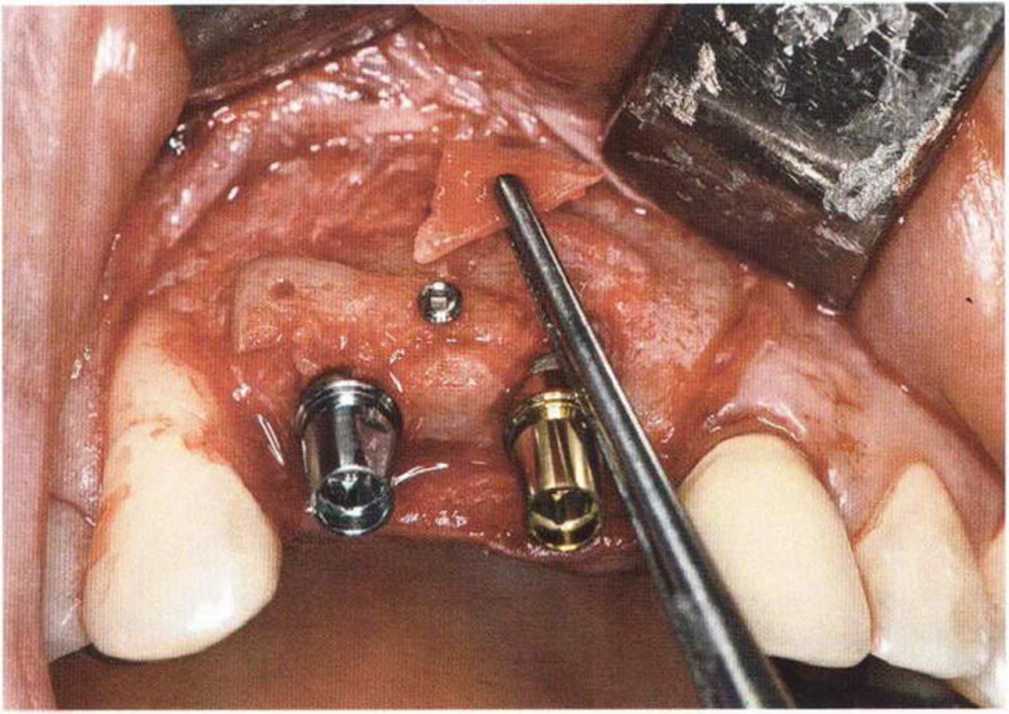
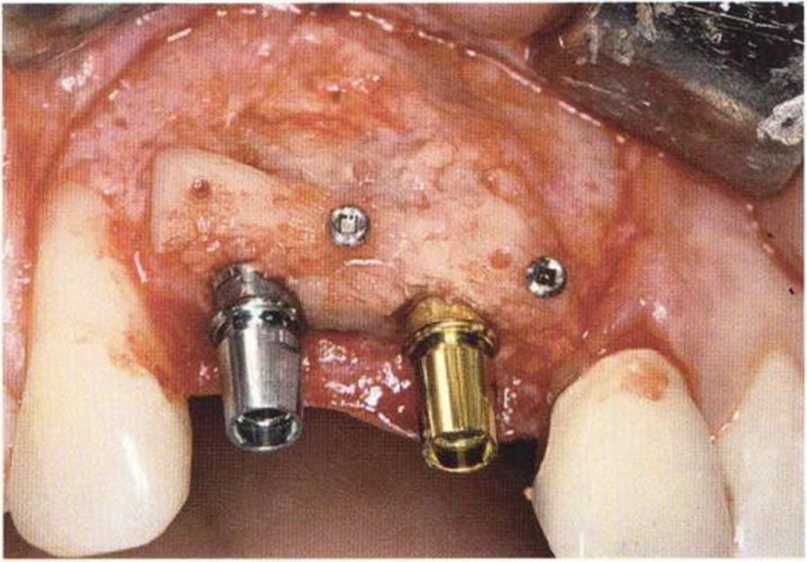
Рис. 9-22т. Установка двух имплантатов при отсутствии костной ткани с вестибулярной стороны мезиального имплантата. В апикальной области отмечается избыток кости.
Рис. 9-22п. Получение апикального костного блока
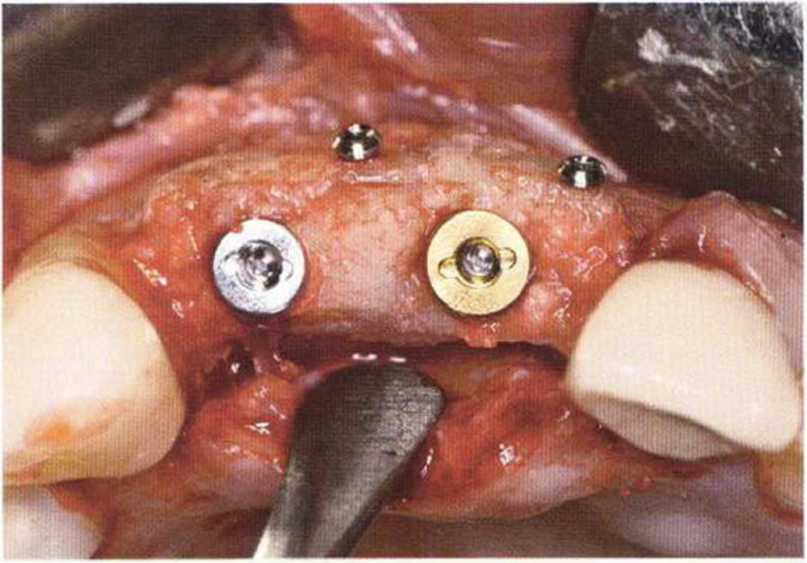
Рис. 9-22р. Окклюзионный вид установленных имплантатов
Рис. 9-22q. Препарирование расщепленного лоскута из вестибулярной надкостницы.
Рис. 9-22г. Перекрывание имплантатов и кости надкостничным лоскутом
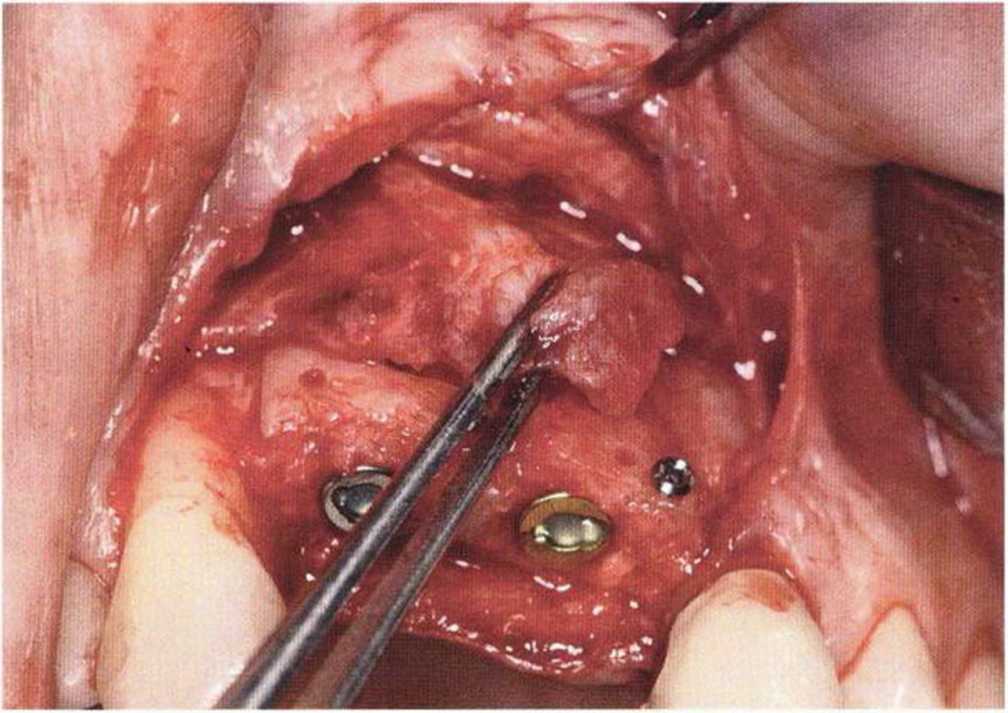
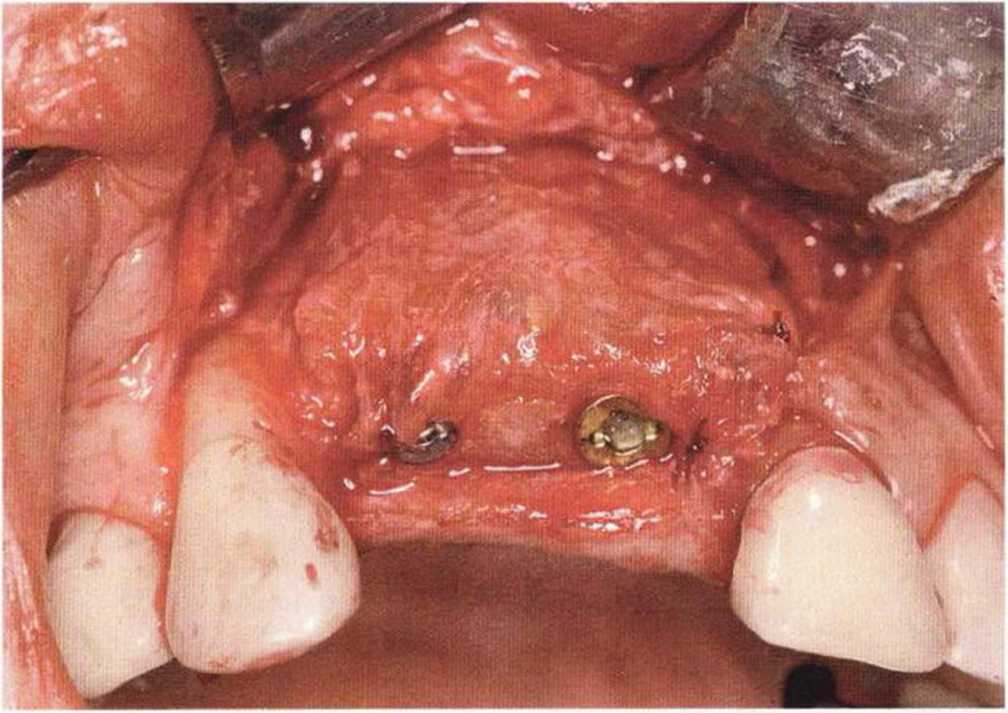

Рис. 9-22s. Нёбный соединительнотканный трансплантат стабилизируется вестибулярно на надкостнице
Рис. 9-22t. Ушивание лоскута над соединигельнотканным трансплантатом
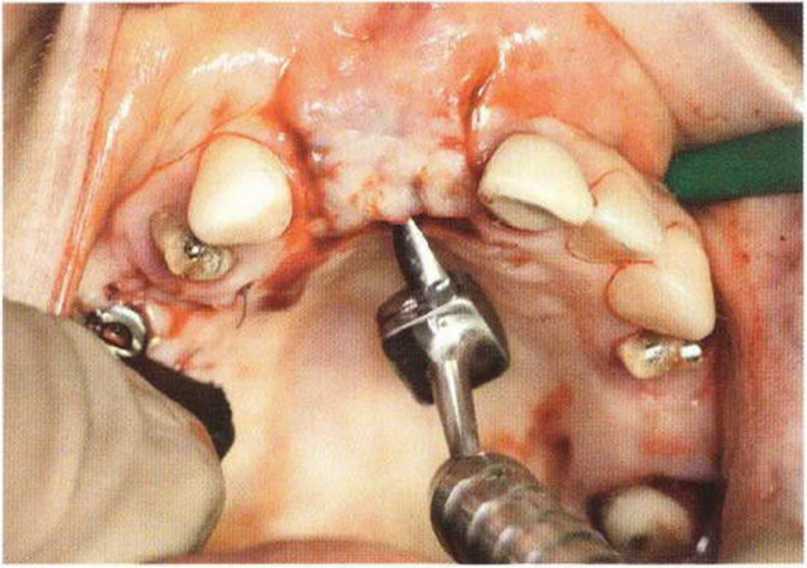
Рис. 9-23а. Клиническая ситуация через 3 мес после операции.
Рис. 9-23Ь. Формирование апикально смещенного лоскута
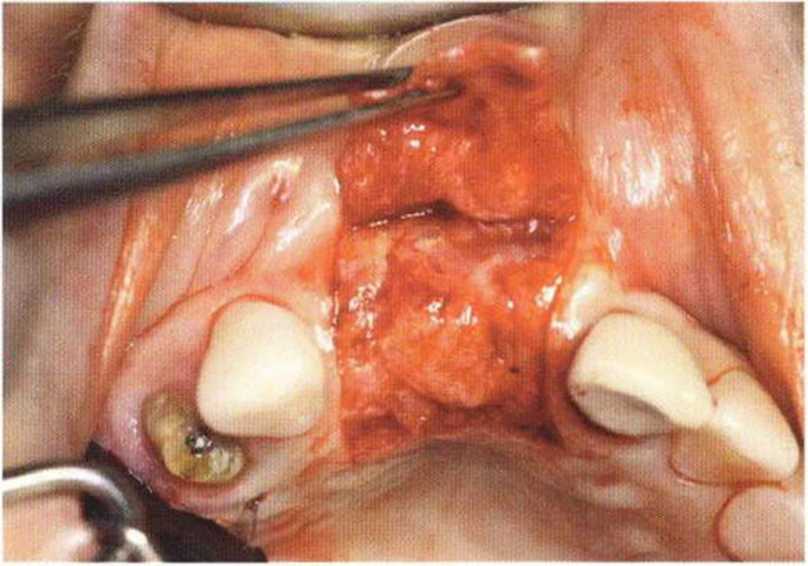
Рис. 9-23с. Наднадкостничное препарирование лоскута
Рис. 9-23d. Раскрытие имплантатов и установка перфорированных формирователей десны
Рис. 9-23f. Апикально смещенный лоскут
Рис. 9-23е. Окклюзионный вид с полноценным объемом альвеолярного гребня
Рис. 9-23h. Окклюзионный вид
Рис. 9-23д. Клиническая ситуация через 5 недель после операции
Рис. 9-23i. После установки абатментов
Рис. 9-23j. Окончательное протезирование (также в области зубов 15 и 25)
Рис. 9-23к. Ортопантомограмма после окончательного протезирования
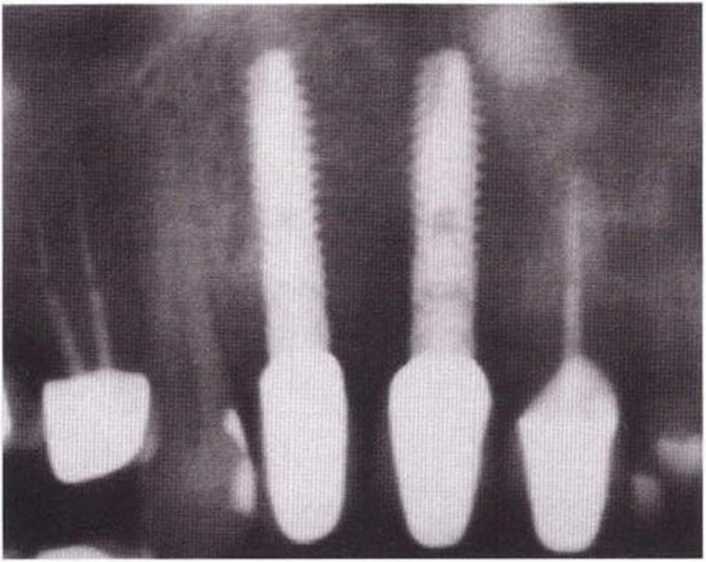
Рис. 9-23I. Передний отдел крупным планом
Обнажение трансплантата после установки имплантатов остается серьезным фактором риска. На данном этапе реваскуляризация кортикальной кости не завершена, поэтому ее экспозиция может привести к инфицированию с риском секвестрации всего трансплантата. В таких случаях ранее описанный биологический принцип пересадки костного блока обеспечивает некоторые преимущества.
Как правило, утрачивается лишь около 1 мм кортикального слоя трансплантата без серьезной угрозы для оставшегося трансплантата или имплантатов (рис. 9-24a-9-24h).
Риск секвестрации вследствие обнажения трансплантата сохраняется даже после установки окончательного протеза. Особенно высокий риск обнажения кости существует на участках давления протеза (рис. 9-25а-9-25к), поэтому после трансплантации костных блоков необходимо изготовить протезы с опорой только на зубы или имплантаты без контакта с десной.
Лишь таким образом можно исключить давление, приводящее к тотальной неудаче всего лечения.
Обнажение костной ткани на участках повышенного давления также возможно даже при изготовлении несъемного протеза. Данное осложнение встречается редко и возникает при избыточном давлении промежуточной части мостовидного протеза или края коронки на тонкую краевую десну между имплантатами (рис. 9-26а-9-26с).
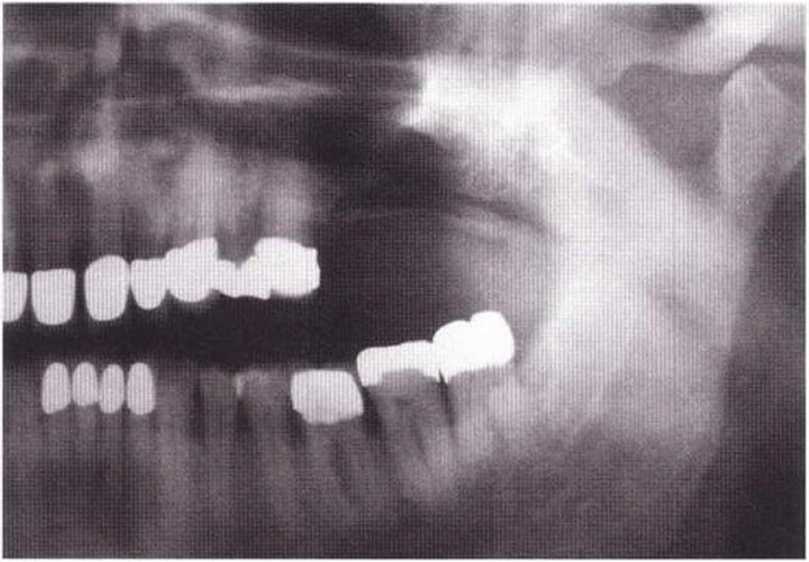
Рис. 9-24а. Вертикальный костный дефект верхней челюсти слева
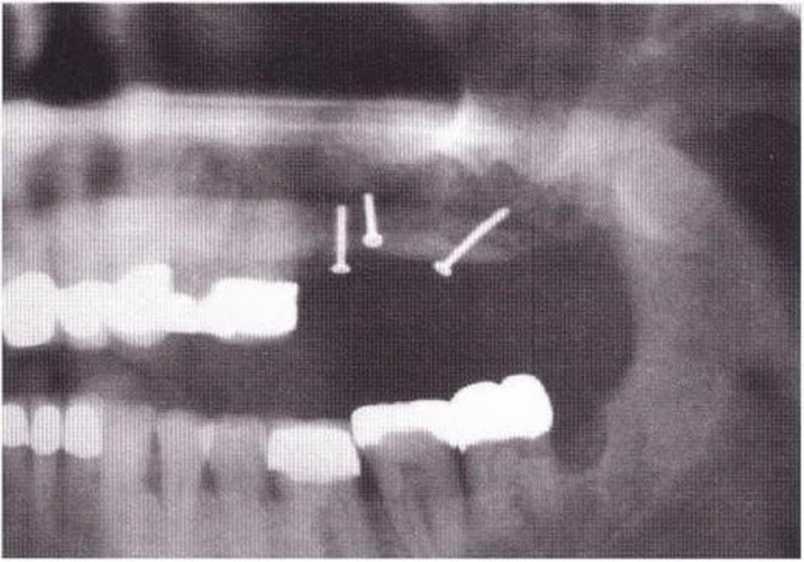
Рис. 9-24Ь. Ортопантомограмма после трехмерной костной пластики и синус-лифтинга с пересадкой нижнечелюстных костных трансплантатов
Рис. 9-24с. Клиническая ситуация через 4 мес после операции. Установка двух имплантатов диаметром 4,5 мм
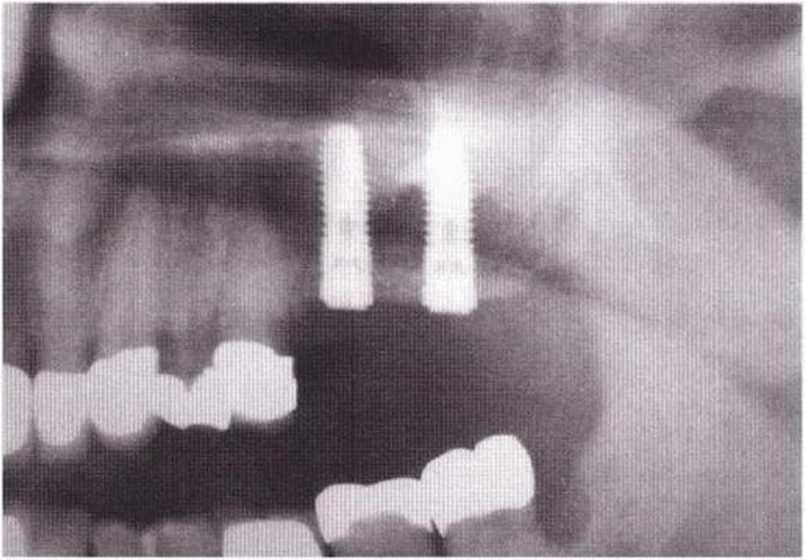
Рис. 9-24d. Ортопантомограмма после имплантации
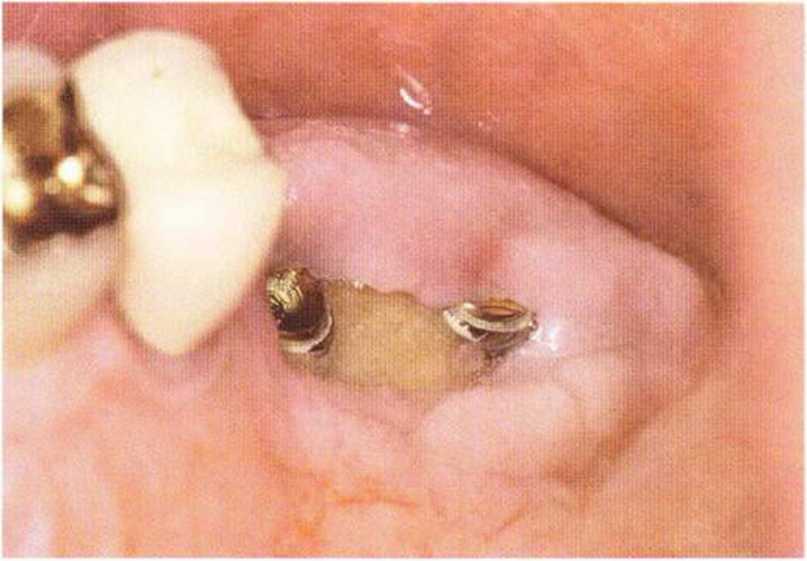
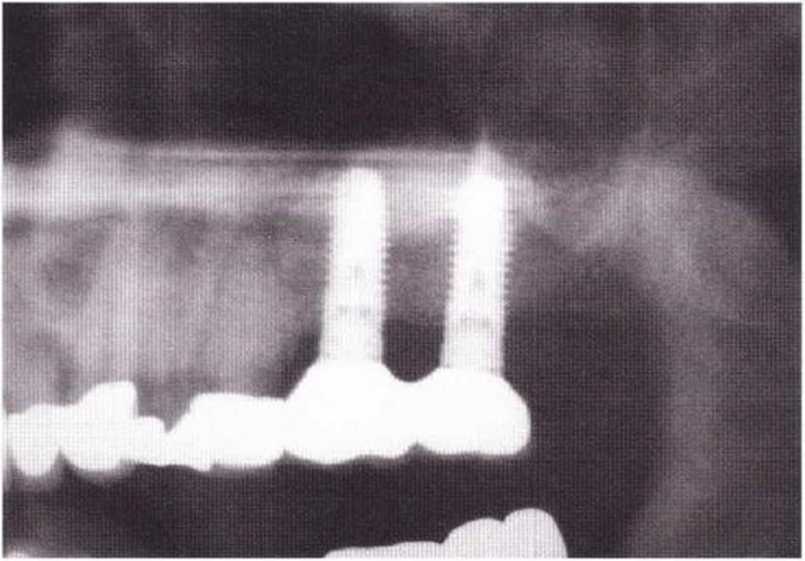
Рис. 9-24е. Некроз лоскута с обнажением кости через 10 дней после установки имплантата вследствие значительной травмы лоскута и неправильного ушивания. В течение 2 недель до улучшения кровоснабжения мягких тканей проводили местную терапию хлоргексидинсодержащим гелем. Затем выполнили ревизию с удалением тонкого кортикального слоя до обнажения хорошо кровоснабжаемой новообразованной кости.
Рис. 9-24f. Ортопантомограмма через 3 года после протезирования: стабильное состояние костной ткани, несмотря на удаление тонкого кортикального слоя
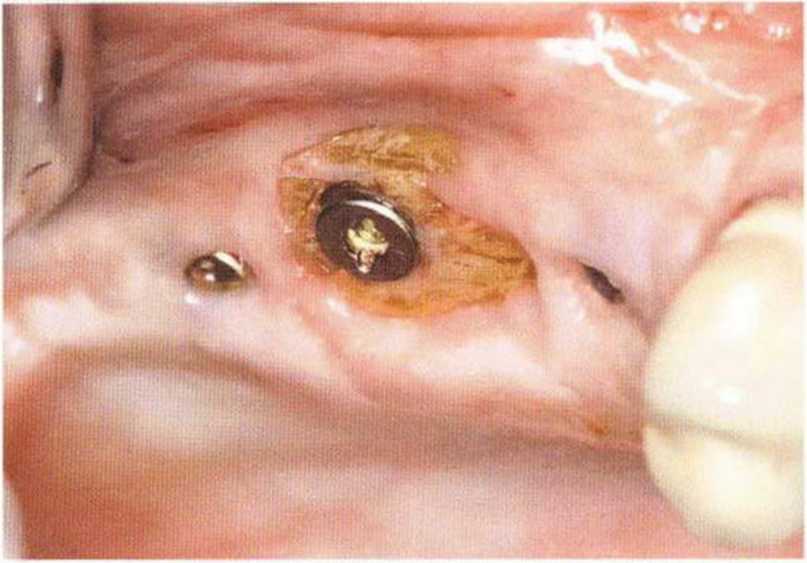
Рис. 9-25а. Обнажение имплантата и кости вследствие обширного некроза лоскута под давлением протеза. Состояние через 4 мес после трехмерной пластики для увеличения высоты альвеолярного гребня
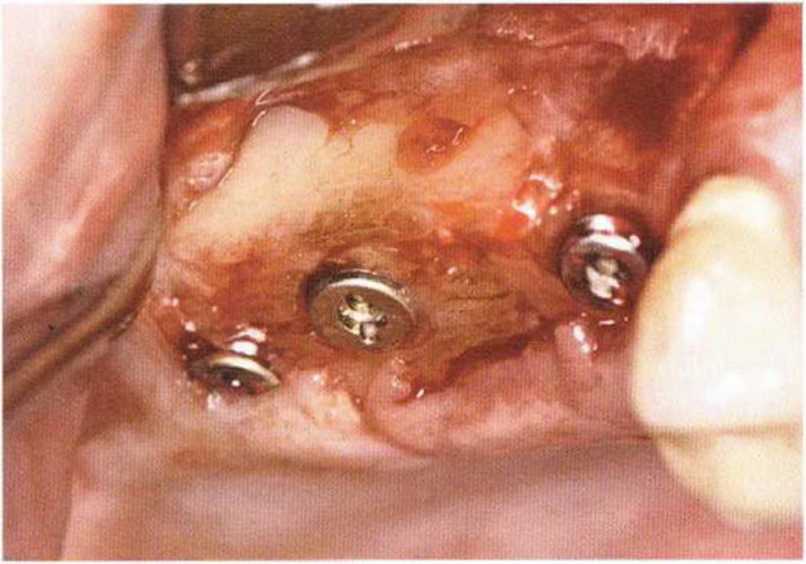
Рис. 9-25Ь. Раскрытие почти не кровоснабжаемого некротизированного компактного слоя
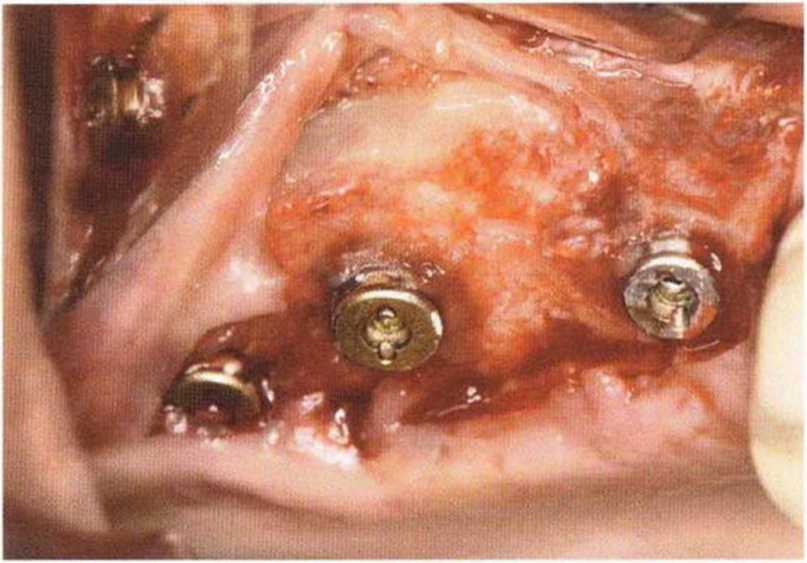
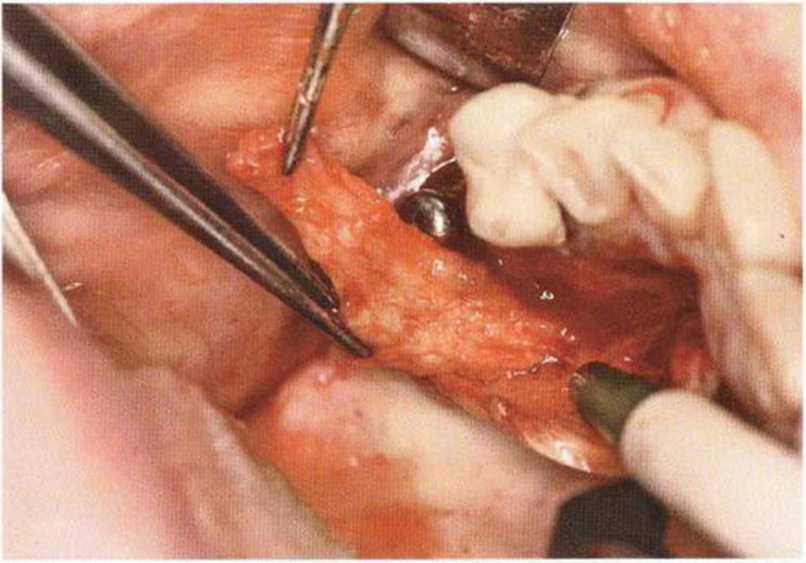
Рис. 9-25с. После удаления тонкой кортикальной пластинки определяется костный слой с лучшим кровоснабжением.
Рис. 9-25d. Препарирование дистального соединительнотканного лоскута на питающей ножке для ушивания раны
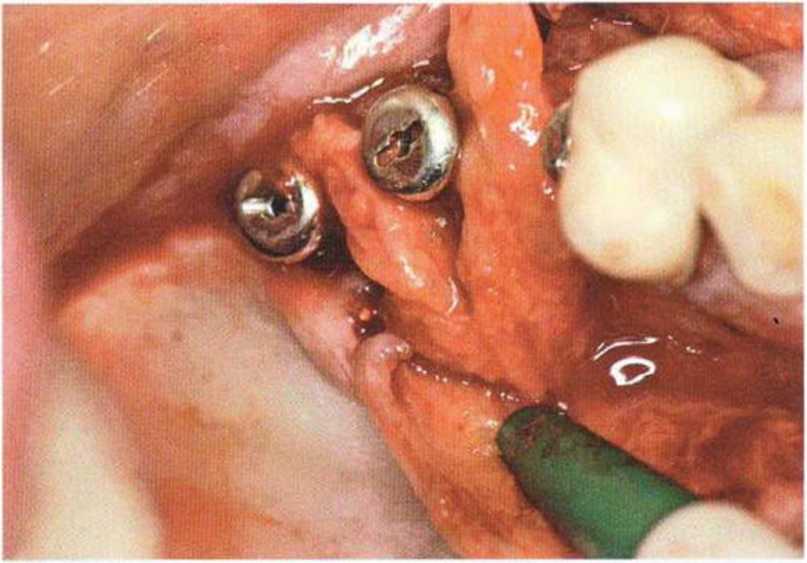
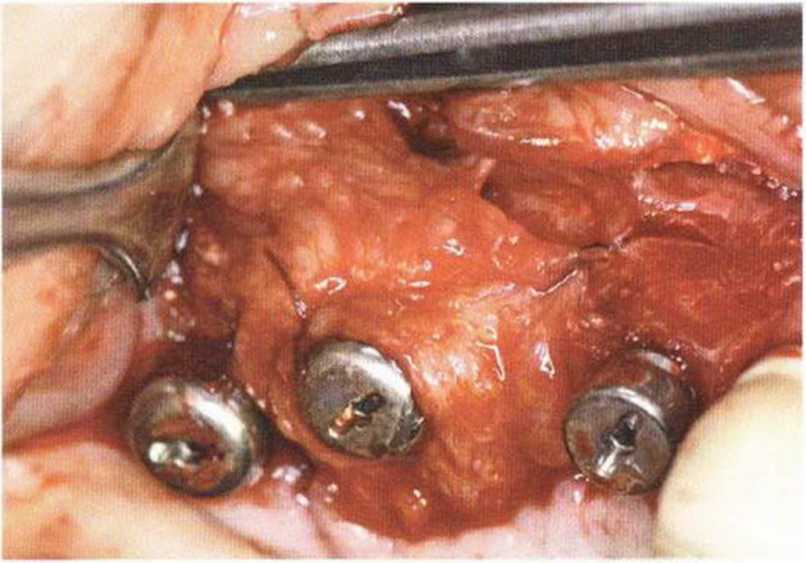
Рис. 9-25е. Соединительнотканный лоскут разделен для перекрывания двух участков.
Рис. 9-25f. Полное устранение дефицита мягких тканей с помощью лоскута на ножке
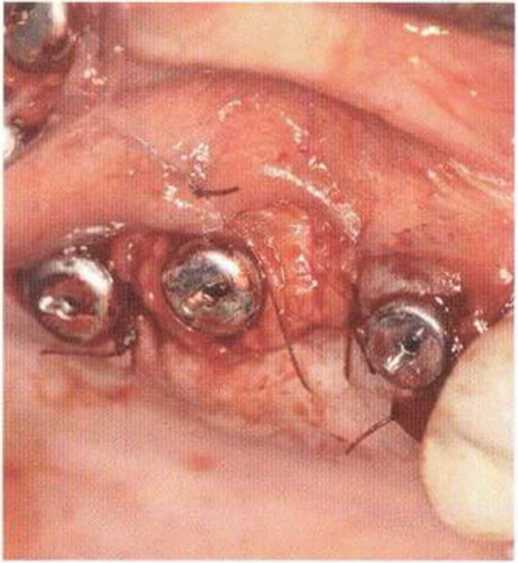
Рис. 9-25д. После репозиции слизисто-надкостничного лоскута и закрытия раны
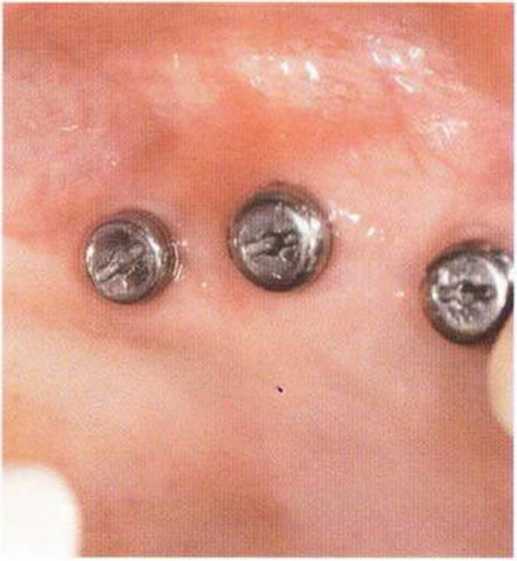
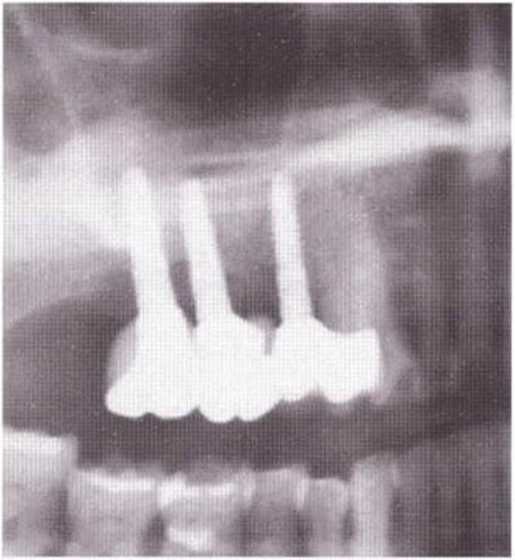
Рис. 9-25h. Клиническая ситуация через 4 недели.
Рис. 9-25L Ортопантомограмма через 2 года после протезирования
Рис. 9-25j. Обнажение кости в области давления протеза через 1 год после увеличения высоты альвеолярного гребня с помощью трансплантатов из гребня подвздошной кости и одновременной имплантацией
Рис. 9-251. Клиническая картина после ревизии с удалением секвестров. Проведено достаточное сошлифовывание придесне вой части протеза
Рис. 9-25к. Частично опирающийся на десну съемный протез верхней челюсти
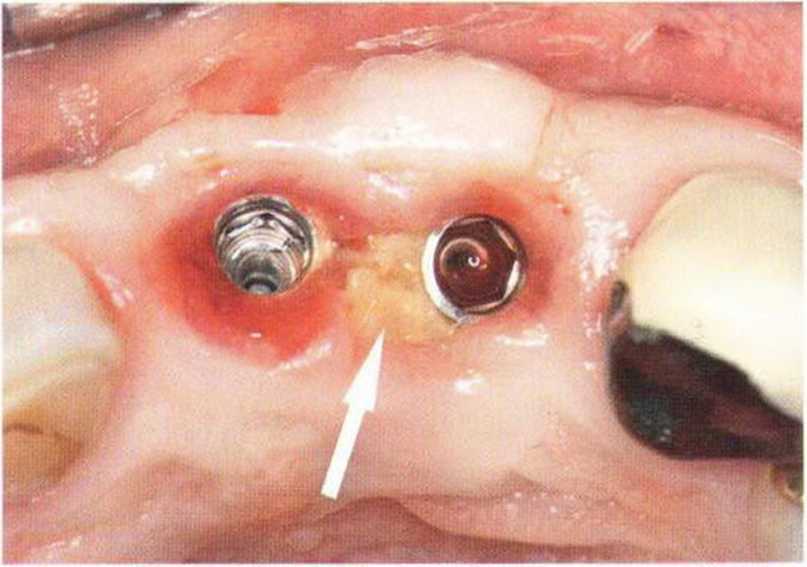
Рис. 9-26а. Обнажение кости между имплантатами через 1 год после увеличения высоты альвеолярного гребня с пересадкой нижнечелюстных костных трансплантатов. Причиной является повышенное давление при избыточном объеме костной ткани
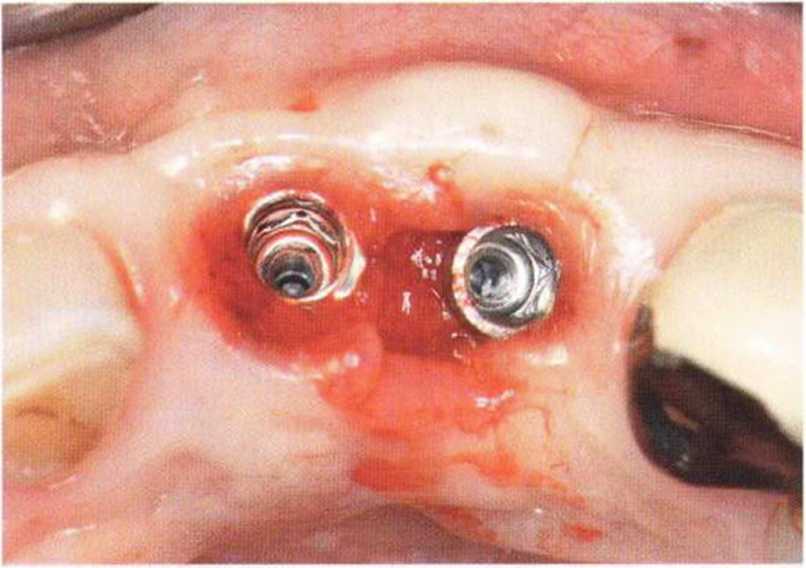
Рис. 9-26Ь. Удаление мелкого костного секвестра. Под кортикальным слоем толщиной 1 мм находилась хорошо кровоснабжаемая регенерированная кость
В процессе заживления раны объем трансплантата может уменьшиться на 25 %, при этом надлежащие мягкие ткани смещаются в направлении резорбции. Однако, несмотря на усадку костной ткани и снижение уровня мягких тканей, фиксирующие винты остаются в исходном положении и могут проникать в покровную слизистую (рис. 9-27а и 9-27Ь).
Обычно винты хорошо воспринимаются мягкими тканями и не вызывают воспаления. Обнажение винтов возникает, как правило, через 2-3 мес после операции, когда костный блок стабилизируется и необходимость в них уже отсутствует. Удаление обнаженных винтов на этом этапе не представляет сложностей, а заживление перфораций мягких тканей завершается в течение нескольких дней.
Причина обнажения винтов на ранней стадии заживления заключается в очень тонком биотипе десны или неполноценном заживлении мягких тканей. При закрытом состоянии остальной части трансплантата обнаженные головки винтов рекомендуется регулярно обрабатывать хлоргекси-динсодержащим гелем. Это позволяет сохранить стабильность винтов и всего трансплантата. В процессе заживления вокруг обнаженных винтов, как правило, отмечаются незначительная резорбция и образование грануляционной ткани (рис. 9-27с и 9-27d).
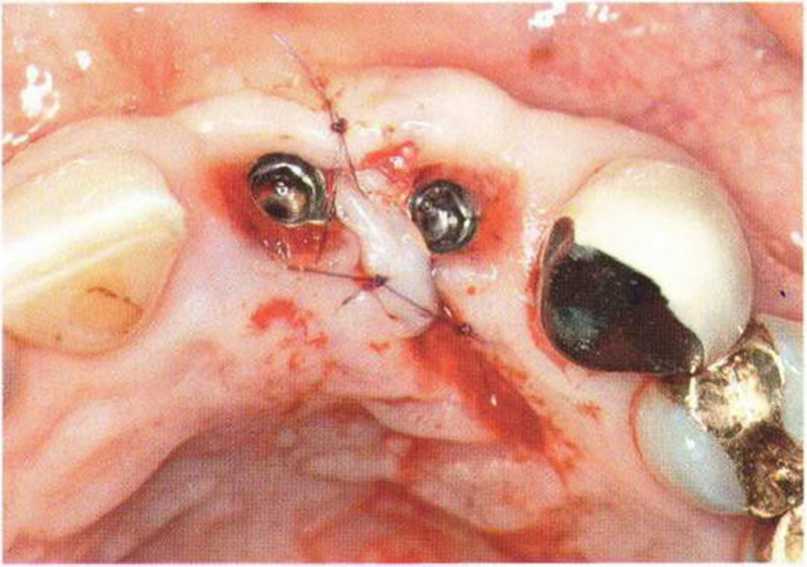
Рис. 9-26с. Ротированный лоскут для устранения дефицита мягких тканей между имплантатами
Рис. 9-27а. Обнажение винта с типичным отсутствием воспалительной реакции
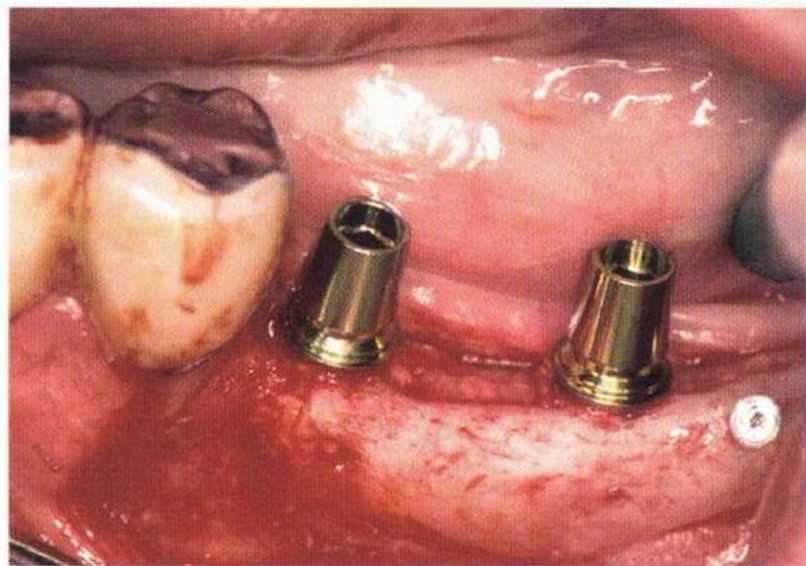
Рис. 9-27Ь. Обнаженный винт не влиял на состояние трансплантата, что позволило установить два имплантата
Рис. 9-27с. Обнаженный винт через 3 мес после увеличения высоты альвеолярного отростка
Рис. 9-27d. В области трансплантации установлены три имплантата диаметром 3,8 мм. В области обнаженного винта (стрелка) произошла незначительная резорбция трансплантата
В зависимости от типа применяемой мембраны нередко возможна полная утрата трансплантата, а применение мембран в целом сопровождается повышением частоты осложнений. ° В частности, мембраны из расширенного политетрафторэтилена (р-ПТФЭ) быстро пропитываются слюной, что приводит к контаминации раны. Даже несмотря на первичное отсутствие экспозиции мембраны при использовании специальных методов ушивания раны (например, при двухслойном ушивании), сохраняется риск бактериальной колонизации мембраны, что ведет к формированию абсцесса или свища после отмены антибиотиков (рис. 9-28а).
В итоге требуется ревизия раны с удалением мембраны и трансплантата со всеми сопутствующими негативными последствиями (рис. 9-28b-9-28d).
По сравнению с другими нерезорбируемыми мембранами, титановые ассоциируются с меньшим риском инфицирования. При раннем обнажении титановой фольги (рис. 9-29а) и отсутствии экссудации возможно наблюдение за раной, обрабатываемой.
Рис. 9-28а. Множественное образование свищей с выделением гноя вследствие инфицирования нерезорби-руемой мембраны (Gore-Tex) на верхней челюсти справа хлоргексидинсодержащим гелем. Пациент самостоятельно проводит ежедневную обработку гелем до удаления мембраны через 3-4 недели.
При позднем обнажении титановой фольги своевременное удаление позволяет исключить или значительно ограничить резорбцию трансплантата (рис. 9-29Ь и 9-29с).
Резорбируемые мембраны, напротив, ассоциируются с меньшими первичными осложнениями. В случае экспозиции коллагеновой мембраны заживление раны после непродолжительного лечения с помощью хлоргексидинсодержащего геля происходит, как правило, спонтанно. Однако, несмотря на это, утрачивается некоторый объем трансплантата (рис. 9-30а—9-30i). В целом резорби-руемые мембраны менее эффективны, чем нере-зорбируемые, но в процессе резорбции мембраны рассасывается не только она, но и все прилегающие резорбируемые структуры, в том числе костное ложе и аутогенный костный трансплантат (рис. 9-31a-9-31d).
Рис. 9-28Ь. ИКР вокруг имплантатов с помощью фрагментов аутогенной кости и нерезорбируемых мембран (Gore-Tex)

Рис. 9-28с. Обнажение мембраны с вестибулярной и нёбной сторон через 8 недель после вмешательства.
Рис. 9-28d. Эстетический дефект после протезирования. Большая часть трансплантата и принимающего ложа утрачена в результате обнажения и инфицирования мембраны
Рис. 9-29а. Обнажение титановой фольги через 10 дней после операции
Рис. 9-29Ь. Обнажение титановой фольги через 3 мес после регенеративного вмешательства
Рис. 9-29с. Под удаленной фольгой находится трансплантат с полноценным кровоснабжением
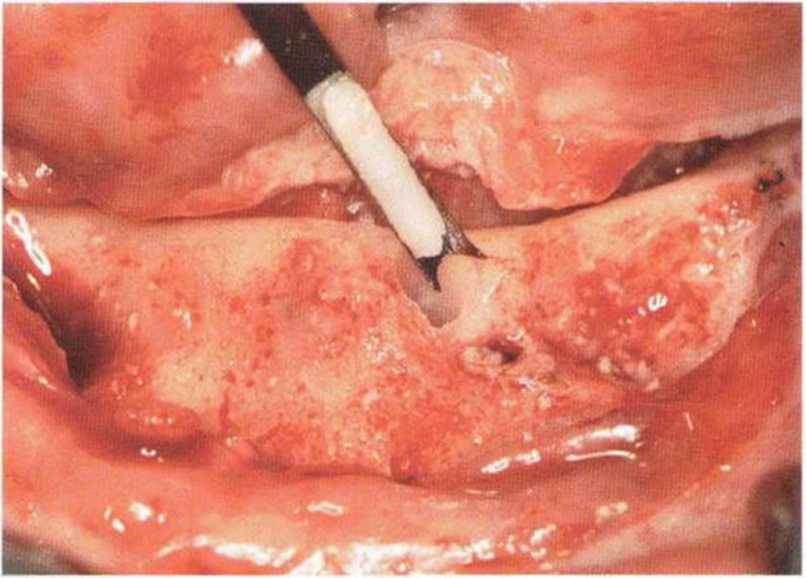
Рис. 9-30а. Получение кости трепаном из атрофированного переднего отдела нижней челюсти
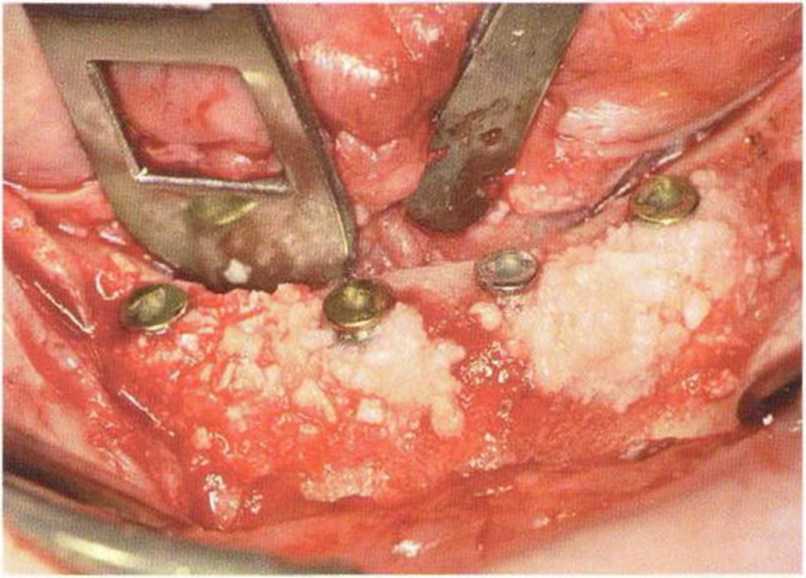
Рис. 9-30с. Покрывание открытой резьбы локальной костной тканью
Рис. 9-30b. Установка четырех имплантатов при вестибулярном дефиците костной ткани в переднем отделе нижней челюсти
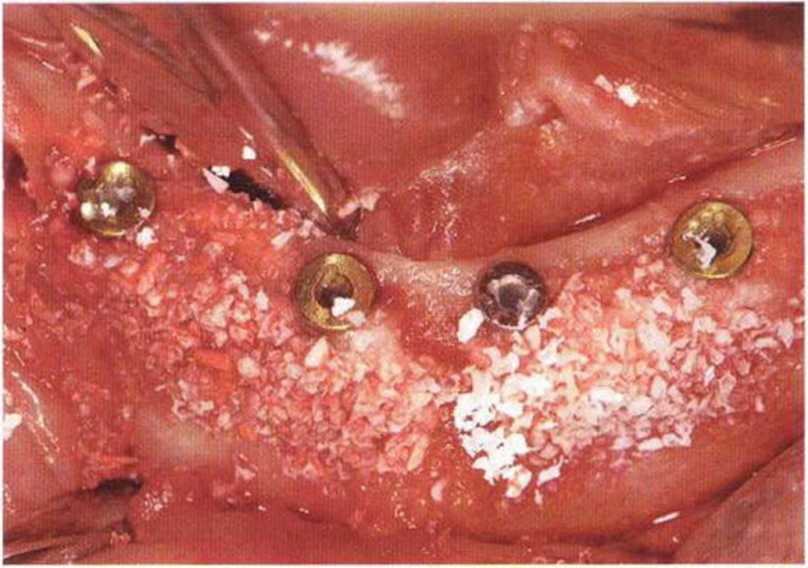
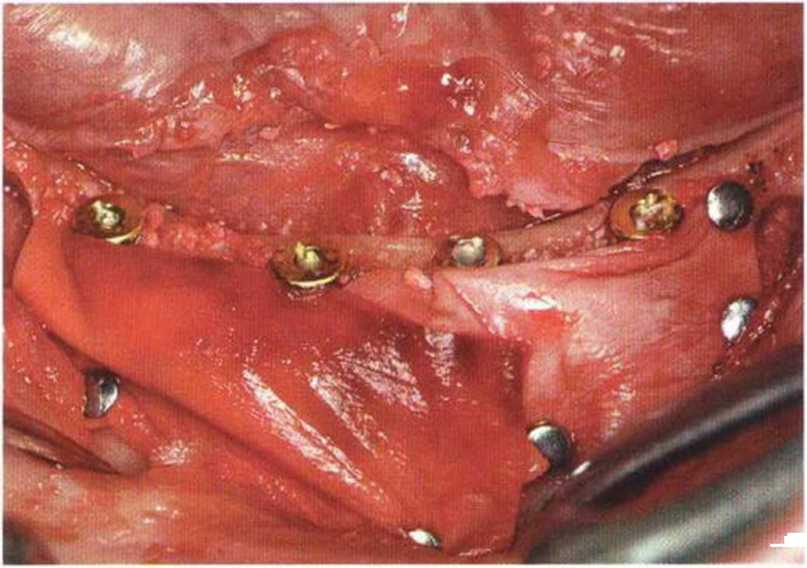
Рис. 9-30d. Над аутогенной костью дополнительно нанесен костный материал (Bio-Oss).
Рис. 9-30е. Перекрывание зоны вмешательства коллагеновой мембраной (Bio-Gide)
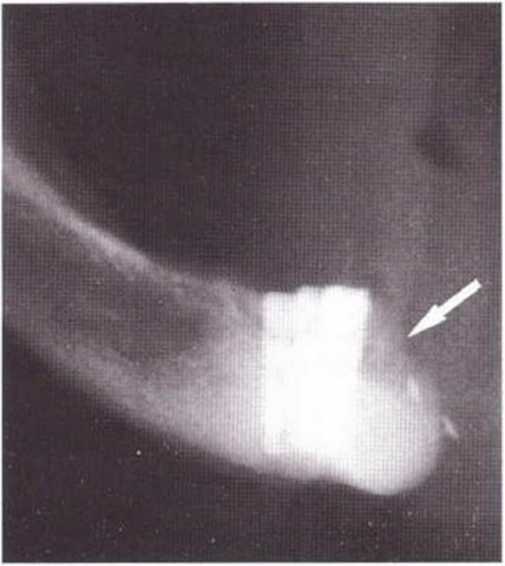
Рис. 9-30f. Объем регенеративного вмешательства на боковой телерентгенограмме непосредственно после операции
Рис. 9-30g. Некроз лоскута с обнажением мембраны
Рис. 9-30i. Боковая телерентгенограмма после протезирования: несмотря на отсутствие патологических изменений в области раны и спонтанное заживление обнаженной области, произошла значительная резорбция всего трансплантата
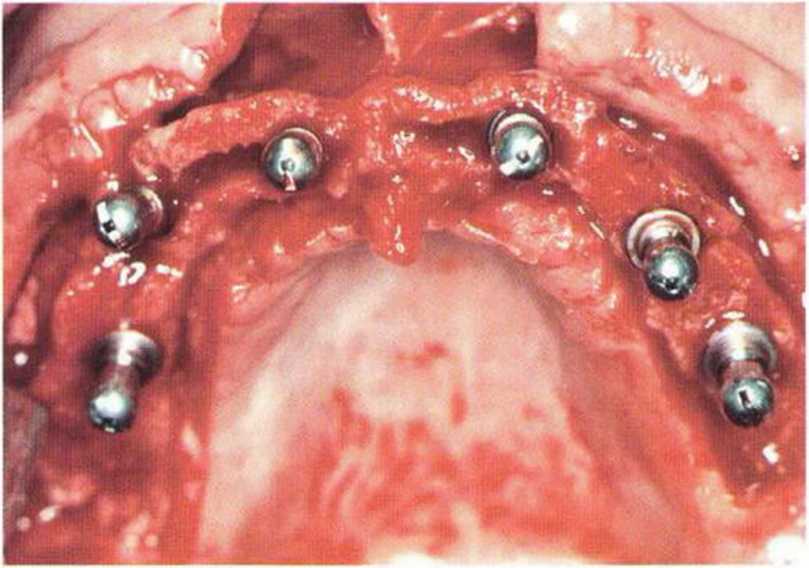
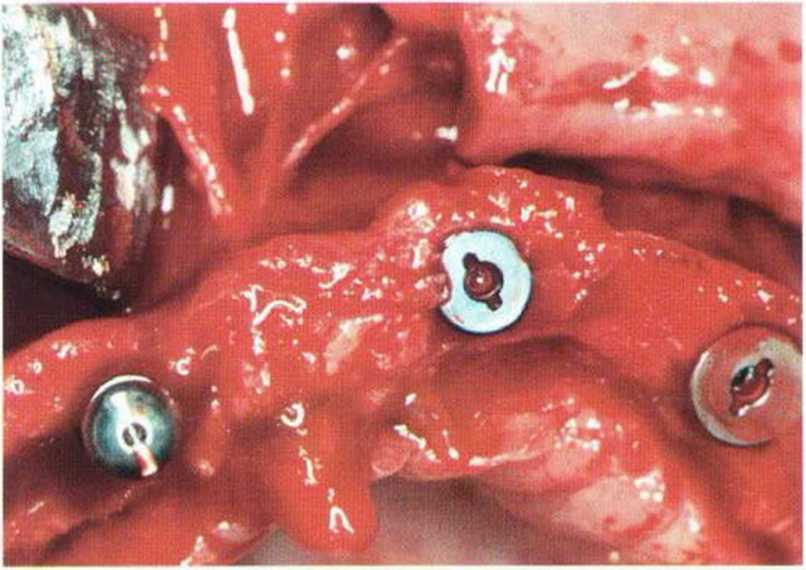
Рис. 9-31а. Установка шести имплантатов на верхней челюсти с расщеплением кости.
Рис. 9-31Ь. Пространства между имплантатами заполнены аутогенной костной стружкой
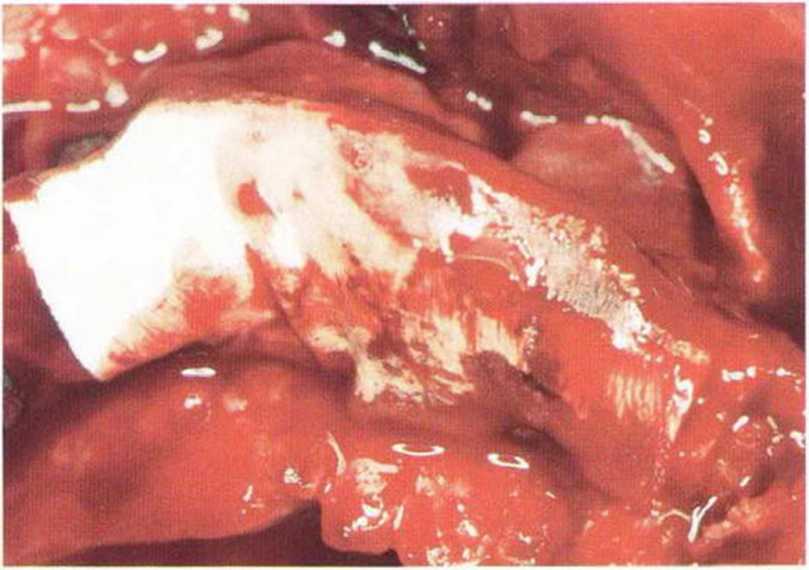
Рис. 9-31с. После расширения кости и установки трансплантата поверхность покрыта резорбируемой коллагеновой мембраной (Bio-Gide)
Рис. 9-31 d. Через 4 мес после имплантации установлено, что одновременно с мембраной резорбировались трансплантат и кость принимающего ложа
При правильном выборе метода, корректном выполнении регенеративного вмешательства и надежном ушивании раны абсцессы, приводящие к утрате трансплантата, образуются редко.
Лечение абсцессов включает в себя проведение разреза, санацию раны и удаление имеющихся инородных тел (мембраны или аллопластических материалов), а также антибиотикотерапию. Рану необходимо регулярно обрабатывать, поскольку персистирующую инфекцию в области регенеративного вмешательства удается контролировать только с помощью периодического полоскания рта антисептиками, а также применения местных антибиотиков (метронидазол) в комбинации с высокими дозами системной антибиотикотерапии (метронидазол 1500 мг/сут в сочетании с клиндамицином 1200 мг/сут).
После прекращения острых явлений проводят ревизию, как правило с удалением большой части трансплантата. Повторное регенеративное вмешательство возможно после заживления, как при частичном обнажении трансплантата.
Для фиксации костного блока применяют винты из разных материалов и разного диаметра. Титановые винты могут остеоинтегрироваться, что не всегда желательно, поскольку после приживления трансплантата их необходимо удалять. Кроме того, титан относительно мягок, поэтому титановые винты диаметром меньше 1,2 мм наиболее часто подвержены деформации или поломке, что значительно затрудняет их извлечение. Нередко фрагменты винтов удаляют с помощью трепанов или оставляют in situ.
9.13 Осложнения после имплантации в новообразованной костной ткани
Успешный исход трансплантации костного блока определяется интенсивностью врастания сосудов из принимающей кости в течение первых 4 мес приживления. При высокой скорости и интенсивности реваскуляризации костного трансплантата улучшаются его регенерация и интеграция. Установку имплантатов проводят через 4 мес после регенеративного вмешательства. К этому моменту трансформация еще продолжается. Даже через несколько месяцев после трансплантации сохраняется большой объем неваскуляризованной костной ткани.’.
На интенсивность регенерации влияют многие факторы, особенно реваскуляризация, которая в губчатой кости протекает почти в 10 раз быстрее, чем в кортикальных трансплантатах. Врастание сосудов в губчатый трансплантат размером 0,5 смпроисходит за 1 неделю.
Следующий ключевой фактор - потенциал регенерации ложа. При значительной атрофии альвеолярный гребень состоит преимущественно из кортикального слоя, который характеризуется бедной васкуляризацией и небольшим числом костных клеток. Клиническими признаками недостаточно активной костной регенерации являются незначительное кровоснабжение и белый оттенок трансплантата, иногда с четкой границей между ним и принимающим ложем.
В предыдущих главах были описаны регенеративные методики, обеспечивающие регенерацию и приживление костных трансплантатов даже при низком качестве принимающего ложа.
В частности, комбинация костных блоков и костной стружки повышает регенеративный потенциал благодаря усилению остеокондуктивной активности. При работе с очень толстыми костными блоками малая поверхность трансплантата затрудняет ревитализацию и реваскуляризацию, что сопровождается увеличением объема омертвевшей части трансплантата. Не следует устанавливать имплантаты при недостаточном восстановлении кровоснабжения трансплантата, так как при этом повышается риск резорбции последнего.
Одним из признаков резорбции является просвечивание головок фиксирующих винтов через мягкую ткань, которая опускается по мере усадки подлежащей кости. Резорбция наблюдается главным образом при пересадке костных блоков-и может составлять до 25 % всего объема трансплантата. При расхождении краев раны резорбция усиливается.
По данным исследований, комбинированное применение мембран и костных блоков способствует меньшей начальной резорбции кости,-однако изоляция надкостницы мембраной задерживает реваскуляризацию трансплантата, а значит, усиливает его оезорбцию в позднем послеоперационном периоде. Кроме того, эффективность данного метода снижается вследствие высокого риска осложнений при применении нерезорбируемых мембран из-за возможного преждевременного обнажения с последующим инфицированием (см. раздел 9.11). Титановые сетки также сокращают резорбцию и по сравнению с другими нерезорбируемыми мембранами ассоциируются с меньшим риском расхождения краев раны.-При обнажении резорбируемых коллагеновых мембран клинические осложнения, как правило, не наблюдаются. Реэпителизация и удаление мембраны обычно не требуются, но кислые метаболиты, высвобождающиеся при резорбции мембран из по-лилактидов, полигликолидов или полиуретана, негативно влияют на регенерацию кости и приводят к резорбции трансплантатов. Повышение плотности и жесткости мембран ассоциируется со снижением васкуляризации и питания трансплантата, что, в свою очередь, приводит к его повышенной резорбции.
Причиной обширной резорбции с почти полной утратой трансплантата часто является воспаление в непосредственной близости от области регенеративного вмешательства. Воспалительная резорбция после травмы соседнего переднего зуба может вызвать резорбцию всего трансплантированного блока (рис. 9-32а и 9-32Ь), поэтому все воспалительные процессы в области соседних зубов должны быть устранены до трансплантации. Также во время операции следует проверить наличие возможных изменений на поверхности корней соседних зубов после эндодонтического лечения. Даже мелкие очаги резорбции корня способны оказать самое губительное воздействие на трансплантат (рис. 9-ЗЗа-9-ЗЗп).
При значительной резорбции трансплантата в процессе его приживления иногда показано проведение дополнительных регенеративных вмешательств. Локальные методы расширения или расщепления кости в области пересадки костных блоков следует исключить, поскольку при этом возможно откалывание трансплантата. Для создания достаточного объема костной ткани нередко требуется еще одна трансплантация. В этих случаях возможно получение костной ткани с помощью трепанов при препарировании ложа имплантата. Также можно использовать костную стружку, накапливающуюся между режущими кромками фрез, применяемых при препарировании ложа имплантата без ирригации с медленным вращением. Скребком Safescraper (МЕТА) на прилегающих участках можно собрать дополнительный объем аутогенной кости. При локализации дефекта в пределах костного контура и достаточной защите трансплантата можно отказаться от применения мембран. В противном случае поверх трансплантата фиксируют мембрану. При пересадке аутогенных трансплантатов следует использовать нерезорбируемые мембраны (например, титановые) (рис. 9-34а-9-34о), поскольку деструкция резорбируемых мембран, как уже отмечалось, может повлечь за собой активную резорбцию подлежащей кости.
При обширной резорбции возможна задержка запланированной имплантации с необходимостью повторного забора костной ткани и последующей фазой заживления до 4 мес. Методика регенеративного вмешательства описана в главе 5 и предполагает комбинацию костного блока и костной стружки. Как уже отмечалось, при проведении регенеративных вмешательств показана антибиоти-копрофилактика.
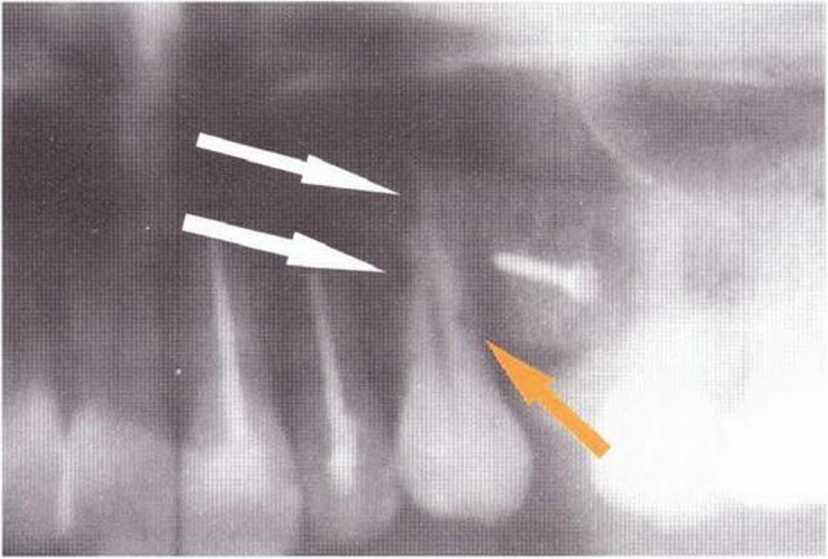
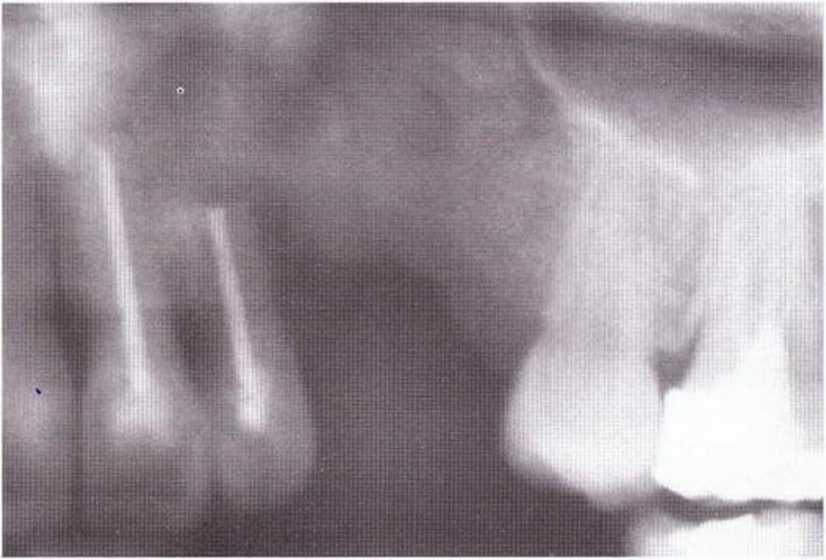
Рис. 9-32Ь. Резорбция всего костного трансплантата. После удаления клыка определяется объем костной деструкции
Рис. 9-32а. Трансплантация костного блока в области реплантированного клыка с воспалительной резорбцией корня (стрелки)
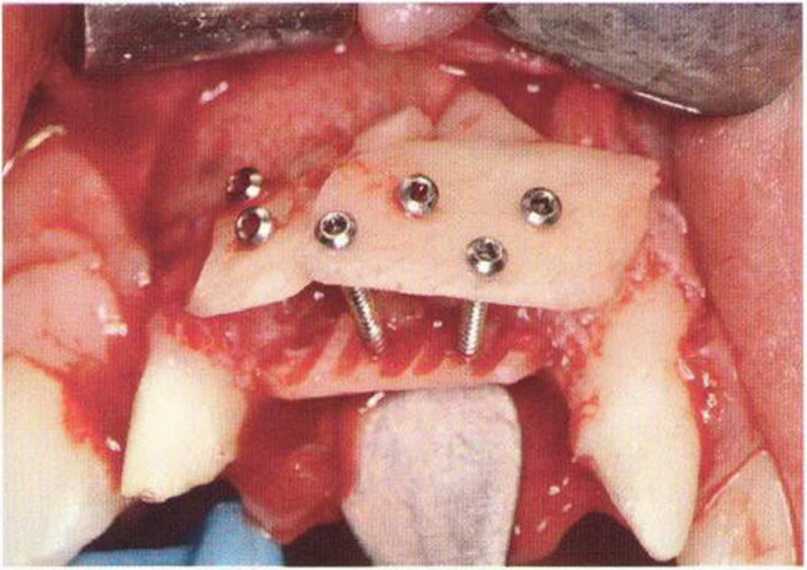
Рис. 9-ЗЗа. Большой костный дефект после травмы передних зубов.
Рис. 9-ЗЗЬ. Трехмерная пластика с пересадкой нижнечелюстных трансплантатов
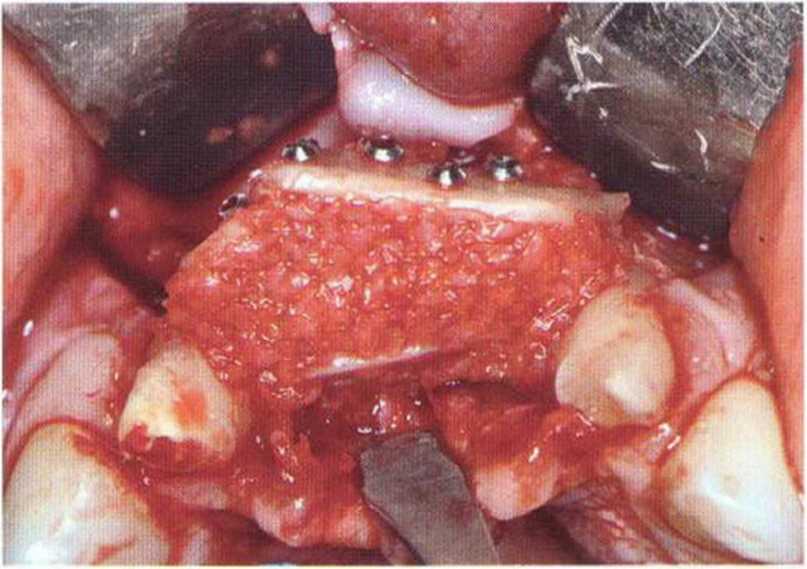
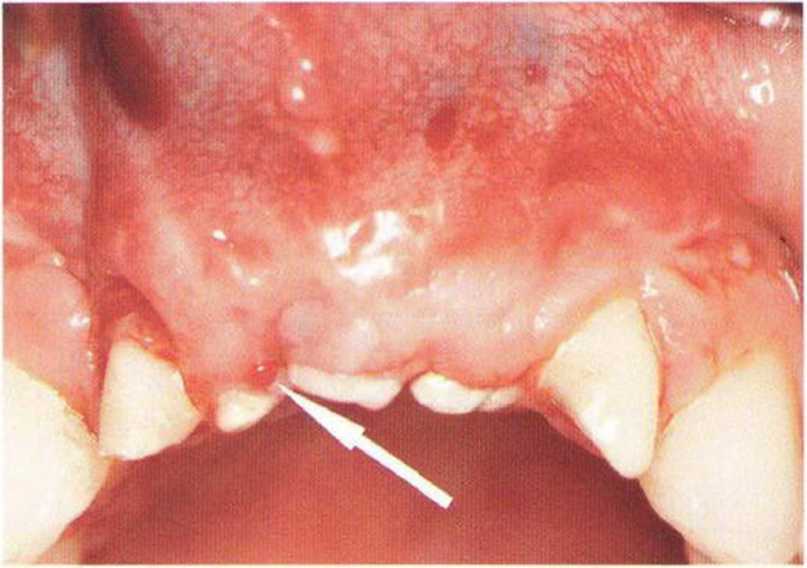
Рис. 9-ЗЗс. В соответствии с протоколом пространства заполняются костной стружкой.
Рис. 9-33d. Клиническая ситуация через 4 мес после операции. Определяется свищ (стрелка)
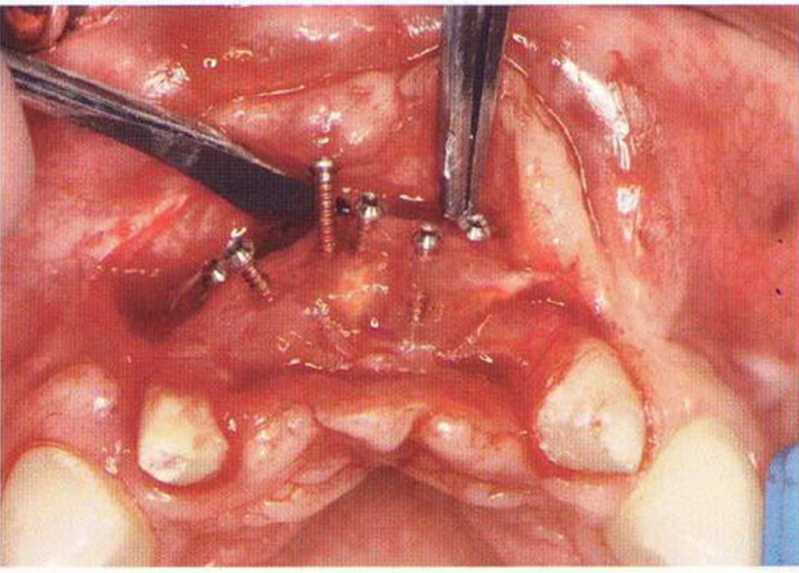
Рис. 9-ЗЗе. Активная резорбция трансплантатов
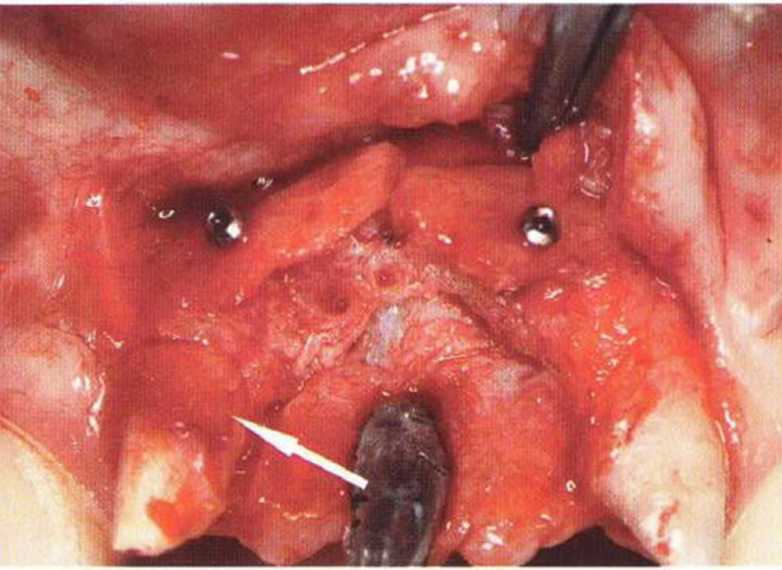
Рис. 9-33f. Неполное удаление грануляционной ткани в области корня соседнего зуба и резорбции корня (стрелка)
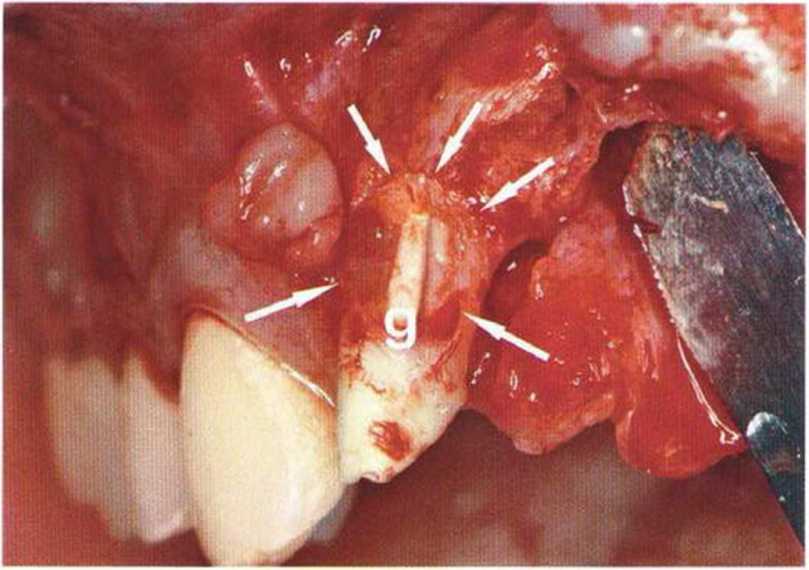
Рис. 9-ЗЗд. После удаления грануляционной ткани определяется объем резорбции корня. Корневой канал и корневая пломба (д: гуттаперча) непосредственно контактируют с областью регенеративного вмешательства, что могло привести к неудаче трансплантации
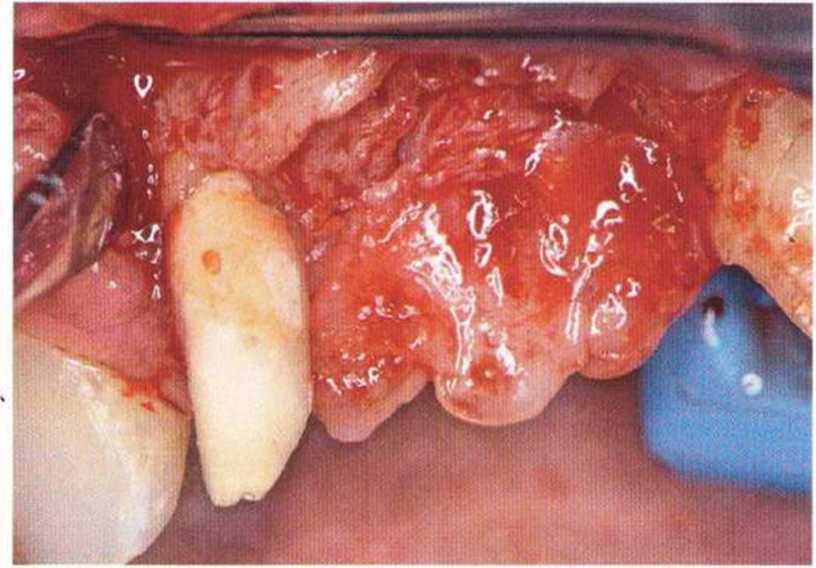
Рис. 9-33h. Обработка зоны резорбции и пломбирование стеклоиономерным цементом
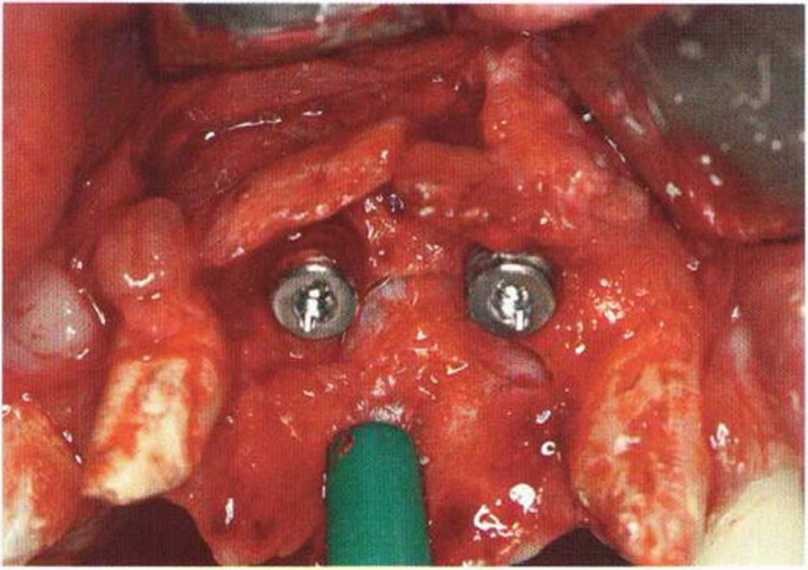
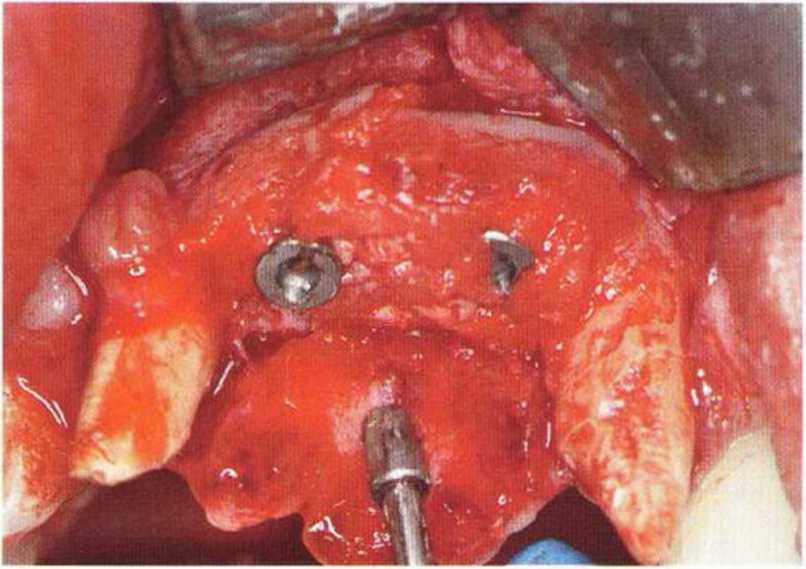
Рис. 9-33i. Установка двух имплантатов в сохранившейся кости
Рис. 9-33j. Регенеративное вмешательство в области имплантатов с пересадкой костного трансплантата с прилегающих участков
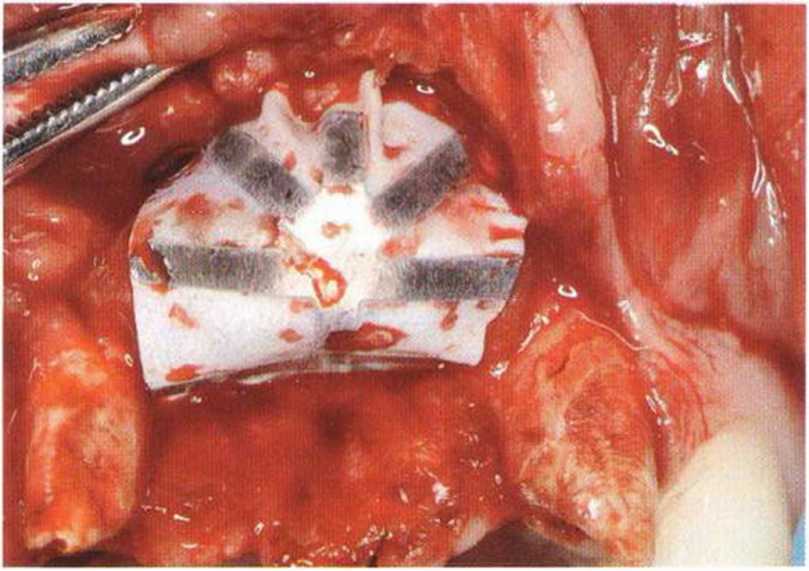
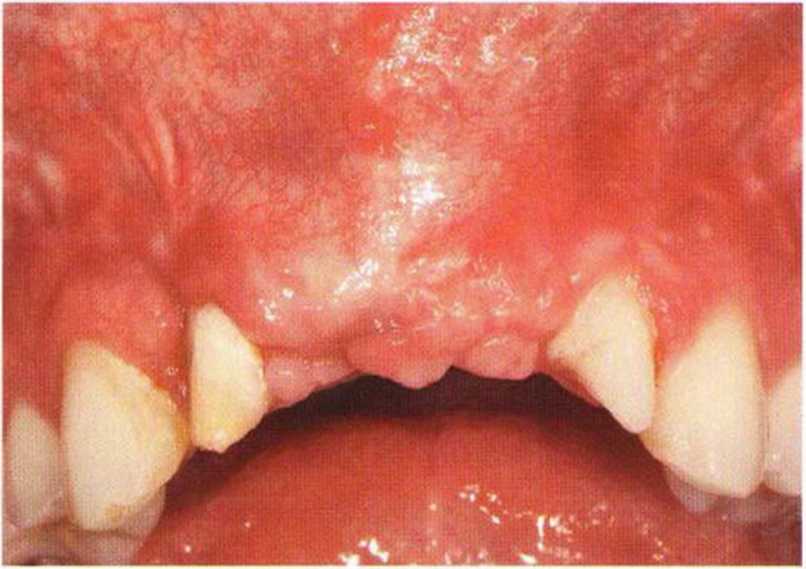
Рис. 9-331. Клиническая ситуация через 3 мес после операции
Рис. 9-ЗЗк. Установка нерезорбируемой мембраны (Gore-Tex)

Рис. 9-ЗЗт. Состояние до удаления мембраны
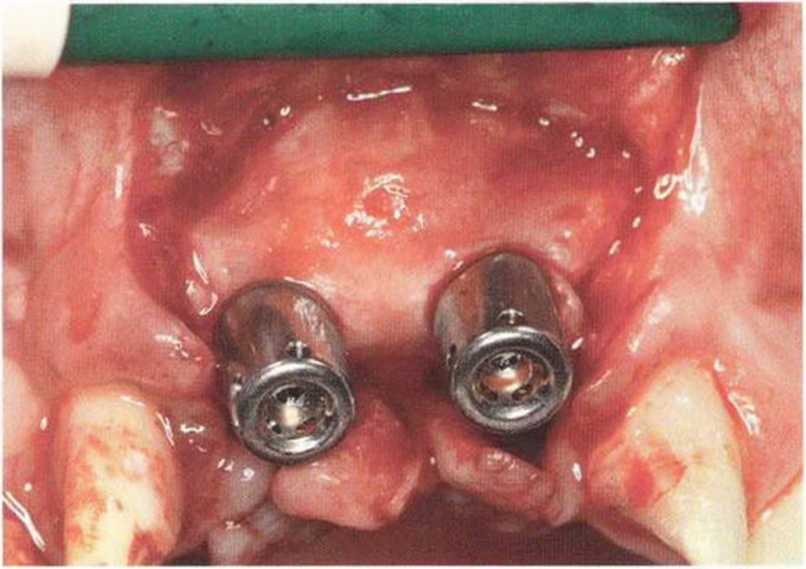
Рис. 9-ЗЗп. Клиническая ситуация после удаления мембраны, раскрытия имплантатов и установки формирователей десны
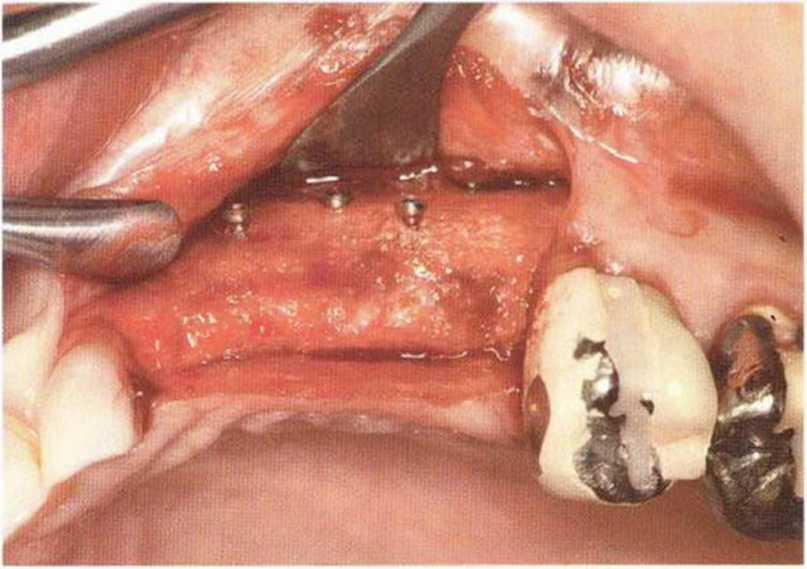
Рис. 9-34а. Значительная костная резорбция после регенеративного вмешательства с пересадкой костного блока на верхней челюсти слева
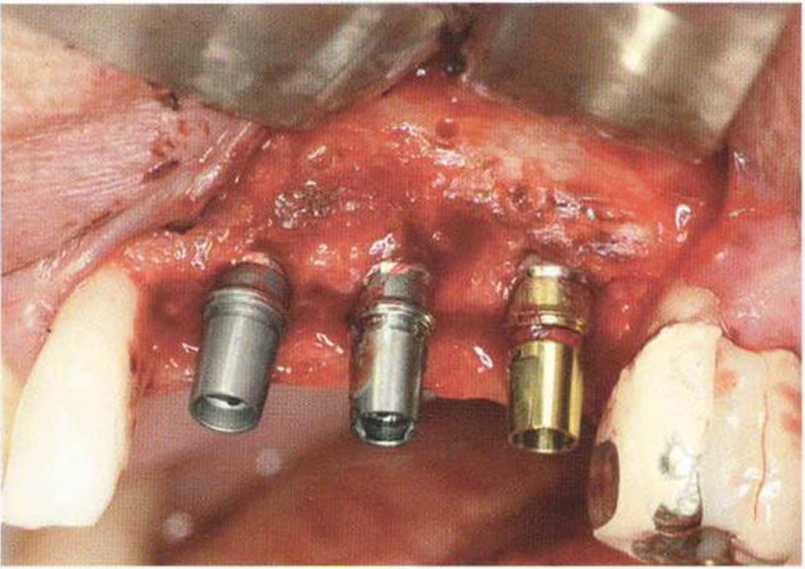
Рис. 9-34Ь. Установка трех имплантатов в области трансплантации. Остаточная толщина вестибулярной костной стенки составляет менее 1 мм
Рис. 9-34f. Двухслойное закрытие раны
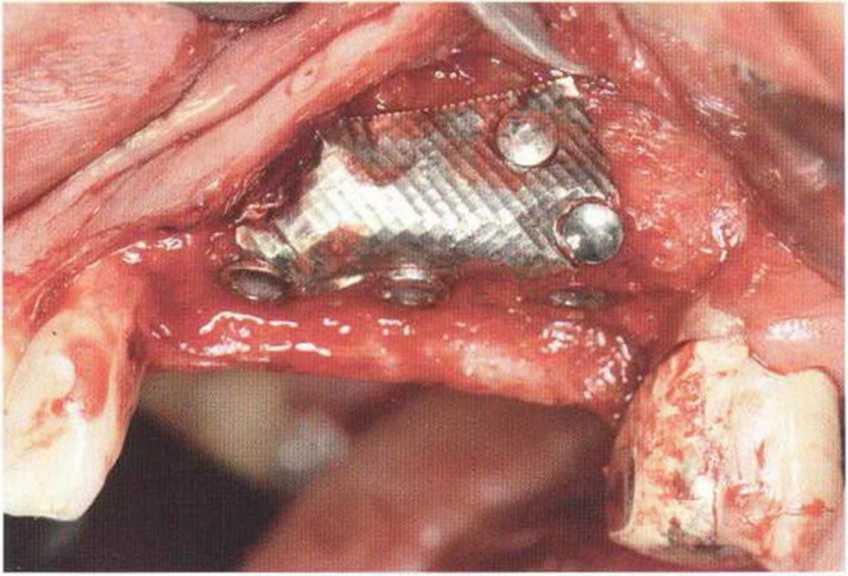
Рис. 9-34с. Увеличение толщины вестибулярной стенки с помощью трансплантата и фиксации титановой фольги (BoneSchield)
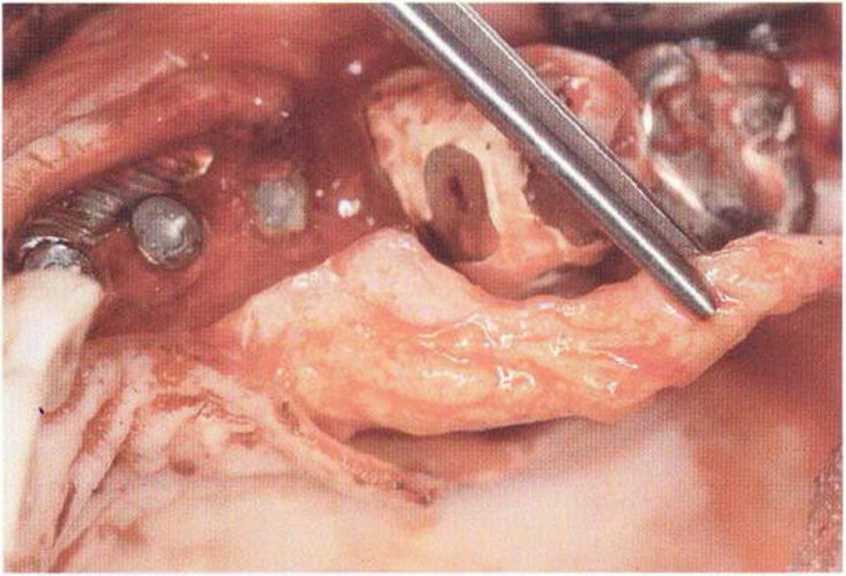
Рис. 9-34d. Препарирование нёбного соединительнотканного лоскута на ножке
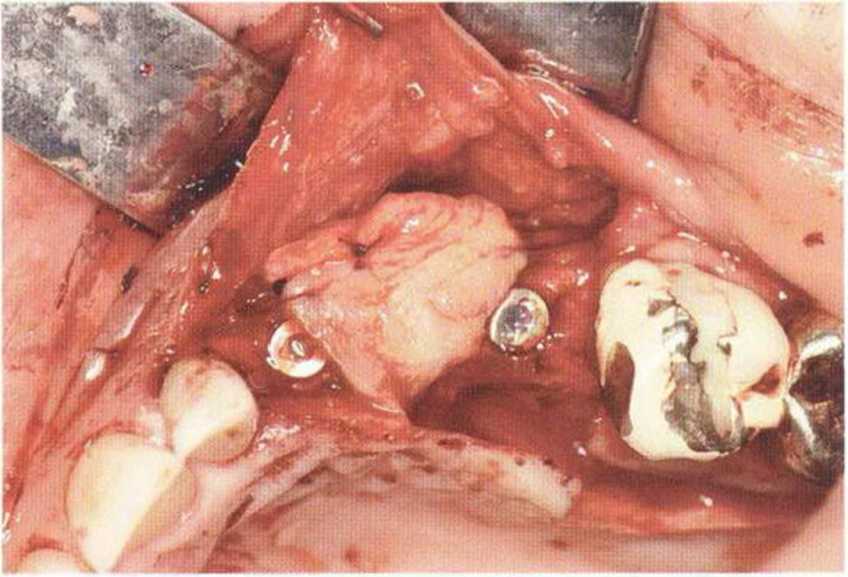
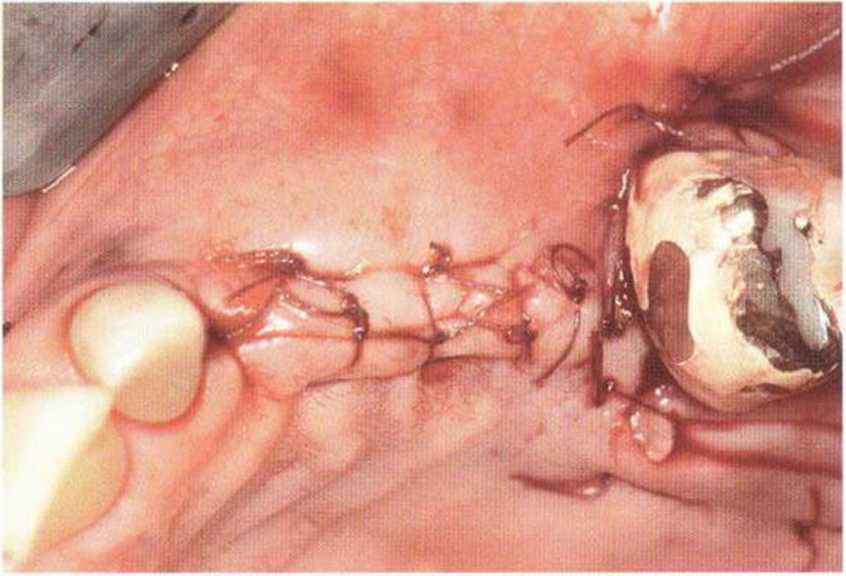
Рис. 9-34е. Ротация соединительнотканного лоскута над титановой фольгой
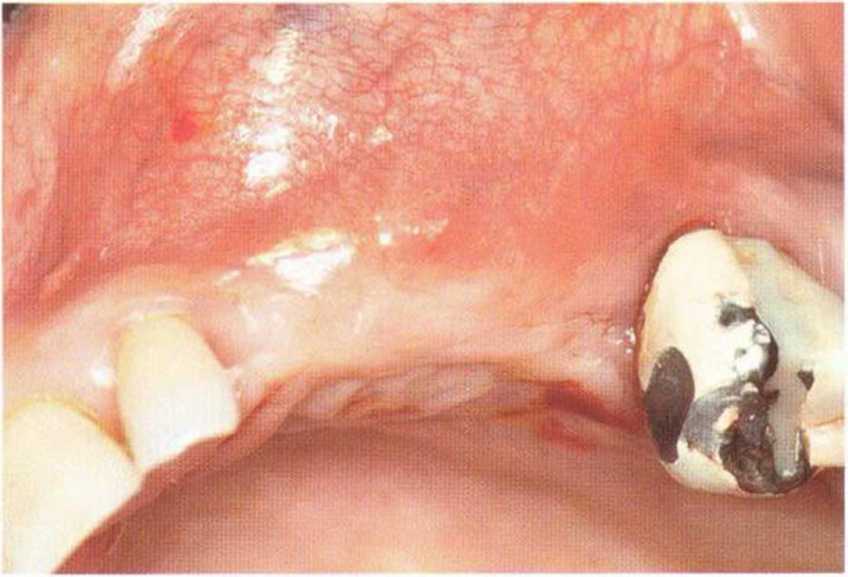
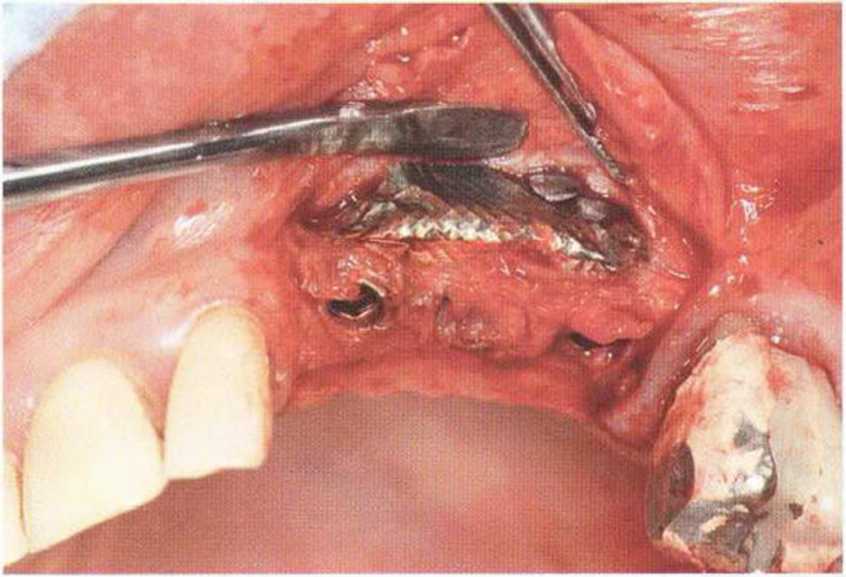
Рис. 9-34д. Клиническая ситуация через 3 мес после операции.
Рис. 9-34И. При обнажении титановой фольги патологические изменения не отмечаются
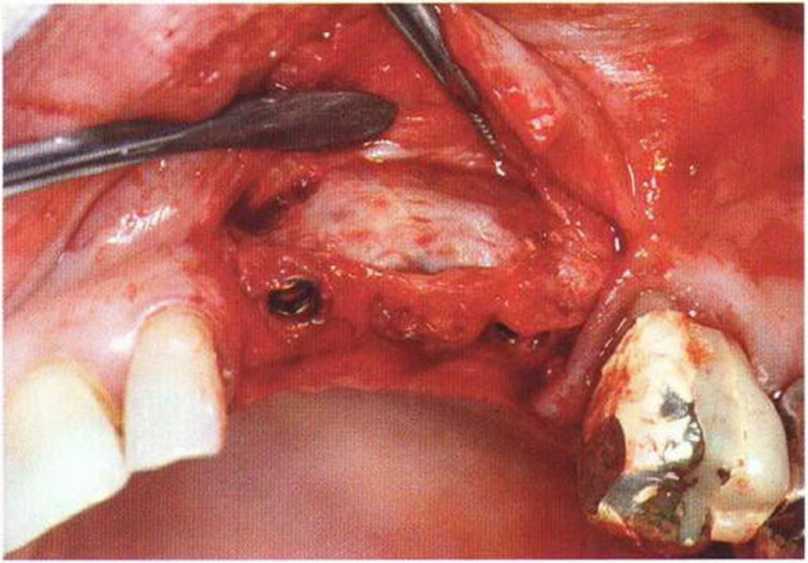
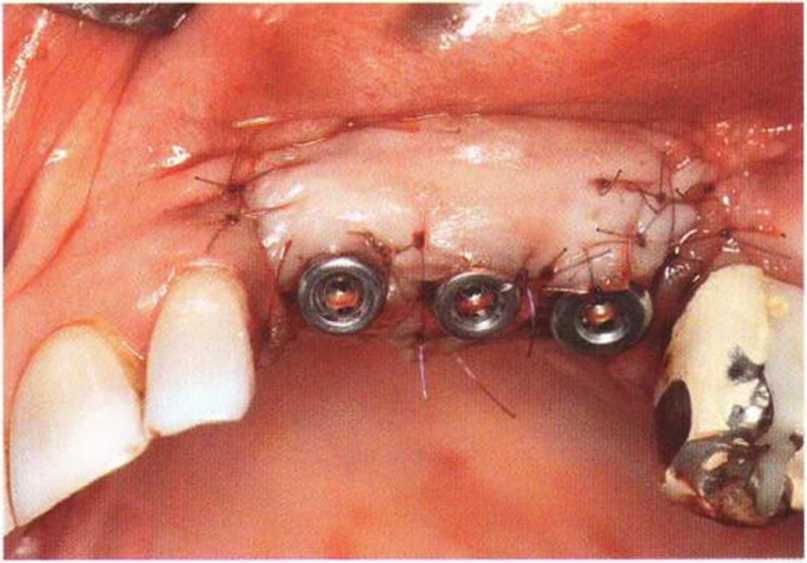
Рис. 9-34j. Апикально смещенный лоскут с перфорированными формирователями десны
Рис. 9-34i. После удаления фольги отмечается удовлетворительная толщина альвеолярного гребня
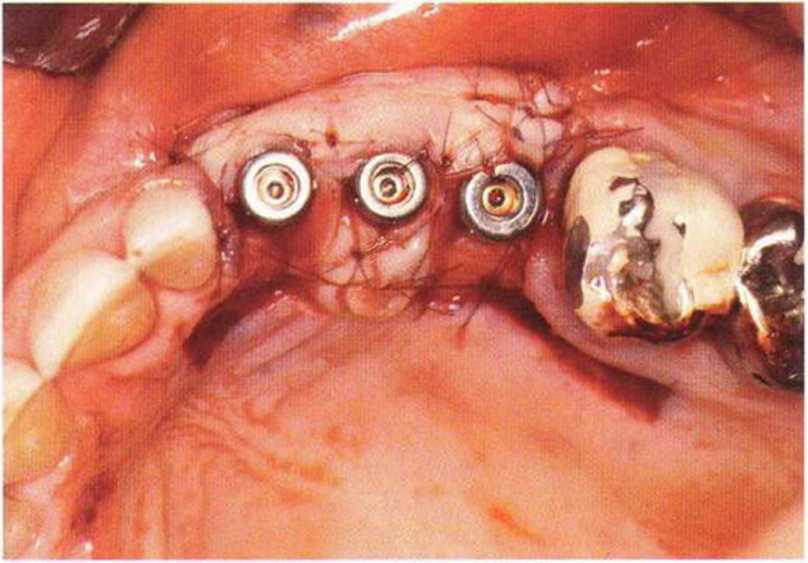
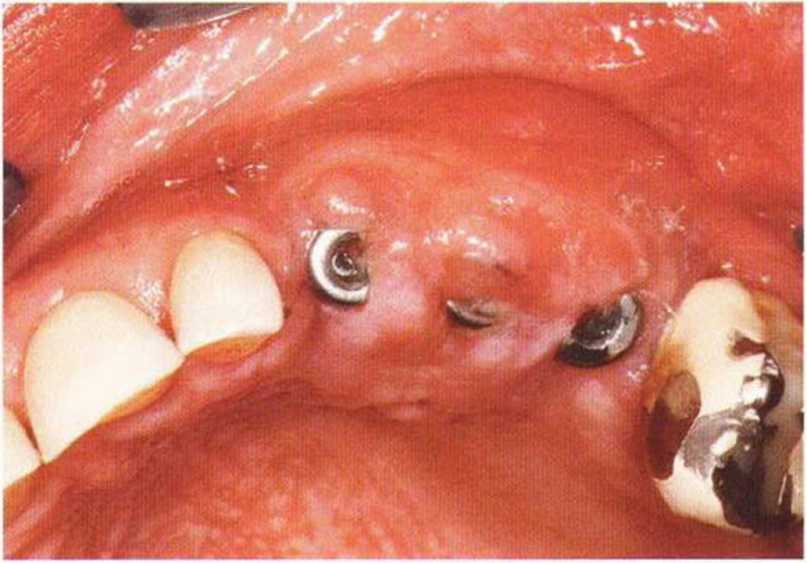
Рис. 9-341. Клиническая ситуация через 3 недели после операции
Рис. 9-34к. Окклюзионный вид. Реконструкция мезиального и дистального сосочков вблизи импланта~а в области зуба 24 с помощью двух нёбных лоскутов
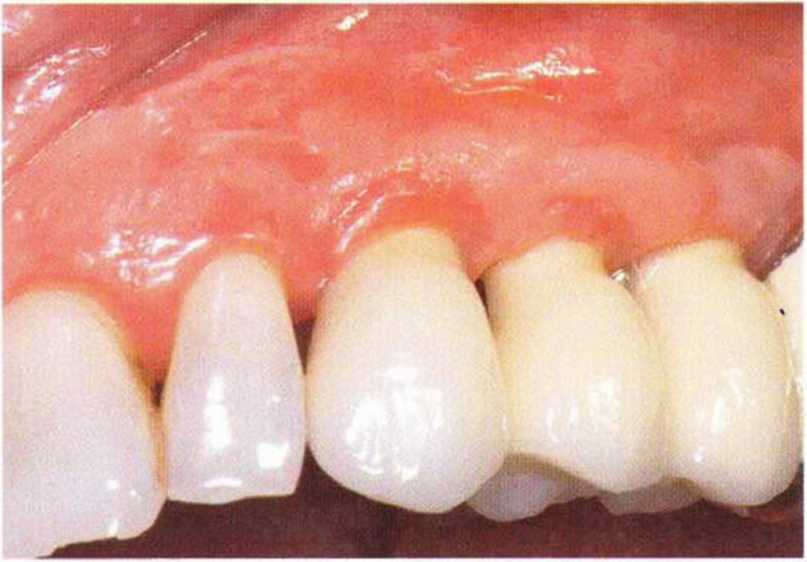
Рис. 9-34т. Ситуация через 2 года после протезирования
Рис. 9-34п. Нёбный вид
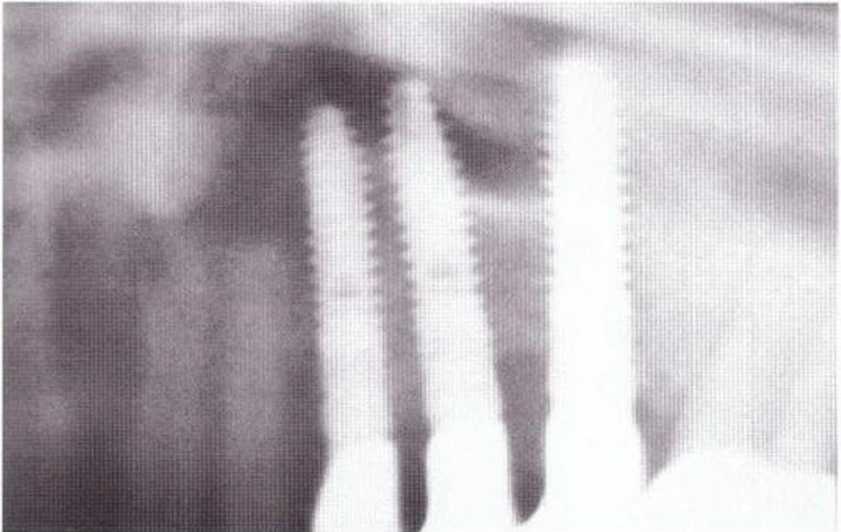
Рис. 9-34о. Контрольная рентгенограмма через 2 года после операции
Трансплантат должен быть плотно фиксирован к принимающему ложу, а любое пространство между ними следует заполнить костной стружкой, чтобы исключить врастание соединительной и грануляционной ткани. При заполнении небольших пространств костной стружкой применение мембраны не требуется.
Для стабилизации и устойчивости трансплантата можно применять титановую фольгу, которая надежно предотвращает врастание соединительной ткани в свободное пространство. Исключением являются регенеративные вмешательства с применением тоннельной методики. При этом регенерация под надкостницей при неполном заполнении пространства между блоком и принимающим ложем протекает без осложнений.
Вросшая соединительная или грануляционная ткань должна быть удалена перед повторным вмешательством на костной ткани или имплантацией (рис. 9-35a-9-35t). В зависимости от размера образовавшегося дефекта может потребоваться повторная трансплантация, а имплантацию следует отложить еще на 4 мес. При возможности имплантации после удаления соединительной или грануляционной ткани имеющиеся дефекты заполняют костной стружкой, полученной с помощью трепанов, боров или скребка Safescraper. Для дополнительной стабилизации костной стружки нередко требуется установка нерезорбируемых мембран.
Надежная фиксация трансплантата является обязательным условием для регенерации и интеграции кости. Известно, что остеобласты при механической нагрузке трансформируются в фибробласты, возможно из-за недостаточной костной регенерации или давления со стороны провизорного протеза. После пересадки костных блоков нельзя проводить расщепление или расширение кости во избежание отделения трансплантата.
При имплантации не рекомендуется уменьшать диаметр ложа относительно диаметра имплантата во избежание эффекта расклинивания, что может привести к отделению трансплантата.
Перед использованием пилотного сверла при препарировании ложа имплантата в области трансплантации рекомендуется нанести метку (создать углубление), чтобы предотвратить соскальзывание инструмента.
При неполной интеграции трансплантат может отделиться от подлежащей кости при ввинчивании имплантата, несмотря на правильное препарирование ложа. В большинстве случаев перед имплантацией винты, фиксирующие трансплантат, нужно удалить. При сохранении некоторой подвижности костного блока на данном этапе можно установить дополнительные винты вне планируемого положения имплантатов для стабилизации блока перед имплантацией. Винты, не препятствующие ей, при недостаточной стабильности трансплантата также можно сохранить.
При обнаружении подвижности костного фрагмента необходимо удалить мягкие ткани, вызвать кровотечение и повторно зафиксировать подвижный фрагмент винтами. Сохраняющийся дефицит костной ткани можно устранить с помощью костной стружки, полученной трепаном при препарировании ложа имплантата. При несостоятельности фрагментов трансплантатов или более крупных дефектах нередко требуется дополнительная пересадка костной ткани из нижней челюсти с повторной фазой приживления 3-4 мес перед последующей имплантацией.
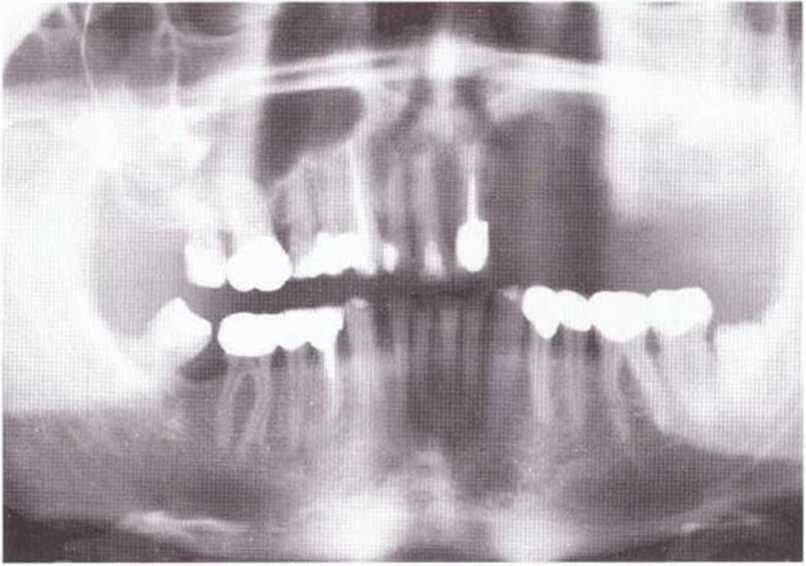
Рис. 9-35а. На ортопантомограмме определяется выраженная потеря костной ткани в области трех имплантатов на верхней челюсти слева.
Рис. 9-35Ь. После удаления имплантатов вертикальный костный дефект составляет более 12 мм и распространяется до основания левой носовой полости
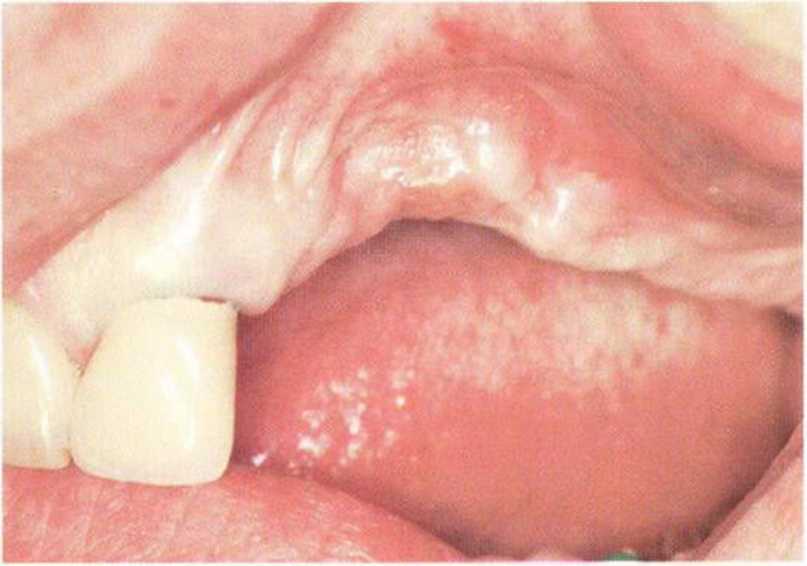
Рис. 9-35с. Клинический вид через 3 мес после эксплантации
Рис. 9-35d. Вертикальный дефект более 12 мм с экспозицией дна полости носа слева
Рис. 9-35е. Костный блок получен в ретромолярной области пилой MicroSaw.
Рис. 9-35f. Толстый костный блск продольно разделяют на два тонких костных блока
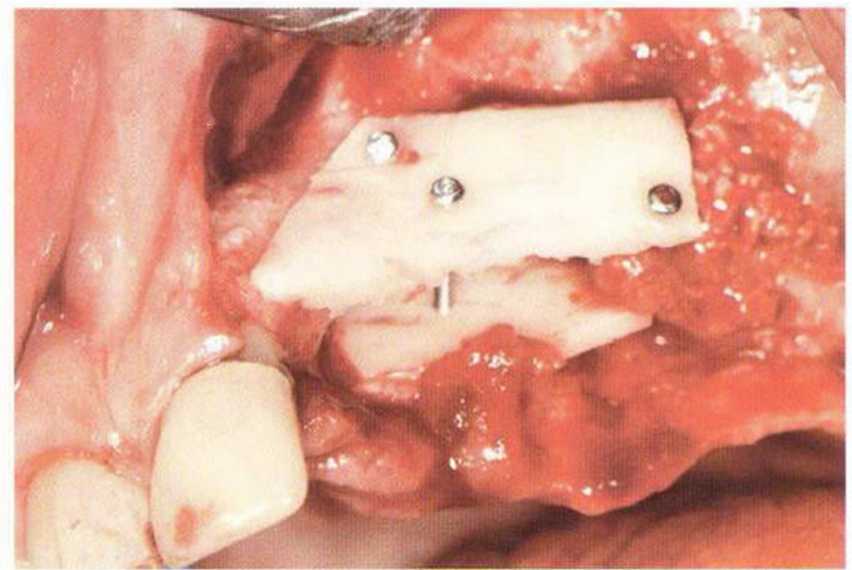
Рис. 9-35д. Реконструкция вестибулярной и нёбной стенок тонкими костными блоками
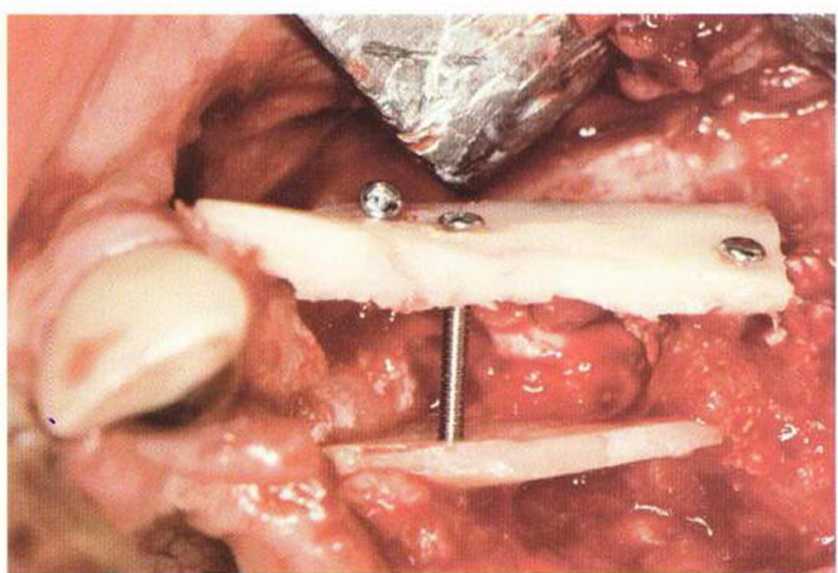
Рис. 9-35И. Окклюзионный вид восстановленного альвеолярного гребня
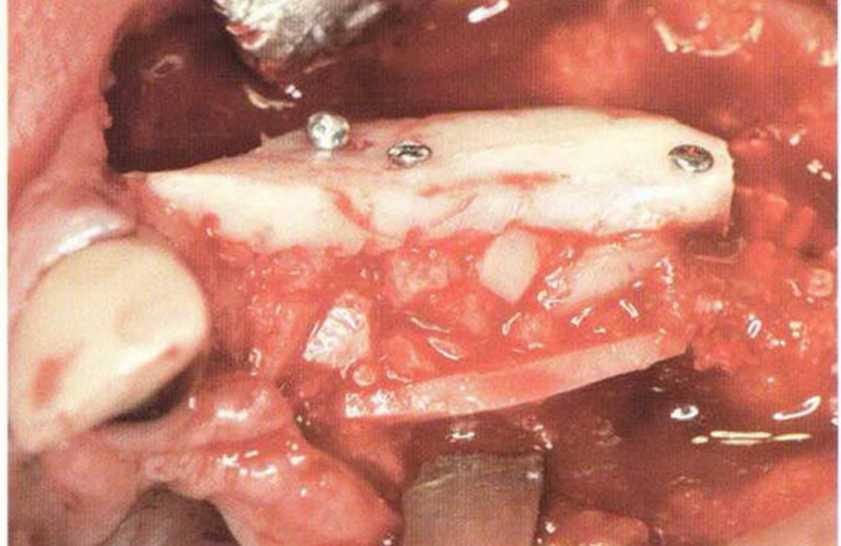
Рис. 9-351. Дефект заполняется губчатой костью и размельченной кортикальной костью
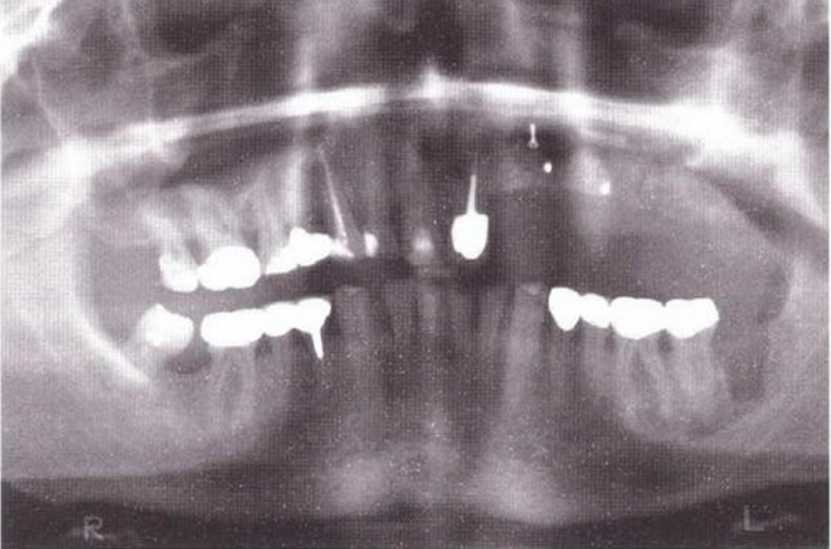
Рис. 9-35j. На ортопантомограмме отмечается место забора костного блока в ретромолярной области нижней челюсти слева с одновременным удалением ретинированного третьего моляра
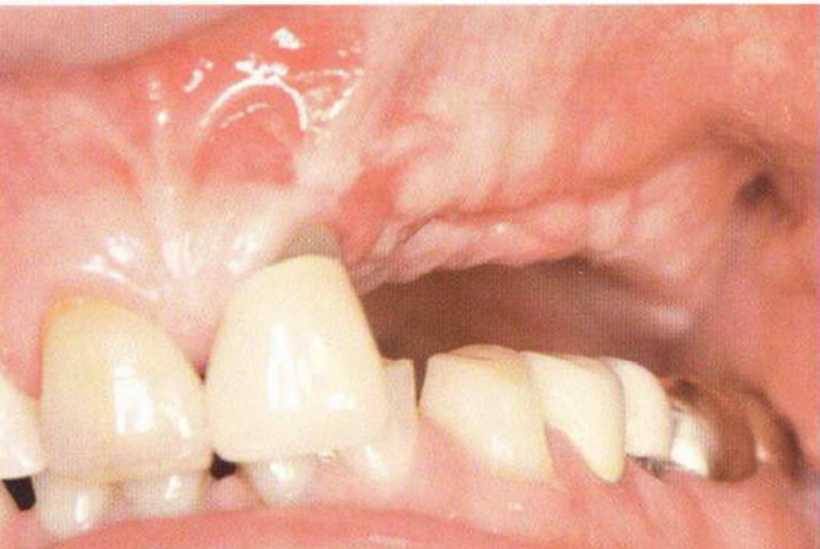
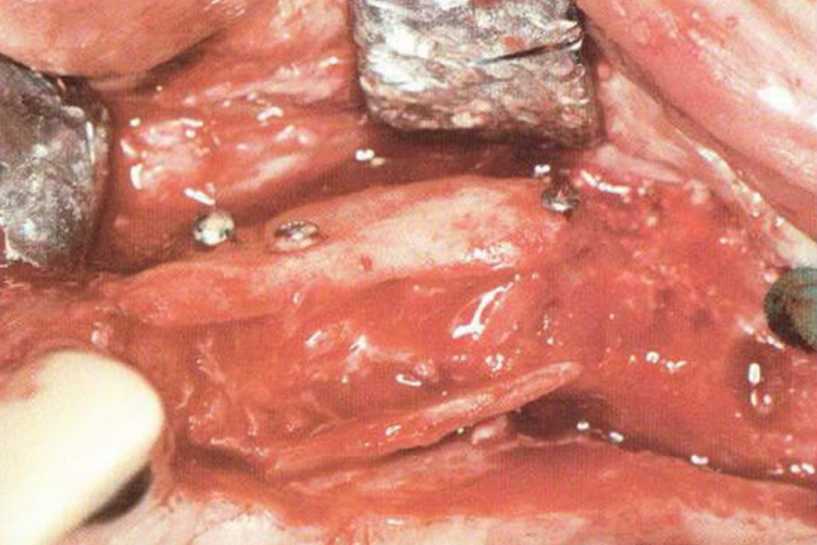
Рис. 9-35к. Клинический вид через 4 мес после вмешательства.
Рис. 9-351. Регенерированный участок через 4 мес после вмешательства
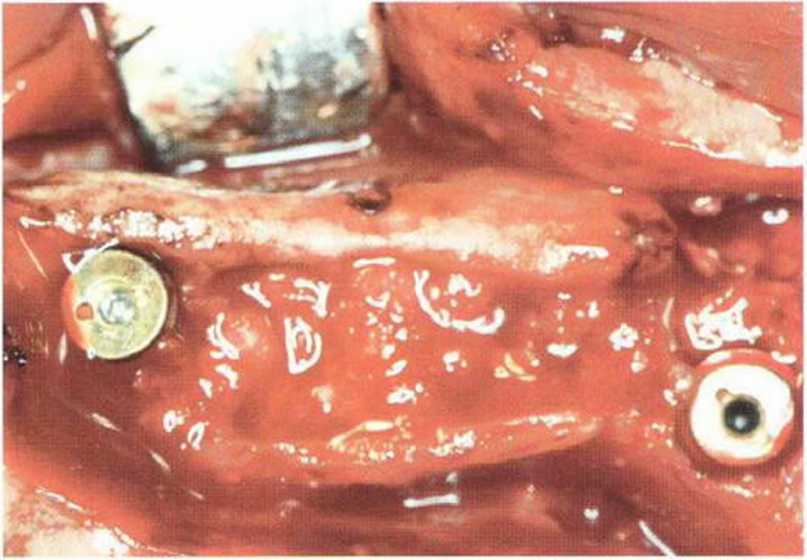
Рис. 9-35т. Неполноценное заживление с врастанием мягких тканей в область регенеративного вмешательства. Соединительная ткань удалена, установлены два имплантата.
Рис. 9-35п. Область неудовлетворительной регенерации заполняется костной тканью, собранной при препарировании ложа двух имплантатов
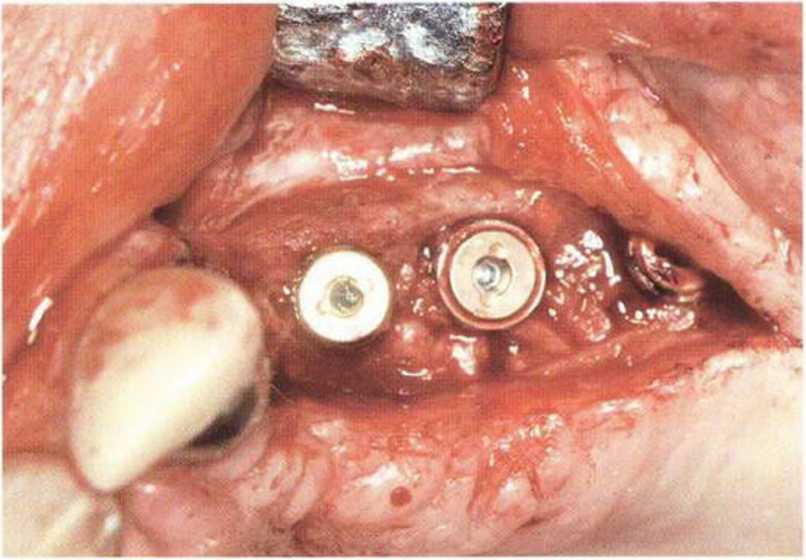
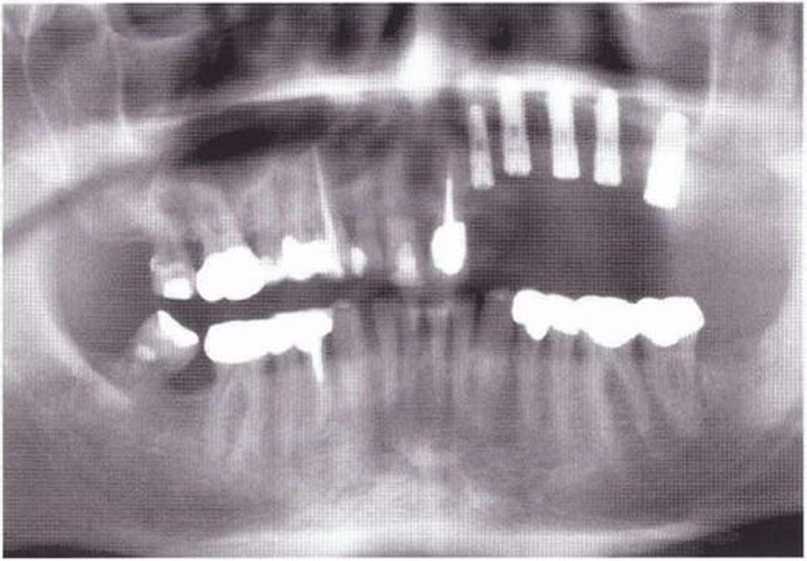
Рис. 9-35р. Ортопантомограмма после операции
Рис. 9-35о. Через 3 мес дополнительно установлены имплантаты
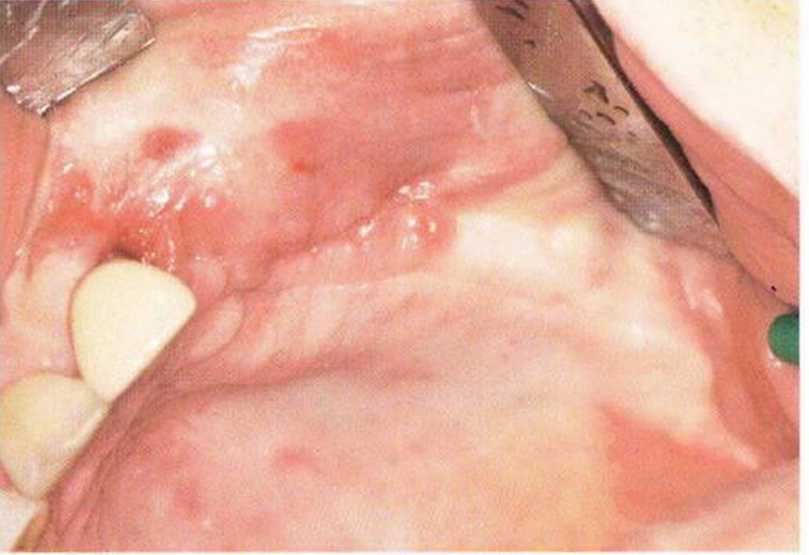
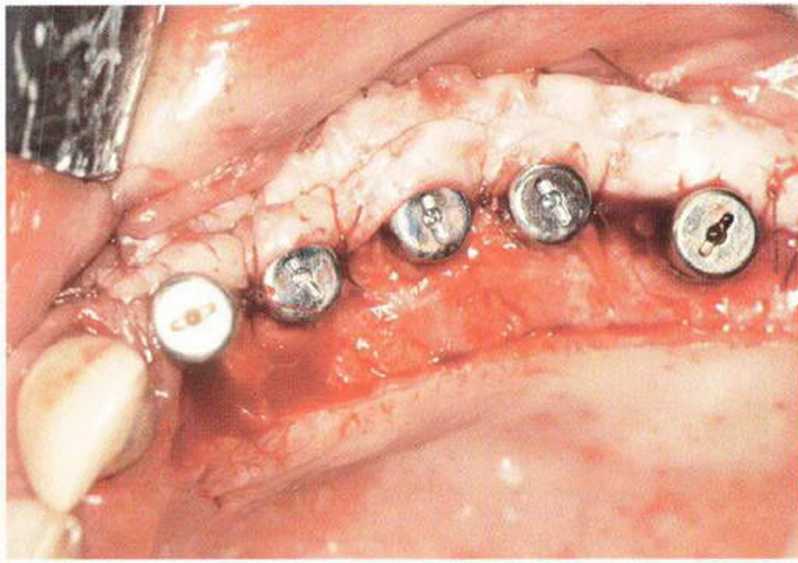
Рис. 9-35г. Раскрытие имплантатов проводилось с препарированием наднадкостничного апикально смещенного лоскута
Ри. 9-35q. Перед раскрытием имплантатов отмечается отсутствие вестибулярной КПД
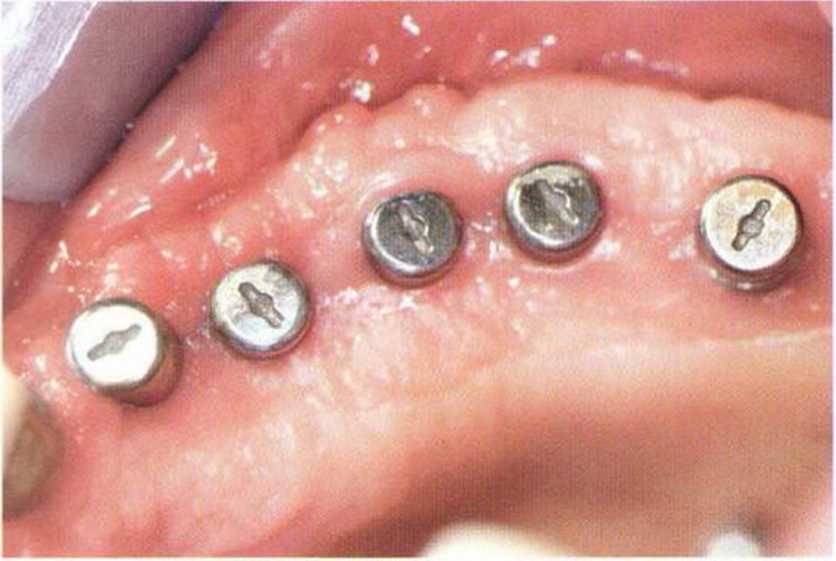
Рис. 9-35s. Через 4 недели после раскрытия имплантатов клинически отмечается достаточный объем КПД
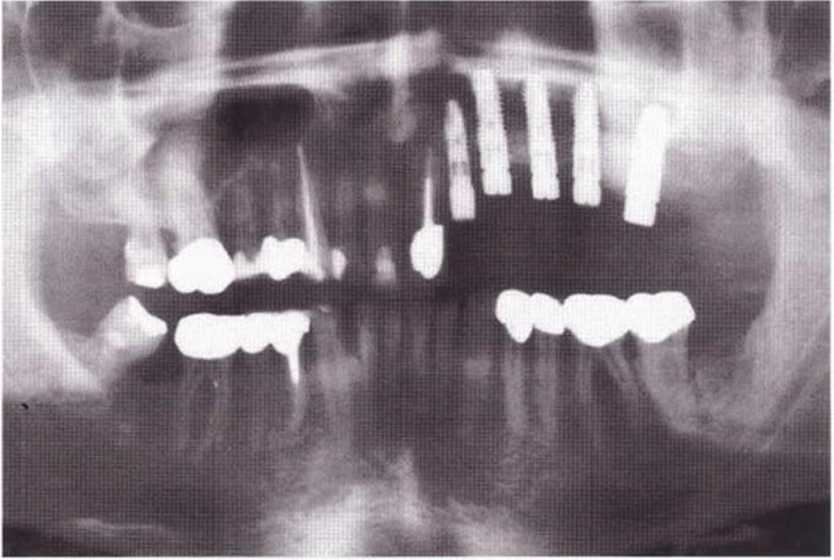
Рис. 9-35t. На панорамной рентгенограмме после раскрытия определяется удовлетворительная остеоинтеграция имплантатов
Подвижный имплантат удаляют и тщательно удаляют грануляции из ложа. Затем сразу устанавливают имплантат большего диаметра или проводят отсроченную имплантацию приблизительно через 6 недель. Образовавшееся в процессе эксплантации сообщение полости рта с верхнечелюстной пазухой закрывают мягкими тканями. Рентгенологический контроль и имплантацию в таких случаях также проводят через 6 недель.
Васкуляризация трансплантата по сравнению с таковой у костного ложа снижена, что негативно влияет на факторы специфической и неспецифической защиты. Даже через несколько месяцев в трансплантате может обнаруживаться некротизированная костная ткань.
При раскрытии имплантатов важно выбрать методику, например с апикальным смещением лоскута, при которой сохраняется перекрывание новообразованной костной ткани надкостницей.В случае экспозиции трансплантата обнаженные участки должны быть немедленно покрыты с помощью соединительнотканных или десневых лоскутов на питающей ножке (рис. 9-36а-9-36д).
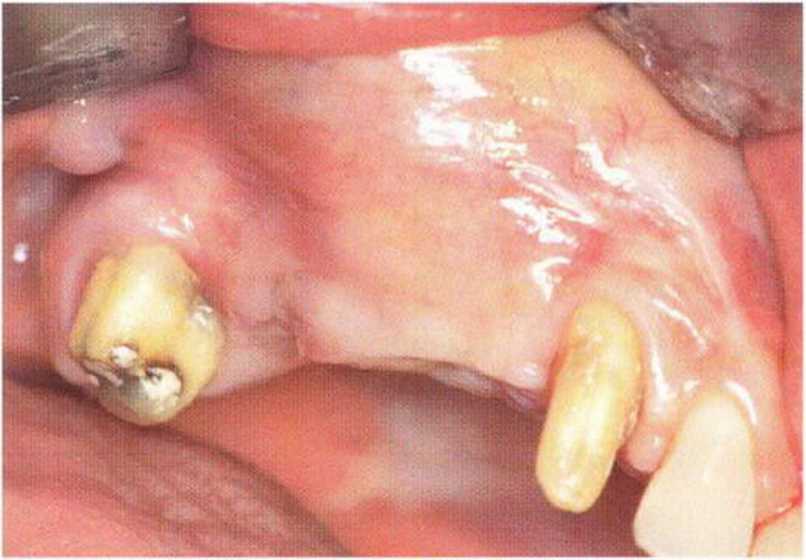
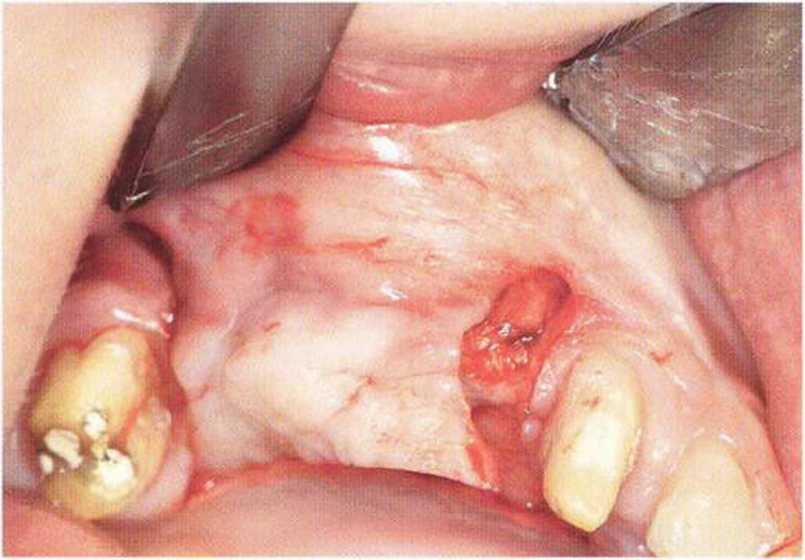
Рис. 9-36Ь. Проведение разреза для препарирования апикально смещенного лоскута
Рис. 9-36а. Дефицит КПД после имплантации и увеличения высоты альвеолярного гребня на верхней челюсти справа
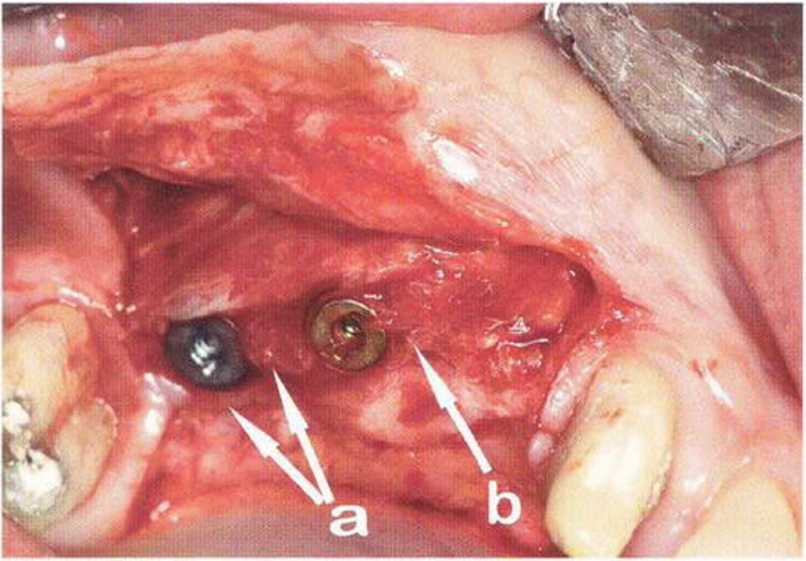
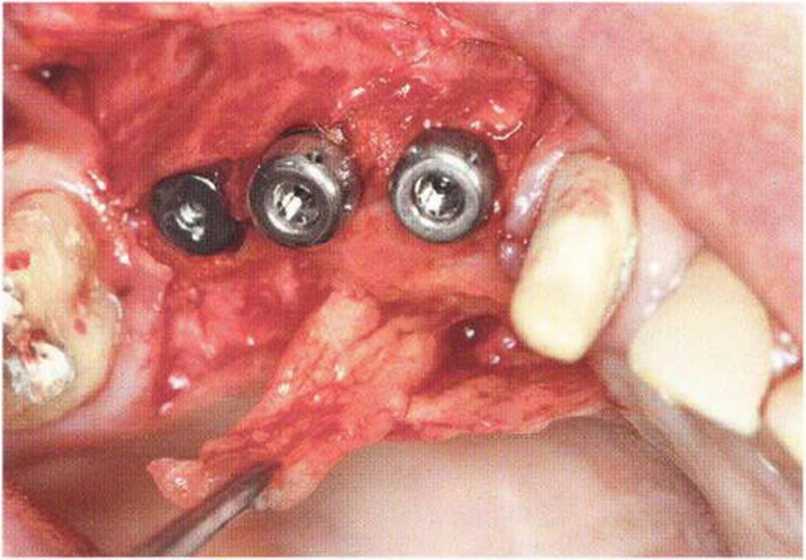
Рис. 9-36с. Несмотря на наднадкостничное препарирование лоскута, в трех местах (а, Ы произошло обнажение кости
Рис. 9-36d. Препарирование дистального соединительнотканного лоскута на ножке
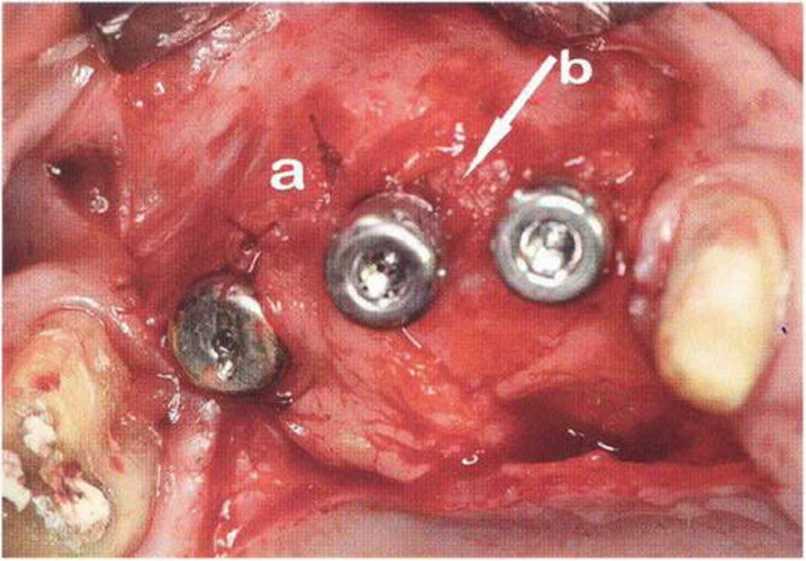
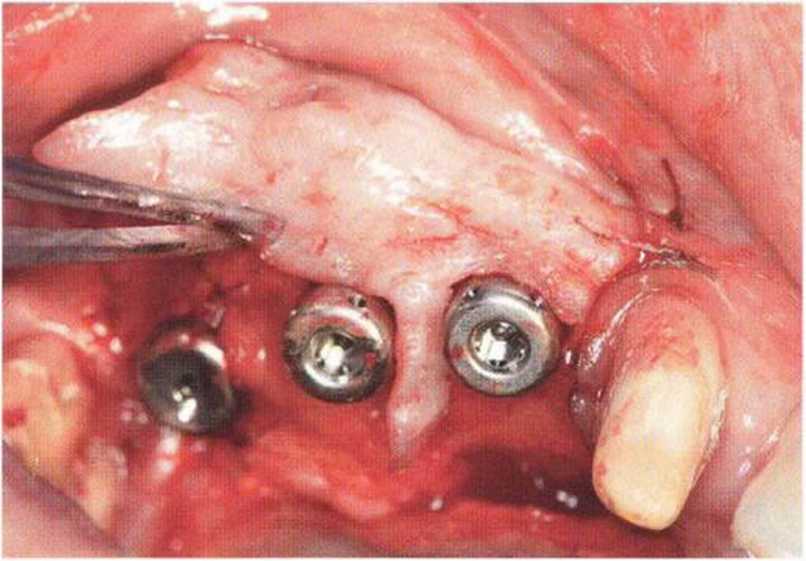
Рис. 9-36f. Для покрывания мезиального участка обнаженной кости препарируют вестибулярный фрагмент лоскута
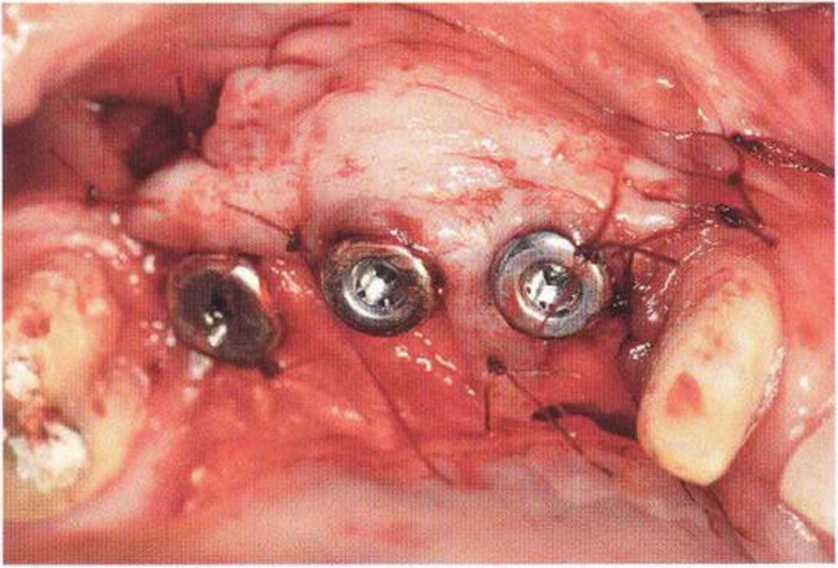
Рис. 9-36д. Апикально смещенный лоскут без обнажения кости
Для увеличения ширины КПД показаны различные вмешательства, в частности апикальное смещение лоскута, которые позволяют сохранить надкостницу на трансплантате. В результате остаются открытые раневые поверхности десны.
В процессе заживления вторичным натяжением повышается риск кровотечения на донорских участках с богатым кровоснабжением тканей, например в области нёба и бугра, поэтому в донорской области необходимо накладывать давящие швы. Для профилактики и остановки кровотечения на нёбе можно использовать защитную нёбную каппу или перебазировать имеющийся протез мягкой прокладкой. После получения на нёбе свободного соединительнотканного трансплантата или формирования соединительнотканного лоскута на питающей ножке также рекомендуется наложение защитной каппы.
Травматичные вмешательства, инфекции или недостаточное кровоснабжение могут привести к некрозу лоскута. Вторичное заживление возможно при сохранении жизнеспособной подлежащей кости и достаточном кровоснабжении (рис. 9-37а и 9-37Ь). При незавершенном процессе ремоделирования кости нередко развивается инфекция и сохраняется обнажение трансплантата (рис. 9-37с).
Сначала можно попытаться освежить и покрыть обнаженную поверхность слизистым или соединительнотканным лоскутом на ножке. В противном случае необходимо обеспечить вторичное заживление с регулярной обработкой 3 % раствором перекиси водорода и хлоргексидинсодержащим гелем. При длительном обнажении инфицированный трансплантат удаляют.
При получении крупного нёбного соединительнотканного трансплантата или формировании соединительнотканного лоскута на ножке также возможен некроз эпителия в области нёба (рис. 9-37с). Заживление раневых поверхностей не представляет сложностей, если только под ними не находится свежий костный трансплантат (рис. 9-37d).
Рис. 9-37а. Поверхностный, но обширный некроз лоскута на верхней челюсти справа при значительном нёбном смещении разреза
Рис. 9-37Ь. Спонтанное заживление через 3 недели
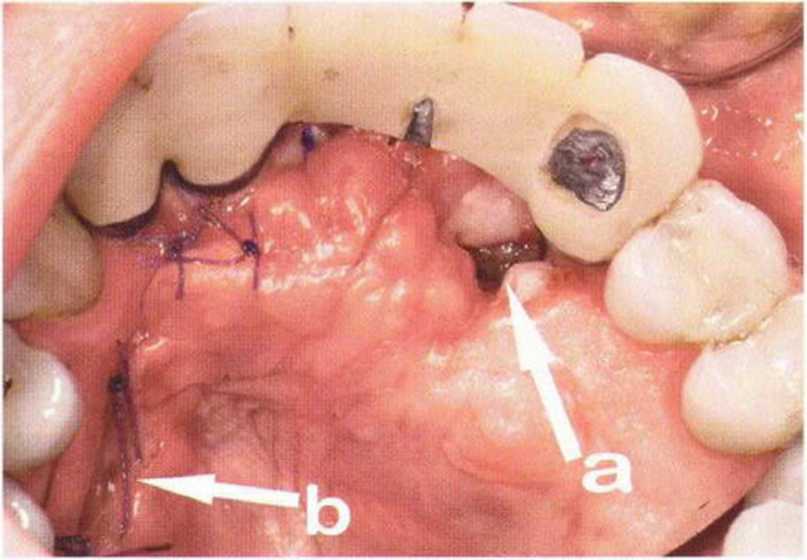
Рис. 9-37с. Некроз лоскута на нёбе с обнажением трансплантата на левой стороне (а) и без обнажения трансплантата на правой стороне (Ь) у злостного курильщика
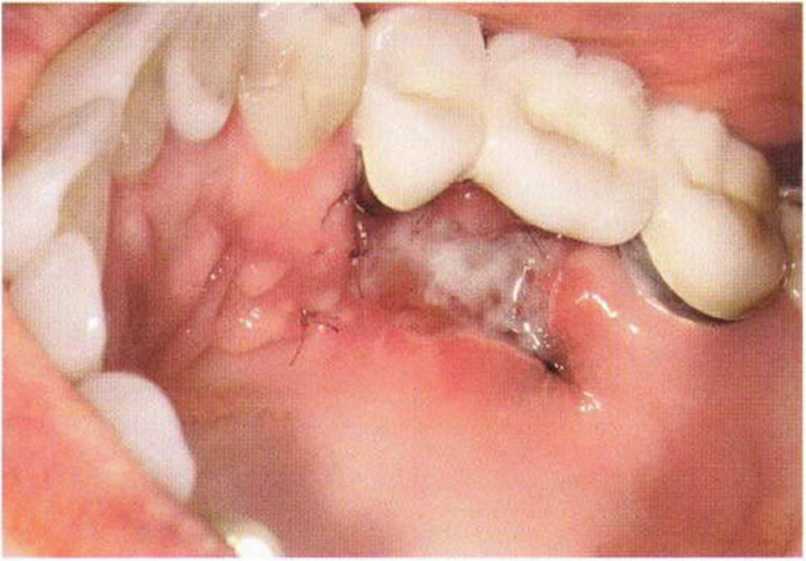
Рис. 9-37d. Некроз лоскута в донорской области
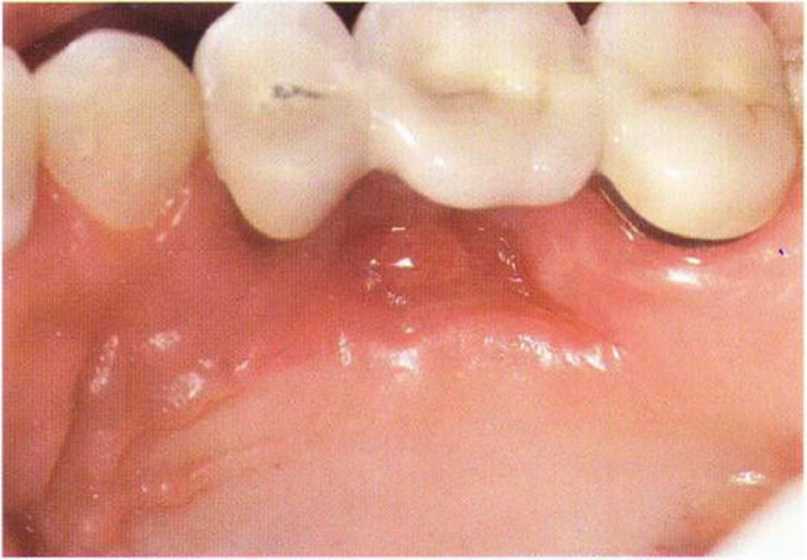
Рис. 9-37е. Спонтанное заживление через 14 дней
Важное условие долгосрочного успеха имплантологического лечения - стабильное состояние кости и десны в области имплантатов.-.
Толщина прилегающих мягких тканей после раскрытия имплантатов влияет на резорбцию кости в процессе формирования биологической ширины.’Предметом для беспокойства является только более интенсивная убыль кости, которая может быть результатом механической перегрузки или хронического воспаления мягких тканей вокруг имплантатов. В связи с этим прежде всего необходимо оптимизировать условия для самостоятельной гигиены в области ортопедических конструкций. При увеличении высоты альвеолярного гребня нередко происходит уменьшение глубины преддверия полости рта, поэтому перед протезированием показана вестибулопластика.
В течение первого годэ после протезирования может происходить убыль КПД в области имплантатов.- Для улучшения объема и качества десны после завершения протезирования с опорой на имплантаты, как правило, применяют свободные соединительнотканные трансплантаты, которые перекрывают коронально смещенным лоскутом.
Следует отметить, что этот метод предпочтительнее пересадки свободного десневого трансплантата, поскольку в последнем случае ткань по цвету и структуре не соответствует окружающим участкам.
Все научные данные указывают на потерю объема десневых сосочков вблизи как одного импланта-
,48.59.60,114
нескольких смежных. Причина этого.
заключается в резорбции подлежащей кости в процессе формирования биологической ширины.-Данный феномен часто наблюдается в области имплантатов и не является следствием регенеративных вмешательств. Резорбция также вероятна при неверном позиционировании имплантатов. Для сохранения объема костной ткани, достаточного для необходимой высоты десневого сосочка, между имплантатами должно быть минимальное расстояние 3 мм. Переключение платформ, при котором на имплантат большего диаметра устанавливают абатмент меньшего диаметра, позволяет сместить границу между имплантатом и абатментом от кости к центру первого, что уменьшает резорбцию костной ткани вокруг шейки имплантата.
9.15.1 Травмирование протезом мягких тканей над костным трансплантатом.
Изготовление провизорного протеза является одним из наиболее ответственных этапов имплантологического лечения. Области операции, особенно после обширных регенеративных вмешательств, должны быть защищены от внешнего давления во избежание обнажения, некроза и утраты трансплантата, поэтому использовать съемные провизорные протезы с опорой на мягкие ткани в области трансплантации не следует. Оптимальны провизорные несъемные протезы с опорой на естественные зубы или имплантаты с немедленной нагрузкой без контакта с десной в области промежуточной части. При обнажении трансплантата под воздействием провизорного зубного протеза проводят мероприятия, представленные в этой главе выше.
9.15.2 Подвижность имплантатов после протезирования.
В течение первых месяцев после трансплантации кости структура костной ткани остается неполноценной, поэтому необходимо максимально исключить нагрузку на имплантаты в этой области. Несмотря на соблюдение соответствующего срока приживления, остеоинтеграция имплантатов может быть недостаточной.
В связи с этим при изготовлении протеза с опорой на имплантаты, установленные в новообразованной кости, необходимо соблюдать соответствующие принципы, которые были подробно изложены в главе 8.
При возникновении подвижности имплантатов, например при вывинчивании формирователей десны или установке абатментов, допускается повторение этапа приживления под лоскутом.
9.15.3 Гипертрофия десны после пересадки соединительнотканного трансплантата.
Пересадку соединительнотканных трансплантатов проводят для улучшения качества или объема мягких тканей. Благоприятные результаты могут быть получены при использовании различных методик, если соблюдается протокол. В редких случаях через несколько лет наблюдается избыточный рост мягких тканей в области трансплантации. При эстетических нарушениях проводят корригирующую гингивэктомию (рис. 9-38a-9-38q).
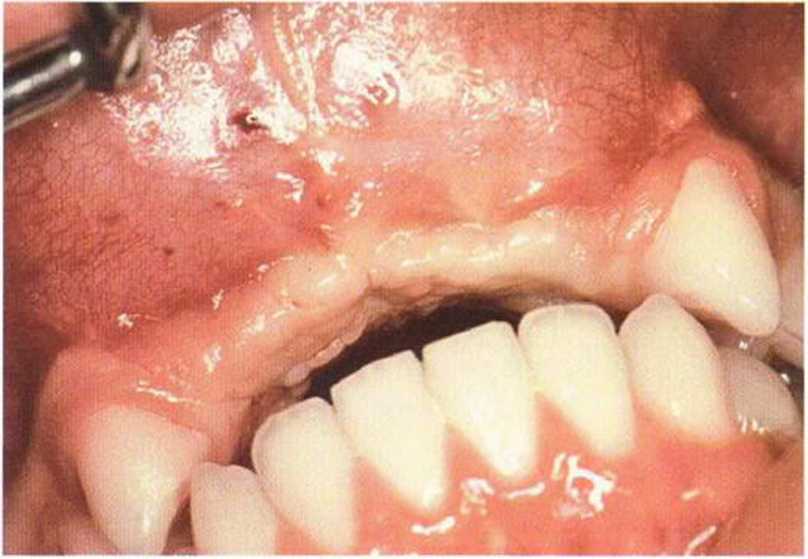
Рис. 9-38а. Состояние после имплантации и регенеративного вмешательства: отмечаются вестибулярное углубление и недостаток КПД
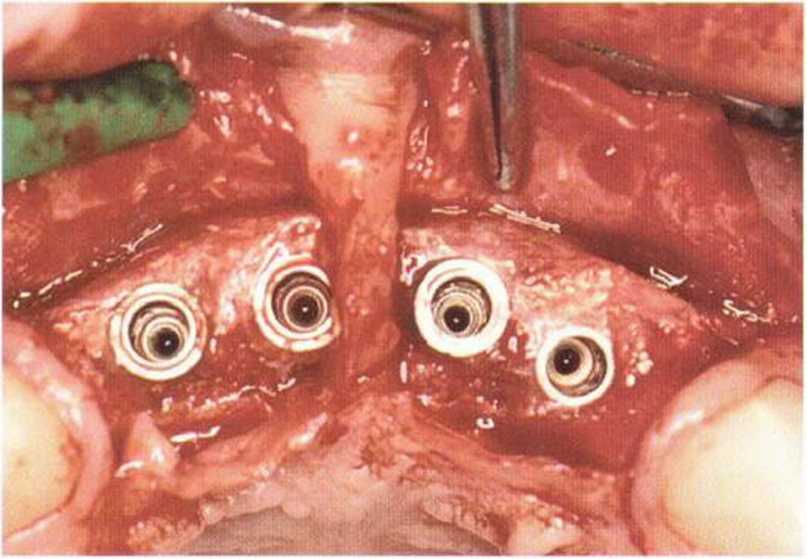
Рис. 9-38Ь. Наднадкостничное препарирование лоскута при раскрытии имплантатов
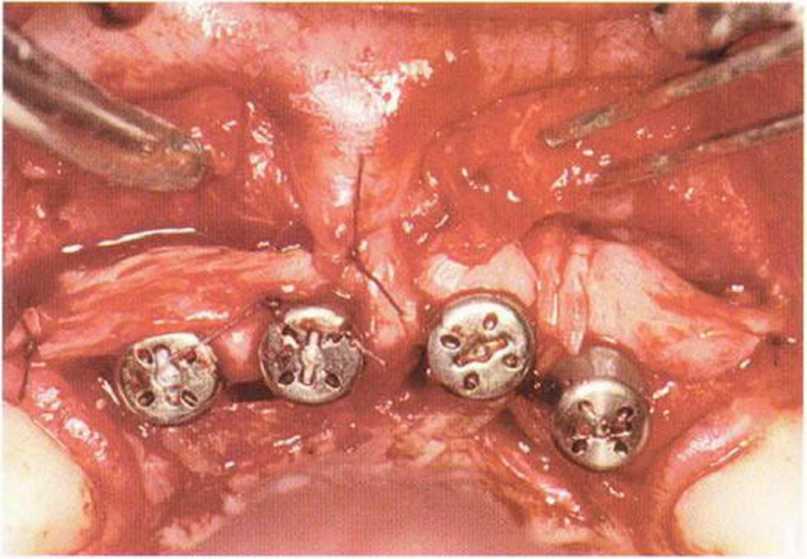
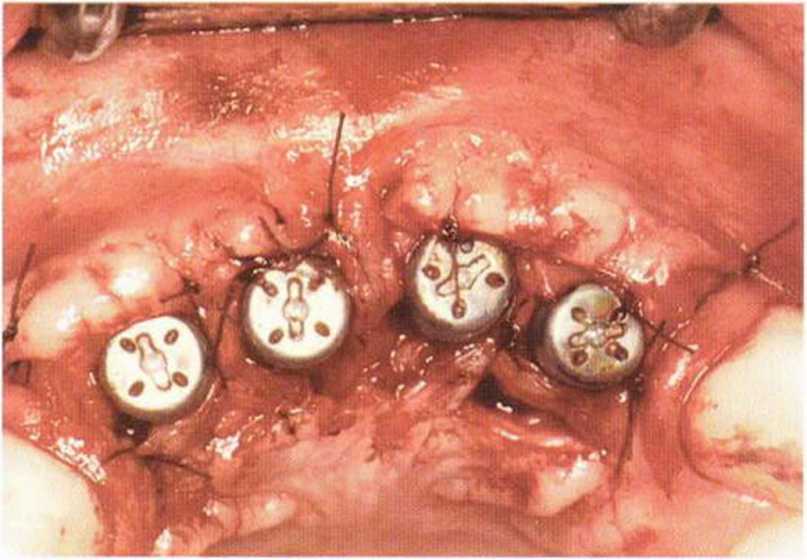
Рис. 9-38с. Стабилизация соединительнотканных трансплантатов на надкостнице.
Рис. 9-38d. Фиксация апикально смещенного лоскута к перфорированным формирователям десны
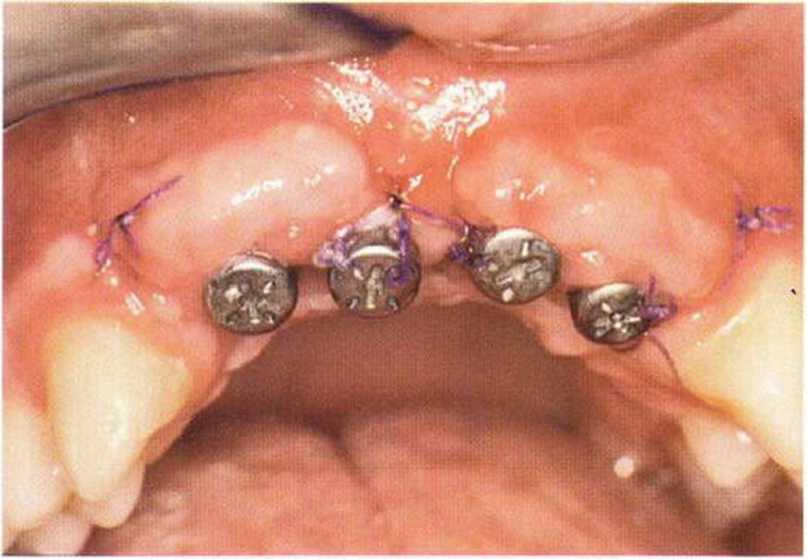
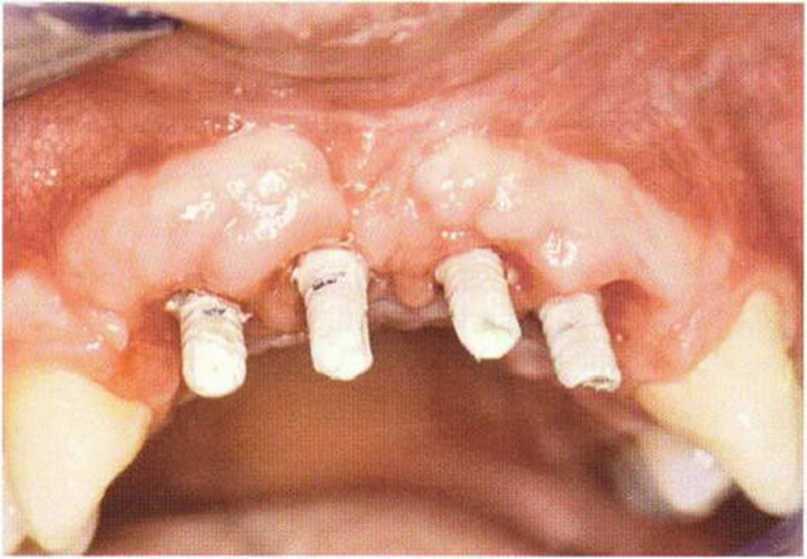
Рис. 9-38е. Клиническая ситуация через 14 дней после операции
Рис. 9-38f. Абатменты для провизорных коронок. Определяется дефицит мягких тканей в области центрального сосочка
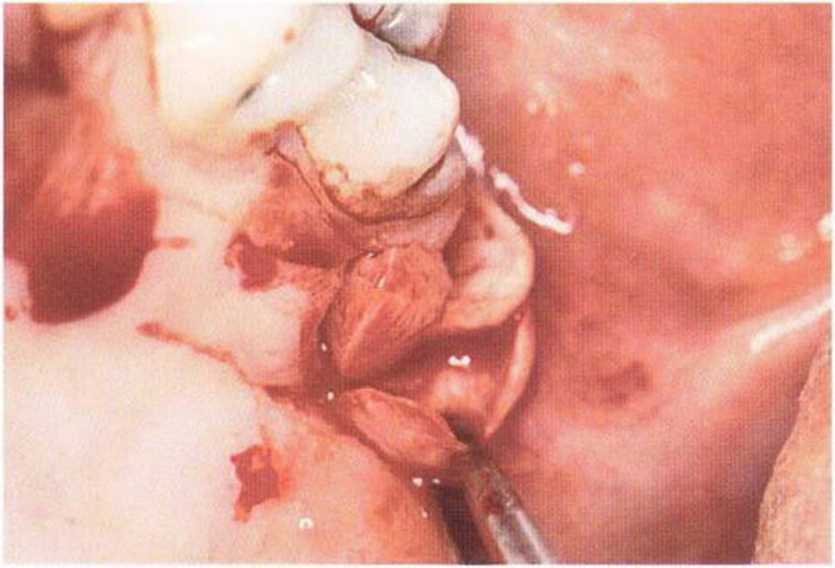
Рис. 9-38д. Получение соединительнотканного трансплантата в области бугра
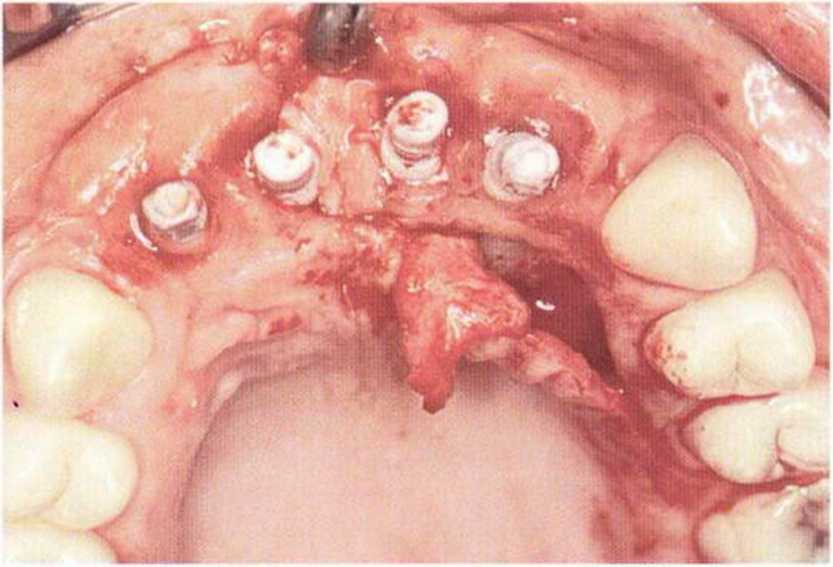
Рис. 9-38h. Стабилизация соединительнотканного трансплантата между двумя центральными имплантатами после деэпителизации десны. Сформирован передний соединительнотканный лоскут на питающей ножке
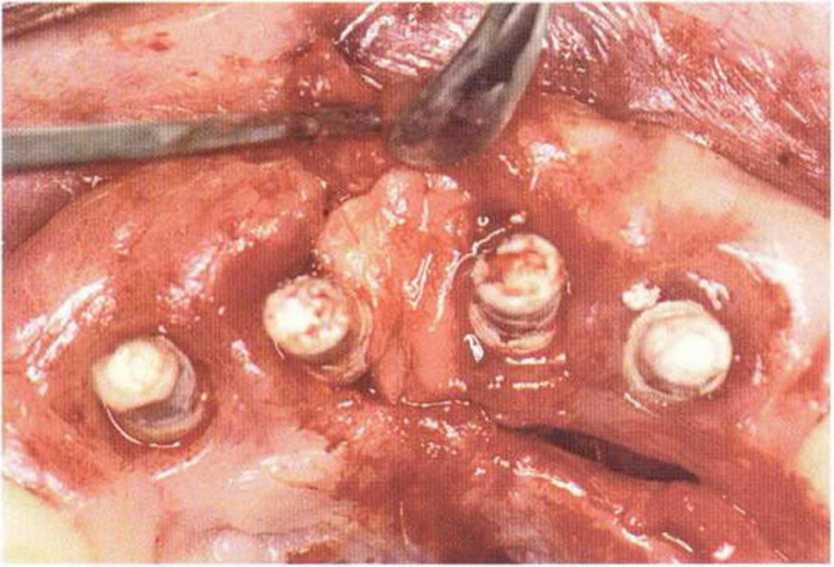
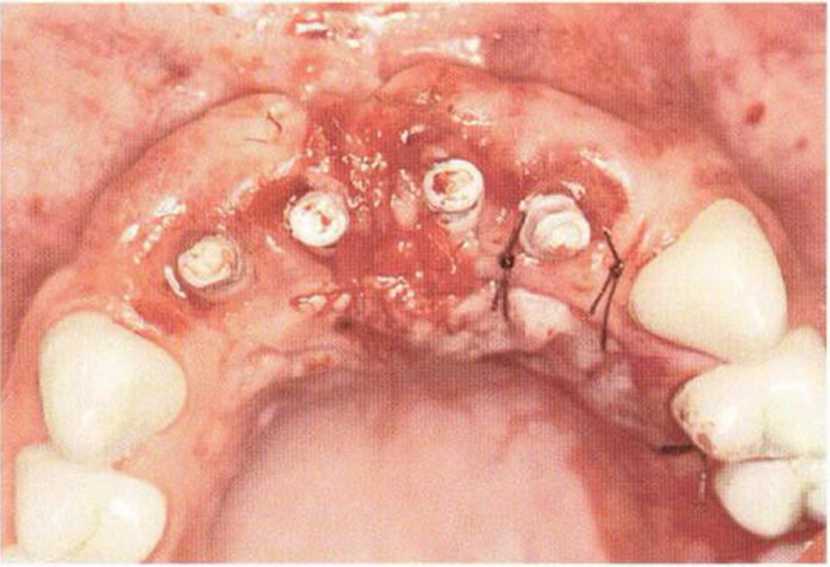
Рис. 9-38i. Ротация соединительнотканного лоскута над соединительнотканным трансплантатом.
Рис. 9-38j. Закрытие раны
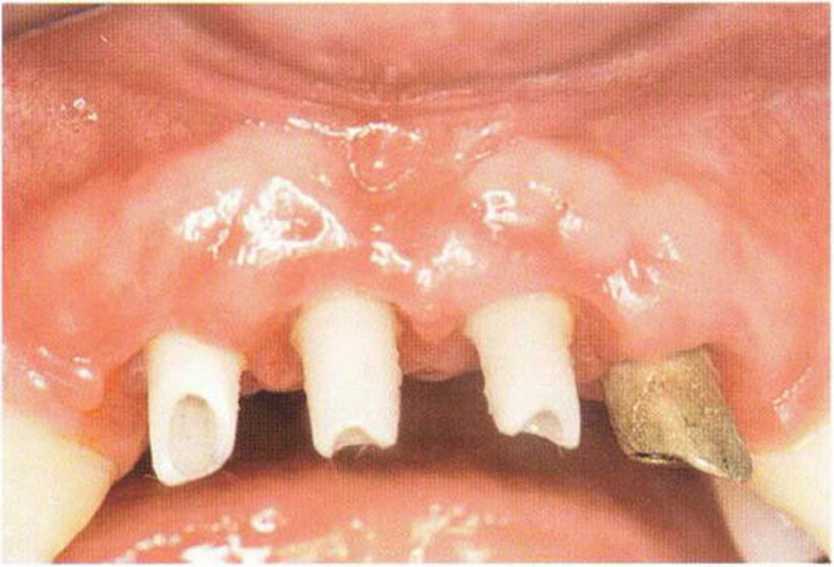
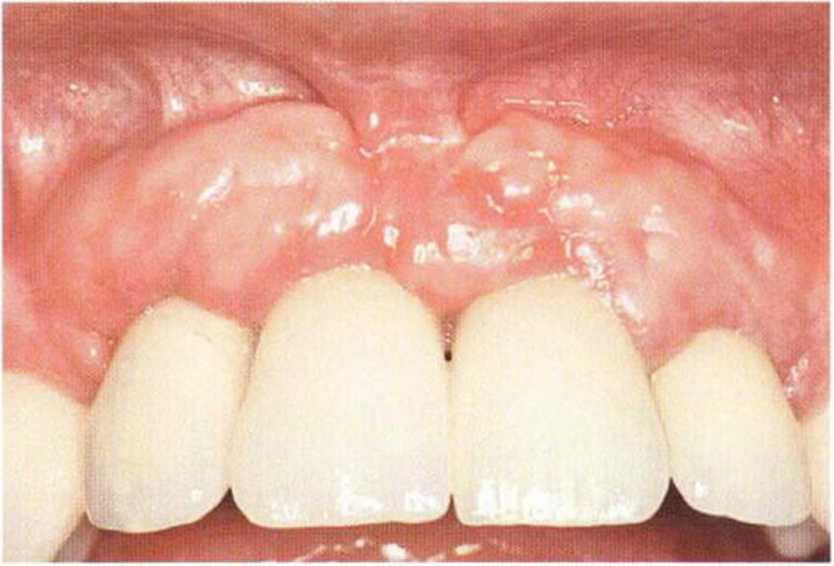
Рис. 9-381. Окончательное ортопедическое восстановление
Рис. 9-38к. Клиническая ситуация после установки керамических абатментов через 3 мес после операции
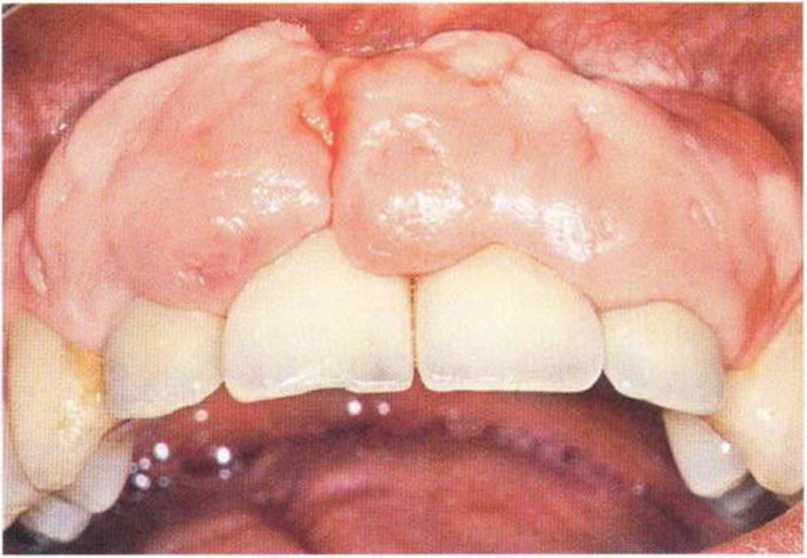
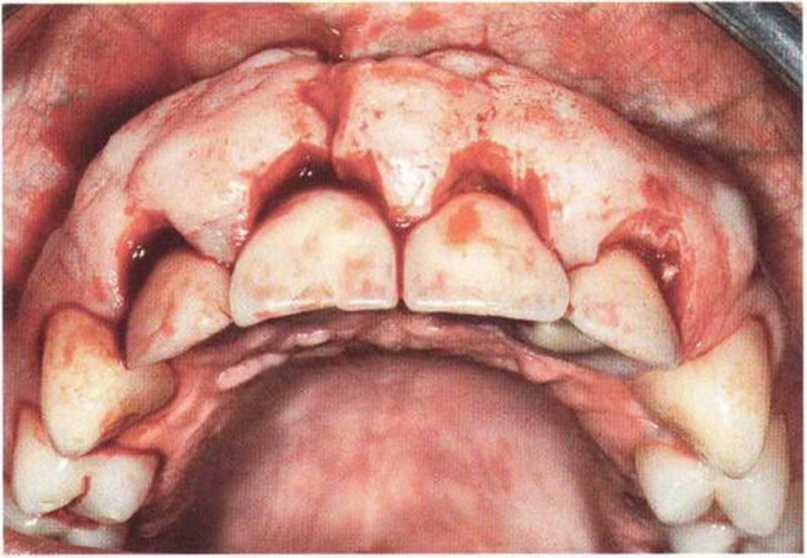
Рис. 9-38т. Через 10 лет после операции клинически определяется массивная гипертрофия десны
Рис. 9-38п. Моделирующая гингивэктомия
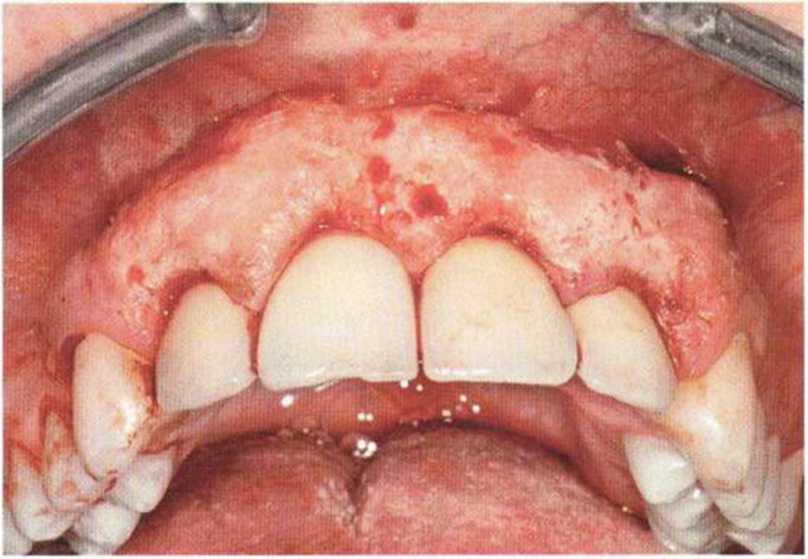
Рис. 9-38о. Сглаживание поверхности десны алмазным бором
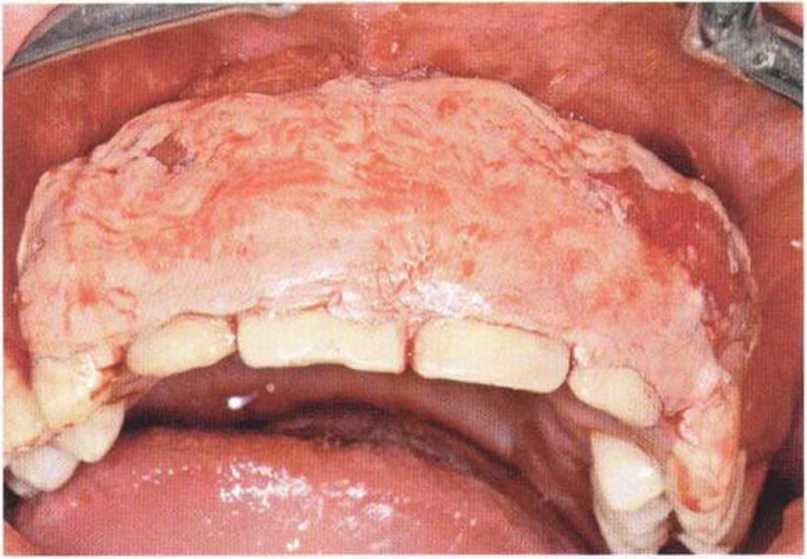
Рис. 9-38р. Раневая повязка
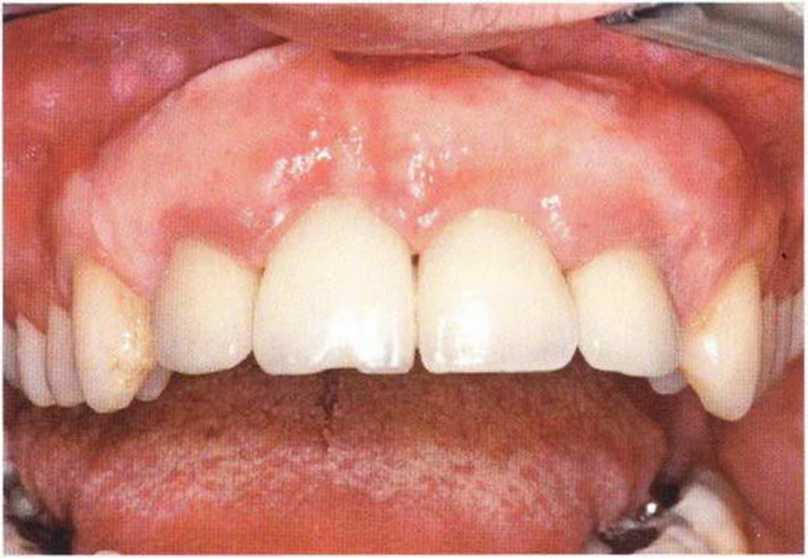
Рис. 9-38q. Клиническая ситуация через 4 недели после операции
По данным большого числа экспериментальных и клинических исследований, благодаря интенсивному междисциплинарному сотрудничеству в настоящее время обеспечиваются высокие стандарты надежности и безопаснос~и при замещении зубов с помощью остеоинтегрированных имплантатов.
Тем не менее долгосрочный успех такого лечения зависит от множества факторов.
Одним из таких факторов, играющих очень важную роль в остеоинтеграции, является качество.
костного ложа. Для остеоинтеграции имплантатов необходимо достаточное количество альвеолярной кости хорошего качества. При дефиците толщины или высоты альвеолярного гребня имплантация во многих случаях возможна только с помощью современных регенеративных методов.
Пересадка костных трансплантатов из внутри-ротовых источников применяется для двух- или трехмерной реконструкции альвеолярного гребня.
Опыт показывает, что независимо от локализации донорского участка при соблюдении определенного протокола лечения возможно безопасно, быстро, точно и относительно щадяще получить костные блоки на нижней челюсти.
Результат регенеративного вмешательства также зависит от надежного ушивания раны без натяжения. Расхождение краев лоскута над трансплантатом в большинстве случаев сопровождается ухудшением результатов лечения. При трехмерной пластике малотравматичное формирование лоскутов и пассивное ушивание раны обязательны.
Осложнения регенеративных вмешательств встречаются относительно редко, однако полностью не исключаются, как при имплантации или любом другом медицинском вмешательстве. Четкое определение показаний и тщательное планирование, соблюдение протокола вмешательств и устранение факторов риска способствуют успеху имплантологического лечения. Регулярное динамическое наблюдение позволяет своевременно выявлять и устранять осложнения. Огромное значение имеют доверительные отношения между врачом и пациентом, построенные на подробном информировании последнего о преимуществах и недостатках предлагаемого лечения.
барьерную функцию, препятствуя восстановлению прикрепления мышц (рис. 4-9а-4-9к).