Ионные вещества, такие, как хлориды, нитриды и оксиды металлов являются основными структурными компонентами в группе материалов, известных под названием керамики, а также в относящейся к керамике специфической группе материалов, называемой стеклами (см. главу 1.4). Эти материалы отличаются повышенной стабильностью благодаря высокой прочности ионной связи.
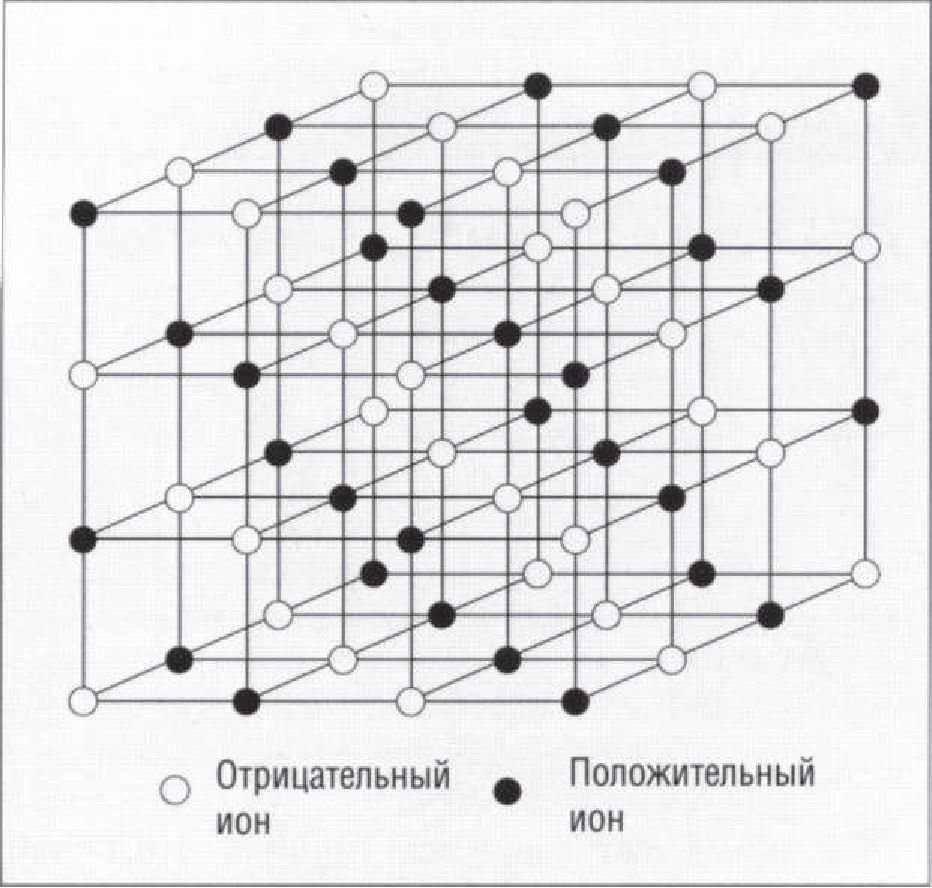
Рис. 1.3.5. Структура твердой соли, образованной ионными связями между ионами натрия (•) и хлора (о)
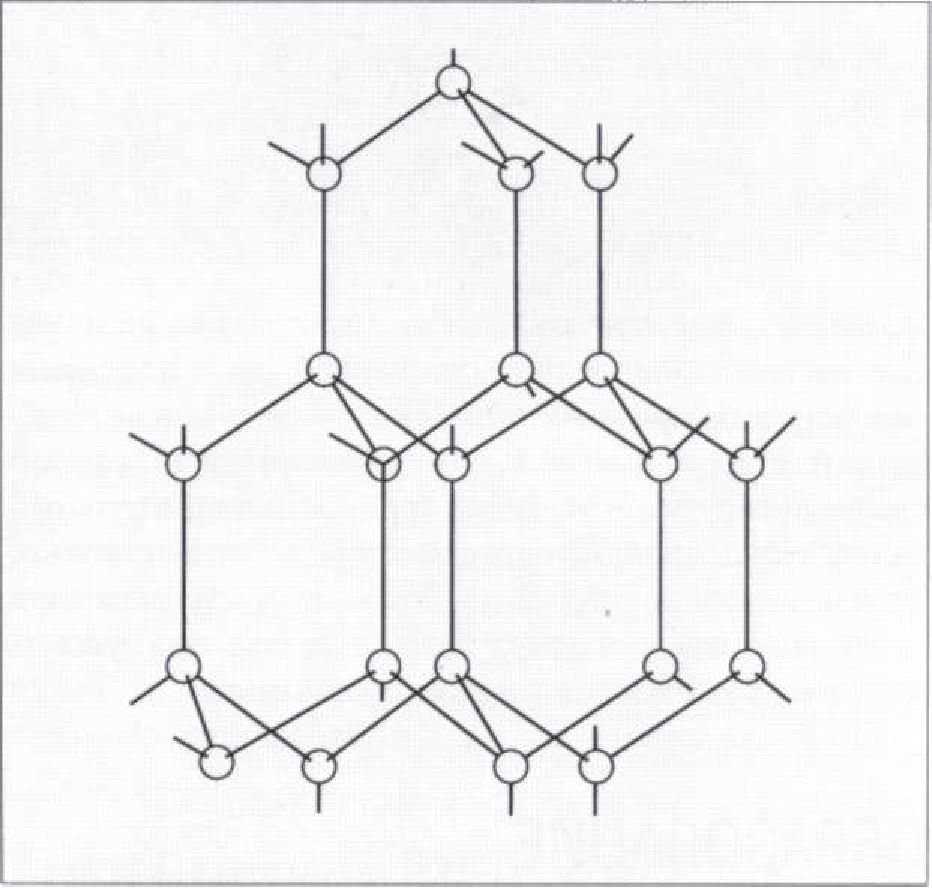
Рис. 1.3.6. Структура алмаза, образованная расположением углеродных связей в виде тетраэдра в трехмерном пространстве кристаллической решетки
Металлические связи в твердом теле.
Расположение, подобное ионным решеткам, может существовать и при наличии металлической связи. В этом случае отдельные атомы удерживаются не за счет сил прочного электростатического притяжения, наблюдаемого между атомами в ионных твердых телах, а за счет обобщенного облака электронов. Это облако придает особые свойства металлам, которые будут рассмотрены в главе 1.5.
Ковалентные связи в твердом теле.
Существует всего несколько твердых веществ с ковалентной связью — ими являются углерод, кремний и германий. Основным отличием ковалентной связи от двух других первичных связей является ее полярность. Полярность обусловливает серьезные ограничения на возможное пространственное расположение атомов.
Одним из примеров твердого материала с ковалентными связями является алмаз, который представляет собой одну из форм углерода. Электроны на внешней оболочке углерода расположены так, что для достижения конфигурации, подобной неону, требуются четыре дополнительных электрона. В случае алмаза это достигается за счет обобществления электронов соседних атомов углерода. Полярность этих связей такова, что они направлены в сторону четырех углов тетраэдра, в центре которого находится атомное ядро углерода. Объемное строение алмаза представлено на Рис. 1.3.6.
Твердые вещества с ковалентными связями, состоящие из одного элемента, встречаются крайне редко. Чаще ковалентные связи образуются между разными элементами. Поскольку для образования таких связей элементы вступают в химическую реакцию, образовавшаяся молекула становится крайне инертной по отношению к другим молекулам того же типа, поэтому вся совокупность молекул будет неспособной образовывать пространственную сетку.
Электронные орбиты перекрываются и электроны становятся общими, что приводит к полному завершению электронных орбит, которое делает связь между атомами очень стабильной. При таком строении отсутствуют незавершенные электронные орбиты, необходимые для дальнейшего соединения атомов по механизмам первичной связи. Таким образом, ковалентно связанные элементы образуют стабильные молекулы, и большинство элементов, соединенных с помощью ковалентных связей, представляют собой газ или жидкость. К этим соединениям относятся вода, кислород и водород. Вода переходит в твердое состояние при 0°С, и для того, чтобы это стало возможным, должны существовать какие-то дополнительные силы притяжения между молекулами воды, но эти силы не будут являться первичными связями.
Вторичные связи.
Два или большее число атомных ядер могут обладать общими электронами непропорционально долгое время в одном определенном положении. Это приведет к тому, что на одном конце молекулы может появиться незначительный по величине положительный заряд, а на другом конце — слабо отрицательный. В результате возникнет электрический дисбаланс, называемый электрическим диполем. Электрические диполи приведут к взаимодействию молекул друг с другом с образованием слабых связей, известных под названием сил Ван дер Ваальса. Эти относительно слабые связи слагаются из трех основных факторов взаимодействия:.
♦ взаимодействие между постоянными диполями;.
♦ взаимодействие между индуцированными диполями;.
♦ взаимодействие между мгновенными диполями.
Последнее взаимодействие известно под названием дисперсионного эффекта Лондона. Оно происходит в тех случаях, когда две молекулы, два иона или два атома, находятся в близком контакте. Эффект и является результатом взаимодействия между их хаотично движущимися электронами.
Особым видом взаимодействия между диполями (так называемое диполь-дипольное взаимодействие) является водородная связь. Атом водорода можно представить, как протон на конце ковалентной связи, но, в отличие от других атомов, положительный заряд
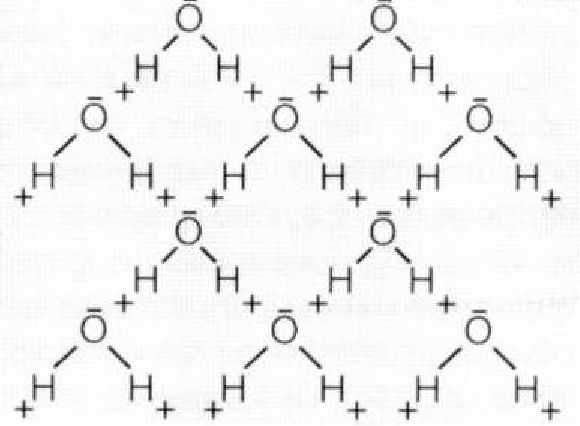
Рис. 1.3.7. Образование водородных связей в структуре льда
протона не экранируется окружающими электронами. Таким образом, протон на конце ковалентной связи несет положительный заряд, и он будет притягивать электроны атомов других молекул. Необходимым условием образования водородной связи является электроотрицательный атом, расположенный поблизости от атома водорода, который в свою очередь, сам связан с электроотрицательным атомом. Примером образования водородной связи является лед, где присутствует взаимодействие между атомом водорода, принадлежащим одной молекуле, и атомом кислорода, относящимся к другой (Рис. 1.3.7).
Прочность этой связи мала — она составляет всего 0,4 эВ (электрон вольт), поэтому при нагревании до температур выше 0°С эта связь разрывается. Большое значение водородной связи состоит в том, что она позволяет объяснить свойственную органическим молекулам, в том числе протеинам, способность к интенсивной адсорбции, и, следовательно, может рас-
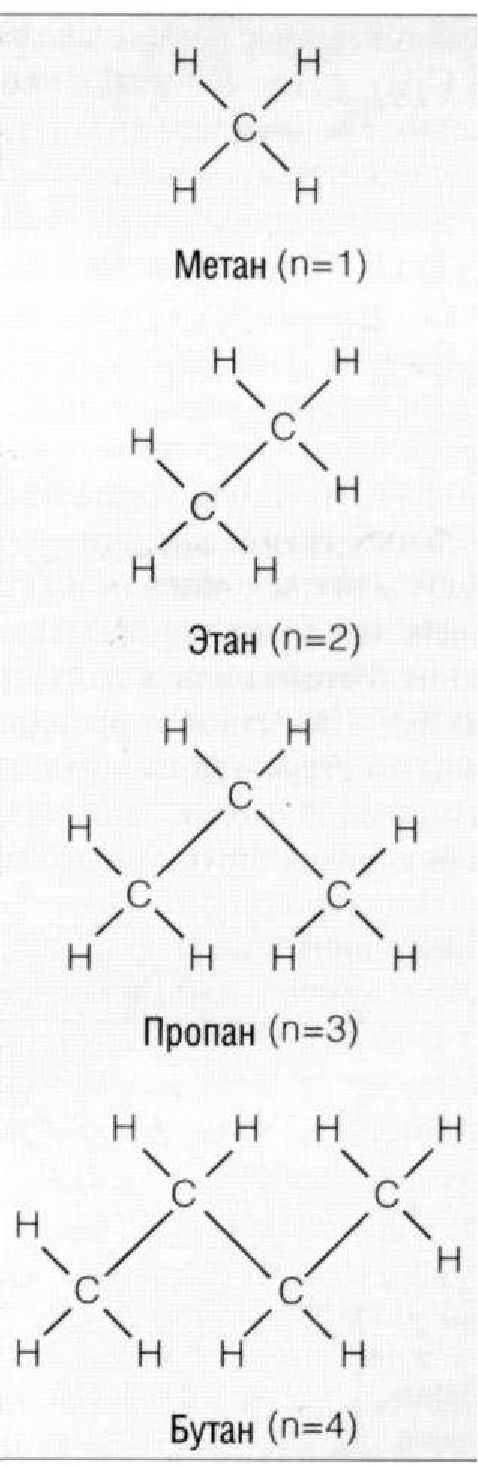
Рис. 1.3.8. Первые четыре члена алифатического ряда с основной углеводородной цепью, соответствующей формуле
С
п
Н
2 п + 2
сматриваться, как неотъемлемый фактор процессов жизнеобеспечения. Вторичные связи формируют основу молекулярного притяжения в твердых телах.
Твердые тела, образованные межмолекулярными связями.
Существует возможность создания множества разных молекул, некоторые из которых могут образовывать при комнатной температуре твердые вещества. Если эти молекулы обладают достаточной длиной, они могут соединяться друг с другом за счет многочисленных диполь-дипольных взаимодействий. Низкая прочность связи означает, что такие молекулярные твердые вещества имеют очень низкую температуру плавления, верхним пределом которой является температура 100°С.
Для того, чтобы понять, как образуются твердые вещества, лучше всего представить себе группу молекул, известную под названием линейных алканов. Основой их строения является прямая цепь углеводоров, отвечающих формуле С
п
Н
2п
+
2
, где п — любое положительное число. Простейшим соединением в этой группе является метан, строение которого отвечает формуле (СН
4
), где n= 1. Если отнять по одному атому водорода от каждой молекулы метана и соединить эти молекулы друг с другом напрямую при помощи связи «углерод-углерод», то получится этан. Этот процесс может длиться до образования очень крупных молекул (Рис. 1.3.8).
Если материал будет состоять из очень большого количества групп — СН
2
-, то в результате присоединении дополнительных групп, аналогичного строения, его свойства будут меняться лишь незначительно. Подобные материалы известны под названием полиэтилены. Это название состоит из двух частей: поли означает много, а этилен — основной структурный элемент цепи. Материалы со структурами подобного типа напваются полимерами, поскольку они состоят из многократно повторяющихся структурных элементов, называемых мерами. Механизм образования полимерами множества твердых веществ с разнообразными структурами, будет подробно рассмотрен в главе 1.6.
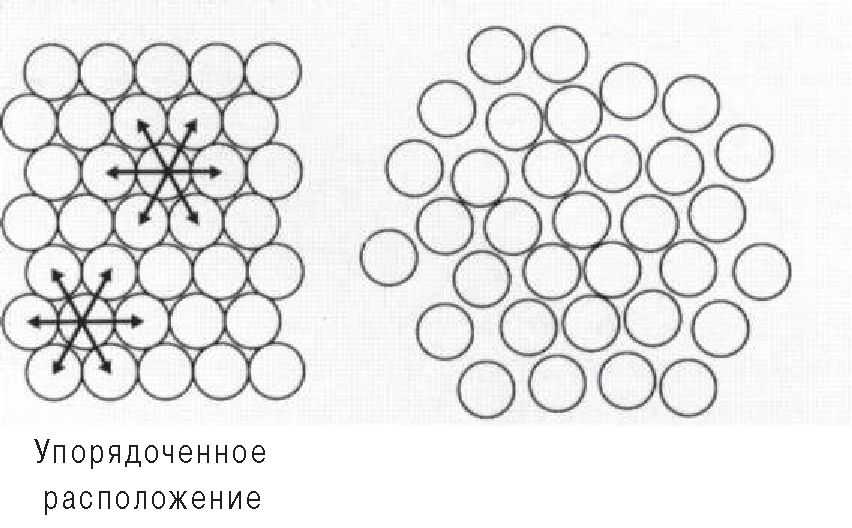
Рис. 1.3.9. Упорядоченное и неупорядоченное (хаотичное) расположение атомов
