Со временем установка имплантатов становится невозможной без восстановления альвеолярных гребней с помощью аутогенных костных трансплантатов. Успех имплантологического лечения, особенно в эстетически значимой зоне, во многом зависит от правильного позиционирования имплантатов относительно предполагаемого протеза. При недостаточной высоте и толщине альвеолярного гребня для установки имплантатов в нужном положении показаны регенеративные вмешательства, выбор которых зависит от морфологических особенностей костного дефекта.
В последние полтора десятилетия было предложено много методов реконструкции альвеолярного гребня с применением аутогенных трансплантатов, аллогенных или аллопластических материалов. Несмотря на многообещающие перспективы аллопластических и аллогенных- материалов, а также направленной тканевой регенерации,- их эффективность уступает таковой при использовании аутогенных костных трансплантатов. Кроме того, аутогенная костная ткань обладает биологическими и иммунологическими преимуществами, а также не ассоциируется с риском переноса инфекционных агентов. Аутогенные трансплантаты кости характеризуются оптимальными механическими (кортикальный слой) и остеогенными (губчатое вещество) свойствами, которых лишены ксеногенные или аллогенные материалы.--.
В литературе описаны разные донорские участки для получения аутогенных трансплантатов, например теменная кость, большеберцовая кость, ребра, бугор верхней челюсти, нёбный торус и нижнечелюстной торус, скуловая кость, гребень подвздошной кости,----- подбородок и ветвь нижней челюсти.-- По сравнению с другими донорскими участками трансплантаты из нижней челюсти отличаются минимальной резорбцией после приживления.
Ниже представлены способы получения костных трансплантатов на внутриротовых донорских участках, описаны протоколы хирургических вмешательств и используемые инструменты,- показания, преимущества и возможные осложнения.
Кроме того, обсуждаются основополагающие биологические принципы реконструкции атрофированного альвеолярного гребня с помощью костных трансплантатов.
5.2 Биологические принципы регенерации с помощью костных трансплантатов.
Приживление всех типов аутогенных трансплантатов, например кости, мягких тканей или зубов, зависит от одинаковых биологических процессов. Во всех случаях успех трансплантации обусловлен реваскуляризацией трансплантата.- При быстром восстановлении кровоснабжения вероятность приживления трансплантата повышается. Как правило, реваскуляризация инициируется в течение первых нескольких часов после трансплантации. Клетки трансплантата, лишенные кровоснабжения после пересадки, сохраняют жизнеспособность до 4 суток благодаря внутренним резервам и диффузии питательных веществ. Восстановление кровотока в первые 3-4 дня обеспечивает последующее выживание тканей. В противном случае клетки погибают. При этом трансплантаты мягких тканей некротизируются и отторгаются, однако в костных трансплантатах протекают иные процессы. Несмотря на атрофию и отмирание биологических компонентов, в костном трансплантате сохраняются минеральные вещества и неорганический каркас (подобно раковине после гибели моллюска), который служит опорой и направляющей для новых костных клеток.
Из принимающего ложа через кровеносные сосуды в трансплантат поступают остеобласты.
Skoglund и соавт. с помощью микроангиографии изучили особенности реваскуляризации трансплантированных или реплантированных зубов с незавершенным формированием корня. Через 10 дней пульпа реваскуляризуется на 50 %, и через 30 дней процесс завершается полностью.
Через 180 дней при сохраняющейся удовлетворительной васкуляризации объем пульпарной полости значительно уменьшается. Описанный клинический феномен наблюдается после успешной трансплантации зубов (рис. 5-1a-5-1h). При этом рентгенологически определяется постепенная облитерация пульпарной камеры и корневых каналов (рис. 5-1 i и 5-1 j). Клинически и гистологически установлено, что такая облитерация происходит главным образом благодаря образованию не дентина, а костной ткани (рис. 5-1 к и 5-11). Реваску-ляризация трансплантированных зубов осуществляется через открытые апикальные отверстия, а в костных трансплантатах пространства для будущих кровеносных сосудов формируются вследствие действия остеокластов.
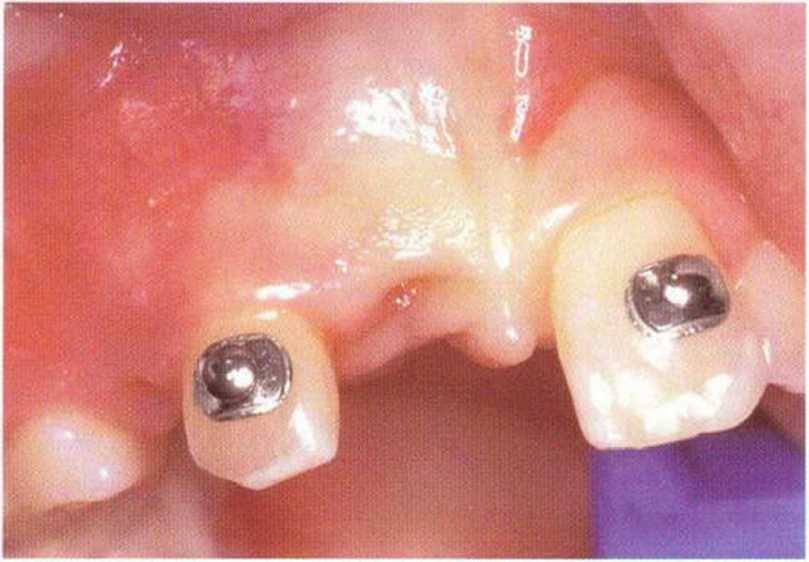
Рис. 5-1 а. Пациент 10 лет, зуб 11 утрачен в результате травмы
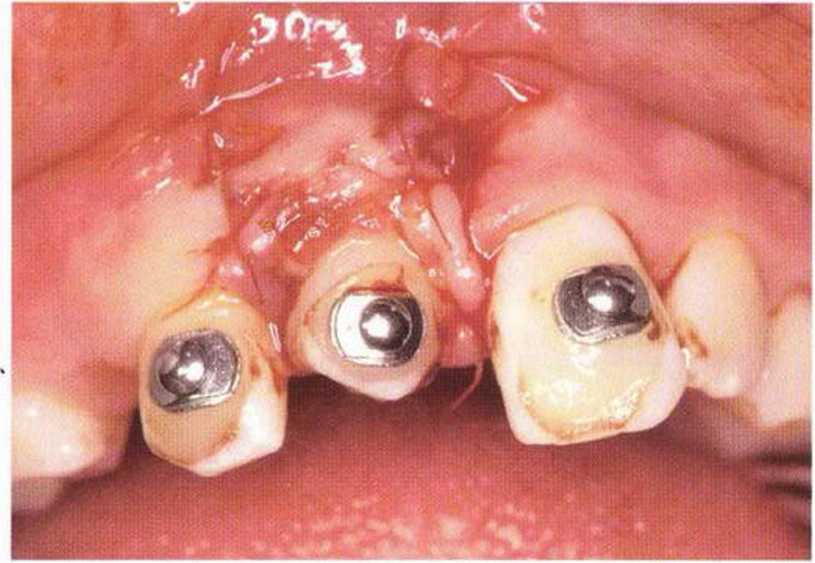
Рис. 5-1Ь. Для замещения утраченного перэднего зуба показана трансплантация премоляра. Вероятность долгосрочного успеха такого лечения составляет более 95 %. В качестве трансплантата обычно используют первый премоляр нижней челюсти (однокорневой зуб с маленькой коронкой и слабо выраженным язычным бугорком)
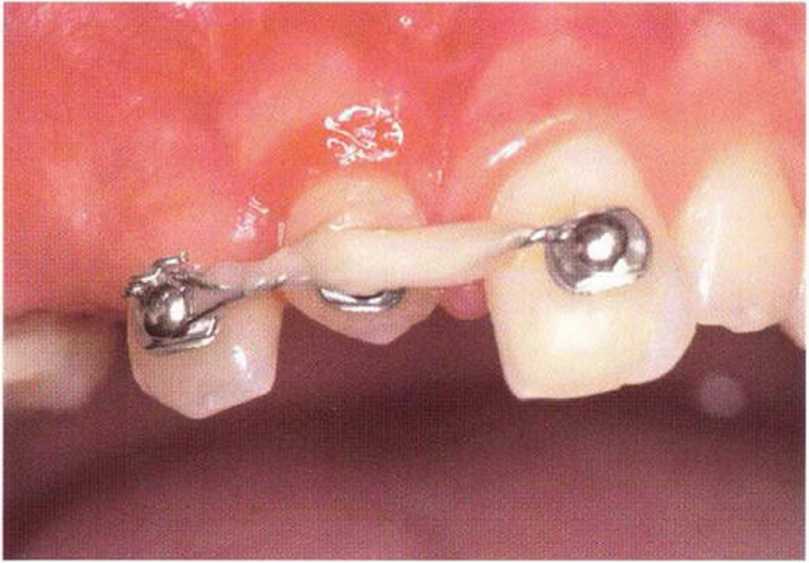
Рис. 5-1 с. Клиническая ситуация через 3 недели после операции: трансплантированный зуб шинируется к соседним зубам с помощью проволоки и композита в течение 5 недель.
Рис. 5-1d. Через 6 мес после операции: после удаления шины коронке трансплантированного зуба придали нужную форму с помощью композита
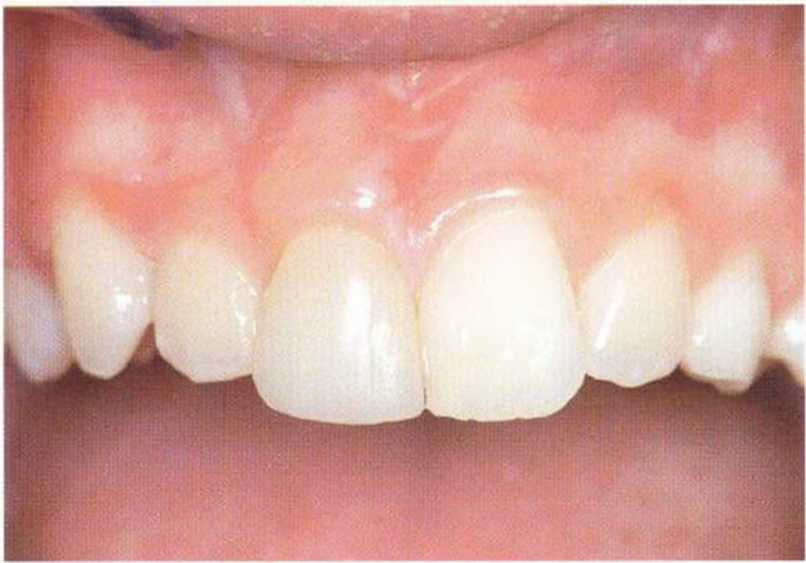
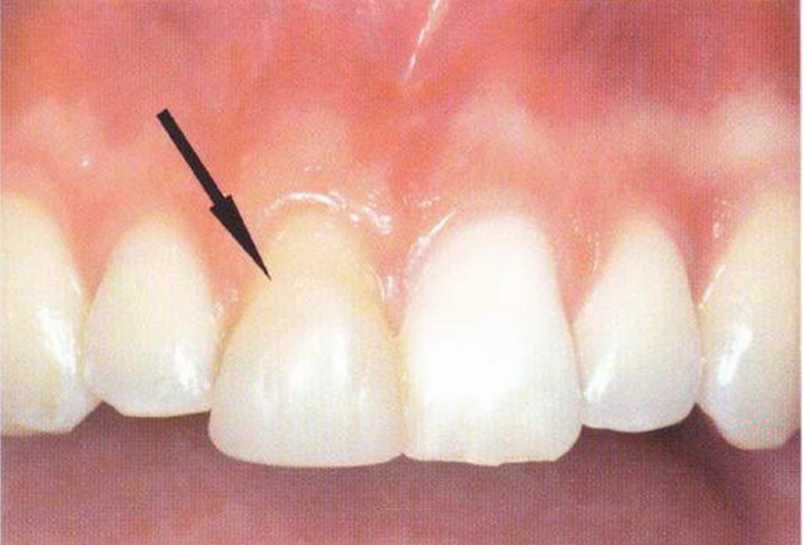
Рис. 5-1 е. Клиническая ситуация через 4 года после трансплантации.
Рис. 5-1f. Клиническая ситуация через 10 лет после трансплан тации: рост трансплантированного зуба продолжается, граница композитной реставрации сместилась коронально
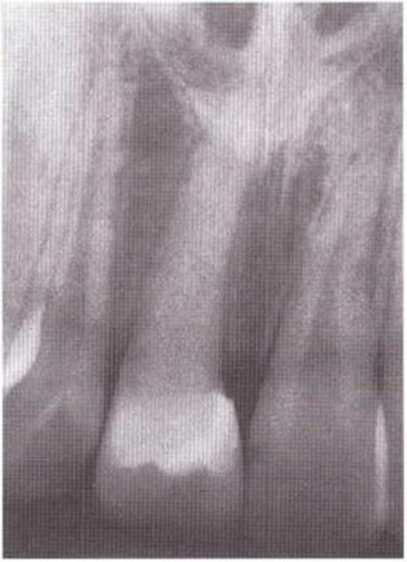
Рис. 5-1 h. Контрольная рентгенограмма через 10 лет после операции: дальнейший рост при полной облитерации пульпы
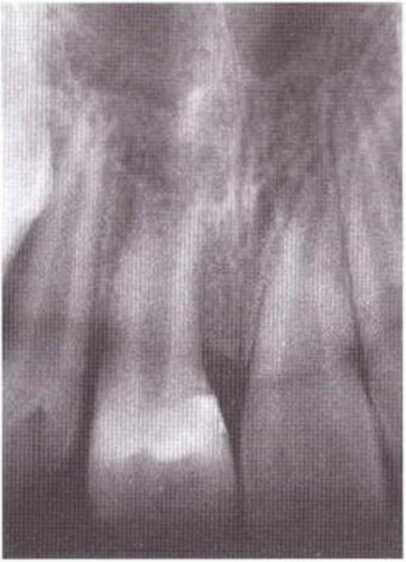
Рис. 5-1 д. Контрольная рентгенограмма через 3 мес после операции: четко определяются пульпа и широко открытое апикальное отверстие
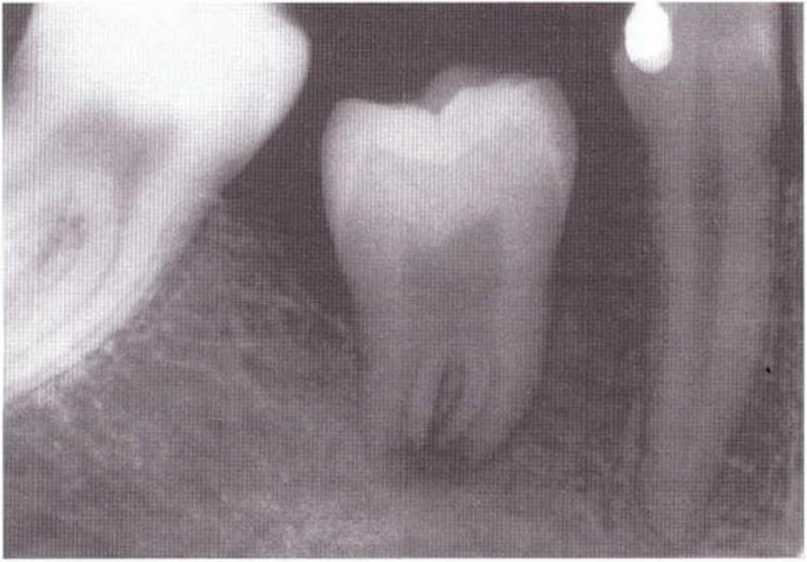
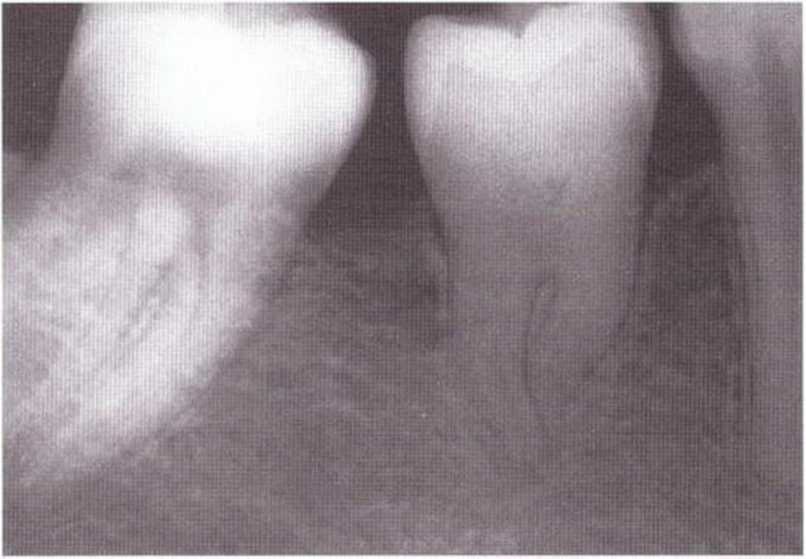
Рис. 5-1 j. Контрольная рентгенограмма через 14 лет после трансплантации зуба: отмечается выраженная облитерация полости пульпы и корневых каналов. Трансплантированный зуб достиг окклюзионной плоскости, произошел дальнейший рост корней

В первые дни после трансплантации костного блока сохранение его жизнеспособности обеспечивают кровеносные сосуды прилегающих к трансплантату структур. Важную роль в реваскуляризации отделов трансплантата, удаленных от принимающего ложа, играют кровеносные сосуды надкостницы и мягких тканей. Перекрывание костного блока мембраной приводит к значительному замедлению реваскуляризации и ремоделирования удаленных от принимающего ложа отделов трансплантата. De Marco и соавт. в сравнительном исследовании на крысах показали более быструю, интенсивную и обширную реваскуляризацию костных трансплантатов без применения мембраны, чем при перекрывании костных блоков мембраной из расширенного политетрафторэтилена (р-ПТФЭ)..
Нерезорбируемые мембраны повышают стабильность объема костного блока и уменьшают резорбцию трансплантата на первом этапе. Однако после удаления такой мембраны отмечаются почти полное отсутствие ремоделирования и минимальная реваскуляризация поверхностного слоя костного блока. Клинически это проявляется относительно белой поверхностью трансплантата (рис. 5-1т-5-1о). В отстутствие реваскуляризации поверхность трансплантата некротизируется, что приводит к его выраженной резорбции в отсроченном периоде. Резорбируемые мембраны имеют тот же недостаток. Кроме того, в ходе резорбции мембраны повышается скорость поверхностной резорбции костного блока (рис. 5-1 р-5-1 г).
Трансплантаты из гребня подвздошной кости обладают выраженным регенеративным потенциалом (рис. 5-2a-5-2h), поскольку в основном представлены губчатым веществом.’ Костный мозг характеризуется высокой способностью к реваскуляризации, что способствует выживаемости большинства костных клеток трансплантата,но, несмотря на высокое качество регенерации, трансплантаты из гребня подвздошной кости не обеспечивают идеальных условий для остеоинтеграции имплантатов. При биопсии через 4 мес после пересадки таких трансплантатов отмечается низкая плотность кости (D4) и обширный фиброз костного мозга (рис. 5-2i). Степень остеоинтеграции имплантатов зависит от качества кости, поэтому у имплантатов, установленных в области пересадки трансплантата из гребня подвздошной кости, сначала отмечается меньшая площадь контакта поверхности имплантата с костной тканью. Со временем под влиянием генетических и функциональных факторов плотность костной ткани вокруг имплантата повышается, и примерно через 2 года он приобретает структуру прилегающего к трансплантату костного ложа (рис. 5-2j). Тем не менее в большинстве случаев протезирование с опорой на имплантаты проводят значительно раньше, поэтому вследствие недостаточно высокой первичной остеоинтеграции возможно их случайное вывинчивание или смещение. Напротив, костные трансплантаты, полученные на нижней челюсти, представлены преимущественно кортикальным веществом с незначительным количеством губчатой ткани. Такие трансплантаты медленнее реваскуляризуются и обладают меньшим регенеративным потенциалом, но благодаря высокой плотности обеспечивают большую площадь контакта костной ткани с поверхностью имплантата.’ В толще трансплантатов из нижней челюсти в течение 3 лет сохраняется множество погибших остеоцитов, что препятствует остеоинтеграции имплантатов (рис. 5-2к).
Реваскуляризация трансплантата зависит не только от качества донорской кости, но и от потенциала регенерации принимающего ложа,’ которое, как правило, невозможно определить до начала вмешательства или даже до получения его результатов. Этим объясняются различия приживления двух трансплантатов из одного источника, но установленных на разных участках. Например, на одном участке, несмотря на плотный костный контакт с принимающим ложем, через 4-5 мес после трансплантации могут отмечаться менее интенсивная реваскуляризация и большее количество омертвевших остеоцитов. В то же время у другого трансплантата при менее выраженном костном контакте за тот же период происходит более выраженная реваскуляризация (рис. 5-3a-5-3d). Кроме того, плохо реваскуляризованный трансплантат с высоким содержанием омертвевших остеоцитов не обеспечивает оптимальных условий для остеоинтеграции имплантатов (рис. 5-Зе—5-Зд). Следовательно, нужно модифицировать методы трансплантации костных блоков для улучшения реваскуляризации и приживления трансплантатов, повышения регенеративного потенциала кортикальных трансплантатов и сохранения плотности кости для достижения оптимальной остеоинтеграции.
Известно много теорий, объясняющих приживление костных трансплантатов. В 1863 г. ортопед Вольфф (Wolff) впервые отметил влияние остеогенеза на приживление костных трансплантатов.
По его представлению, регенерацию костной ткани при трансплантации обеспечивает большое количество сохранившихся жизнеспособных остеобластов. Однако Barth (1893) на основании гистологических данных пришел к мнению, что число витальных остеобластов недостаточно для регенерации кости, и предложил каркасную теорию. В соответствии с ней регенерация осуществляется посредством остеокондукции: обычно сохраняющаяся после отмирания биологической части костной клетки минерализованная структура трансплантата служит каркасом для остеобластов принимающего ложа, которые в значительной степени обеспечивают костную регенерацию. В настоящее время выделяют третий - остеоиндук-тивный - способ костной регенерации при использовании аутогенного трансплантата (Boyne, 1997).Остеоиндукция заключается в дифференциации полипотентных клеток в остеогенные клетки и остеобласты, которые, в свою очередь, способны развиваться до остеоцитов. Этот процесс протекает под влиянием гормонов и костных морфогенетических протеинов (КМП). Главное преимущество аутогенных костных трансплантатов заключается в том, что они задействуют три регенеративных механизма. По сравнению с другими материалами (например, обладающими только остеокондуктивной активностью) аутогенная кость обладает гораздо более высоким потенциалом регенерации и поэтому считается золотым стандартом.
Рис. 5-1 к. Распил через пульпу третьего моляра, трансплантированного 8 лет назад: полость пульпы (Р) заполнена костеподобной твердой тканью (стрелка: кровеносный сосуд, D: дентин)
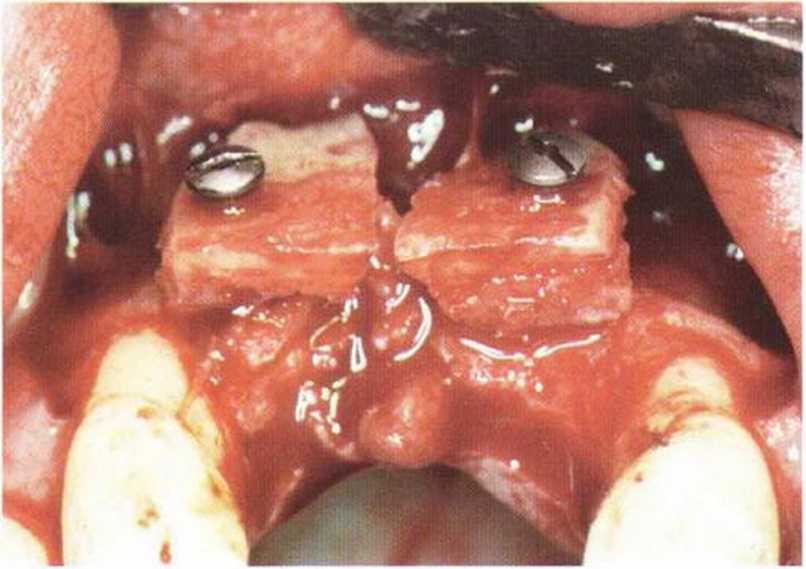
Рис. 5-1 т. Трансплантация двух костных блоков в области передних зубов верхней челюсти
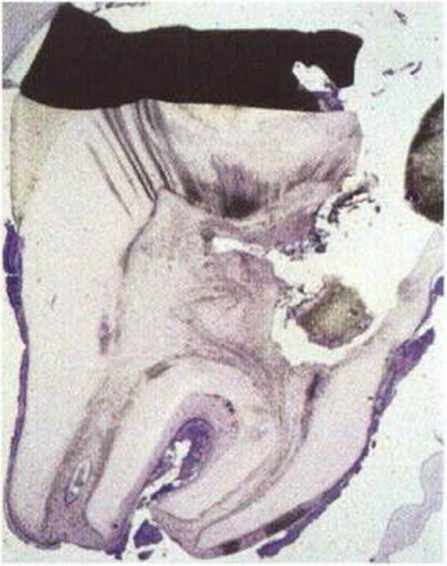
Рис. 5-11. На гистологическом срезе третьего моляра, трансплантированного 14 лет назад (удален по поводу глубокого кариеса), полость пульпы и корневые каналы заполнены костеподобными клетками
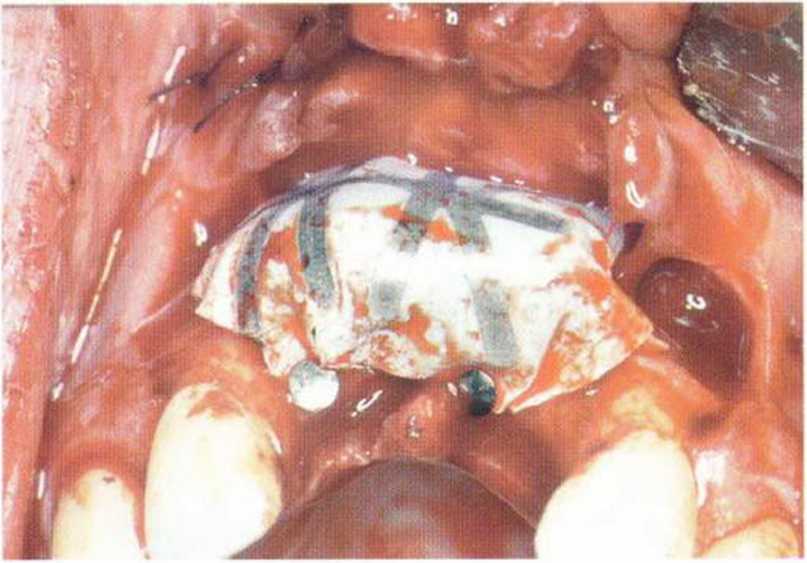
Рис. 5-1 п. Трансплантаты перекрыты нерезорбируемой мембраной (Gore-Tex, WL Gore)
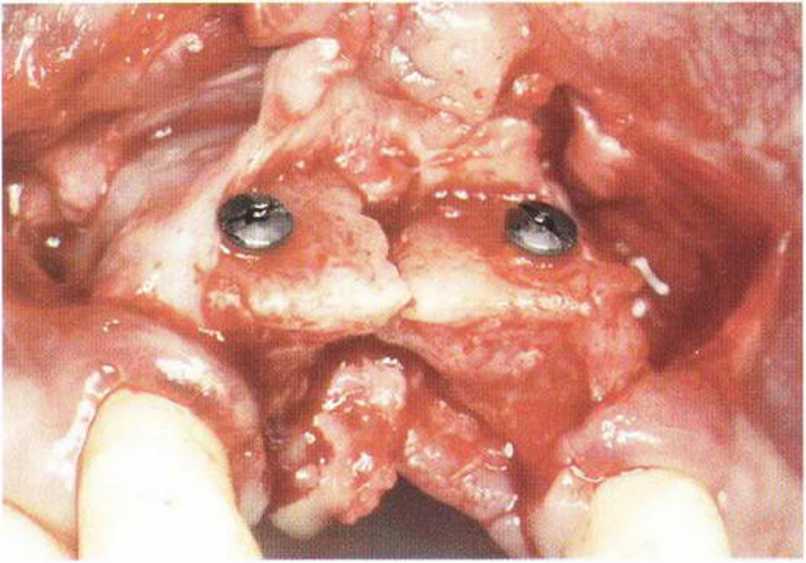
Рис. 5-1 о. Повторное вмешательство через 8 мес: после удаления мембраны отмечается белый оттенок поверхности трансплантата, практически не подвергшегося резорбции
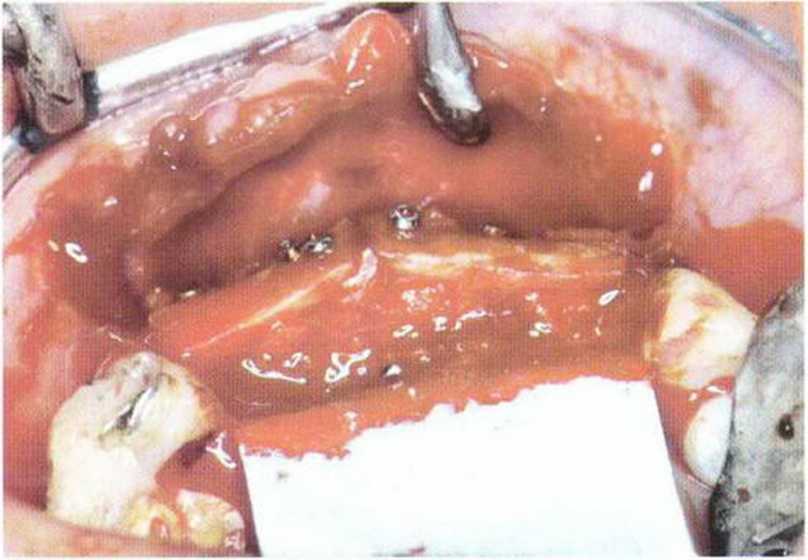
Рис. 5-1 р. Трансплантация костного блока в области зубов 12-22, резорбируемая мембрана (Bio-Guide, Geistlich Biomaterials) подготовлена к использованию
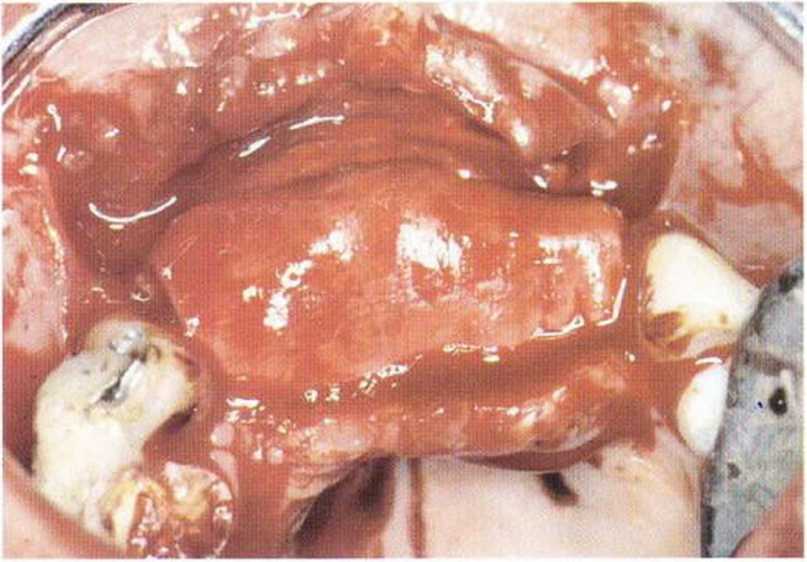
Рис. 5-1 q. Трансплантаты перекрыты резорбируемой мембраной
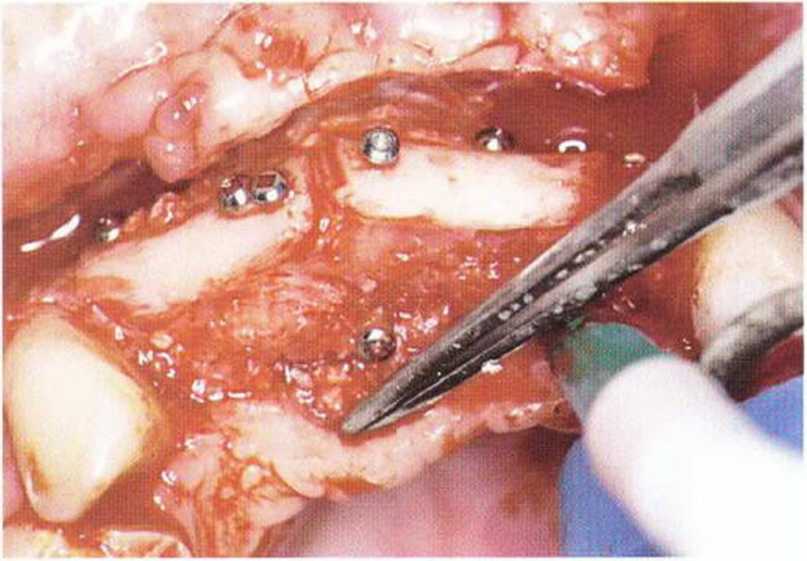
Рис. 5-1 г. Повторное вмешательство через 5 мес после трансплантации: поверхность костных блоков имеет белый оттенок и почти не васкуляризована. Косная стружка, заполнявшая пространство между костным блоком и принимающим ложем, в значительной степени замещена грануляционной тканью
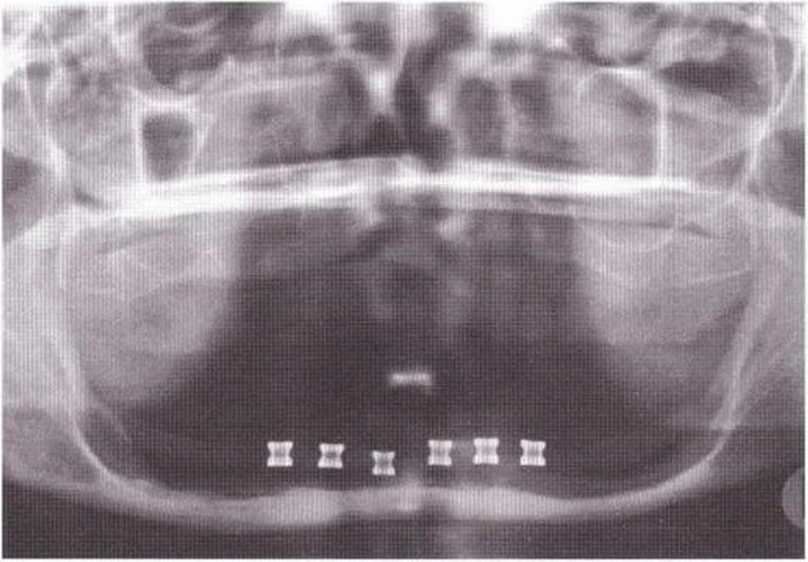
Рис. 5-2Ь. На степень атрофии указывают сильное углубление поверхности альвеолярного гребня и обнажение нижнего альвеолярного нерва
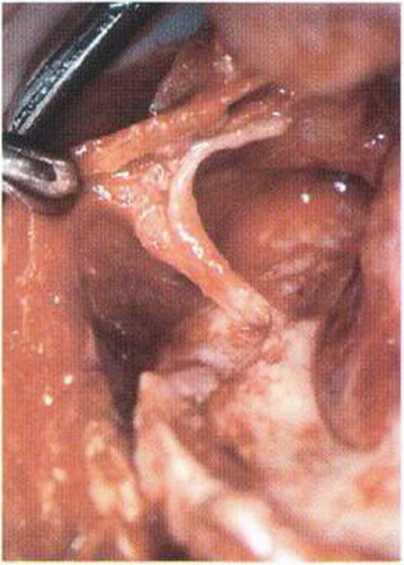
Рис. 5-2а. Выраженная атрофия альвеолярного гребня нижней челюсти
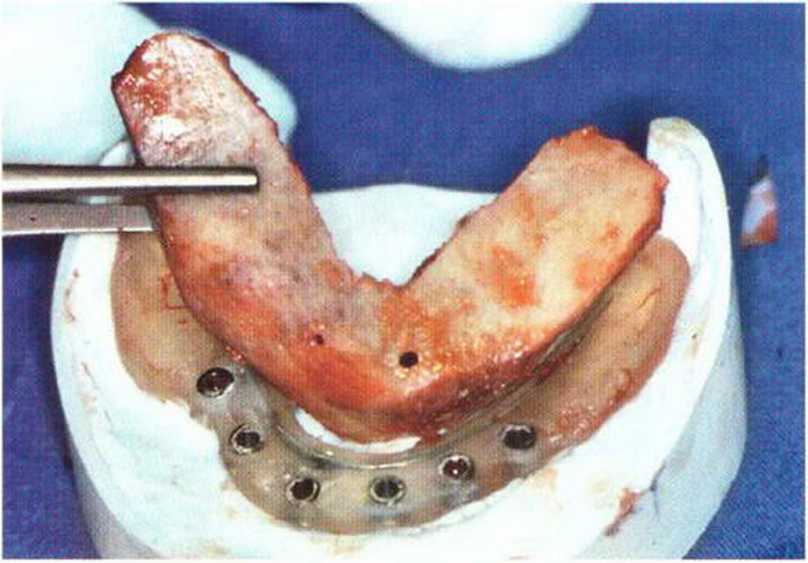
Рис. 5-2с. Хирургический шаблон и трансплантат из гребня подвздошной кости
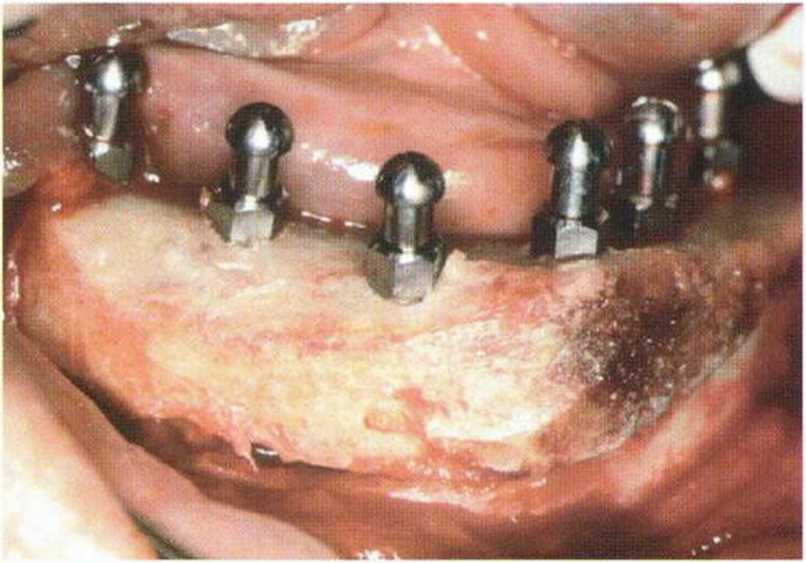
Рис. 5-2d. Увеличение высоты альвеолярного гребня с одновременной установкой 6 имплантатов
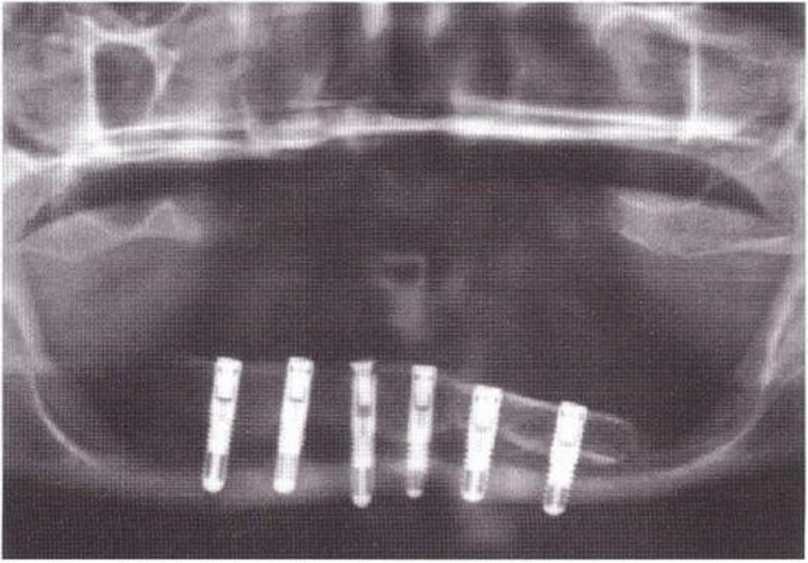
Рис. 5-2f. При раскрытии имплантата через 4 мес после операции избыток костной ткани над имплантатом иссекается бором
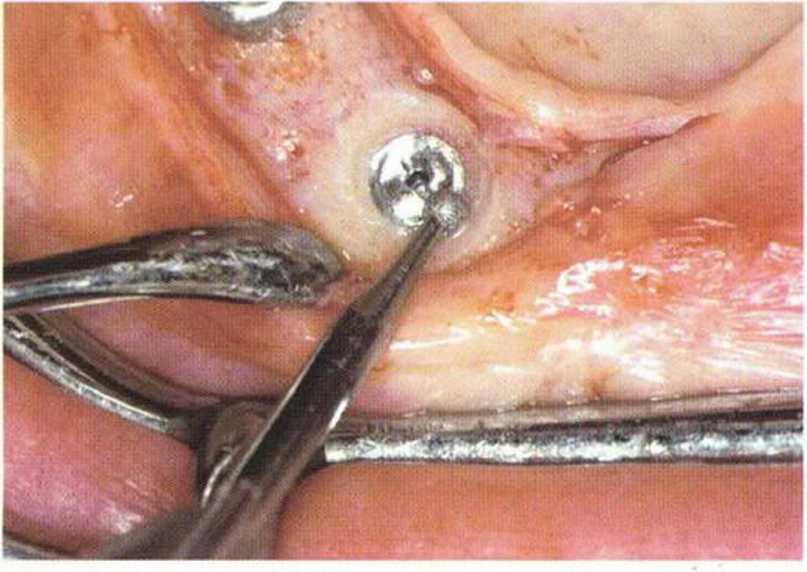
Рис. 5-2е. Послеоперационная рентгенограмма
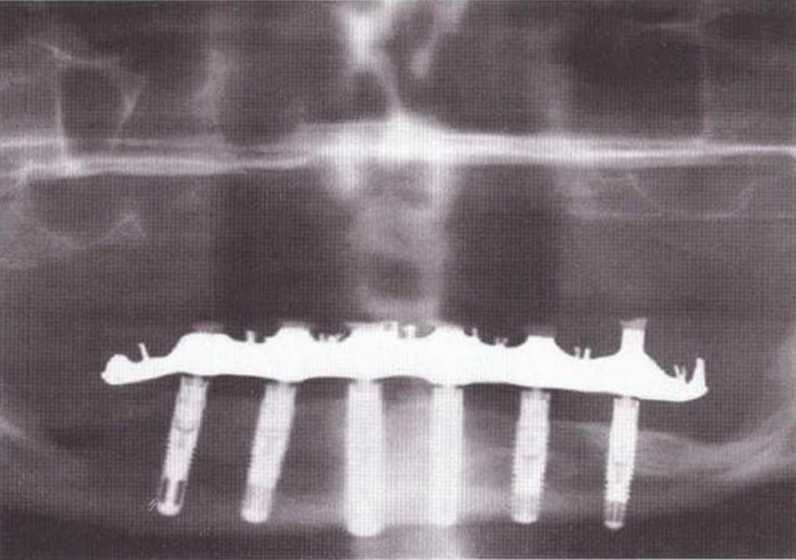
Рис. 5-2д. Ортопантомограмма через 10 лет после трансплантации
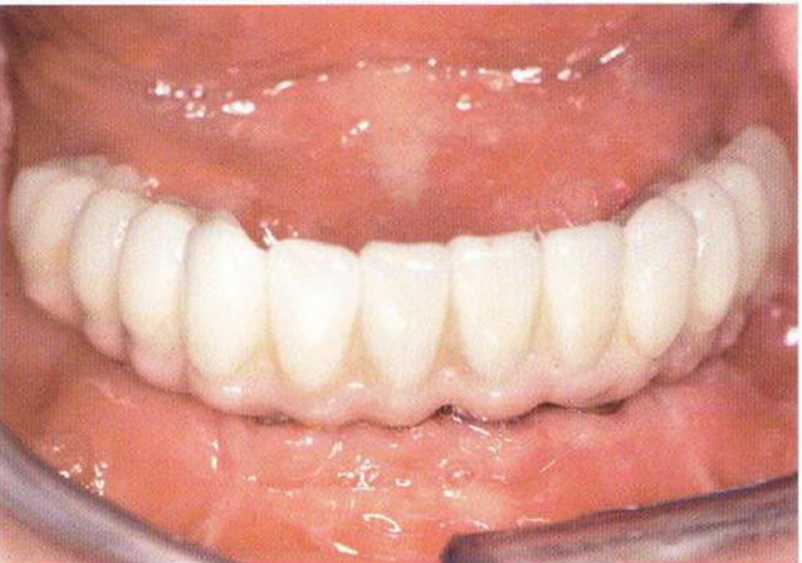
Рис. 5-2h. Вид ортопедической конструкции
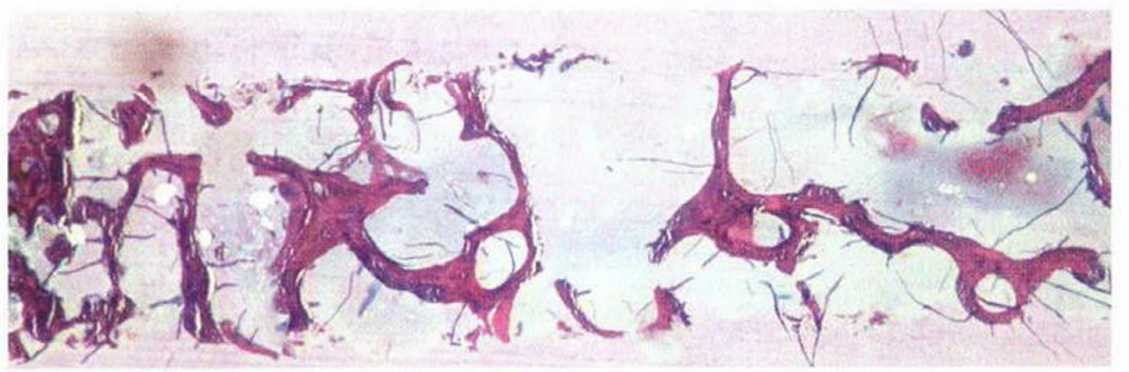
Рис. 5-2i. Биопсия кости через 4 мес после операции подверждает крайне низкую плотность костной ткани и обширный фиброз костного мозга (окраска: толуиди-новый синий, основной фуксин)
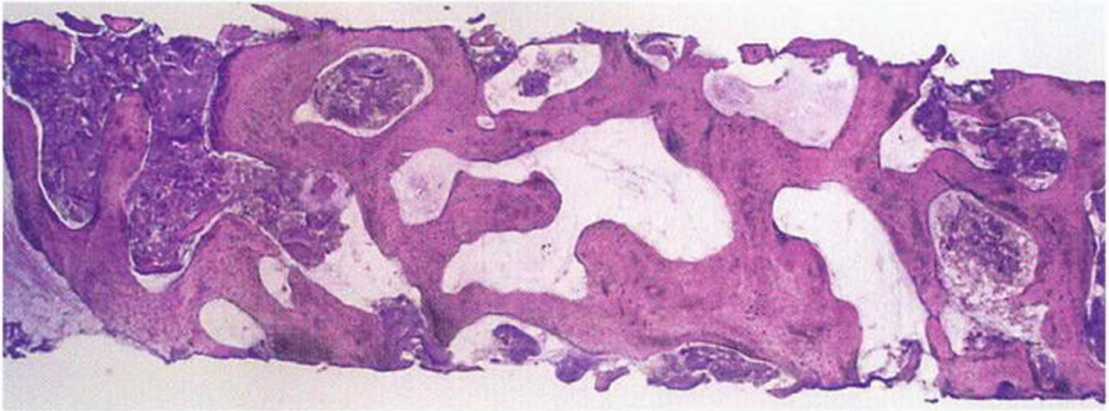
Рис. 5-2j. При повторной биопсии из той же области через 2 года после протезирования отмечается повышение плотности кости
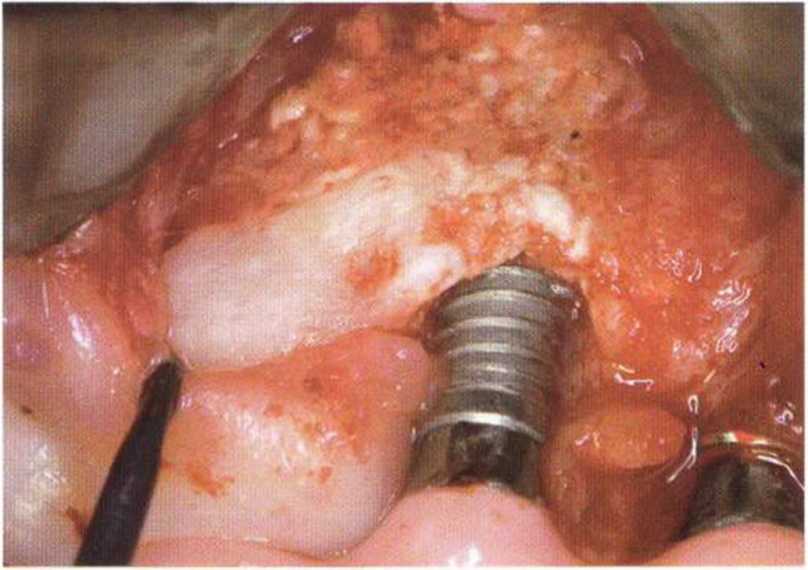
Рис. 5-2к. Клиническая ситуация через 4 года после установки имплантатов в области пересадки толстого нижнечелюстного костного трансплантата. Часть трансплантата резорбировалась, белая поверхность указывает на отсутствие кровеносных сосудов
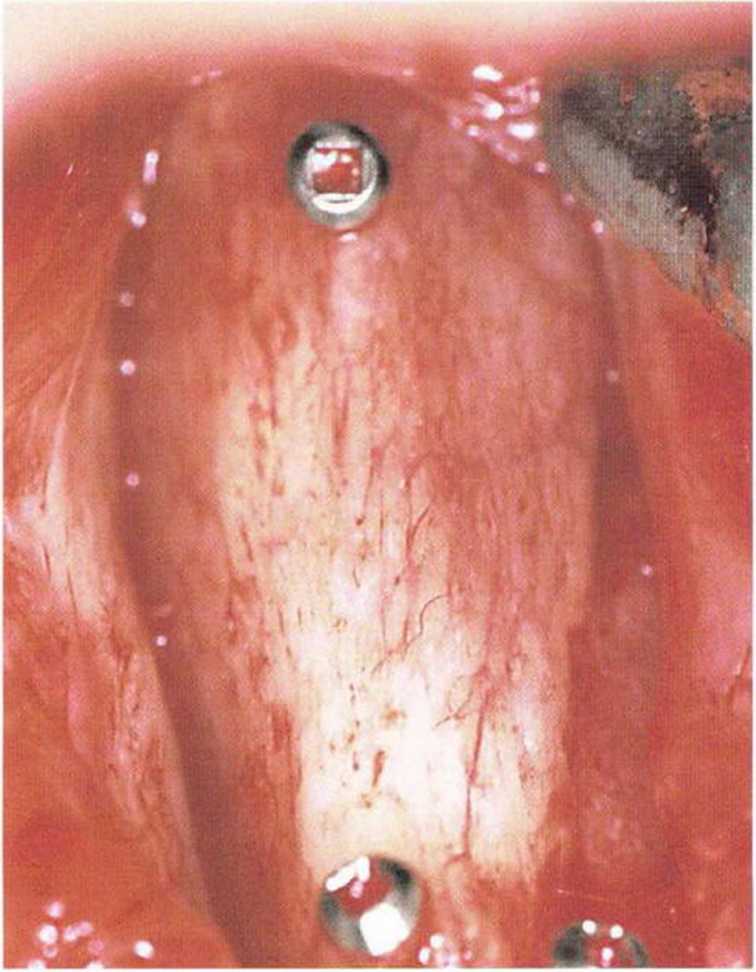
Рис. 5-За. Выраженную реваскуляризацию костного трансплантата через 4 мес подтверждает кэасный цвет его поверхности
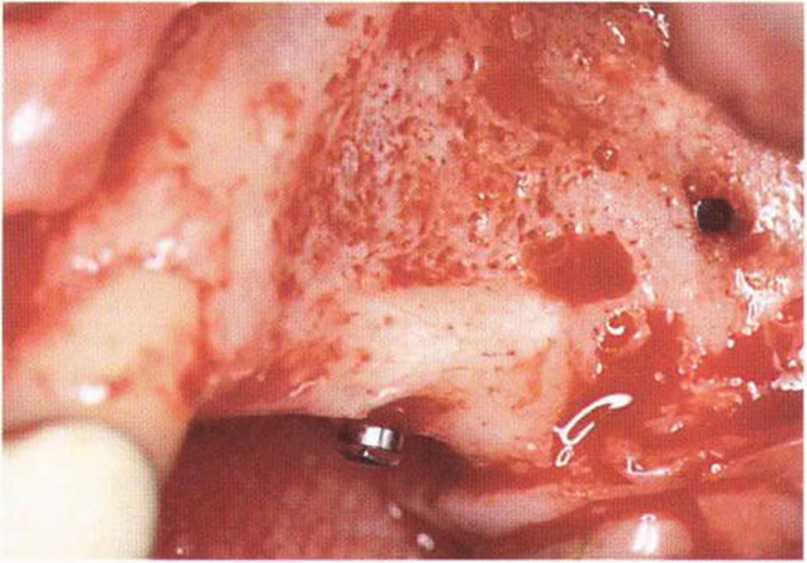
Рис. 5-ЗЬ. Через 4 мес после увеличения высоты альвеолярного гребня, несмотря на удовлетворительную интеграцию с прилегающей костью, белый оттенок указывает на недостаточную васкуляризацию поверхности трансплантата
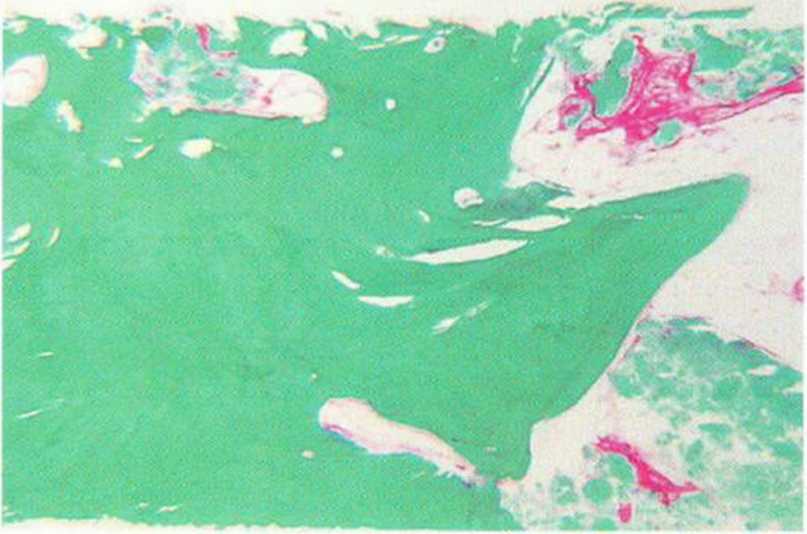
Рис. 5-Зс. Биопсия области трансплантации (с рис. 5-ЗЫ подтверждает высокую плотность и незначительное ремоделирование кортикальной кости. Более 80 % сохранившихся остеоцитов погибло (окраска по Массону-Голднеру; х35)

Рис. 5-3d. При большем увеличении отмечается обширный некроз остеоцитов (DO)
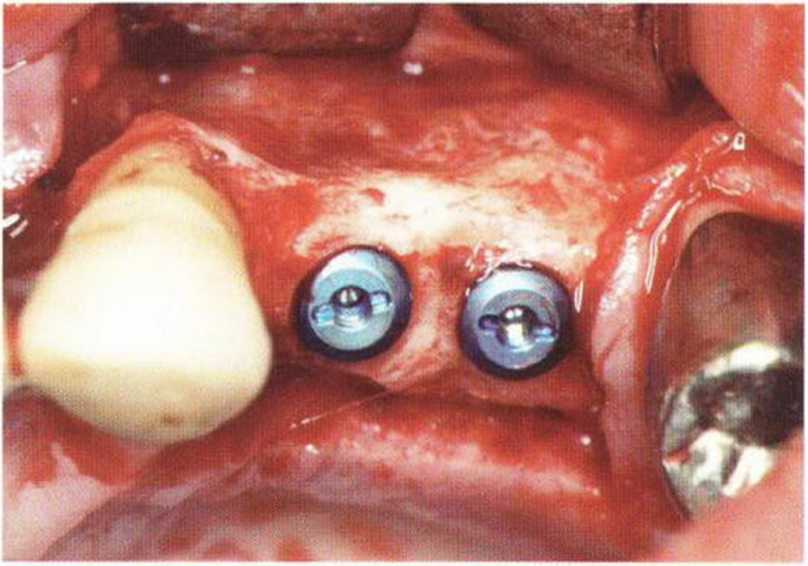
Рис. 5-Зе. Установка двух имплантатов в области пересадки трансплантата, который не подвергся значительной трансформации
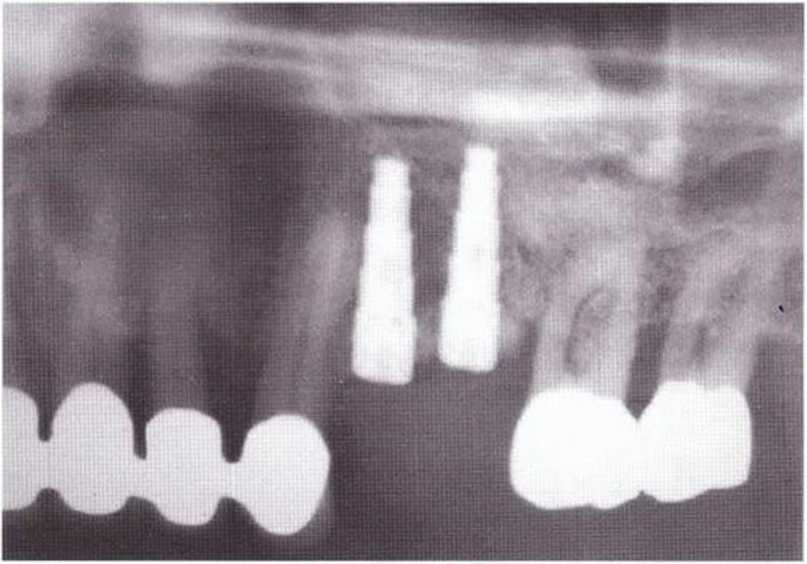
Рис. 5-3f. Рентгенограмма после имплантации
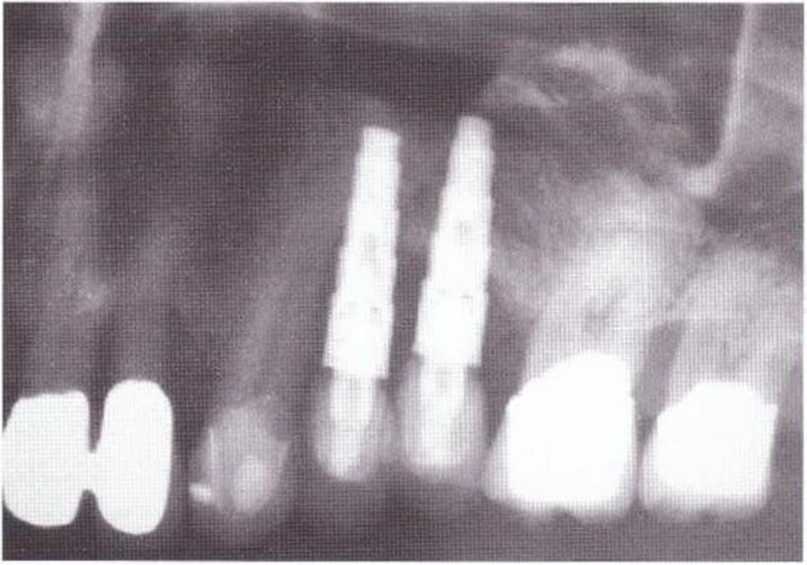
Рис. 5-Зд. На контрольной рентгенограмме через 3 года после имплантации отмечается почти полная резорбция трансплантата.
.
.
Таким образом, при пересадке аутогенных костных трансплантатов задействуются три механизма регенерации: остеогенез, остеоиндукция и остеокондукция. Интенсивность каждого из них определяется происхождением и качеством трансплантата. В частности, трансплантаты из гребня подвздошной кости характеризуются в основном губчатой структурой и высокой концентрацией активных остеогенных клеток, что обусловливает остеогенетическую и остеокондуктивную активность. Трансплантаты из нижней челюсти отличаются наличием выраженного кортикального слоя и небольшим количеством остеогенных клеток. Количество витальных остеоцитов или остеобластов настолько мало, что остеогенез составляет не более 10-15 % регенеративного потенциала. При пересадке нижнечелюстных трансплантатов ведущую роль играет остеокондуктивный механизм регенерации костной ткани,’ что нужно учитывать при проведении лечения.
Остеокондукция заключается в колонизации неорганического матрикса трансплантата остеобластами принимающего ложа, мигрирующими в трансплантат со стороны принимающего костного ложа по ходу новообразованных сосудов и из прилегающих костных структур. Формирование остеоидных слоев, которые образуют перепончатую ретикулофиброзную и затем пластинчатую кость, возможно на любой свободной поверхности трансплантата, прилегающей к витальной костной ткани (рис. 5-4а). Одновременно с этим макрофаги (остеокласты) резорбируют значительный объем трансплантата (в том числе омертвевшие клетки), освобождая пространство для новых костных клеток (рис. 5-4Ь). Ускорение реваскуляризации и регенерации позволяет преодолеть активность остеокластов, т.е. ограничить резорбцию костного трансплантата. Клинически резорбция трансплантата наиболее активно протекает в его поверхностном (самом удаленном от принимающего ложа) слое, в который реваскуляризуется в последнюю очередь и поэтому содержит большое число мертвых остеоцитов. Таким образом, при ‘пересадке костного блока для увеличения толщины альвеолярного гребня наибольшей резорбции подвергается окклюзионно-вестибулярный край трансплантата.
Остеокондуктивный потенциал нижнечелюстного костного трансплантата коррелирует с площадью его свободной поверхности: чем больше эта площадь, тем выше остеокондуктивная активность. Таким образом, увеличение поверхности положительно влияет на новообразование костной ткани. Поверхность отдельного костного блока относительно ограничена, однако его разделение на фрагменты приводит к увеличению общей площади поверхности трансплантата, что повышает регенеративный потенциал последнего. Pallesen и соавт.изучили в гистологическом и стереометрическом исследовании влияние размера частиц размельченных костных трансплантатов на интенсивность и скорость регенерации. Оказалось, что через 2 и 4 недели более интенсивная костная регенерация и созревание новообразованной кости отмечались при использовании костной стружки (0,5-2 мм), а не при пересадке крупных костных фрагментов (10 мм).
При этом применение только костной стружки не позволяет обеспечить стабильность формы материала в области дефекта. Использование мембран для стабилизации стружки в области обширных дефектов допустимо, но ассоциируется с риском обнажения и инфицирования мембран, что ведет к неудаче лечения. В качестве альтернативы можно ограничивать стружку кортикальной и губчатой кости с помощью тонких костных пластинок. Целесообразно неравномерное размельчение костной ткани, поскольку мелкая стружка (0,5-2 мм) способствует лучшей регенерации, но резор-бируется быстрее, чем крупная (10 мм). По сути, тонкий кортикальный блок служит аутогенной мембраной, стабилизирующей костную стружку. Регенеративное вмешательство проводят в два этапа. Сначала тонкие костные пластинки фиксируются винтами на некотором удалении от принимающего костного ложа, образуя ограниченное пространство и моделируя требуемые параметры альвеолярного гребня (рис. 5-5а-5-5е). Затем это пространство заполняют стружкой губчатой и кортикальной кости, что обеспечивает лучшие условия для реваскуляризации и высокий регенеративный потенциал. Полное заполнение пространства размельченной костью необходимо для предупреждения проникновения мягких тканей в область дефекта.
В целом описанный метод напоминает пересадку трансплантата из гребня подвздошной кости, который характеризуется наличием толстого губчатого и тонкого кортикального слоев. Такая комбинация аналогична использованию костной стружки, ограниченной тонкими кортикальными пластинками (рис. 5-5f-5-5g). В результате обеспечиваются высокий регенеративный потенциал, близкий к таковому у подвздошной кости, и оптимальные условия для остеоинтеграции имплантатов, как на нижней челюсти. Кроме того, при применении данного метода созревание новообразованной костной ткани через 4 мес также аналогично трансплантату из гребня подвздошной кости. Новообразованная кость, в которую устанавливают имплантаты, окрашивается красным благодаря интенсивному кровообращению, в отличие от остающегося белым наружного кортикального костного блока. Последний сохраняет контуры гребня, а также стабилизирует и защищает костную стружку (рис. 5-5h-5-5o).
В результате обеспечиваются оптимальные условия для остеоинтеграции имплантатов, которые с одной стороны контактируют с интактной костной тканью принимающего ложа, а с другой с новообразованной костной тканью, характеризующейся высоким регенеративным потенциалом и богатым кровоснабжением (рис. 5-6а-5-6о).
Аналогичный метод применяется при устранении вертикального дефицита кости. При этом проводят трехмерную пластику альвеолярного гребня с использованием нескольких тонких костных пластинок, пространство между которыми заполняют костной стружкой (рис. 5-7а-5-7е) (см. раздел 5.4.5).
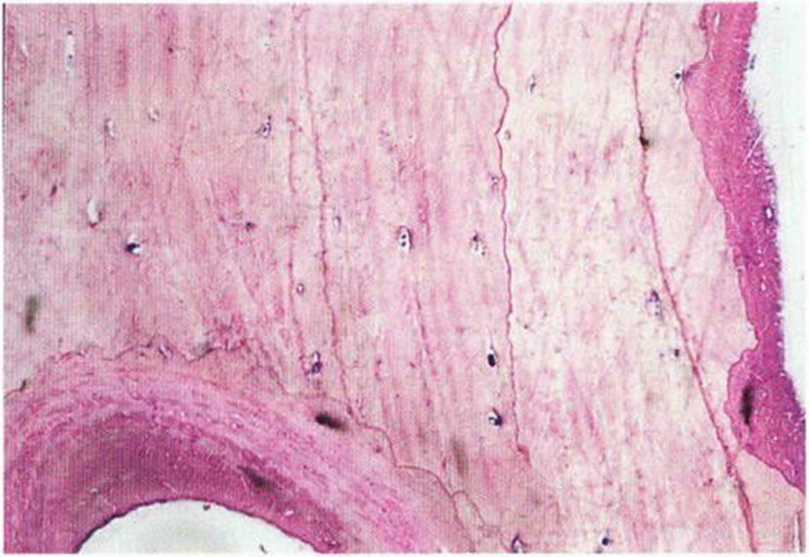
Рис. 5-4Ь. Биопсия через 4 мес после трансплантации: отмечается остеокластическая активность (гигантские многоядерные клетки) в непосредственной близости от мертвых остеоцитов (окраска: толуидиновый синий, основной фуксин)
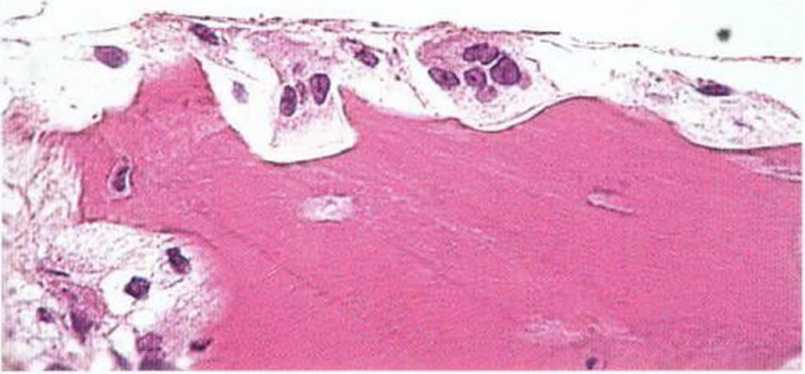
Рис. 5-4а. Биопсия трансплантата через 4 мес после его пересадки подтверждает типичную регенерацию посредством остеокондукции: в более светлой центральной части трансплантата содержится большое число мертвых остеоцитов (пустые или пикнотические клетки). Поверхность кости покрыта остеоидным и остеобластическим слоем (более темная часть) (окраска: толуиди-новый синий, основной фуксин; х200. Гистологическое исследование рис. 5-4а и 5-4Ь проведено проф. К. Donath, Гамбургский университет)
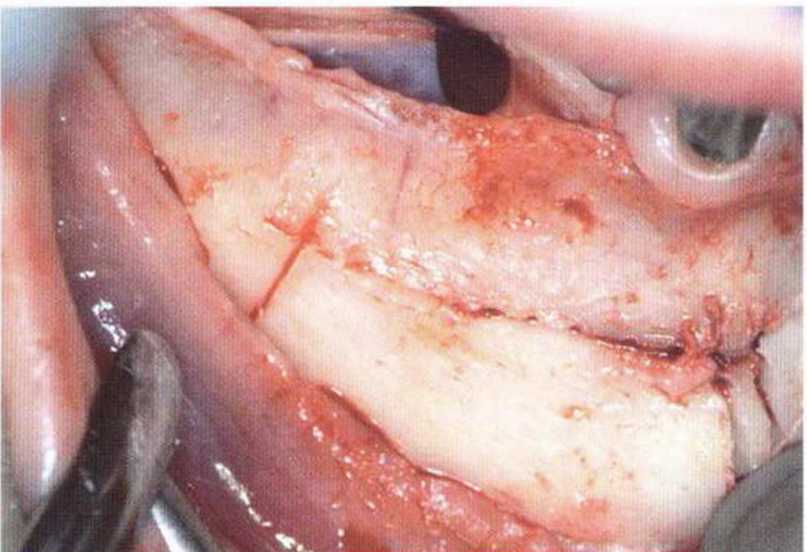
Рис. 5-5а. Узкий альвеолярный гребень нижней челюсти справа
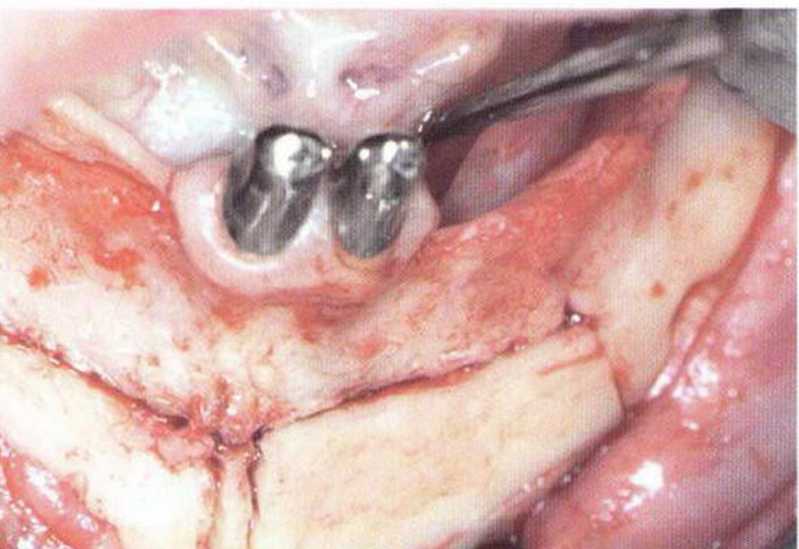
Рис. 5-5Ь. Узкий альвеолярный гребень нижней челюсти слева
Рис. 5-5с. Пересадка трансплантатов кости из подбородочной области
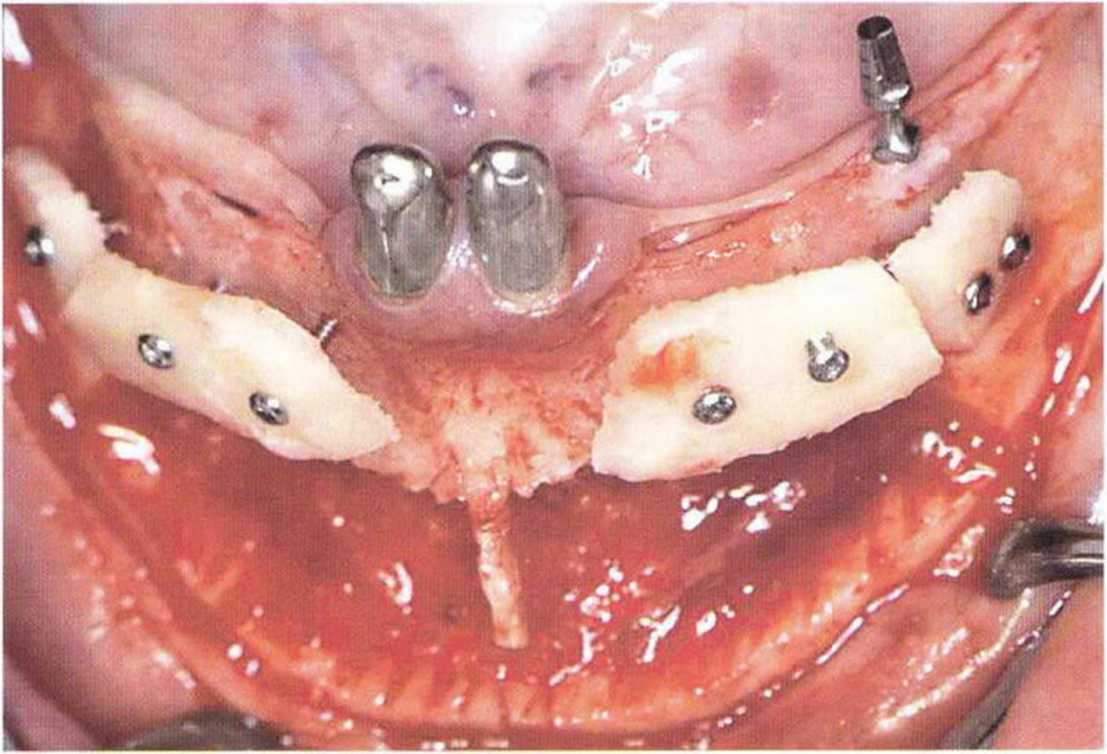
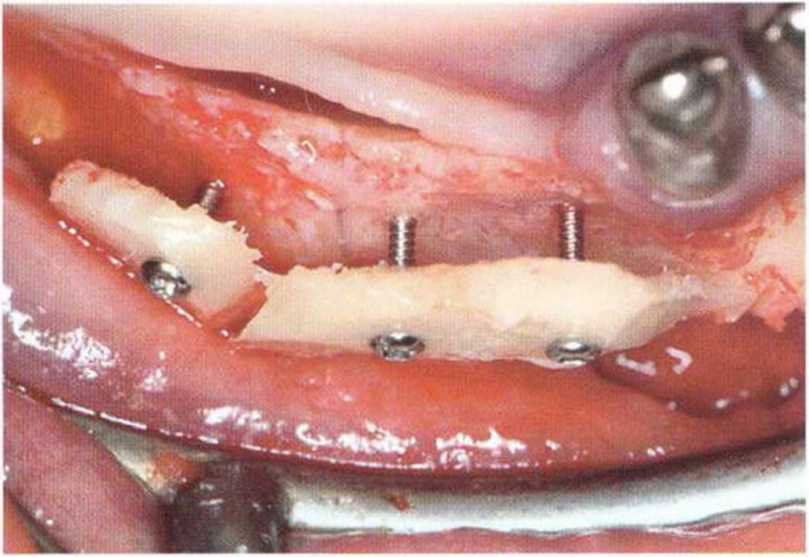
Рис. 5-5d. Тонкие кортикальные костные пластинки фиксируют винтами на некотором удалении от костного ложа
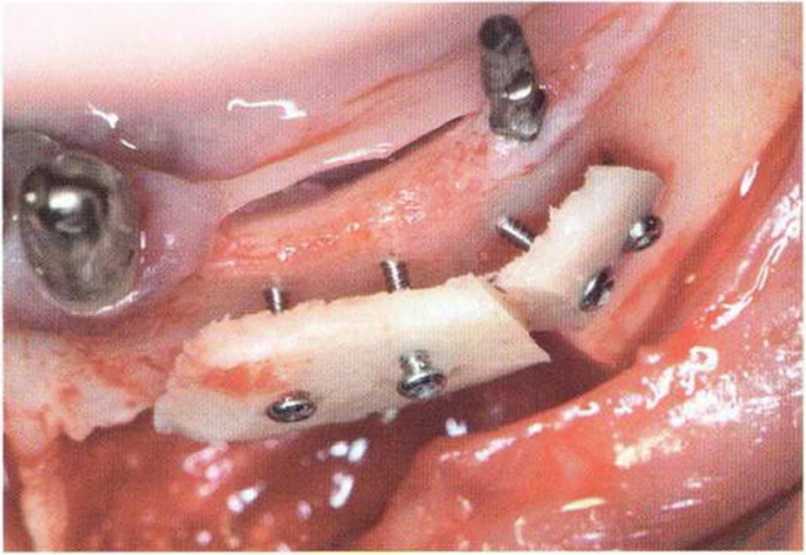
Рис. 5-5е. Аналогичная ситуация в области нижней челюсти слева.
5 Костные трансплантаты нижней челюсти
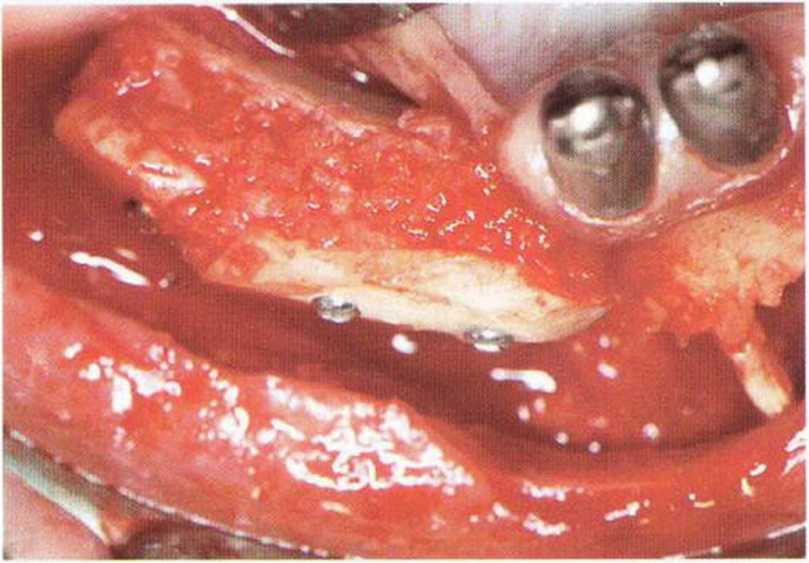
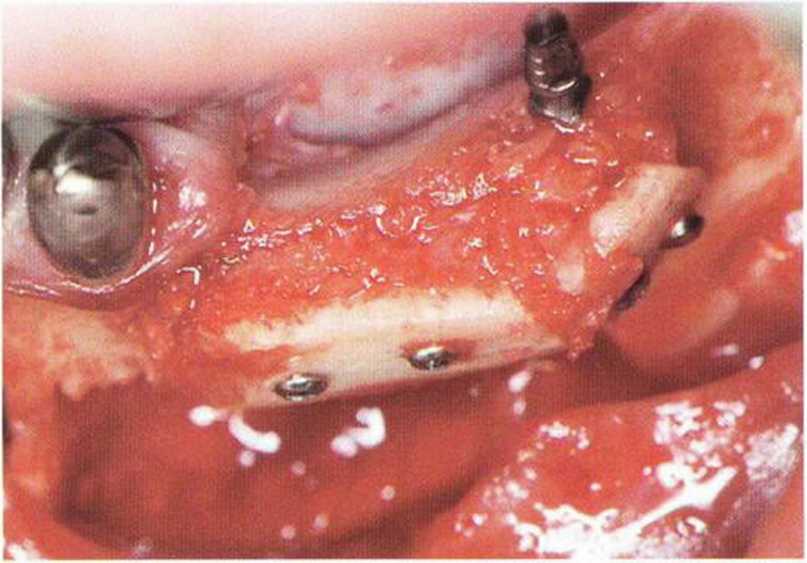
Рис. 5-5f. Пространство между костным блоком и альвеолярным гребнем заполняют губчатым веществом и кортикальной костной стружкой
Рис. 5-5д. Аналогичная ситуация на левой стороне
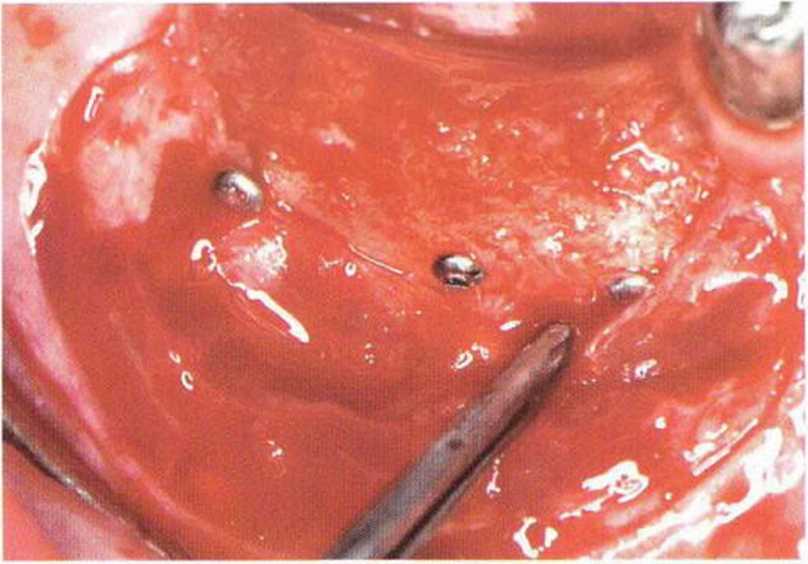
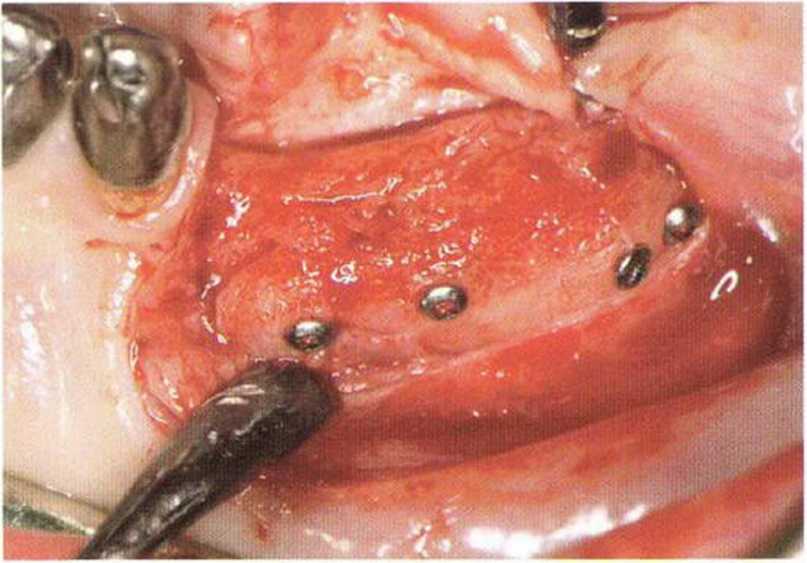
Рис. 5-5i. Соответствующая ситуация в области нижней челюсти слева
Рис. 5-5h. Клиническая ситуация через 4 мес после регенеративного вмешательства подтверждает оптимальную регенерацию трансплантата красного цвета благодаря интенсивной реваскуляризации
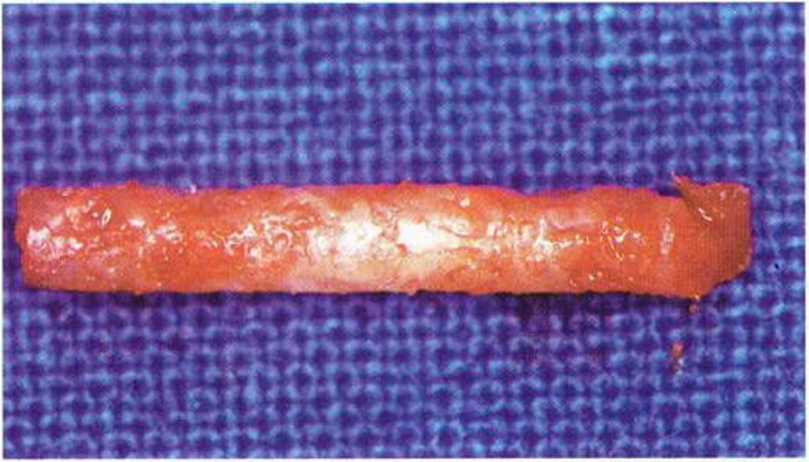
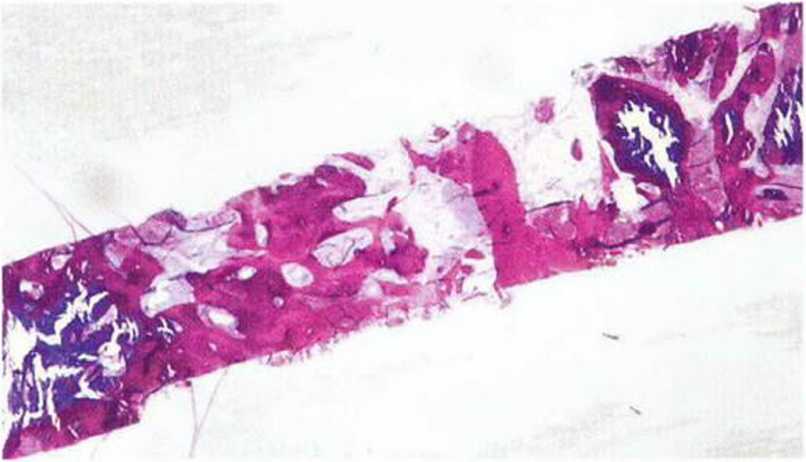
Рис. 5-5к. Гистологически подтверждается в основном остеокон-дуктивный механизм регенерации костной ткани (темно-красное окрашивание) в области трансплантации (светлое окрашивание) (окраска: толуидиновый синий, основной фуксин)
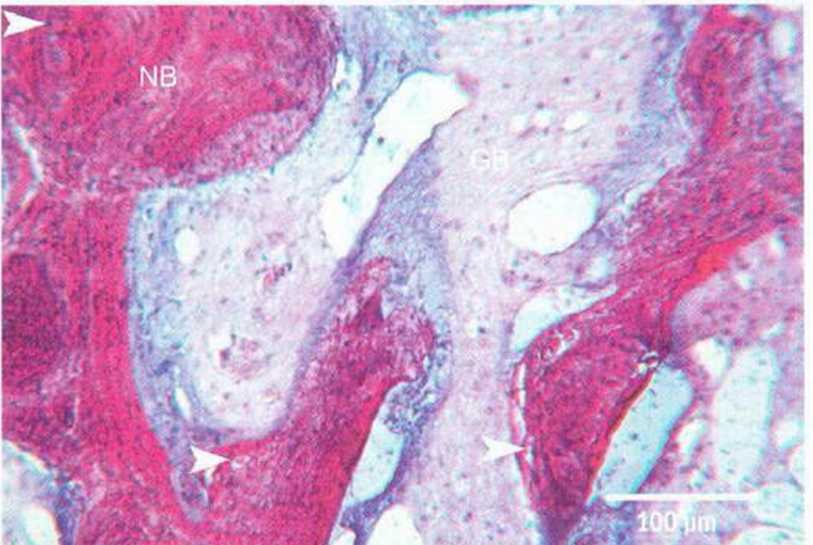
Рис. 5-51. При большом увеличении определяется формирование новой кости (NB, темное окрашивание) в области трансплантата (GB). Кроме того, в трансплантате отмечается большое число витальных остеоцитов (гистологические препараты на рис. 5-Зс, 5-3d и 5-5к, 5-51: проф. G. Bruel и г-жа J. Rue, гистологическая лаборатория стоматологического факультета, Тулуза, Франция)

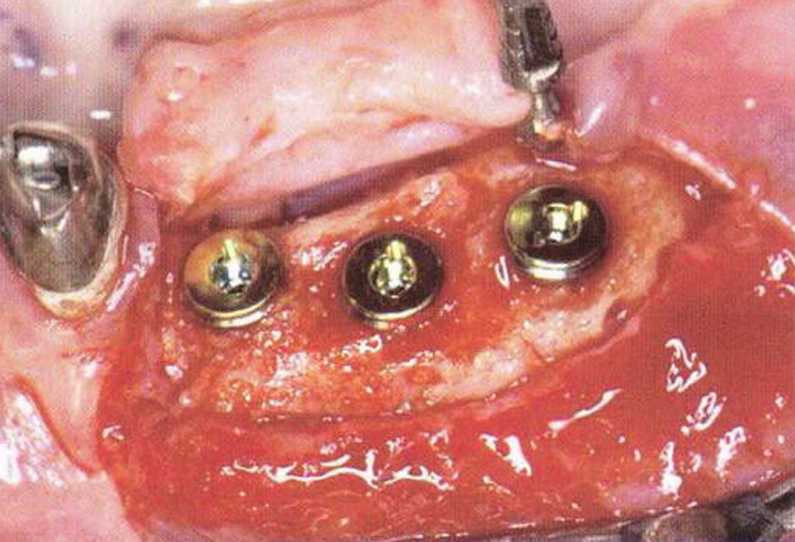
Рис. 5-5т. Установка имплантатов в области трансплантации
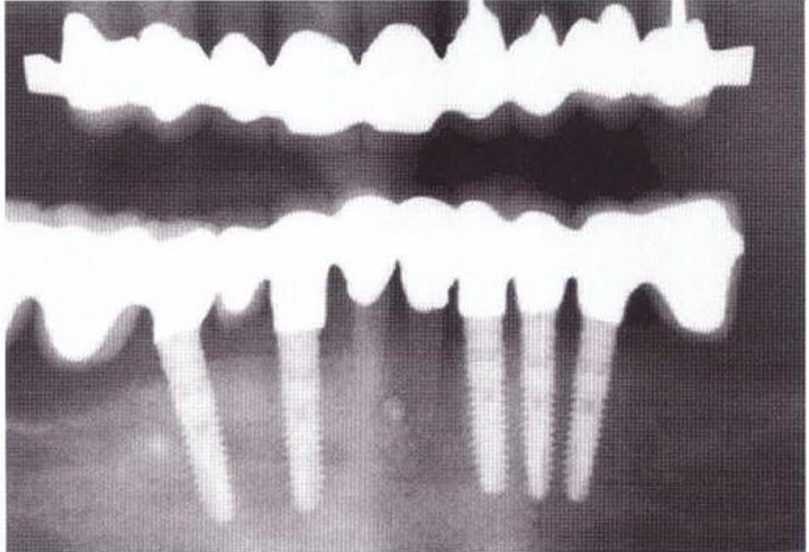
Рис. 5-5о. На контрольной рентгенограмме через 5 лет после операции определяется стабильная остеоин~еграция без потери костной ткани
Рис. 5-5п. Имплантаты контактируют преимущественно с хорошо кровоснабжаемой и новообразованной костью (красный цвет)
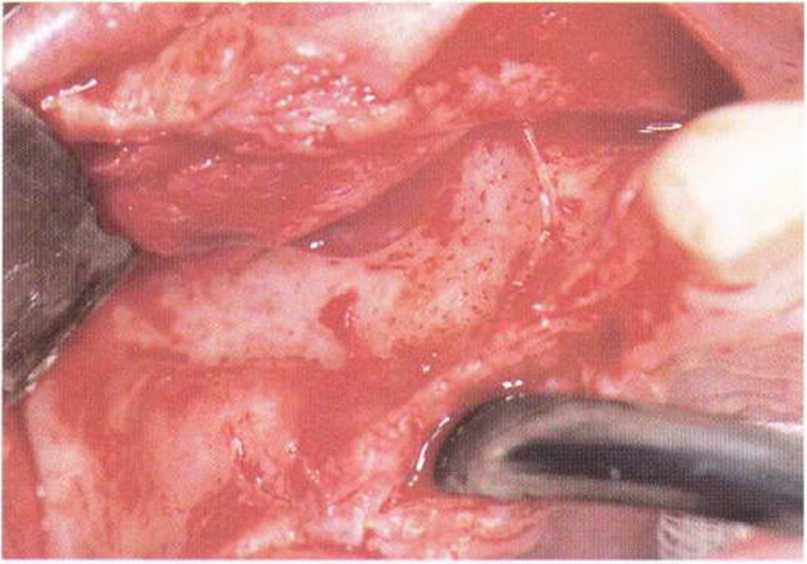
Рис. 5-6а. Крайне узкий альвеолярный гребень в переднем отделе верхней челюсти
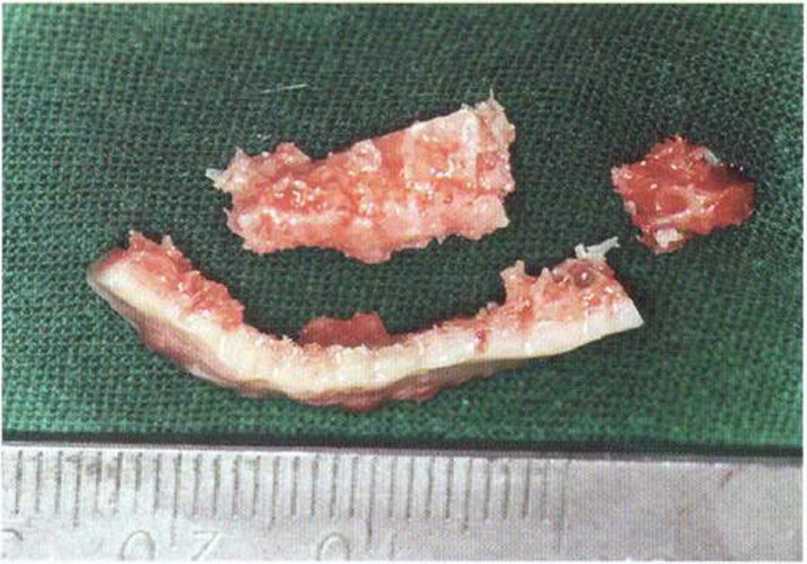
Рис. 5-6Ь. Тонкий кортикальный трансплантат и губчатое вещество из подбородочной области
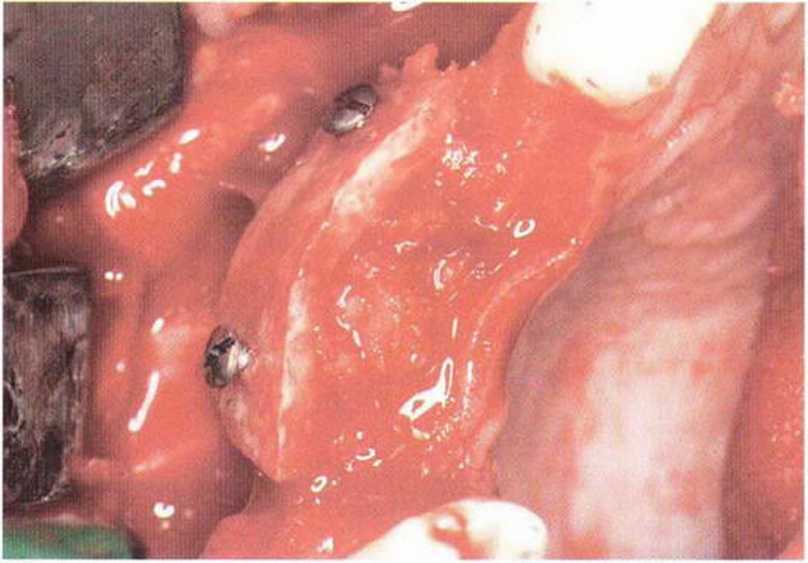
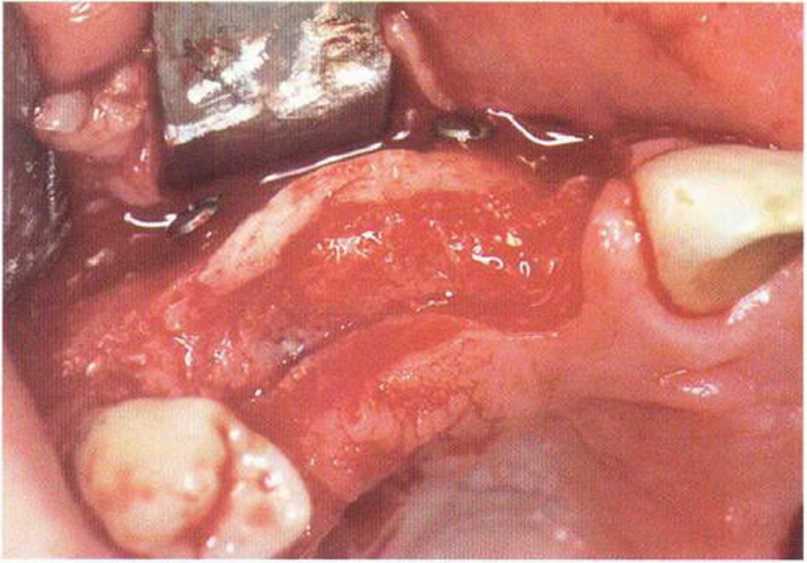
Рис. 5-6с. Кортикальный блок фиксирован на небольшом удалении от альвеолярного гребня, пространство между костными поверхностями заполняют губчатым веществом и кортикальной костной стружкой.
Рис. 5-6d. Через 4 мес клинически отмечается типичный красный оттенок васкуляризованной поверхности трансплантата
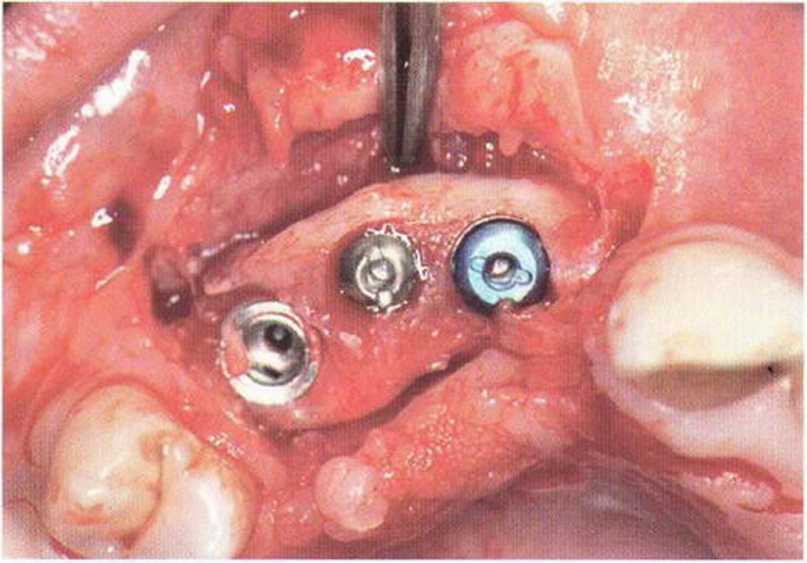
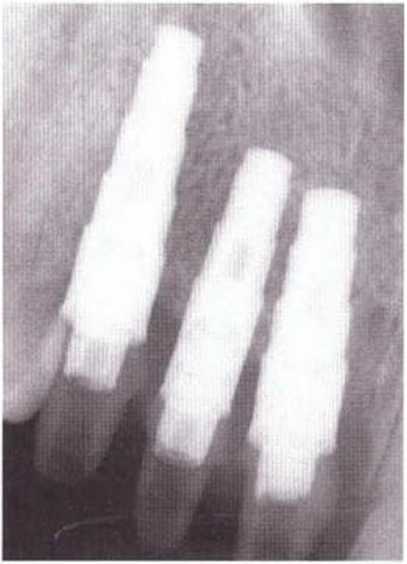
Рис. 5-6f. На контрольной рентгенограмме через 12 лет после имплантации отмечается стабильное состояние костной ткани
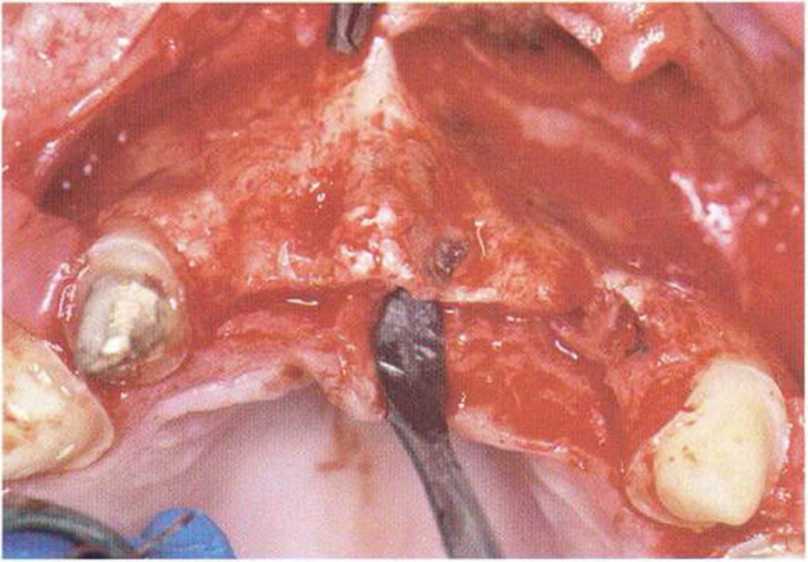
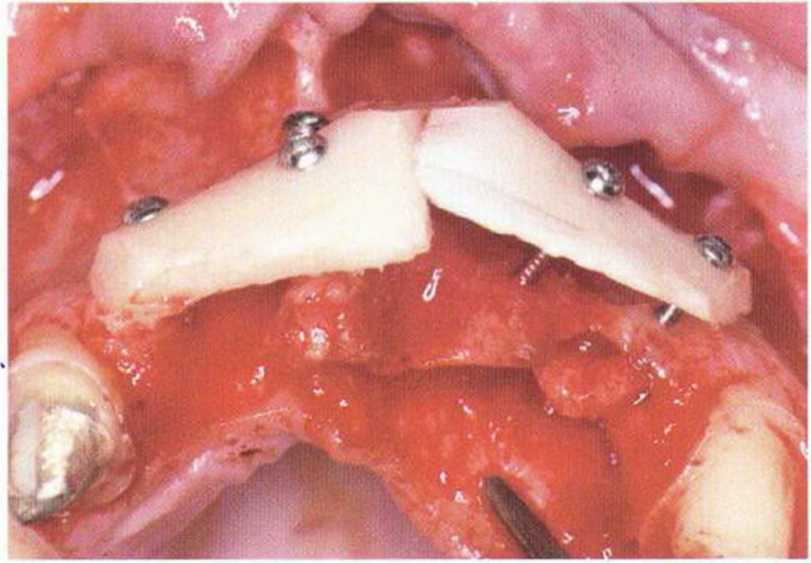
Рис. 5-6g. Обширный костный дефект в переднем отделе верхней челюсти, толщина альвеолярного гребня 0,5-1 мм.
Рис. 5-6h. Два тонких костных блока, полученных в ретромо-лярной области, фиксированы винтами на расстоянии 6-8 мм от принимающего ложа
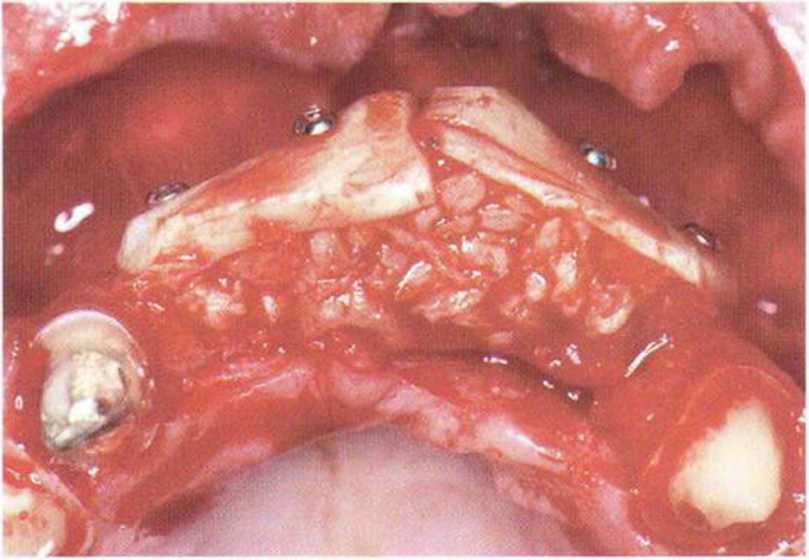
Рис. 5-6i. Пространство заполняют костной стружкой и губчатым веществом
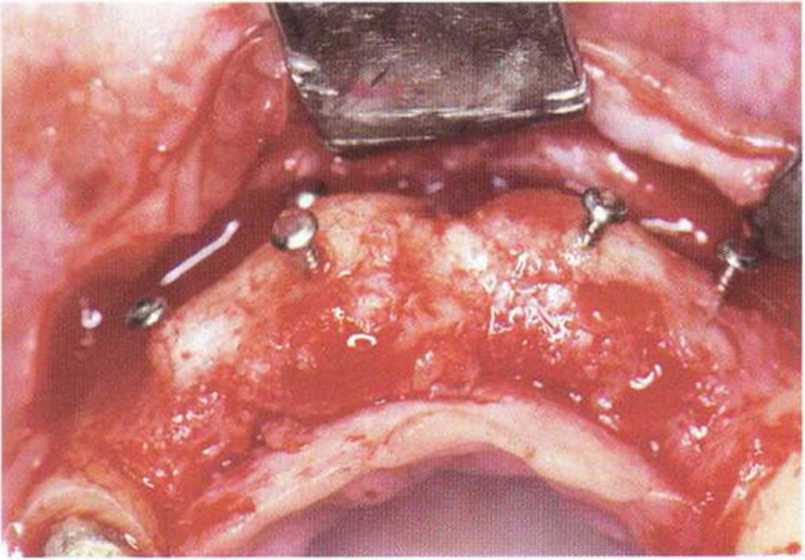
Рис. 5-6j. Клинические признаки приживления через 4 мес после операции
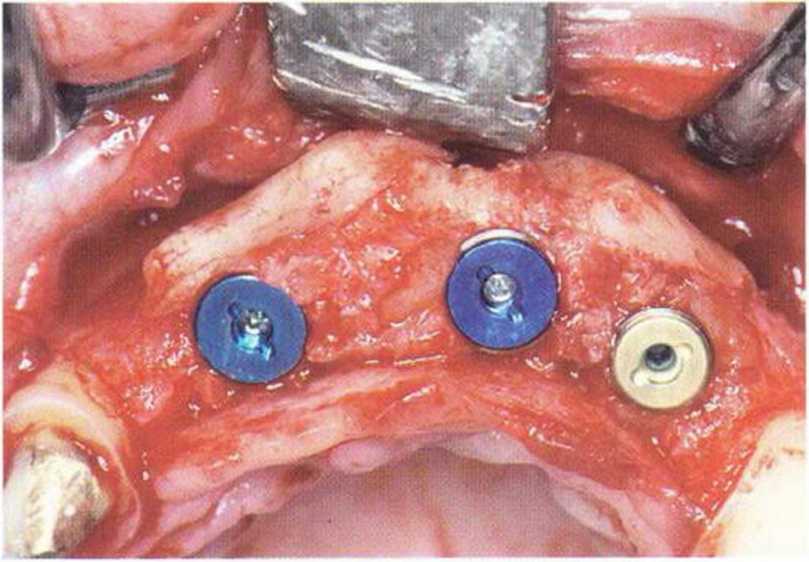
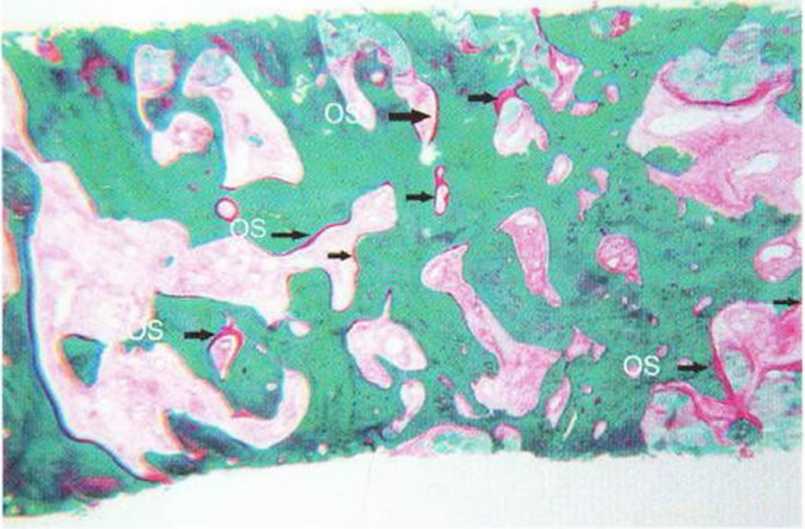
Рис. 5-6к. Установка трех имплантатов XiVE разного диаметра (4,5 мм синие; 3,8 мм желтый) через 4 мес после трансплантации.
Рис. 5-6I. При биопсии через 4 мес после операции определяется выраженная трансформация трансплантата с множеством остеоидных слоев (OS) на его поверхности (окраска по Массону-Голднеру; х25)
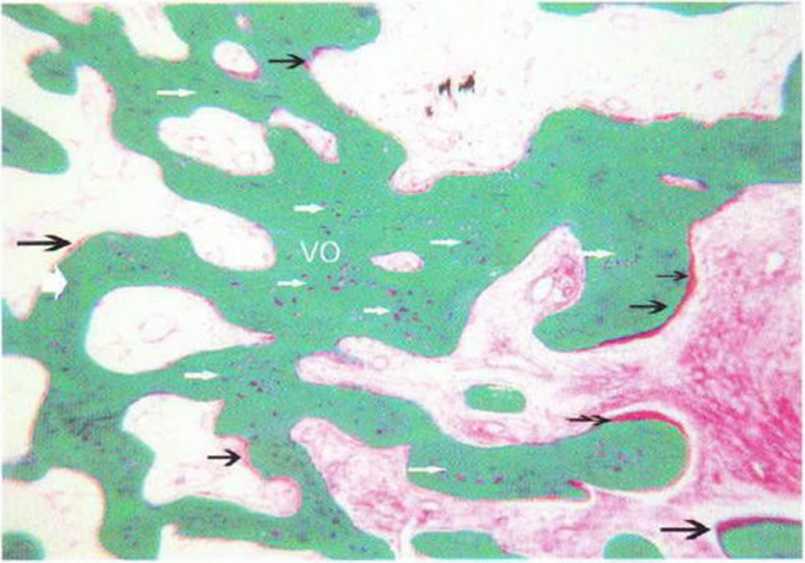
Рис. 5-6т. Отмечают большое число витальных остеоцитов (VO, белые стрелки) и много остеоидных слоев (черные стрелки) (окраска по Массону-Голднеру; хбЗ)
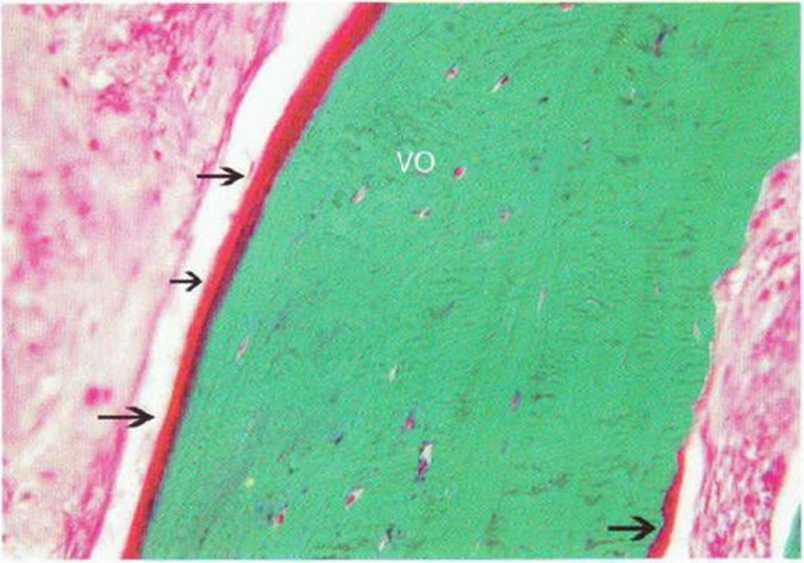
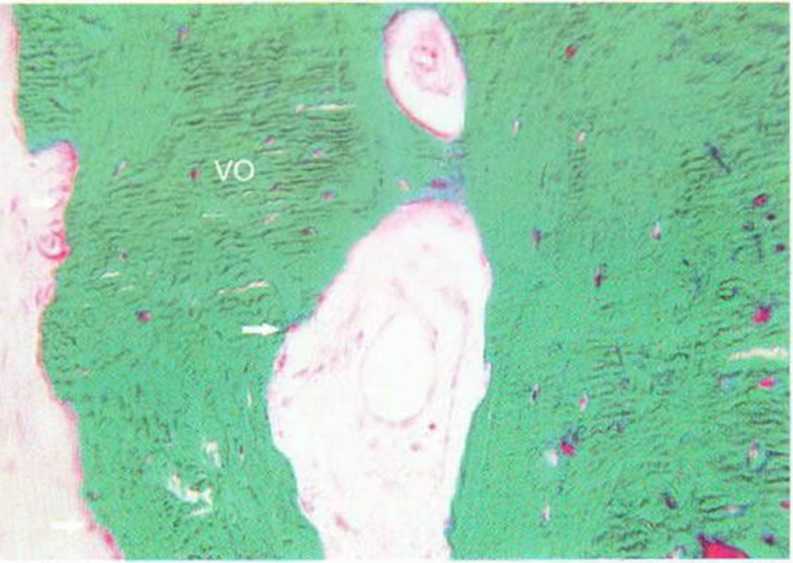
Рис. 5-6п. Остеоидные слои окружают аутогенную кость с большим числом витальных остеоцитов (VO) (окраска по Массону-Голднеру; х250).
Рис. 5-6о. Высокая концентрация витальных остеоцитов. Также определяются слои остеобластов (белые стрелки) (окраска по Массону-Голднеру; х250) (гистологическое исследование проведено проф. G. Brunei, Тулуза, Франция)
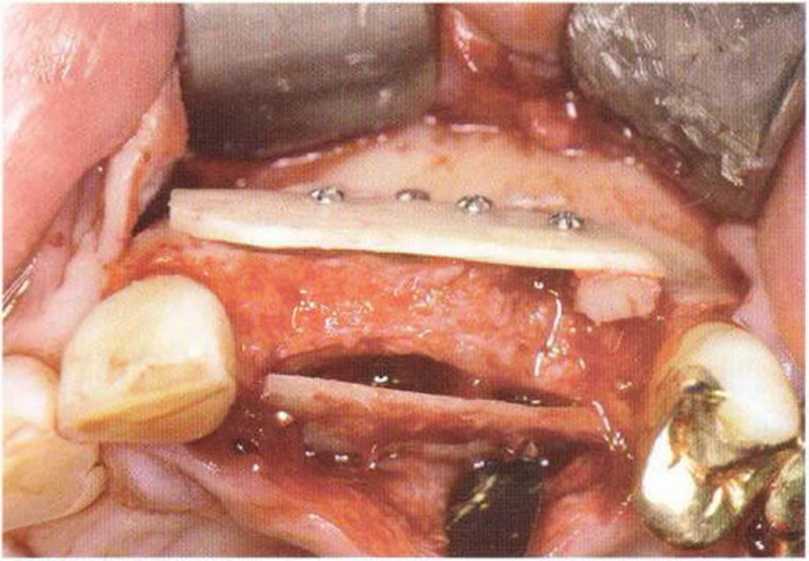
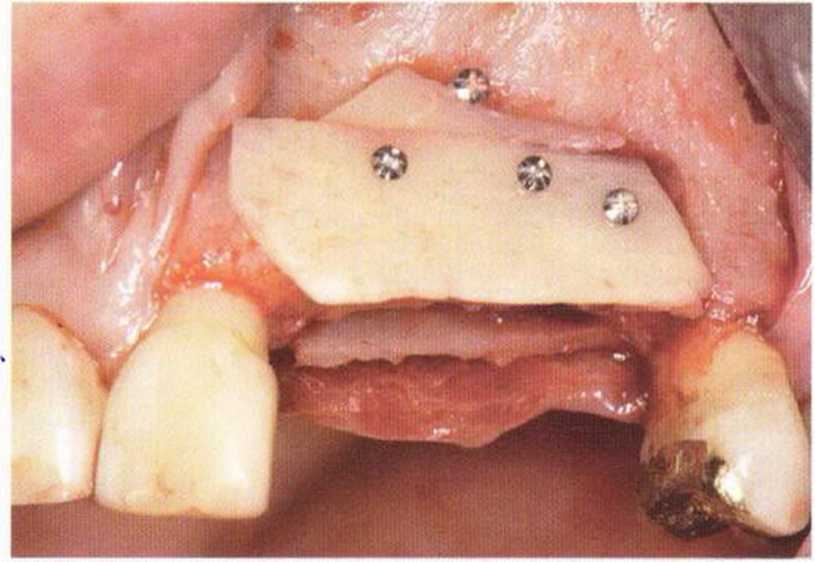
Рис. 5-7Ь. Вестибулярный вид
Рис. 5-7а. Устранение вертикального костного дефекта переднего отдела верхней челюсти с помощью двух тонких блоков из нижней челюсти
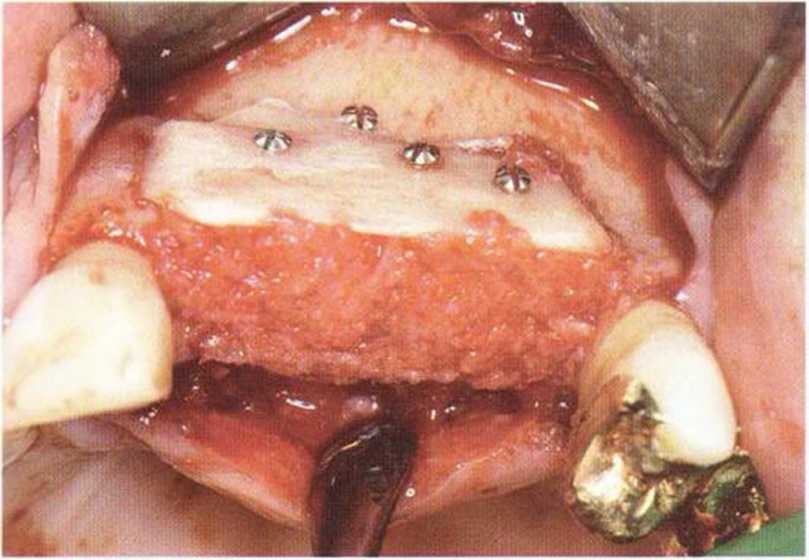
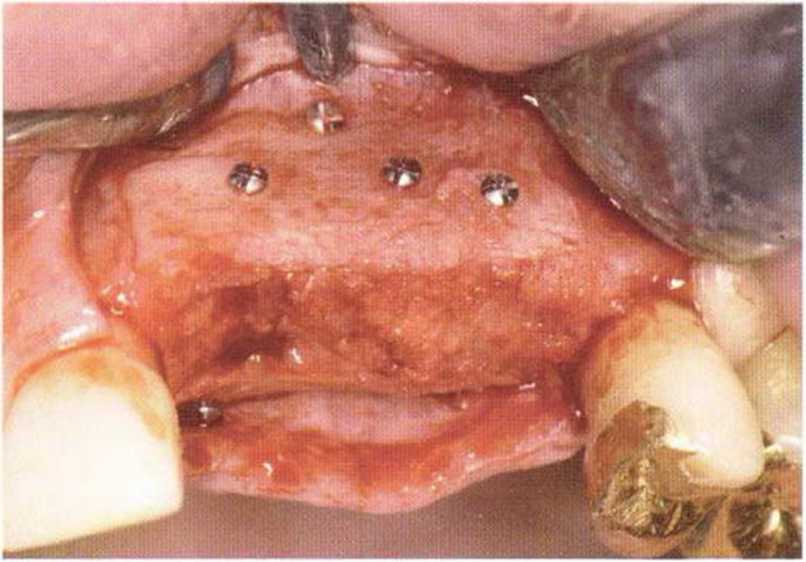
Рис. 5-7с. Заполнение зазора между двумя блоками костной стружкой
Рис. 5-7d. Клинический вид через 4 мес после операции
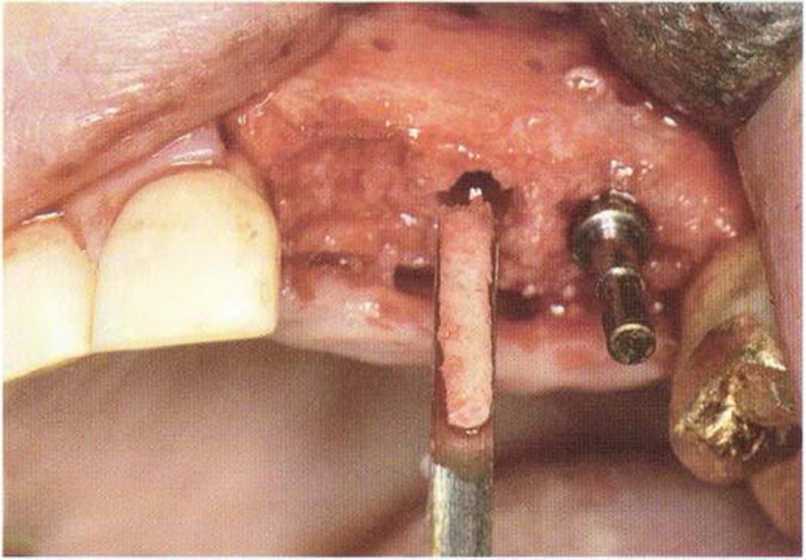
Рис. 5-7е. Биопсия позволяет определить кэчество новообразованной костной ткани