Обычно получение и пересадка костных трансплантатов не вызывают технических сложностей, что позволяет применять их для устранения дефектов альвеолярного отростка верхней челюсти и альвеолярной части нижней челюсти.---- В качестве донорских используют следующие участки:.
- область кости, прилегающая к месту установки имплантата;.
- бугор верхней челюсти;.
- передняя носовая ость;.
- стенка верхнечелюстной пазухи;.
- передний отдел нёбной кости;.
- основание нижней челюсти в области моляров;.
- ретромолярная область нижней челюсти (в том числе ветвь нижней челюсти);.
- подбородочный отдел нижней челюсти (симфиз);.
- области адентии челюстей (край гребня, тело),.
- экзостозы (вестибулярные, нёбные или язычные).
.
Для получения костных блоков большого размера подходят ретромолярная и подбородочная области (рис. 5-8а).
Близость расположения внутриротового донорского участка к устраняемому дефекту сокращает продолжительность вмешательства и снижает требования к анестезии, что позволяет проводить лечение в амбулаторных условиях. Кроме того, такие операции ассоциируются с меньшим послеоперационным дискомфортом, чем трансплантация кости из внеротовых источников.
При получении внутриротовых костных трансплантатов следует учитывать местные и общие противопоказания. Пациентов нужно проинформировать о преимуществах и недостатках планируемого вмешательства, а также возможной необходимости повторных операций и потенциальных интра- и послеоперационных осложнениях. Анатомические особенности донорских участков обусловливают разную форму и размеры трансплантатов, что требует тщательного клинического обследования.-При осмотре и пальпации можно получить приблизительное представление о контурах и размере донорской области (например, подбородочный выступ, участок адентии, наружная косая линия нижней челюсти).- Клиническое обследование позволяет сделать предположение о форме потенциального костного трансплантата. Дополнительную информацию о донорском участке и его расположении относительно важных анатомических структур можно получить с помощью следующих лучевых методов диагностики:.
- панорамная рентгенография (ортопантомограмма);.
- телерентгенография головы в боковой проекции;.
- рентгенография головы в ретроальвеолярной проекции;.
- рентгенография в окклюзионной проекции;.
- компьютерная томография (КТ-скан и Дента-Скан);.
- томография и конусно-лучевая компьютерная томография (КЛКТ).
На панорамной рентгенограмме можно определить локализацию нижнечелюстных каналов и подбородочных отверстий (рис. 5-8Ь), а также положение и выраженность наружной косой линии нижней челюсти. Кроме того, с помощью панорамного снимка возможно приблизительно оценить качество костной ткани челюстей. Телерентгенограммы позволяют провести анализ состояния кости в области подбородка и зубов (рис. 5-8с). Трехмерная визуализация корней передних зубов нижней челюсти облегчает планирование получения костного трансплантата на безопасном расстоянии от верхушек корней. Рентгенограммы в ретроальве-олярной и окклюзионной проекциях способствуют определению взаимного расположения разных анатомических структур. Калибровочные рентгенограммы и томограммы допускается делать только при недостатке информации после перечисленных выше исследований.
Перед трансплантацией костной ткани показано профилактическое назначение антибиотиков. Антимикробный препарат (пенициллин G, 1x10 ME)вводят внутривенно непосредственно перед проведением местной анестезии, т.е. до наступления сосудосуживающего эффекта, или перорально (пенициллин V, 1 х 10 ME), как минимум за 1 час до операции. Антибиотикопрофилактика продолжается в течение 7-10 дней после операции (3x10 МЕ/сут).
При аллергии к пенициллину назначают клинда-мицин (таблетки по 300 или 600 мг, 1,2 г/сут).При проведении синус-лифтинга назначают амок-сициллин (2 г/сут). Кроме того, в течение 1 недели после вмешательства пациент должен полоскать рот 0,02 % раствором хлоргексидина и принимать обезболивающее средство (например, ибупрофен по 400 мг 3 раза в день).
Трансплантацию аутогенной кости из внутриротовых источников обычно проводят под местной анестезией в сочетании с пероральным или внутривенным введением седативного препарата. Общая анестезия показана при выполнении длительных вмешательств (более 3 часов) и трансплантации кости из нескольких донорских участков.
Рис. 5-8а. Донорские участки нижнечелюстных костных блоков
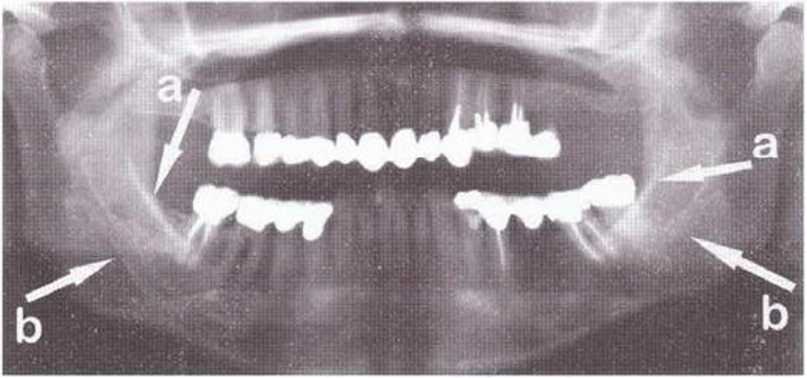
Рис. 5-8Ь. На ортопантомограмме отмечаются выраженность наружной косой линии (а) и расположение нижнего альвеолярного нерва (Ь)
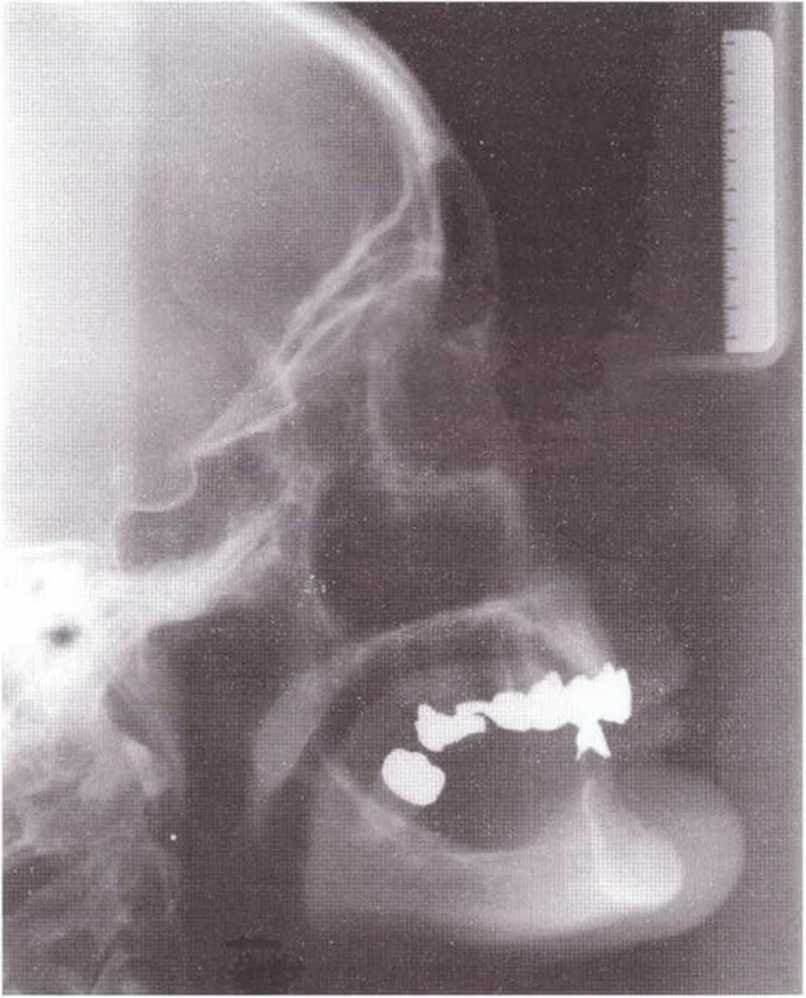
Рис. 5-8с. Перед получением костных трансплантатов в области подбородка проводят боковую телерентгенографию
Рис. 5-9а. Основные инструменты для проведения регенеративных вмешательств (Stoma, Storz am Mark и Dentsply Friadent)
5.3.4 Инструменты, применяемые при трансплантации костной ткани и других регенеративных вмешательствах.
При пересадке костных трансплантатов, проведении регенеративных вмешательств и установке имплантатов нужно использовать соответствующие инструменты (рис. 5-9a-5-9d) с учетом показаний и объема вмешательства.
Остеотомы разной конфигурации (ВопеСоп-denser, BoneExpander, Dentsply Friadent) позволяют создать ложе для имплантатов без иссечения кости и улучшить его качество благодаря уплотнению костной ткани (рис. 5-9е). Кроме того, остеотомы применяются для повышения дна пазухи (закрытого синус-лифтинга) и блокирования мелких сосудов при остановке кровотечения. Полые фрезы, или трепаны, разного диаметра (обычно 3 и 3,5 мм) удобны для получения костного трансплантата в области предполагаемого ложа имплантата или на других участках (рис. 5-9f и 5-9д). Для получения костной ткани используют многие инструменты. В частности, костным скребком Safescraper (МЕТА) соскабливают костную стружку с любых доступных костных поверхностей на разных участках с помощью специальных фильтров (рис. 5-9г), однако нужно следить, чтобы при аспирации в фильтры поступала исключительно костная ткань, иначе не исключается контаминация костной стружки.
Рис. 5-9Ь. Тонкий анатомический пинцет со специальным захватом, тонкий хирургический пинцет, двухсторонние распаторы (Партча) разного размера для отслаивания мягких тканей
Рис. 5-9с. Длинные тканевые ножницы Метценбаума (Metzenbaum), тонкий иглодержатель, щипцы Люера разного размера
Рис. 5-9d. Распаторы и тонкая аспирационная канюля (удобна при синус-лифтинге)

Рис. 5-9е. Остеотомы BoneCondenser и BoneExpander

Рис. 5-9f. Трепаны разного диаметра (разных производителей) ках, например при создании доступа через стенку верхнечелюстной пазухи для открытого синус-лифтинга. Наряду с этим скребком можно истончить костные блоки, полученные на нижней челюсти (рис. 5-9h-5-9k). Для размельчения костных блоков
Рис. 5-9д. Костный стержень выпилен треганом (внешний диаметр 3,5 мм) и извлечен с помощью специального штопора (Dentsply Friadent)
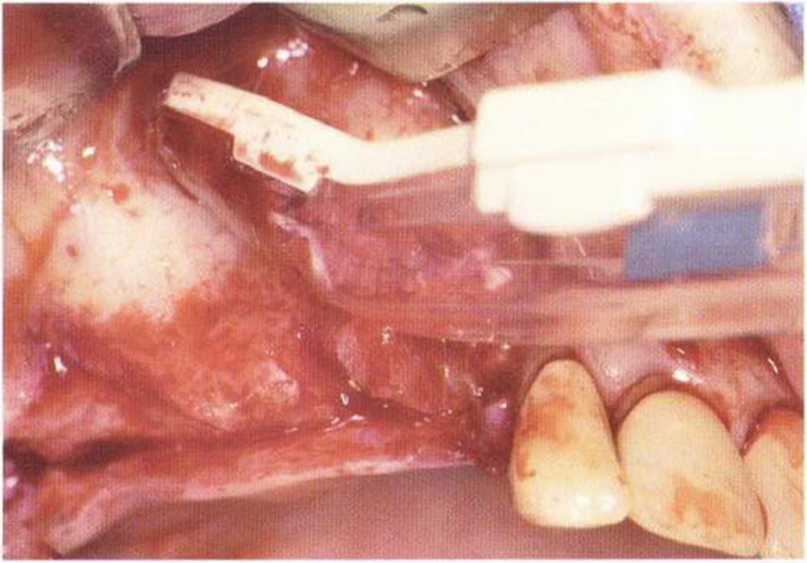
Рис. 5-9h. Получение костной стружки скребком Safescraper с поверхности верхнечелюстной пазухи при проведении синус-лифтинга
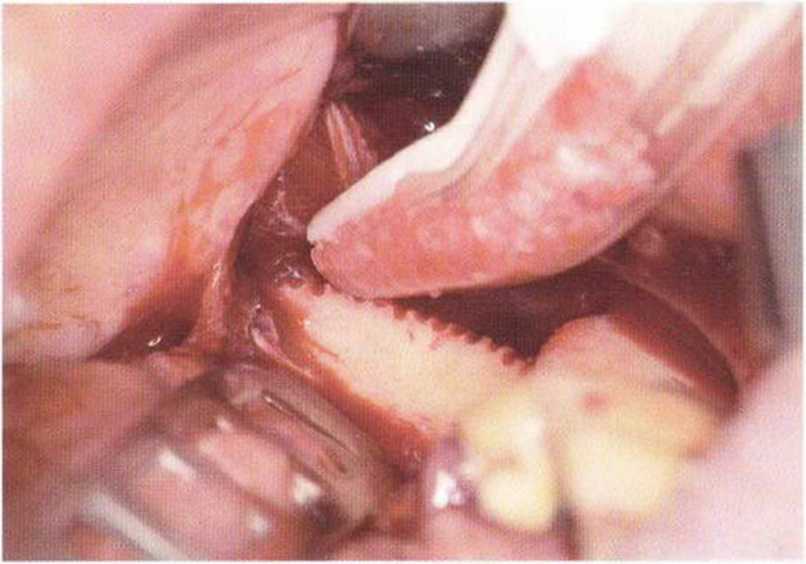
Рис. 5-9i. Сглаживание острых костных краев костного блока, полученного в области зуба 38. с одновременным получением костной стружки с помощью скребка Safescraper
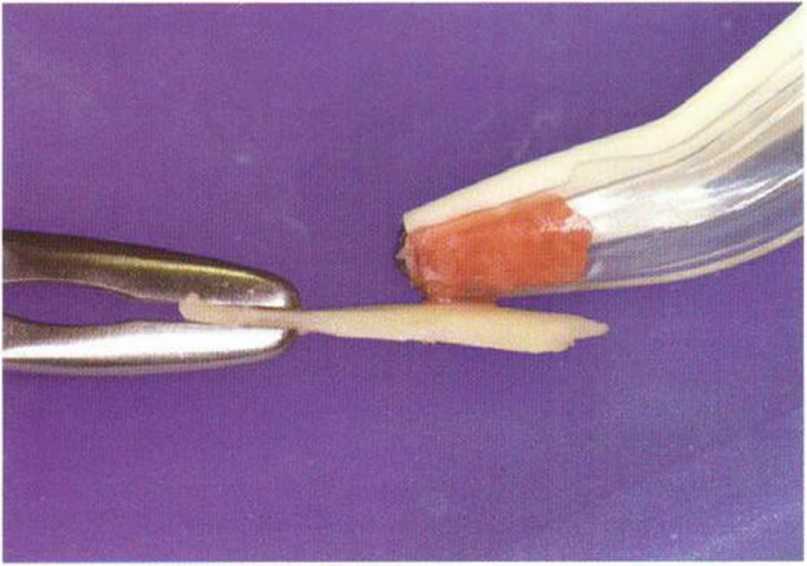
Рис. 5-9j. Истончение костного блока с одновременным получением костной стружки с помощью скребка Safescraper
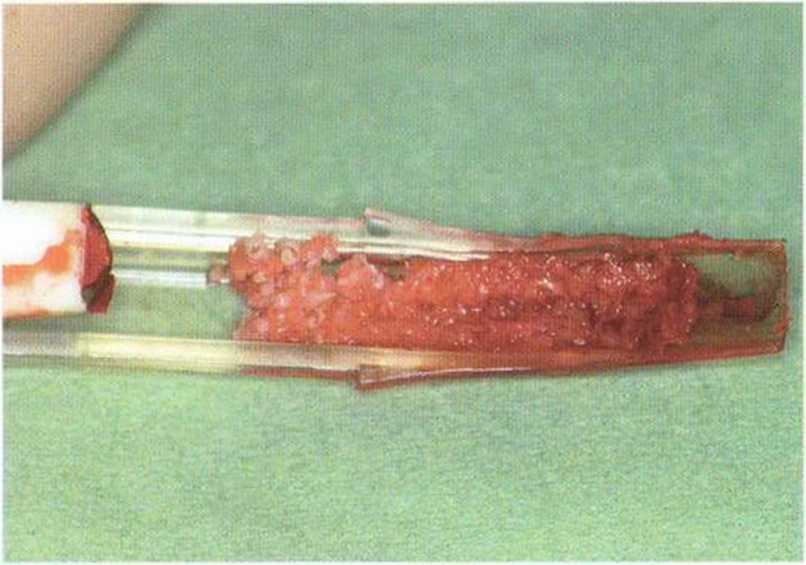
Рис. 5-9к. Полученная костная стружка

Рис. 5-91. Костный пресс (Stoma)

Рис. 5-9т. Костный блок измельчен с помощью костного пресса

Рис. 5-9п. Костная стружка после измельчения костного блока в костной мельнице
Рис. 5-9о. Контаминация измельченной кости металлическими частицами
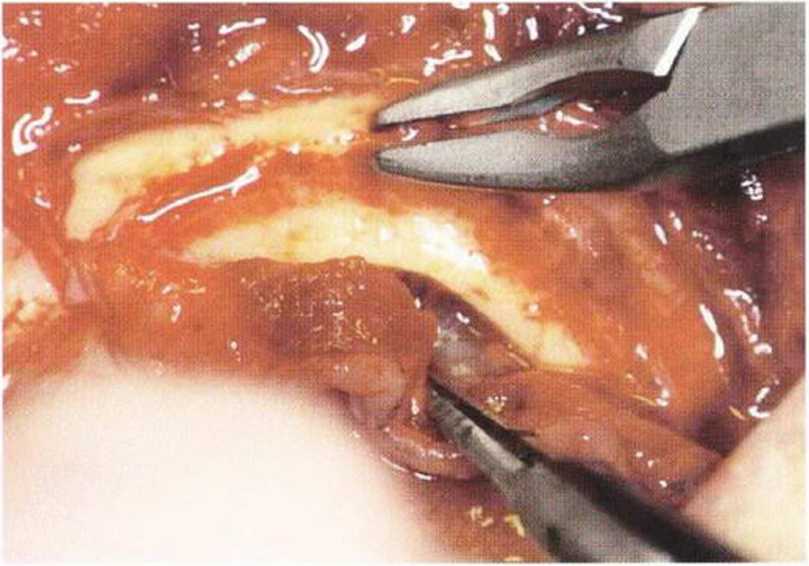
Рис. 5-9р. Иссечение края альвеолярного гребня щипцами Люера
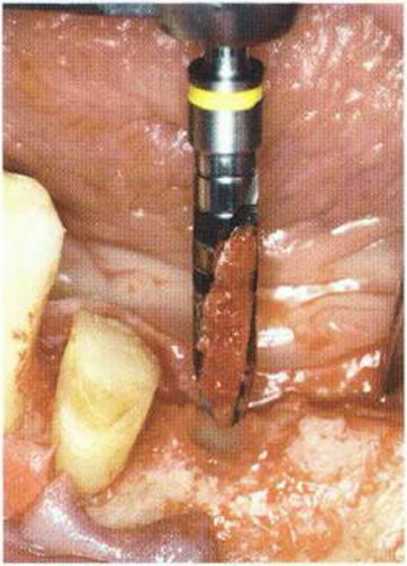
Рис. 5-9q. Получение аутогенной кости сверлом при препарировании ложа имплантата
Рис. 5-9г. Получение костной ткани с помощью костного фильтра BoneCollector
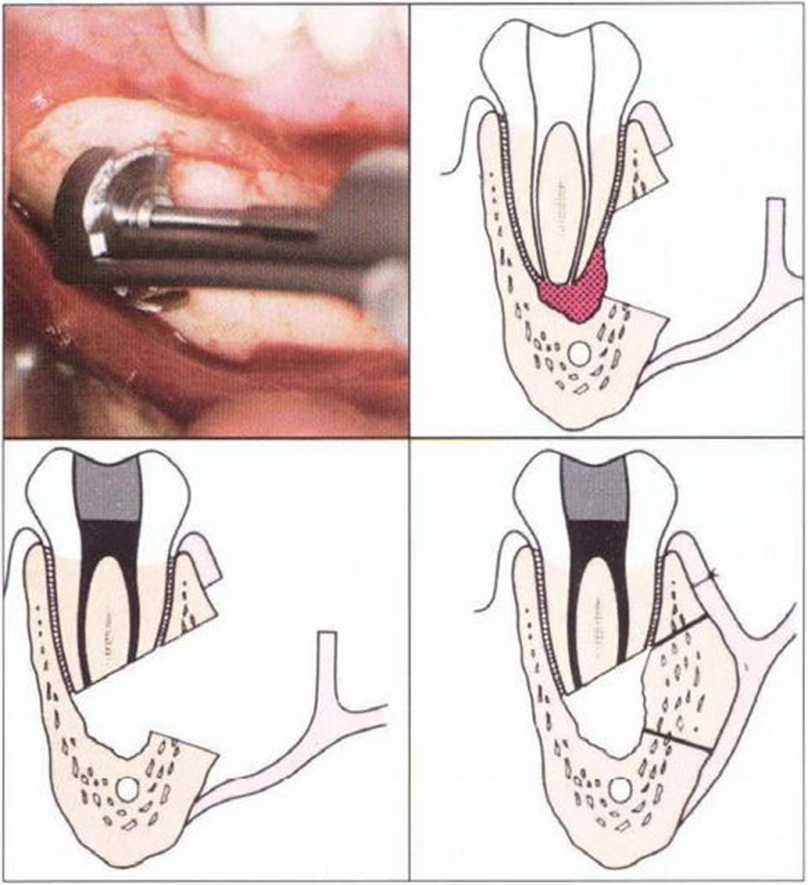
Рис. 5-1ОЬ. Набор MicroSaw включает в себя прямой и угловой наконечники, алмазный диск и защитный кожух
Рис. 5-1 Оа. Схема пересадки костного фрагмента при резекции верхушки корня нижнего моляра


Рис. 5-10d. Набор MicroSaw
Рис. 5-1 Ос. Поворотный защитный кожух.
.
В течение длительного времени для получения костных блоков на внутриротовых участках успешно применяется микропила MicroSaw (Dentsply Friadent), которая исходно (в 1984 г.) была разработана для получения костного лоскута (рис. 5-1 Оа) при резекции верхушек корней моляров нижней челюсти.- Микропила представляет собой алмазный диск толщиной 0,25 мм и диаметром 8 мм, который приводится в движение прямым или угловым наконечником. Пила комплектуется защитным кожухом, препятствующим повреждению мягких тканей (рис. 5-1 ОЬ и 5-1 Ос). Кроме алмазных дисков и защитного кожуха в набор включены фрезы, а также по одному прямому и изогнутому долоту большого и маленького размера (рис. 5-10d).
Применяемые для стабилизации костных блоков винты изготавливают преимущественно из титана. Биологически совместимые титановые мини-винты не требуют удаления и давно используются в детской травматологии. Схожие мини-винты предлагаются для реконструктивных вмешательств в имплантологической практике. В связи с меньшей прочностью титана по сравнению со сталью диаметр этих титановых винтов составляет 1,3-2 мм, причем для фиксации маленьких и тонких костных блоков необходим меньший диаметр винтов. Титановые винты диаметром меньше 1,3 мм легко ломаются, особенно в момент удаления при их частичной остеоинтеграции перед установкой имплантатов (рис. 5-11 а и 5-11Ь), поэтому в таких случаях целесообразно применять мини-винты из медицинской стали (например, Biodur, Dentsply Friadent).
В настоящее время широко применяются мини-винты диаметром 1-1,2 мм и длиной 6-14 мм, эффективность которых подтверждена экспериментально и клинически. Простой и удобный набор инструментов и надежные мини-винты (рис. 5-11 с-5-11 е) облегчают проведение регенеративных вмешательств на разных участках полости рта (рис. 5-12а-5-12е).
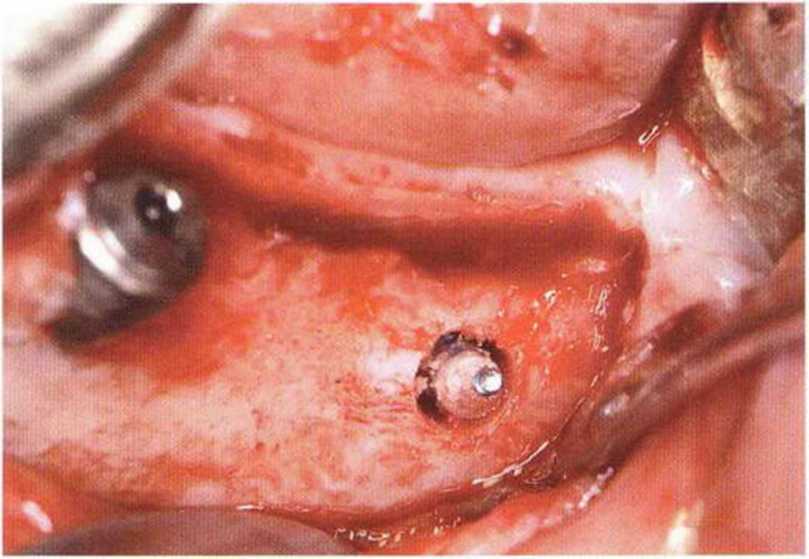
Рис. 5-11а. Перелом головки титанового винта. Оставшуюся часть удаляют трепаном

Рис. 5-11Ь. Обломки удаленного винта
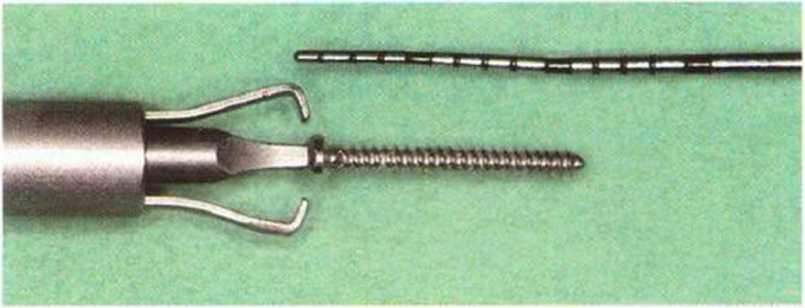
Рис. 5-11 d. Мини-винт (диаметр 1 мм, длина 10 мм) со специальной отверткой. Стабильная и надежная фиксация винта обеспечивается благодаря зажиму, который устанавливают на шляпку винта

Рис. 5-11с. Набор MicroScrew (Stoma)

Рис. 5-11 е. Специальная отвертка с зажимем под шляпкой винта
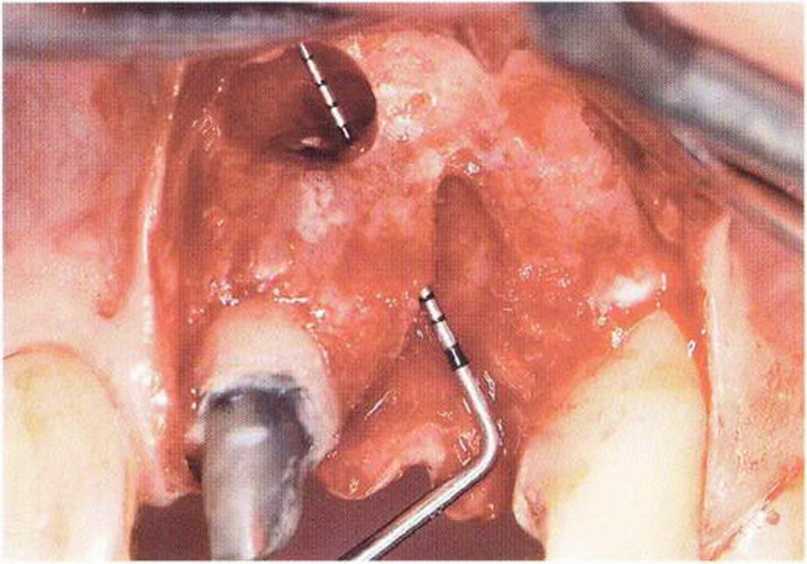
Рис. 5-12а. Костный дефект в области зуба 22, сообщающийся с кистой в области зуба 21
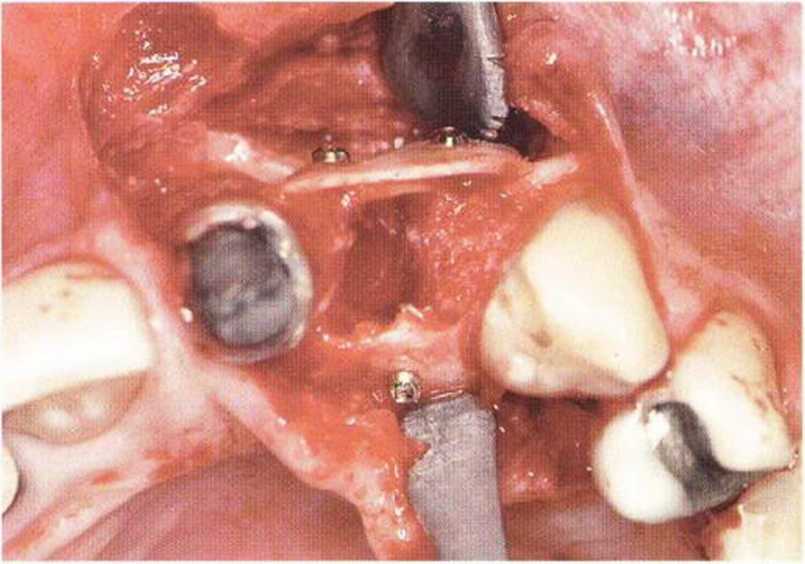
Рис. 5-12Ь. Трехмерная костная пластика в области зуба 22: два костных блока фиксированы тонкими винтами с вестибулярной и нёбной сторон
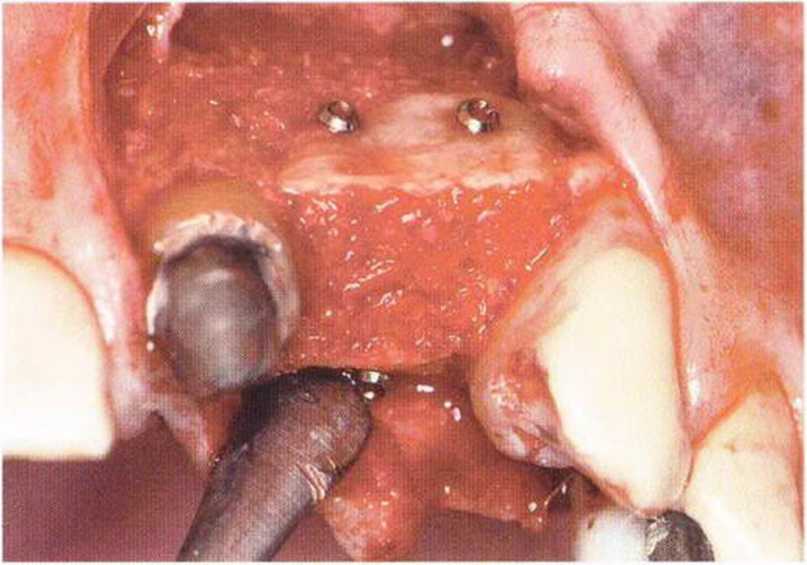
Рис. 5-12с. Заполнение полости костной стружкой
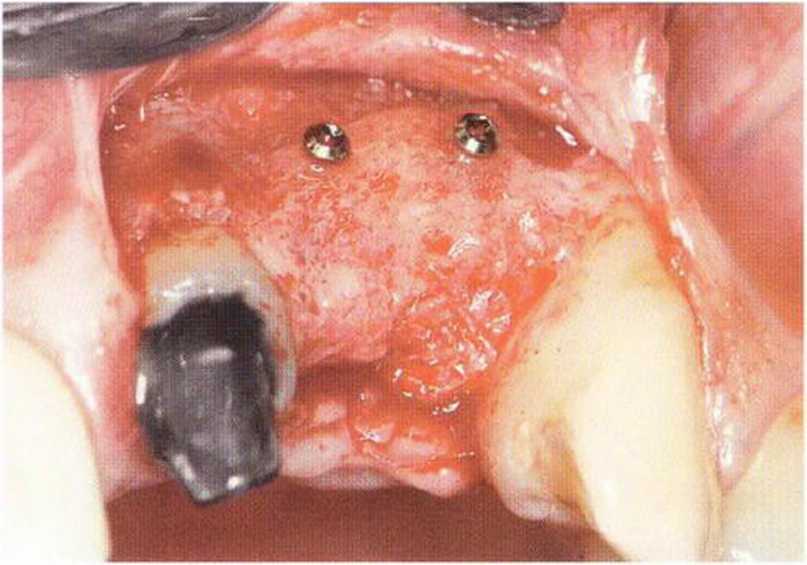
Рис. 5-12d. Клиническая ситуация через 4 мес после трансплантации: костная резорбция вокруг шляпок винтов отсутствует
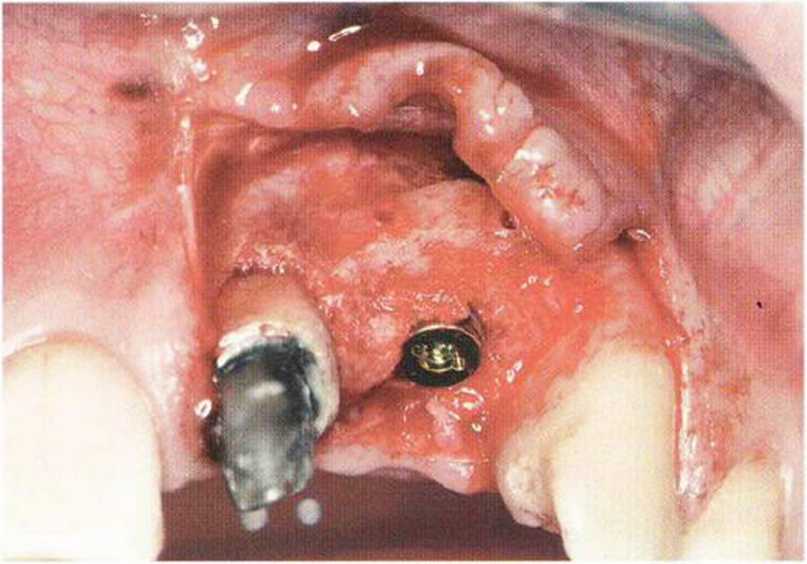
5.3.5 Устранение мелких дефектов с помощью внутриротовых костных трансплантатов.
Реконструкцию альвеолярного гребня при наличии относительно мелких дефектов можно проводить с помощью аутогенной кости, полученной в области планируемой имплантации. Такой подход сокращает затраты на операцию и уменьшает дискомфорт пациентов в послеоперационном периоде.
Рис. 5-13Ь. Препарирование трепаном ложа имплантата в области зуба 14
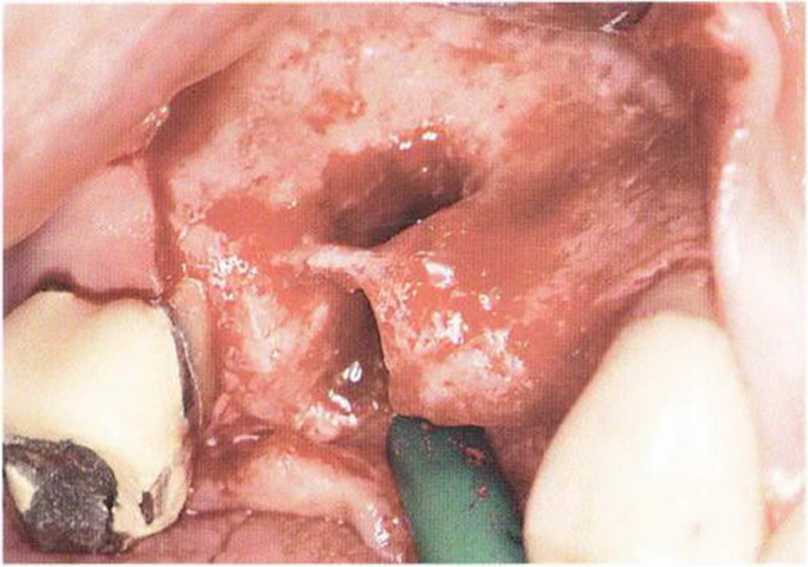
Рис. 5-1 За. Апикальный и нёбный костный дефект в области зуба 15
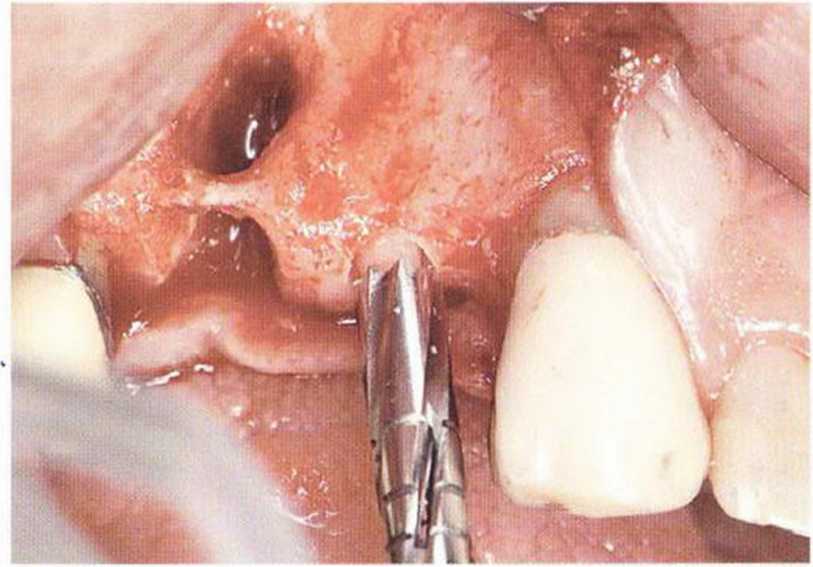
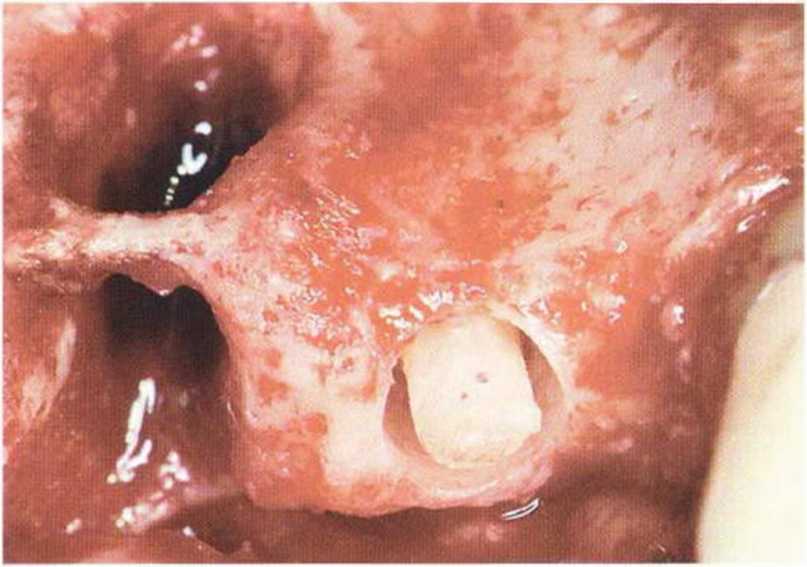
Рис. 5-13с. Препарированный костный стержень
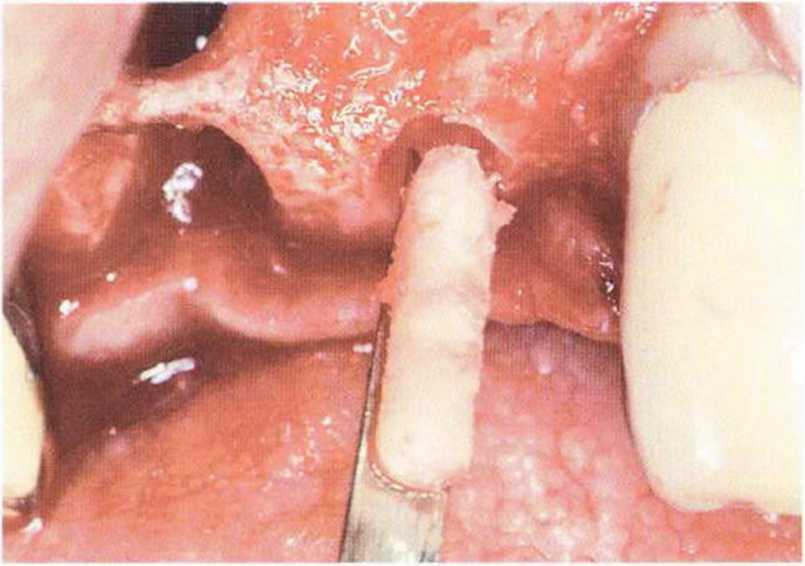
Рис. 5-13d. Вывихивание костного стержня штопором.
Один из методов заключается в сборе костной стружки, образующейся при препарировании ложа имплантата, с помощью специального фильтра.
Как уже отмечалось, при аспирации костной стружки нужно избегать попадания в фильтр слюны, крови и ирригационной жидкости. В противном случае происходят вымывание и контаминация собранной костной ткани. Кроме того, костный трансплантат можно получить трепаном при препарировании ложа имплантата (рис. 5-1 За—5-13j). При этом необходимо работать с достаточным охлаждением водой и без избыточного давления, во избежание перегревания кости. При соответствующей форме сверл, применяемых для препарирования ложа имплантата, также можно собрать костную стружку при низкой скорости вращения и без ирригации.
Однако при очень плотной структуре кости без охлаждения рекомендуется работать только до предпоследнего сверла, чтобы не допустить ее перегревания.
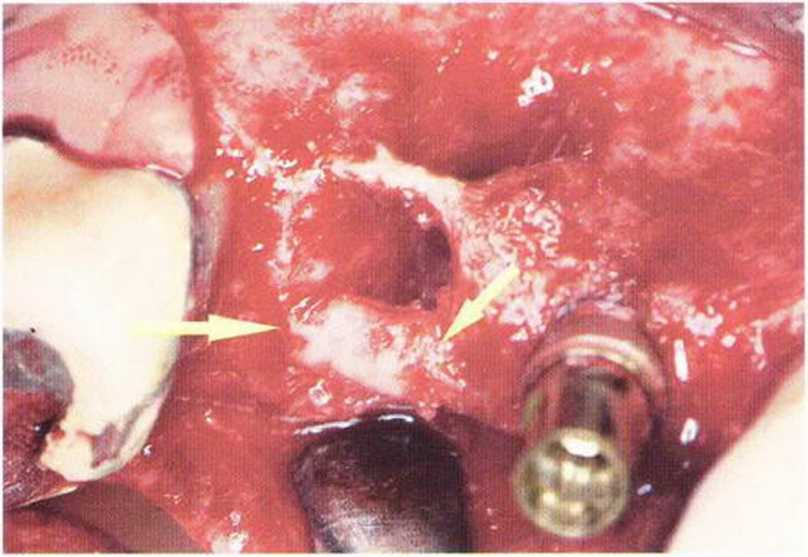
Рис. 5-13е. Восстановление нёбной костной стенки с помощью фрагмента костного стержня (стрелки)

Рис. 5-13f. Аутогенная кость получена с помощью сверла при препарировании ложа имплантата в области зуба 14
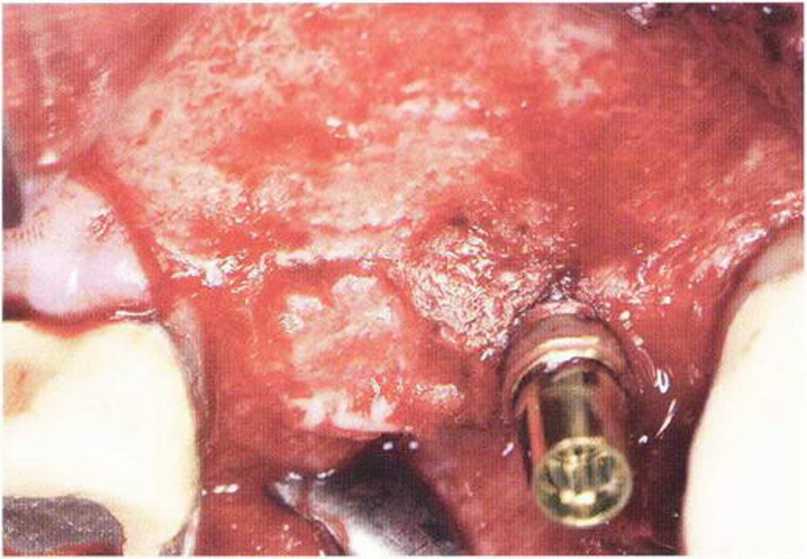
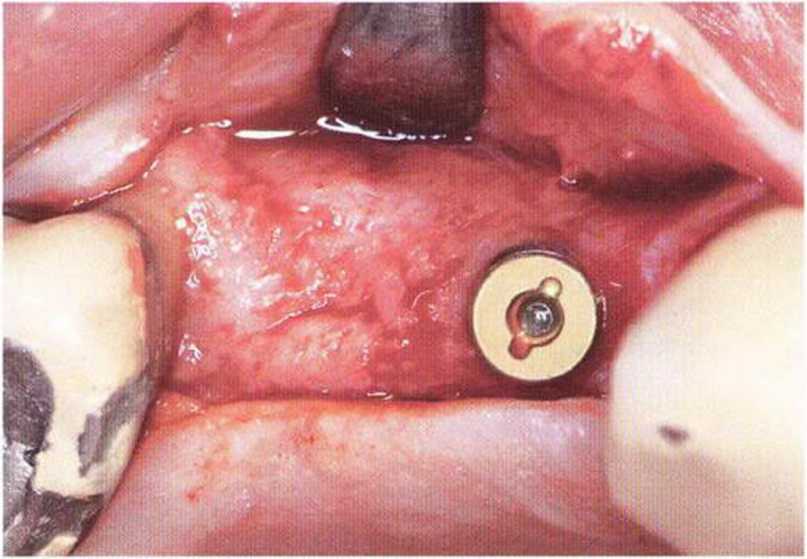
Рис. 5-13д. Клиническая ситуация после имплантации в области зуба 14 и заполнения дефекта в области зуба 15 аутогенной костью.
Рис. 5-13И. Клиническая ситуация через 4 мес после операции
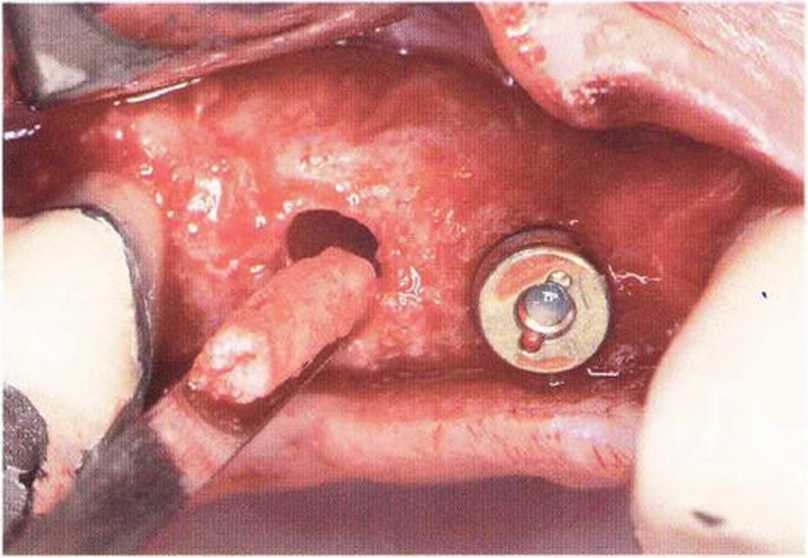
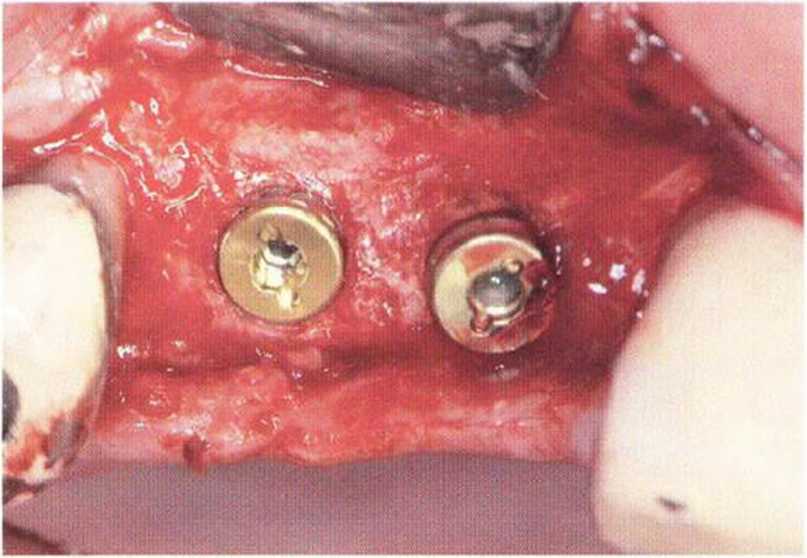
Рис. 5-13j. Клиническая ситуация после установки имплантата XiVE диаметром 3,8 мм в области трансплантации
Рис. 5-14с. Отделение экзостоза
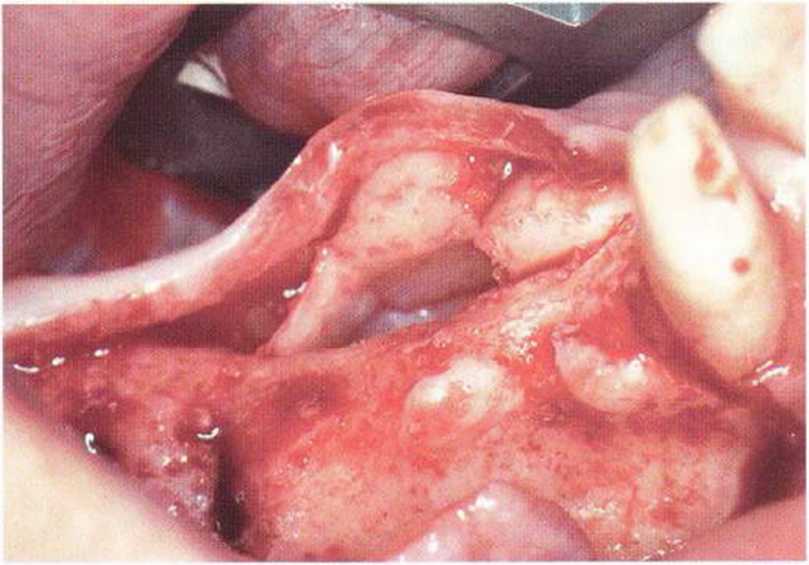
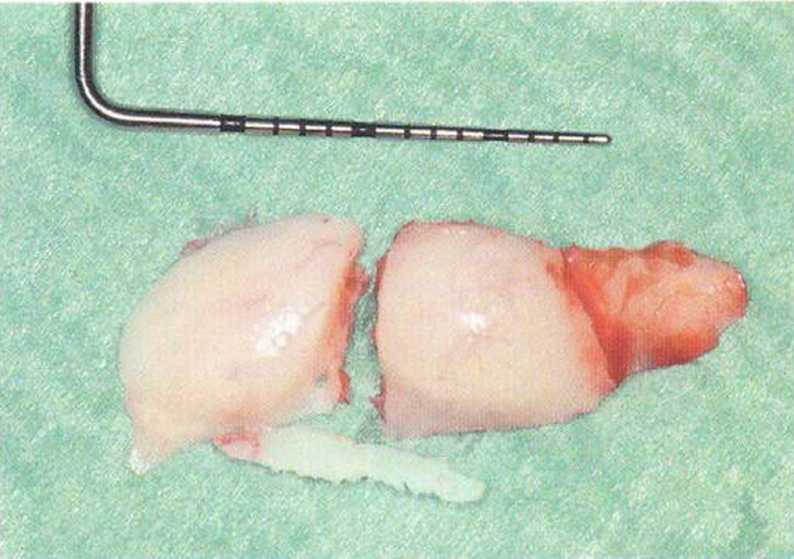
Рис. 5-14Ь. Распил микропилой MicroSaw
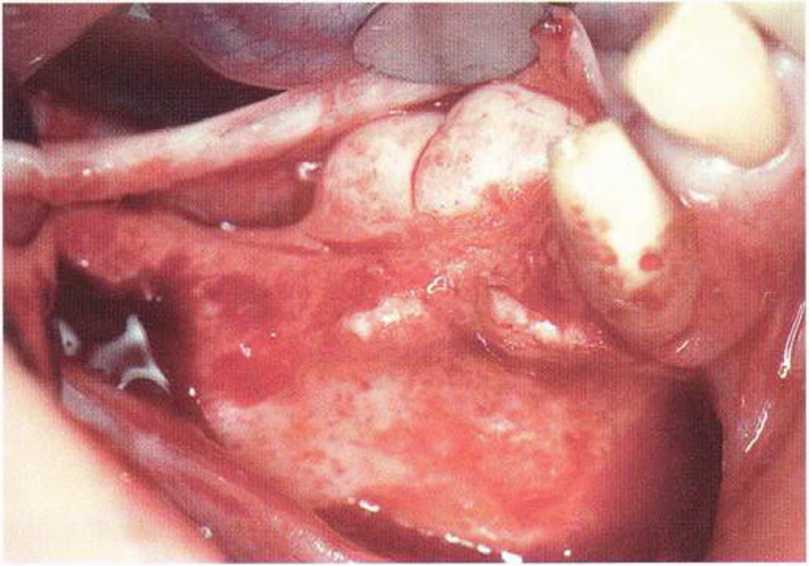
Рис. 5-14а. Язычный экзостоз в области зубов 44/45
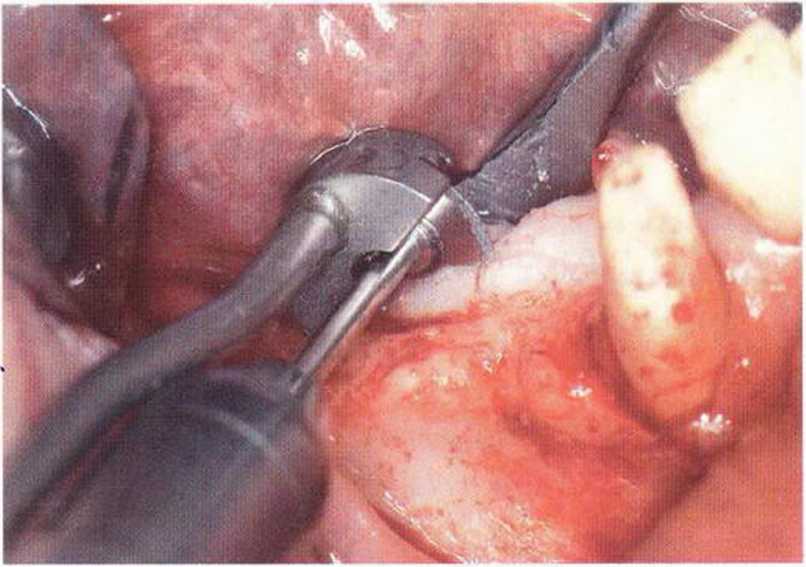
Рис. 5-14d. Удаленный экзостоз используется в качестве трансплантата при проведении регенеративного вмешательства на верхней челюсти.
При недостаточном объеме костной ткани, взятой в области ложа имплантата, можно дополнительно получить кость в непосредственной близости от ложа имплантата или на прилегающих участках. С этой целью применяются костные кусачки Люера, которыми удобно получить костную ткань, например, из передней носовой ости или бугра верхней челюсти. С помощью микропилы MicroSaw и тонкого долота можно удалить экзостозы любого размера и любой формы на верхней и нижней челюстях (рис. 5-14а—5-14е). Костным скребком Safescraper удобно собирать костную стружку при создании доступа к верхнечелюстной пазухе. Костный фрагмент, полученный при формировании костного окна к пазухе, также можно применять для трансплантации (рис. 5-15а—5-15f).
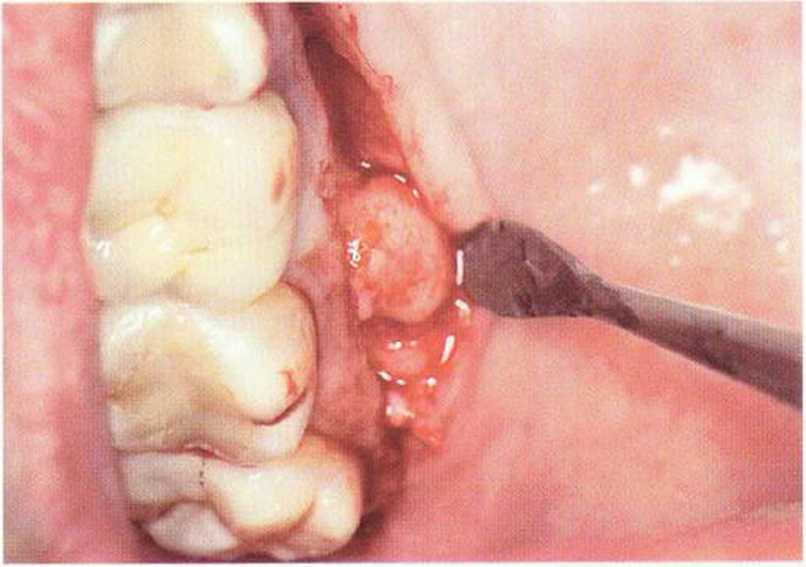
Рис. 5-14е. Нёбный экзостоз в области зуба 16
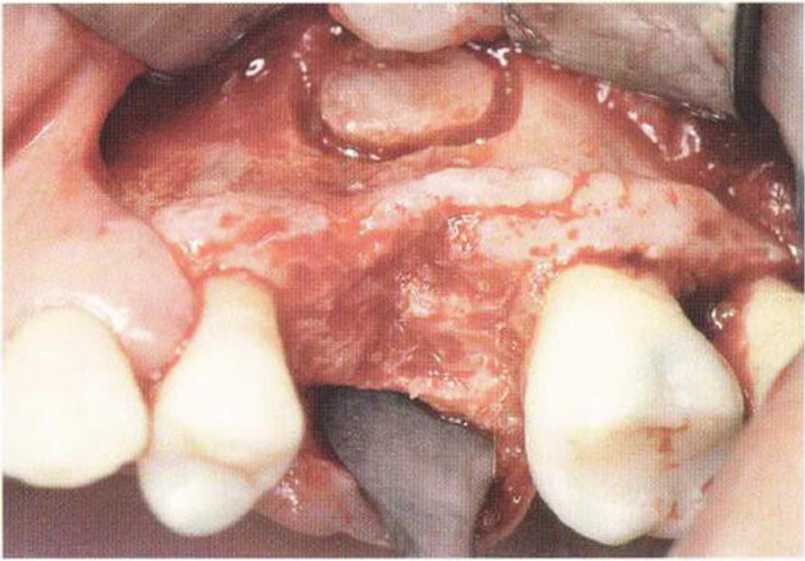
Рис. 5-15а. Костный дефект в области зуба 26
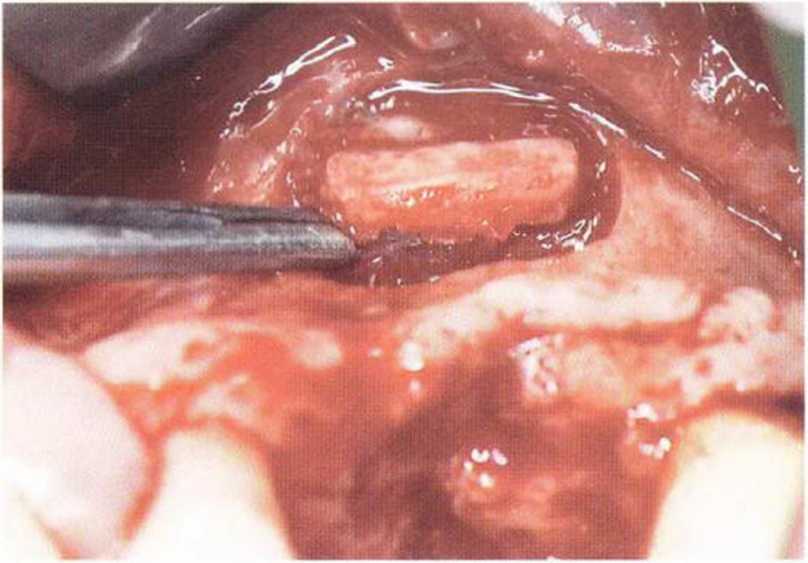
Рис. 5-15Ь. Выпиливание костного фрагмента при создании доступа к верхнечелюстной пазухе при синус-лифтинге
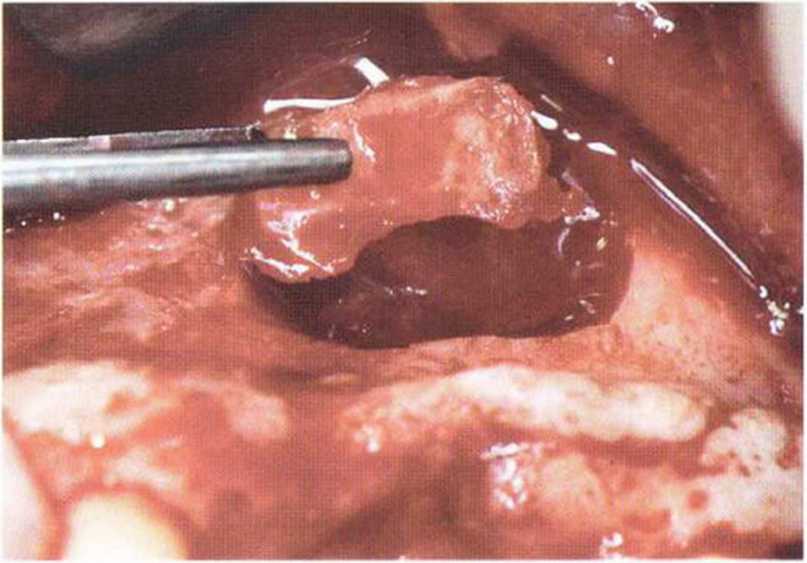
Рис. 5-15с. Костный лоскут осторожно отделяют от слизистой пазухи
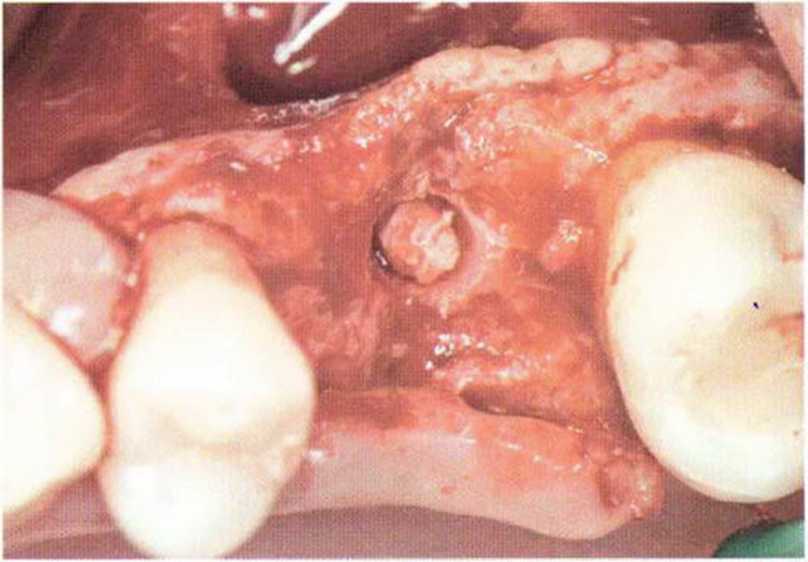
Рис. 5-15d. Полученный костный лоскут
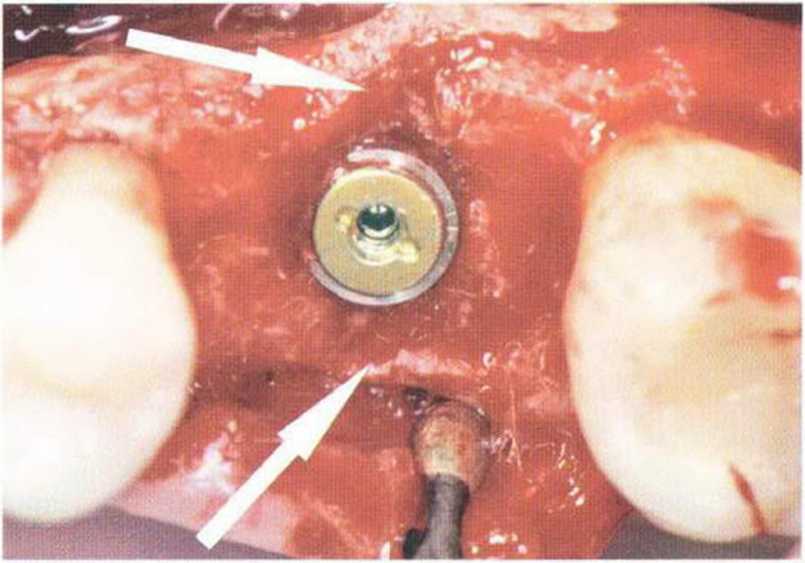
Рис. 5-15f. Установка имплантата в пределах костных контуров. С вестибулярной и нёбной сторон сохраняются дефекты
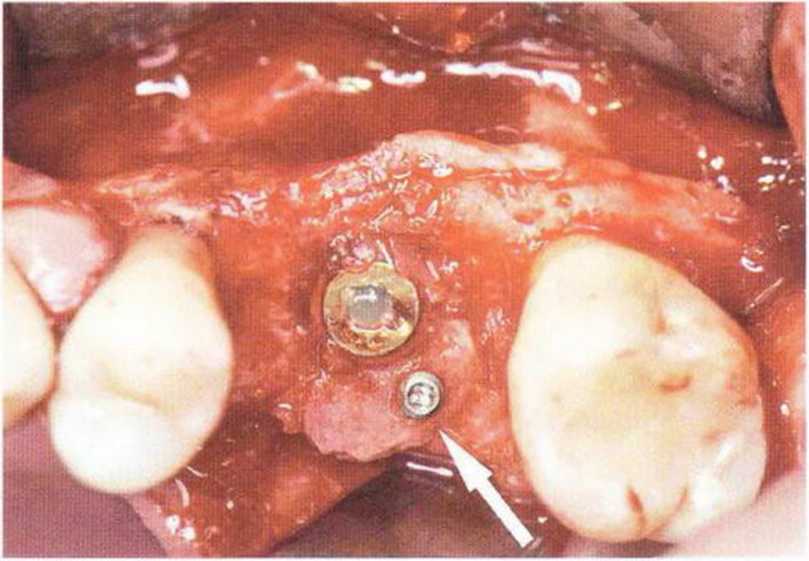
Рис. 5-15д. Вестибулярный костный дефект заполнен костной стружкой. Вертикальный нёбный костный дефект устранен с помощью костного фрагмента.
.
5.3.6 Устранение крупных дефектов с помощью внутриротовых костных трансплантатов.
При выраженных дефектах альвеолярного гребня проводят двух- или трехмерную пластику с помощью костных трансплантатов, полученных из вне-или внутриротовых источников.
В настоящее время в качестве внеротовых донорских участков нередко используют свод черепа, ребра, большеберцовую кость и гребень подвздошной кости. В переднем отделе верхнего гребня подвздошной кости можно получить монокорти-кальный блок без разрушения контура тазовой кости, однако данное вмешательство проводится в условиях стационара и может ассоциироваться с временным ограничением ходьбы, нарушениями чувствительности в области бедра и рубцеванием мягких тканей.
В отличие от внеротовых трансплантатов, преимущество внутриротовых донорских участков заключается в отсутствии удаленного второго операционного поля, но в полости рта костные блоки можно получить только на нижней челюсти, причем применение реципрокных, осциллирующих и сагиттальных пил часто затруднено, особенно в ретромолярной области, и приводит к потере большого количества костной ткани.
Как отмечалось выше, микропила MicroSaw была предложена для распилов кости при резекции верхушек корней нижних моляров и позволяет быстро выделить костные блоки на различных участках нижней челюсти.- Кроме того, эта пила удобна для проведения распилов при расщеплении или расширении альвеолярного "ребня, а также при цистэктомии, удалении инородных тел либо латерализации нижнего альвеолярного нерва. Полученные с помощью микропилы костные блоки применяются в качестве накладок или вкладок, их можно измельчать и использовать при направленной костной регенерации или синус-лифтинге.
Ниже описан эффективный и безопасный протокол получения костного блока из нижней челюсти с помощью микропилы.
В 1982-2006 гг. нами в рамках регенеративных и реконструктивных вмешательств было получено 5964 нижнечелюстных костных блока. Донорские участки распределились следующим образом:
Ретромолярный отдел нижней челюсти | 4831 трансплантат |
Подбородок | 716 трансплантатов |
Беззубый отдел челюсти | 417 трансплантатов |
Экзостозы | 63 трансплантата |
Пересадка костной ткани из ретромолярной области.
В таких случаях, как правило, не требуется проводниковая анестезия нижнего альвеолярного нерва. Обычно достаточно местной вестибулярной и язычной инфильтрации 4 % раствором артикаи-на с адреналином (1:100000, ультракаин DS форте; Ultracain DS forte, Sanofi Aventis). Такой подход снижает риск повреждения нижнечелюстного нерва, поскольку пациент может проинформировать хирурга о боли при приближении инструмента к нижнечелюстному каналу.
После проведения трапециевидного разреза и отслаивания слизисто-надкостничного лоскута (как при удалении ретинированных зубов мудрости) визуализируется участок нижней челюсти в области наружной косой линии на протяжении 3-4 см и на глубину 2 см. Затем по представленному ниже протоколу с помощью микропилы в сопровождении непрерывной ирригации стерильным физиологическим раствором проводят распилы для выделения трансплантата (рис. 5-10).
5 Костные трансплантаты нижней челюсти.
Размер полученного блока зависит от протяженности наружной косой линии и объема костной ткани, необходимого для планируемого регенеративного вмешательства (рис. 5-16а). Микропилой выполняют три распила: два вертикальных (рис. 5-166 и 5-16с) и один горизонтальный у основания (рис. 5-16d). Последний (верхний) горизонтальный распил параллельно наружной косой линии проводят не микропилой, а фрезой диаметром 1 мм (рис. 5-16е), что объясняется лучшим доступом. В зависимости от выраженности наружной косой линии мезиальный вертикальный распил в области моляров можно проводить микропилой в прямом наконечнике. Длина этого распила определяется размерами предполагаемого трансплантата. У мезиального бокового края ветви над наружной косой линией делают задний вертикальный распил. При выполнении обоих распилов алмазный диск не должен погружаться в кость глубже чем на 3,2 мм.
По данным исследований, расстояние от нижнечелюстного канала до вестибулярной поверхности нижней челюсти в ретромолярной области составляет 3,8-5,7 мм (в среднем 4,7 мм) (рис. 5-16f—5-16h). Однако в области восходящей ветви нижней челюсти нерв располагается значительно ближе к поверхности. Обнажение нерва возможно при слабо выраженной наружной косой линии и препарировании костного блока ниже уровня нерва, а также при расположении вертикального распила на восходящей ветви нижней челюсти, где нижний альвеолярный нерв проходит близко от вестибулярного кортикального слоя до перехода в тело нижней челюсти с язычной стороны. В этих случаях не следует погружать алмазный диск на полную глубину. Кроме того, с учетом данных панорамной рентгенографии сначала можно сформировать первый костный блок выше нерва, а затем, после оценки костных структур, при необходимости получить второй костный блок в апикальном отделе (рис. 5-16i и 5-16j).
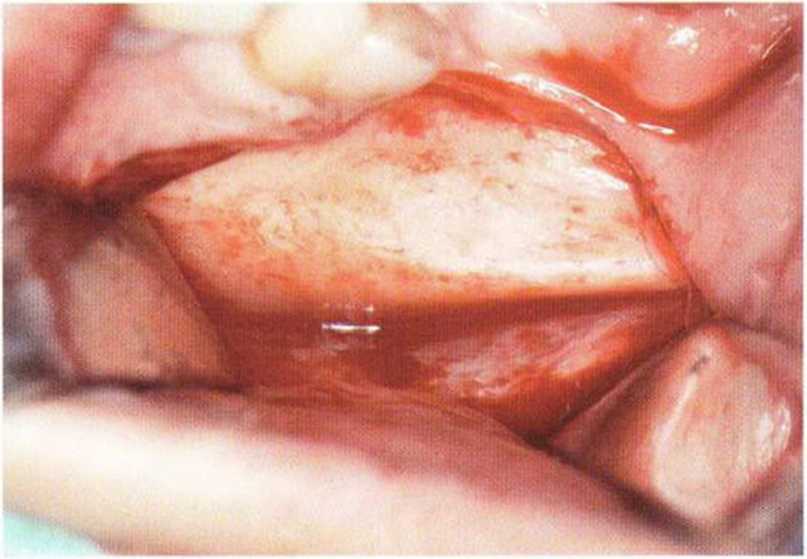
Рис. 5-16а. Клинический вид наружной косой линии
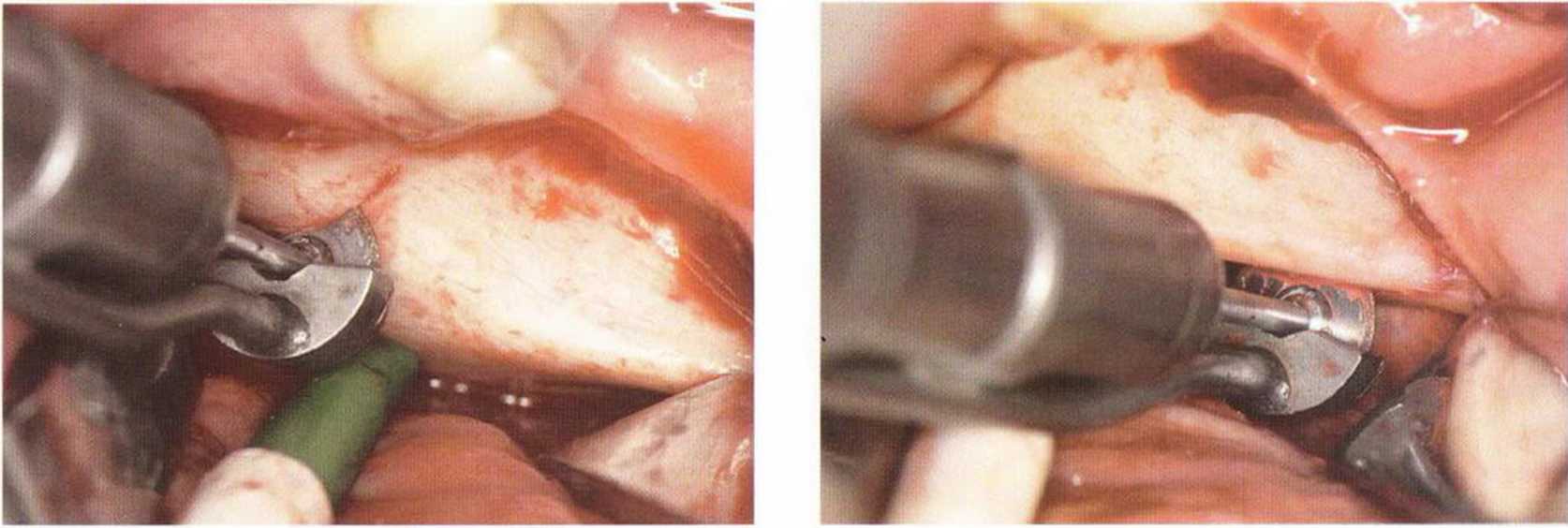
Рис. 5-16Ь и 5-16с. Мезизльный (Ь) и дистальный (с) вертикальные распилы выполнены пилой MicroSaw в прямом наконечнике. Защитный кожух снижает риск повреждения мягких тканей
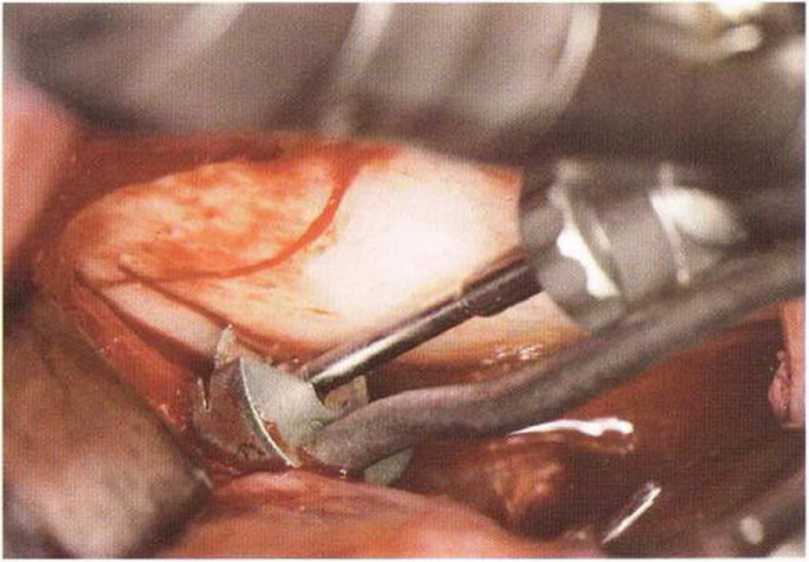
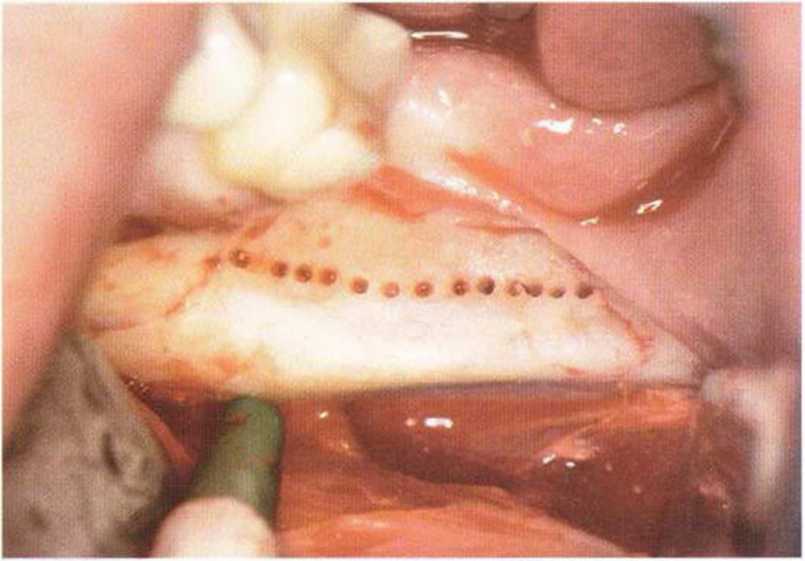
Рис. 5-16d. Апикальное объединение вертикальных распилов с помощью пилы MicroSaw в угловом наконечнике.
Рис. 5-16е. Между верхними краями вертикальных распилов сверлом перфорируют кортикальный слой кости.
Алмазный диск нужно располагать перпендикулярно поверхности кости, чтобы избежать образования поднутрений, затрудняющих отделение костного блока. Два вертикальных распила объединяются у основания горизонтальным распилом, который проводят микропилой в угловом наконечнике, причем глубина распила не должна превышать 2,5 мм. Такой распил задает границу отделения блока в базальной области. Благодаря защитному кожуху распилы при необходимости можно продлить до базального края нижней челюсти без риска повреждения прилегающих мягких тканей. Между вертикальными распилами от дистального к мезиальному краю просверливают точечные отверстия глубиной 3-4 мм, которые располагаются примерно на середине расстояния между наружной косой линией и альвеолярным краем. Осторожными ударами молоточка по тонкому долоту эти перфорации объединяют друг с другом для отделения костного блока (рис. 5-16к).
Долото должно быть направлено параллельно наружной поверхности тела нижней челюсти, что облегчает сепарацию трансплантата. Долото не следует погружать в губчатую кость. При отделении костного блока этс не требуется, поскольку после просверливания нескольких отверстий в области верхнего края возникает напряжение с эффектом «взрыва», в результате чего блок отделяется после соединения перфораций (рис. 5-161 и 5-16т) даже без значительного погружения долота в толщу кости.
Если после трех ударов молоточка по долоту костный блок не отделяется, сначала нужно проверить направление распилов. Нередко оказывается, что распилы не объединены между собой (часто в мезиальной области), а значит, отсутствует полное рассечение кортикального слоя. В этом случае распилы необходимо продлить. При неверном наклоне алмазного диска в области мези-ального вертикального распила могут возникнуть поднутрения, которые затрудняют вывихивание блока. При невозможности отделения костного блока без большого физического усилия и сильных ударов молоточка, даже несмотря на правильное выполнение распилов, во избежание перелома челюсти показано вертикальное распиливание костного блока на две части (рис. 5-16п). После этого сначала отщепляют дистальный, а затем ме-зиальный блок.
Костный блок после вывихивания осторожно и медленно отделяют распатором в вестибулярном направлении. Нужно помнить, что нижнеальвеолярный нерв в случае слабо выраженной наружной косой линии может быть спаян с вестибулярным кортикальным слоем. При слишком быстром удалении возможно растяжение и повреждение нерва. Кроме того, в области дистального распила высока вероятность обнажения нерва из-за уменьшения толщины костных структур в этом отделе.
Трансплантат, полученный в ретромолярной области нижней челюсти, состоит из толстого кортикального и тонкого губчатого слоев (рис. 5-16о) и поэтому считается кортикально-губчатым.
Толщина кортикального слоя в ретромолярной области в среднем составляет 3 мм (рис. 5-16р) и значительно более выражена у мезиального края блока, чем у дистального, что объясняет оптимальную глубину погружения алмазного диска
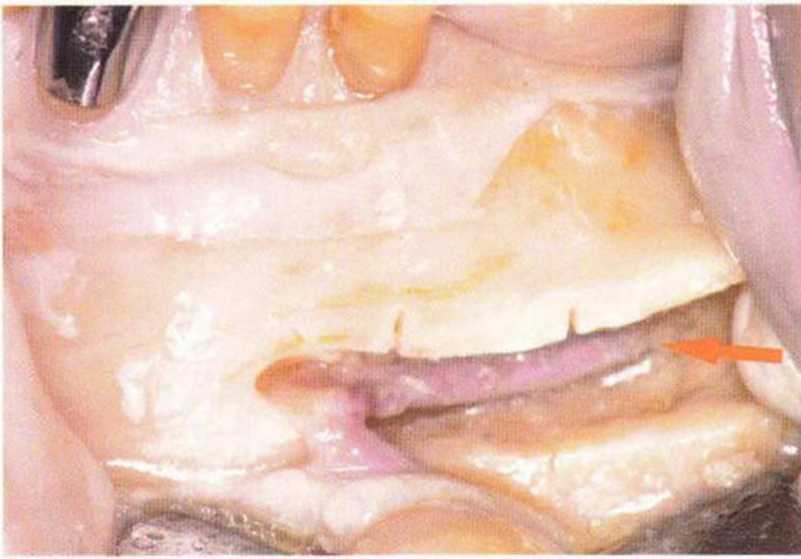
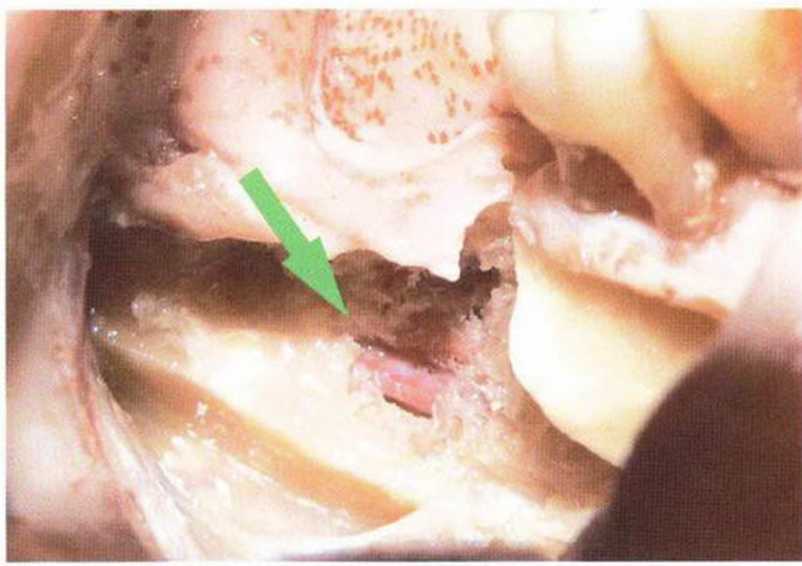
Рис. 5-16д. Вскрытие нижнечелюстного канала в ретромоляр ной области на глубине 4,5 мм (с вестибулярной стороны) на препарате
Рис. 5-16f. Язычное положение нижнего альвеолярного нерва в области моляров на препарате
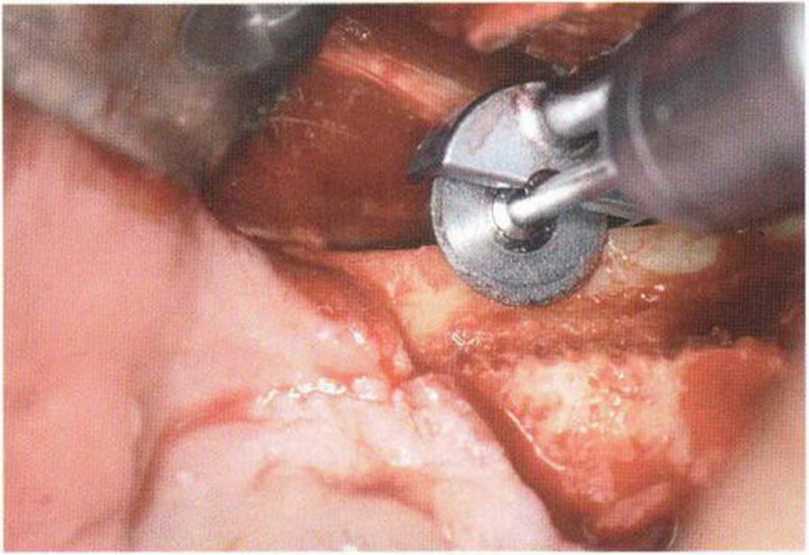
Рис. 5-16h. Максимальная глубина погружения алмазного диска составляет 3,2 мм, что приблизительно соответствует толщине кортикального слоя
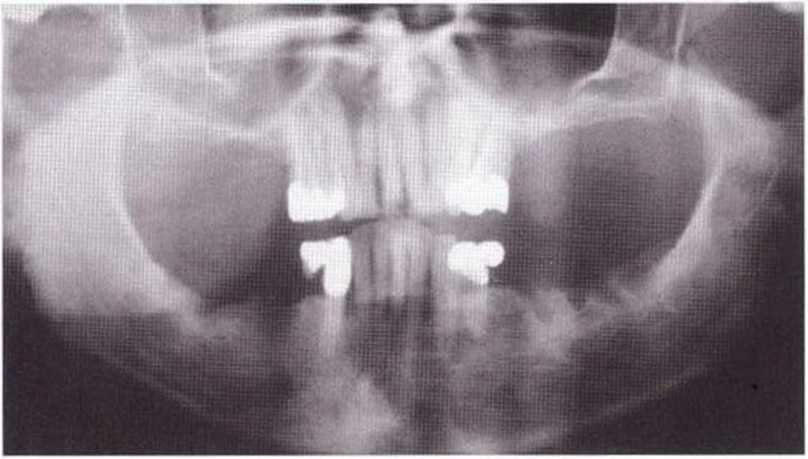
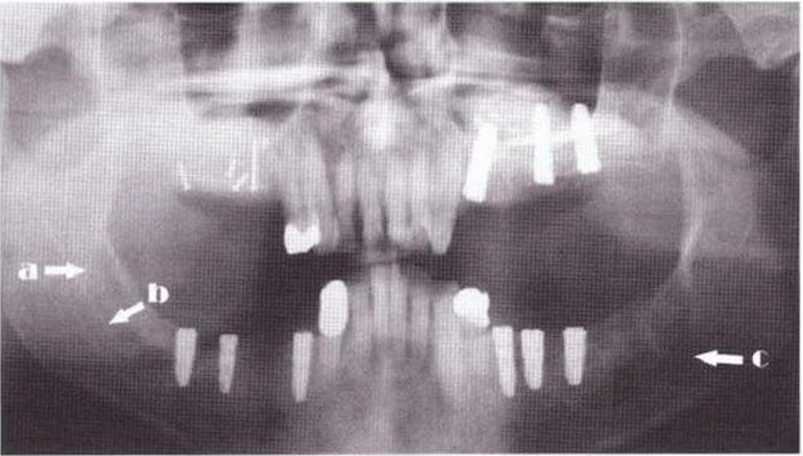
Рис. 5-16i. Ортопантомограмма до операции: с обеих сторон хорошо визуализируются косая линия и нижнечелюстной канал
Рис. 5-16j. Получение костного трансплантата в области зубов 38 и 48 для регенеративного вмешательства на верхней челюсти. На нижней челюсти справа дистальный веэтикальный распил проходит в области восходящей ветви (а), поэтому апикальный распил выполнен выше нижнечелюстного канала. На нижней челюсти слева дистальный вертикальный распил проходит ниже ретромолярной области, поэтому забор костного блока проводили более апикально (с)
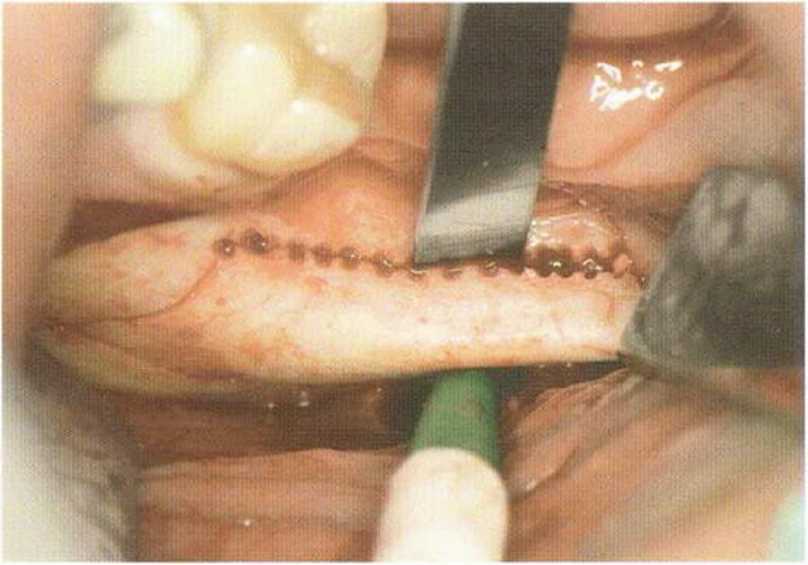
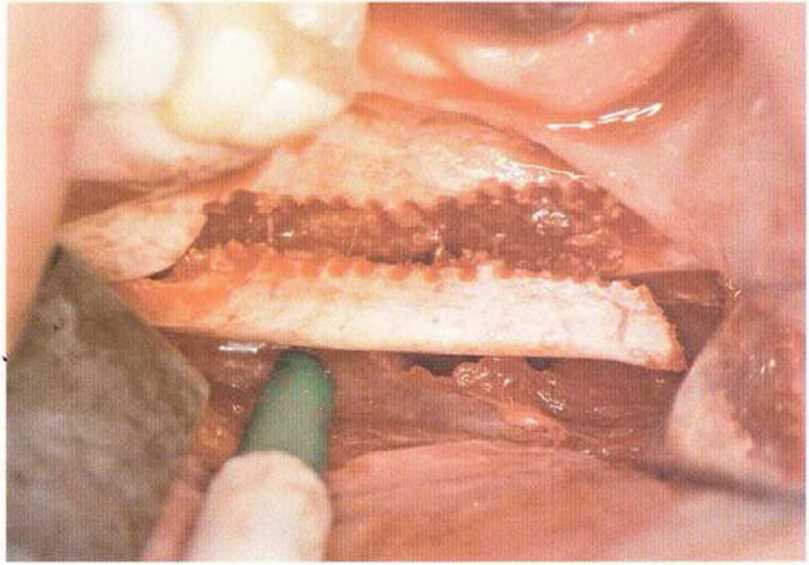
Рис. 5-161. Отделение блока за счет напряжения
Рис. 5-16к. Перфорации объединяют между собой тонким долотом
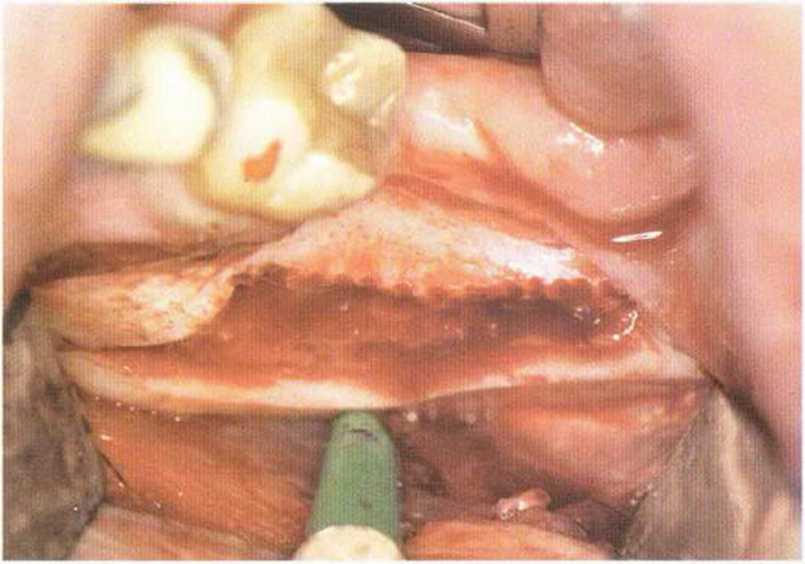
Рис. 5-16т. Донорский участок в ретромолярной области после удаления блока
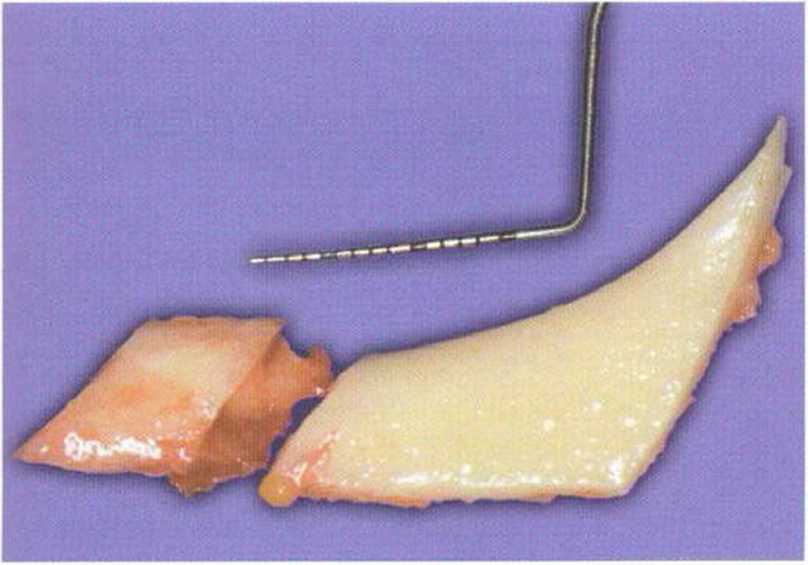
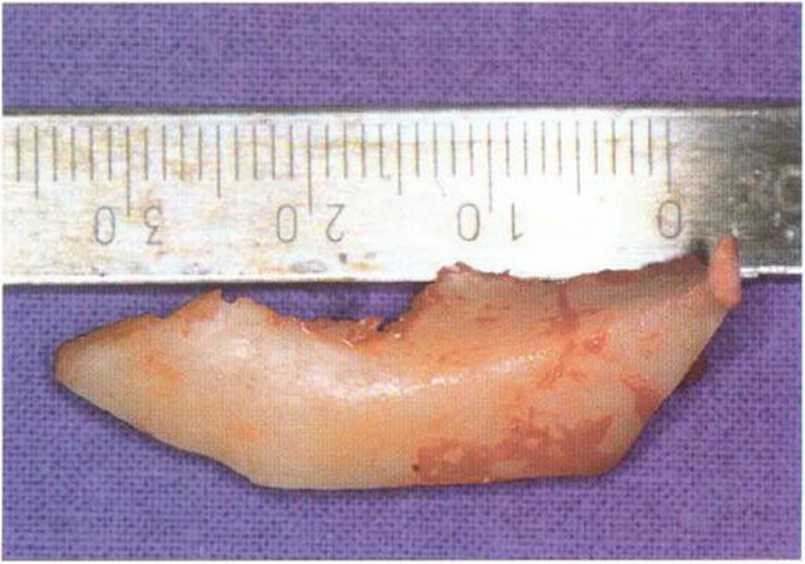
Рис. 5-16о. Костный блок длиной 3 см
Рис. 5-16п. Костный блок с ранее отделенной мезиальной частью
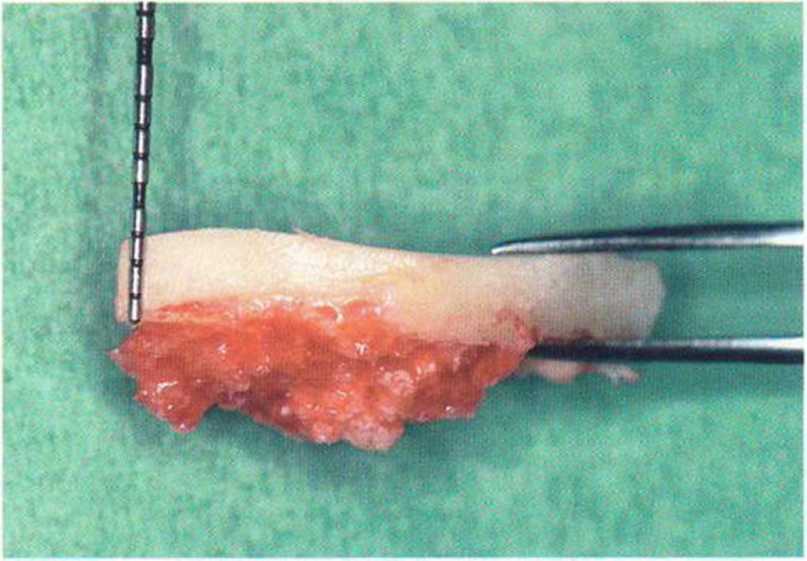
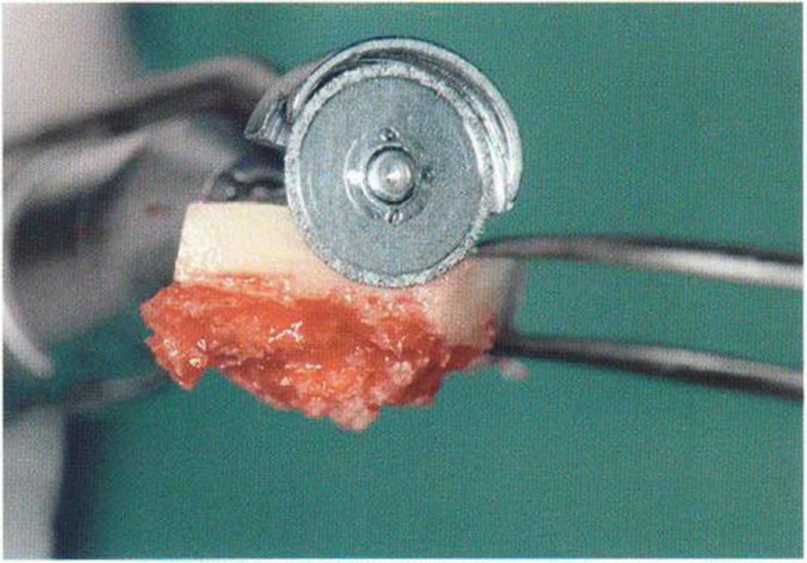
Рис. 5-16q. Погружение алмазного диска на толщину кортикального слоя
Рис. 5-16р. Средняя толщина кортикального слоя составляет 3 мм
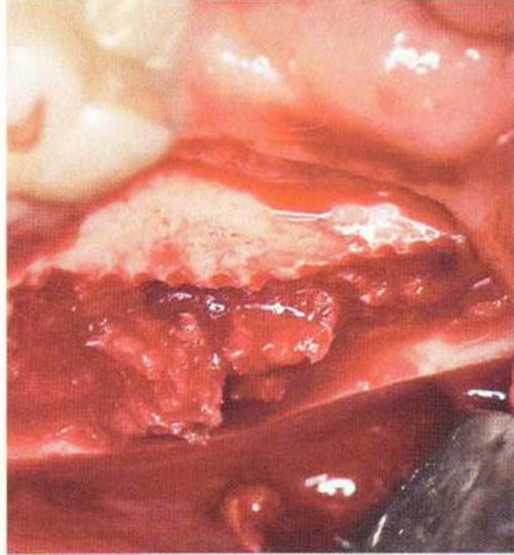
Рис. 5-16г. Получение губчатой кости непосредственно под кортикальным слоем
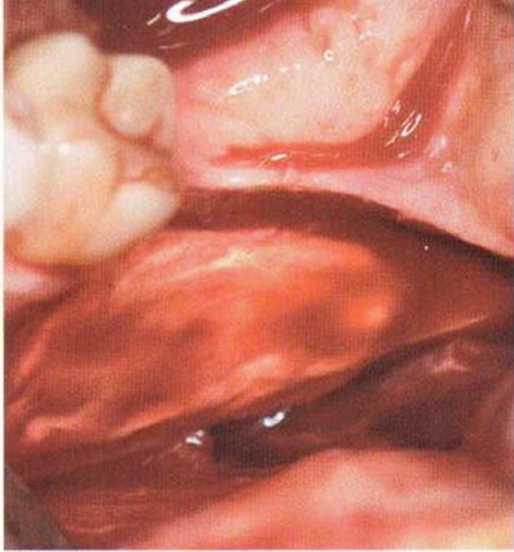
Рис. 5-16s. Донорский участок заполнен коллагеном
(рис. 5-16q). На следующем этапе хирургической кюретой собирают губчатую кость с учетом расположения нижнего альвеолярного нерва (рис. 5-16г). При этом язычная кортикальная стенка должна оставаться неповрежденной. При необходимости это вмешательство можно проводить в сочетании с удалением зуба мудрости.
Донорский участок обычно заполняют коллагеновой губкой. Некоторые коллагеновые материалы (например, Resorba) обладают гемостатическими свойствами, что способствует стабилизации кровяного сгустка и лучшему заживлению (рис. 5-16s).
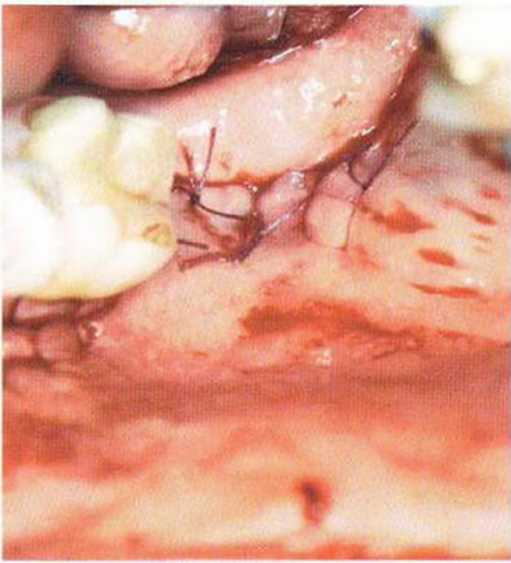
Кроме того, коллагеновая губка запечатывает раскрытые после удаления блока костномозговые пространства и уменьшает кровотечение. Рану ушивают простыми узловыми швами (рис. 5-16t). Заполнение донорской области костным материалом, например гидроксиапатитом, обычно не требуется.
В противном случае сначала следует поместить на донорский участок коллагеновую мембрану, чтобы предотвратить миграцию костного материала вокруг нерва или в нижнечелюстной канал, поскольку это может привести к повреждению нерва (рис. 5-16и-5-16х). При выраженной наружной косой линии можно получить относительно крупные костные блоки (рис. 5-16у и 5-16z).
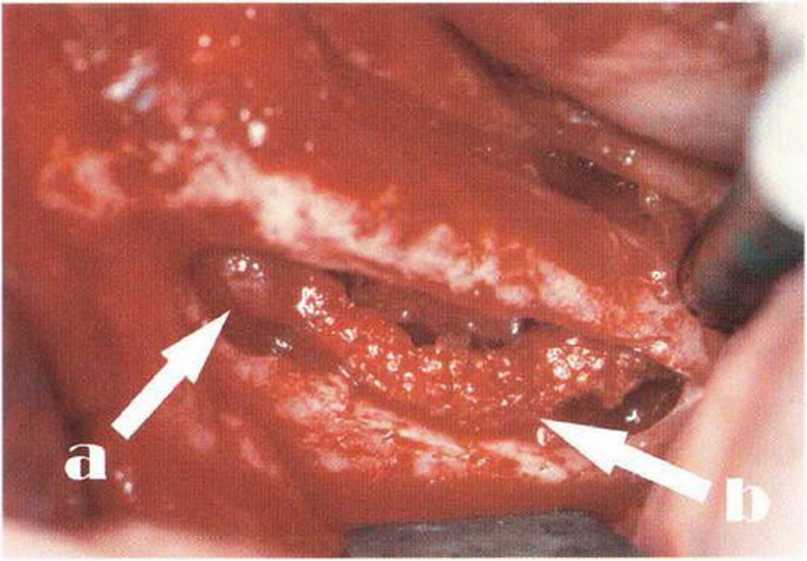
Рис. 5-16и. Визуализация нерва через 4 мес после попадания ксеногенного костного материала в нижнечелюстной канал: выраженное отличие между нормальной (а) и измененной (Ь) тканью
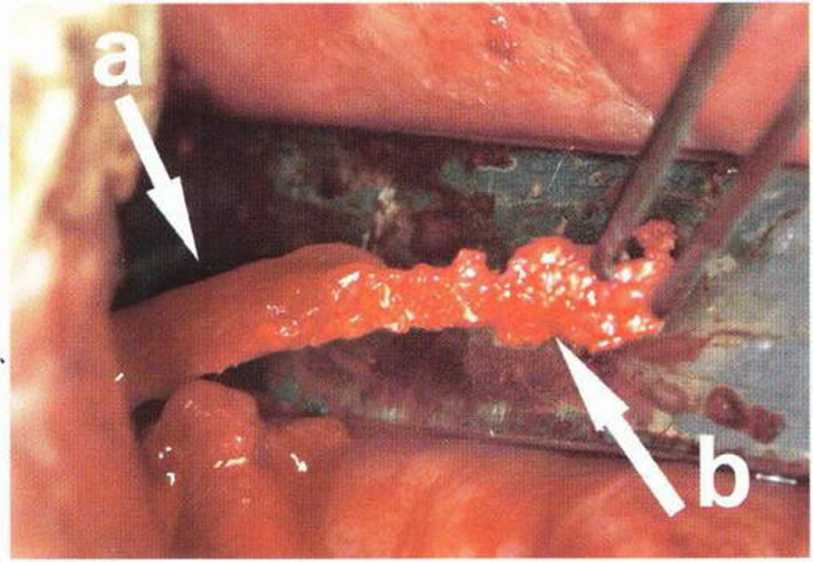
Рис. 5-16v. Ситуация перед иссечением фрагментов измененных тканей
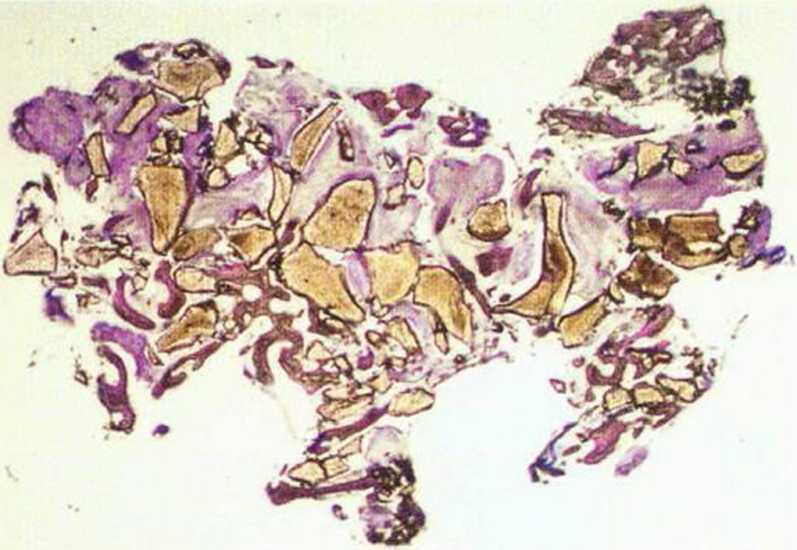
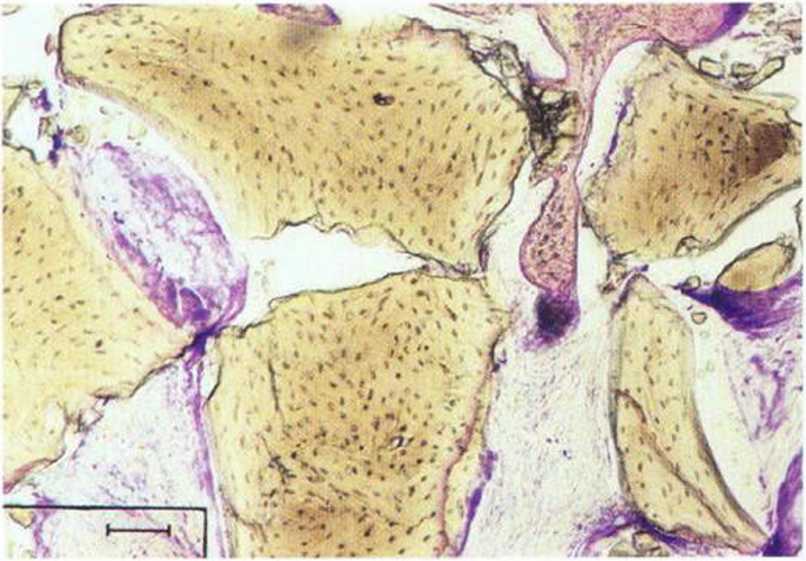
Рис. 5-16w. Биоптат полностью состоит из ксеногенного материала.
Рис. 5-16х. При большем увеличении вместо нервной ткани определяются многочисленные фрагменты биомбтериала
Рис. 5-16у. Донорский участок после забора крупного костного блока
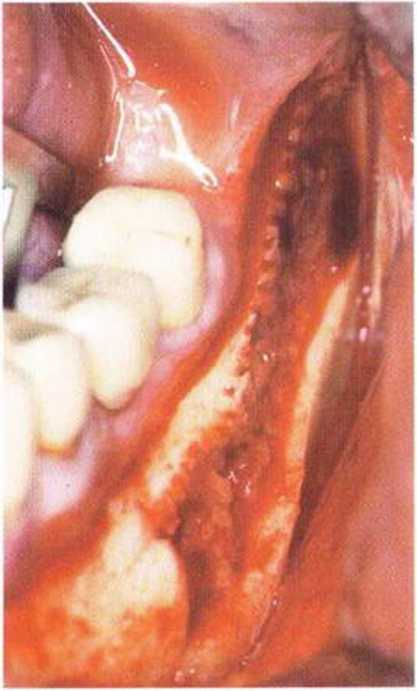
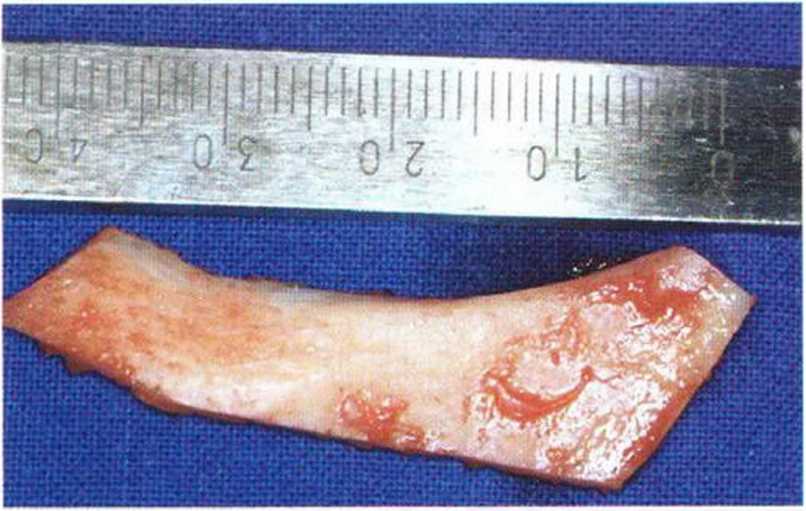
Рис. 5-16z. Костный блок длиной более 4 см
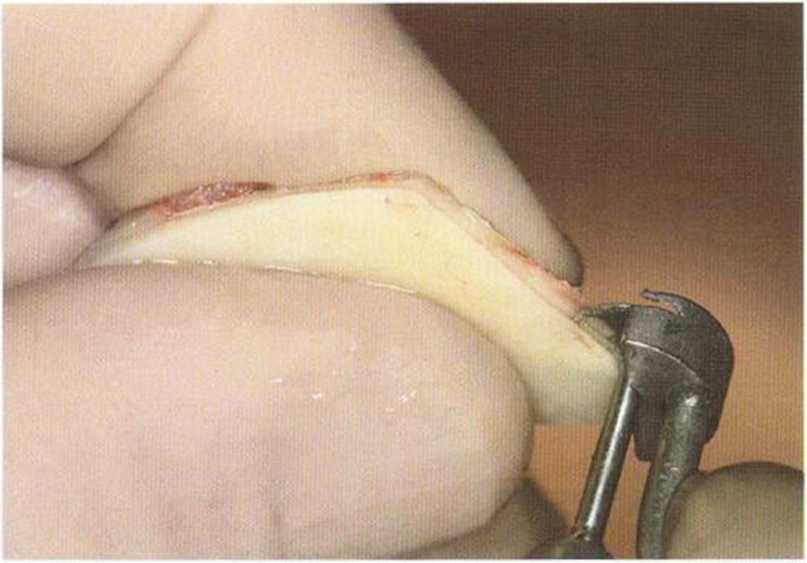
Рис. 5-17а. Продольное распиливание костного блока пилой MicroSaw
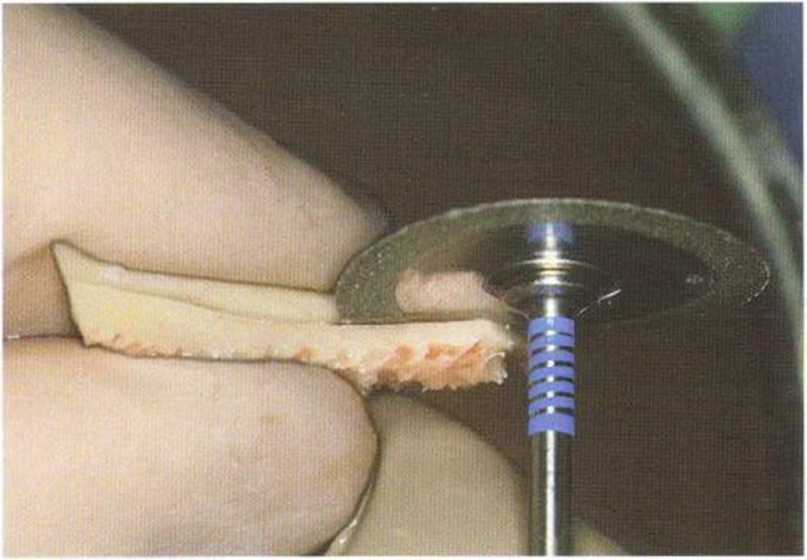
Рис. 5-17Ь. Углубление распила более крупным алмазным диском (Komet Brasseler)
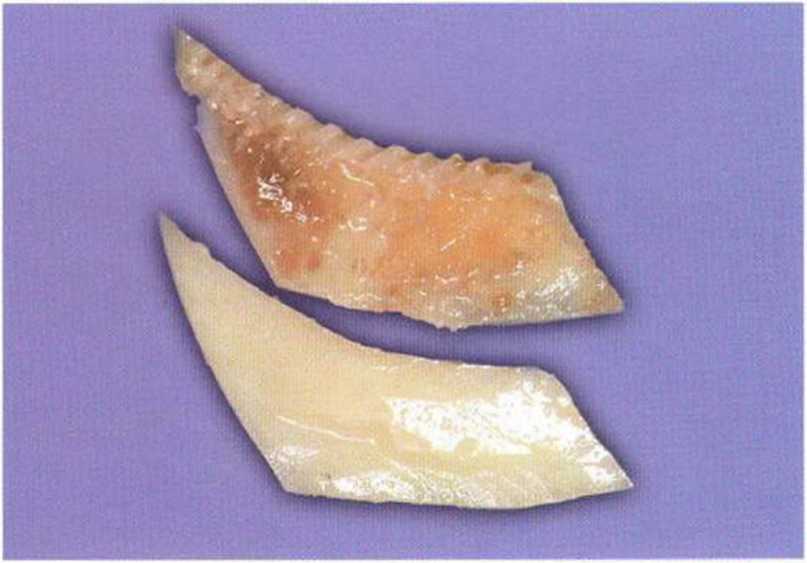
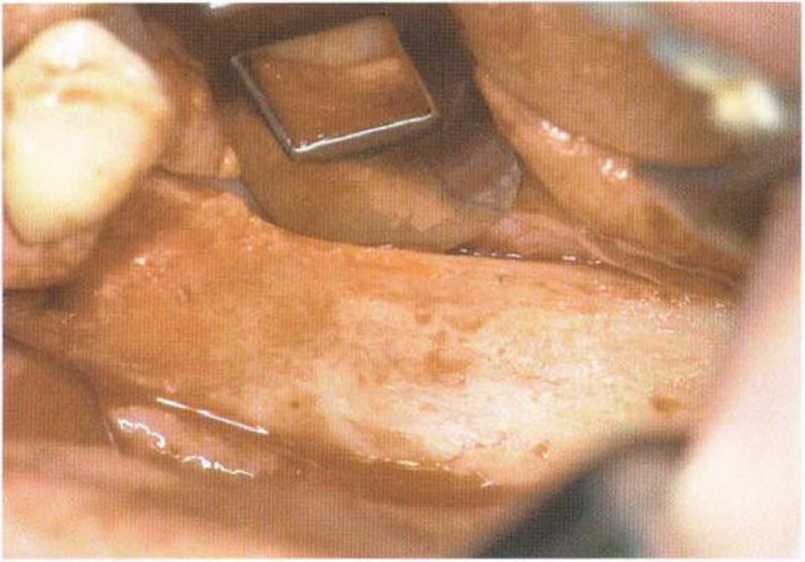
Рис. 5-17с. После продольного разделения образуется два тонких блока.
Рис. 5-17d. Крайне тонкий альвеолярный гребень нижней челюсти в области жевательных зубоБ. Толщина кости составляет лишь 1 мм.
По ранее описанной методике костный блок распиливают продольно на два тонких блока сначала микропилой, а затем большим алмазным диском (рис. 5-17а-5-17с). С помощью микропилы также можно получить дополнительные костные фрагменты в принимающем ложе.
(рис. 5-17d-5-17f). Один из двух костных блоков фиксируют винтами на некотором удалении от принимающего участка и заполняют пространство костной стружкой. Вторую половину костного блока возвращают в донорскую область и благодаря точным распилам оставляют без дополнительной фиксации (рис. 5-17д—5-17т).
Костная регенерация протекает аналогично заживлению после удаления ретинированных третьих моляров. Рентгенологически дефекты на донорском участке определяются в течение 6-12 мес в зависимости от выраженности регенеративного потенциала. При получении крупных костных блоков пациентам рекомендуется в течение первых 6 недель после операции есть исключительно мягкую пищу, чтобы снизить риск перелома нижней челюсти. Наиболее высокий его риск отмечается через 2-3 недели после трансплантации, когда спадает отек и пациенты снова начинают беспрепятственно принимать пищу.
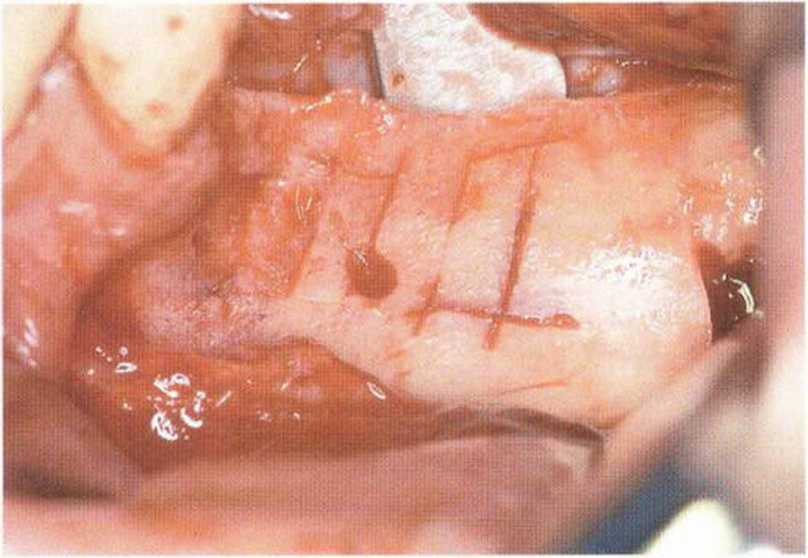
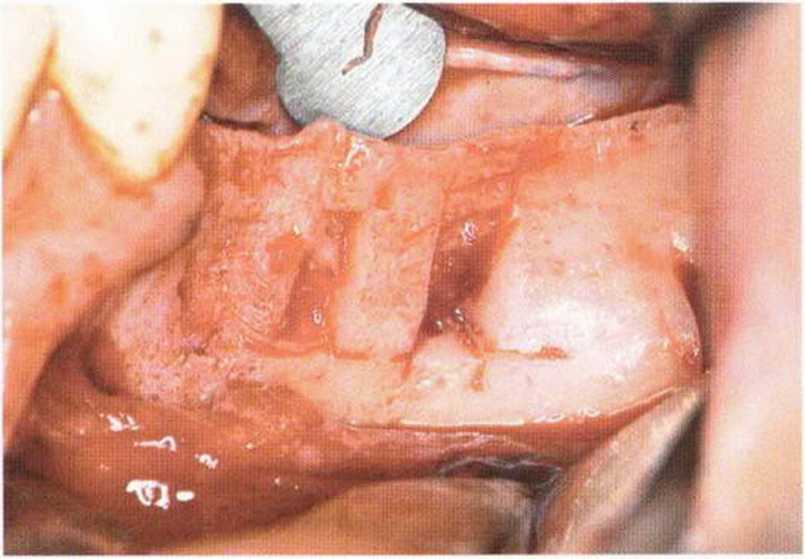
Рис. 5-17е. Распилы для получения дополнительных трансплантатов из принимающего ложа.
Рис. 5-17f. После взятия малых костных фрагментов из принимающего ложа
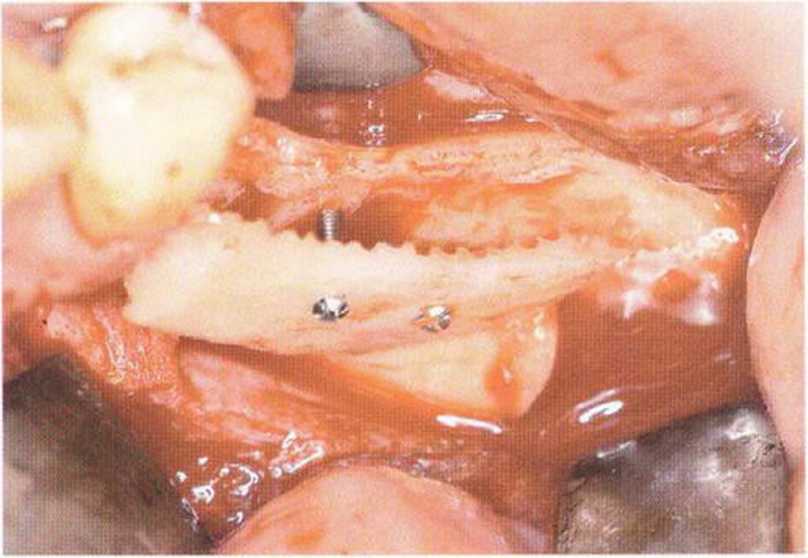
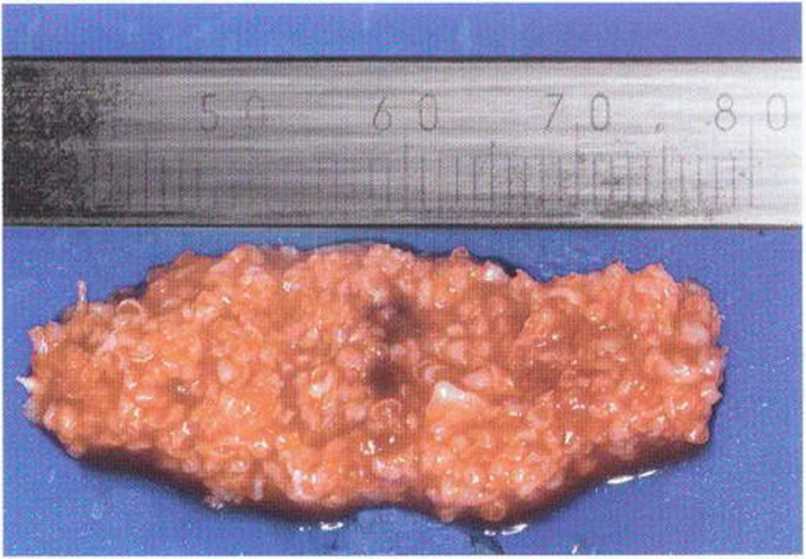
Рис. 5-17д. Фиксация одного блока на удалении от принимающего ложа.
Рис. 5-17h. Костная стружка получена скребком Safescraper

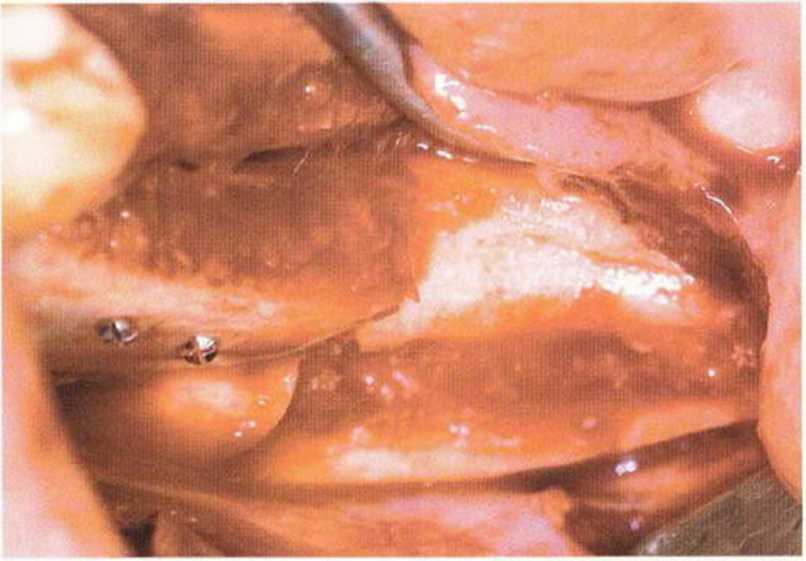
Рис. 5-17j. Донорский участок костной ткани расположен вблизи области регенеративного вмешательства
Рис. 5-17i. Заполнение пространства костной стружкой
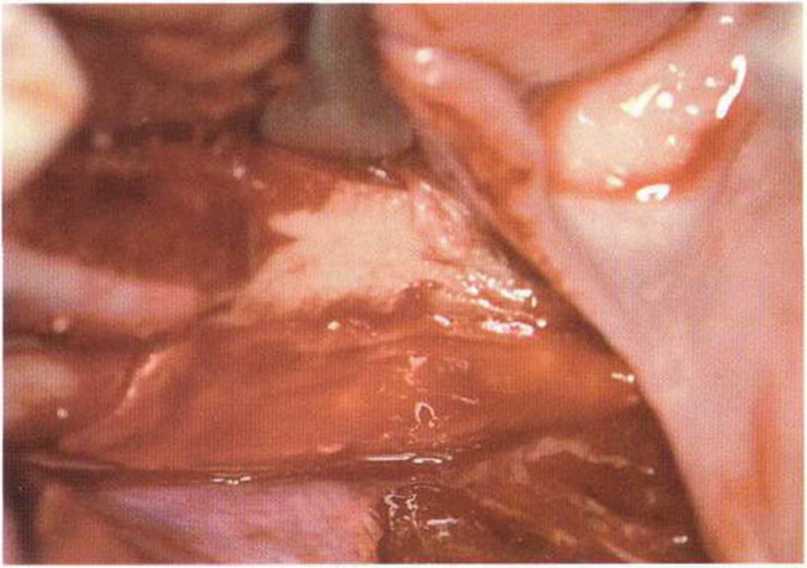
Рис. 5-17к. Донорский участок покрывают коллагеновой губкой
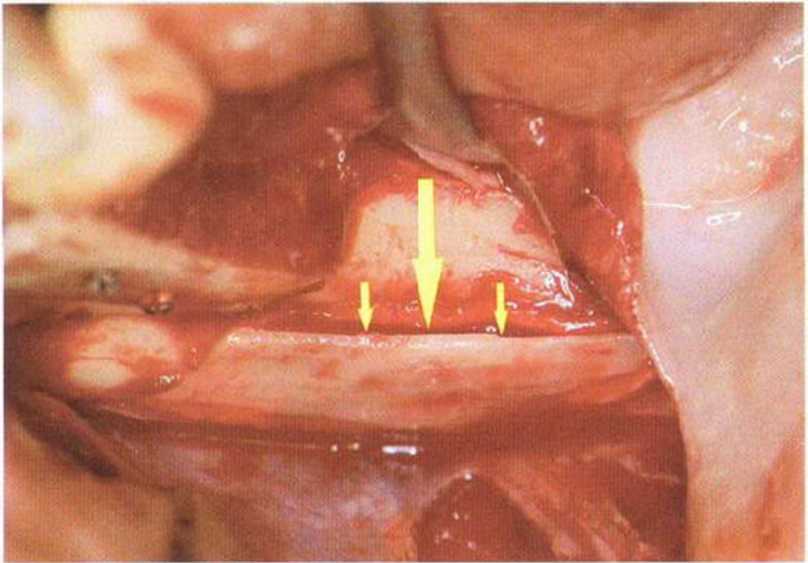
Рис. 5-171. Реплантация второго блока в донорский участок для восстановления контура косой линии
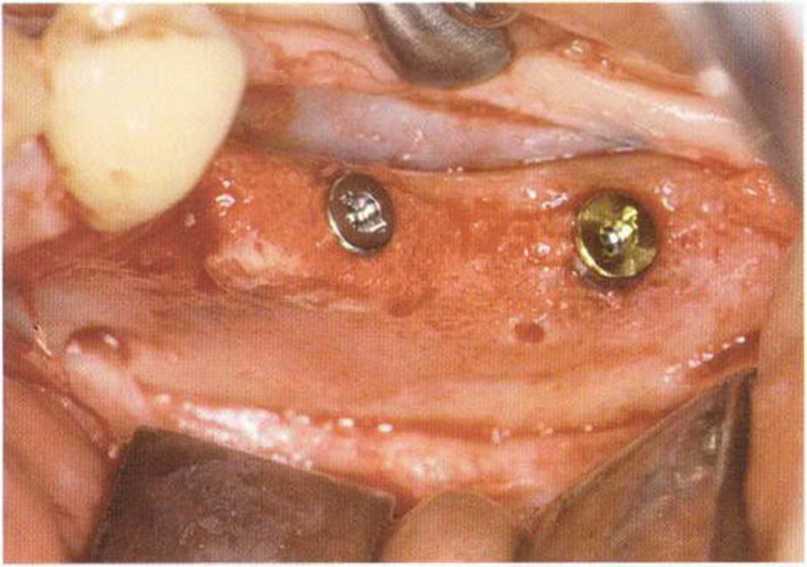
Рис. 5-17т. Установка двух имплантатов XiVE через 3 мес после трансплантации.
.
.
В некоторых случаях забор костного блока можно сочетать с латерализацией нижнего альвеолярного нерва (рис. 5-18а-5-18е).
Пересадка костной ткани из подбородочной области.
Данное вмешательство проводят под проводниковой анестезией в области правого и левого подбородочных отверстий, а также под вестибулярной и язычной инфильтрационной анестезией подбородочной области. После достижения обезболивания между зубами 33 и 43 выполняют вестибулярный разрез примерно на 5 мм апикаль-нее СДС. При наличии передних зубов нижней челюсти лезвие располагают не перпендикулярно, а под острым углом к поверхности кости, чтобы создать более широкие края раны и обеспечить ее двухслойное ушивание. В качестве альтернативы возможно проведение внутрибороздково-го разреза. В случае отсутствия передних зубов разрез можно выполнить по краю альвеолярного гребня. Такой подход особенно удобен при планировании одновременной установки имплантатов в переднем отделе нижней челюсти, поскольку обеспечивает достаточную визуализацию кости.
Для доступа к донорскому участку отслаивают слизисто-надкостничный лоскут до нижнего края подбородка.
Затем микропилой MicroSaw выпиливают костный блок нужного размера. При этом необходимо помнить о безопасном расстоянии - 3-5 мм до верхушек корней передних зубов нижней челюсти.- Боковая телерентгенограмма обеспечивает информацию об имеющемся объеме костной ткани, положении верхушек корней и наклоне корней нижних резцов (рис. 5-8с). Для сохранения контуров нижней челюсти нижний горизонтальный распил выполняют на расстоянии не менее 3-5 мм от нижнего края нижней челюсти. Оба горизонтальных распила делают с помощью углового наконечника, полностью погружая алмазный диск (рис. 5-19а). Если допускает длина корней клыков,распилы могут достигать подбородочных отверстий. При этом следует учитывать возможное направление петли нижнего альвеолярного нерва. Горизонтальные распилы соединяют между собой вертикальными, которые делают с помощью прямого наконечника с максимальным погружением алмазного диска (рис. 5-19Ь).
Как правило, алмазный диск (глубина погружения 3-3,2 мм, в зависимости от наклона диска) полностью ра1секает кортикальный слой (рис. 5-19с). Кроме того, вдоль распилов просверливают дополнительные отверстия (рис. 5-19d и 5-19е), что позволяет точнее оценить качество костной ткани и толщину кортикального слоя. Обозначенный таким образом трансплантат отделяют костным долотом (рис. 5-19f—5-19h). Затем распатором или долотом можно соскрести губчатое вещество вплоть до язычного кортикального слоя (рис. 5-19i и 5-19j).
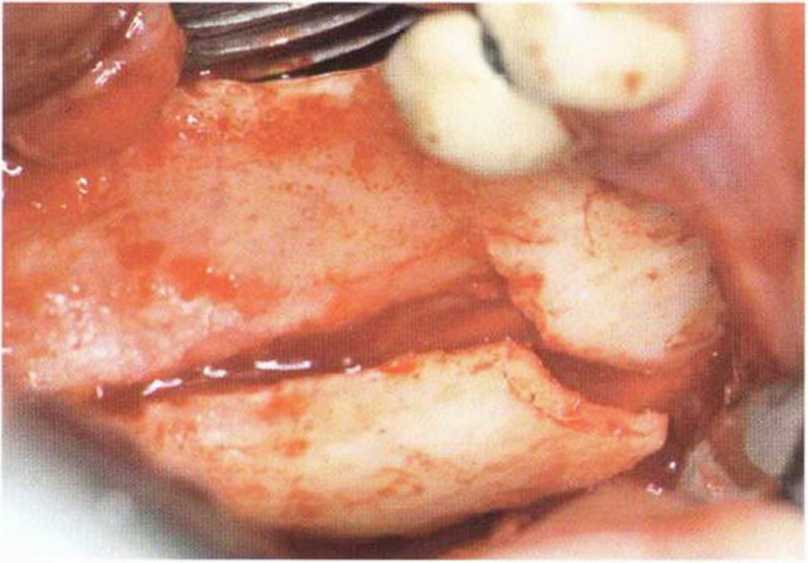
Рис. 5-18а. Тонкий альвеолярный край (около 1 мм) в области зубов 46/47. Косая линия удалена в результате предыдущей операции по поводу дисгнатии. В связи с близким расположением нижнечелюстного канала к альвеолярному краю трансплантат получают в сочетании с латерализацией нерва
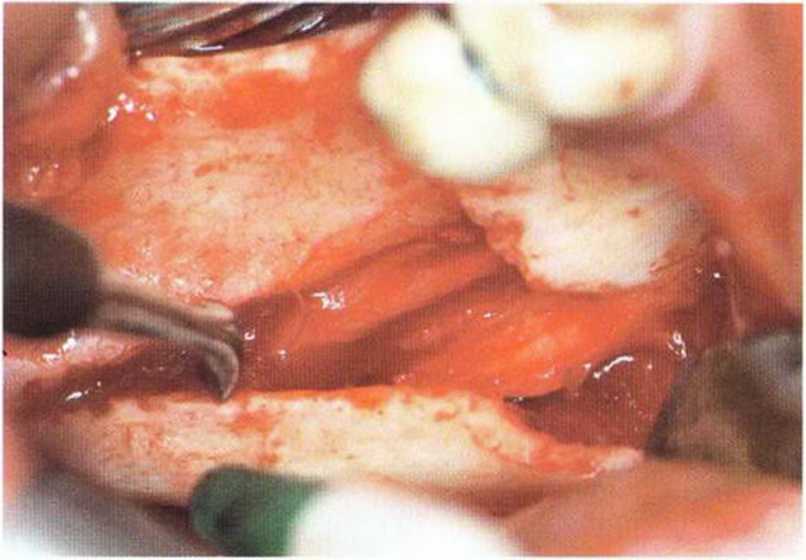
Рис. 5-18Ь. Отделение костного фрагмента и обнажение нижнечелюстного канала
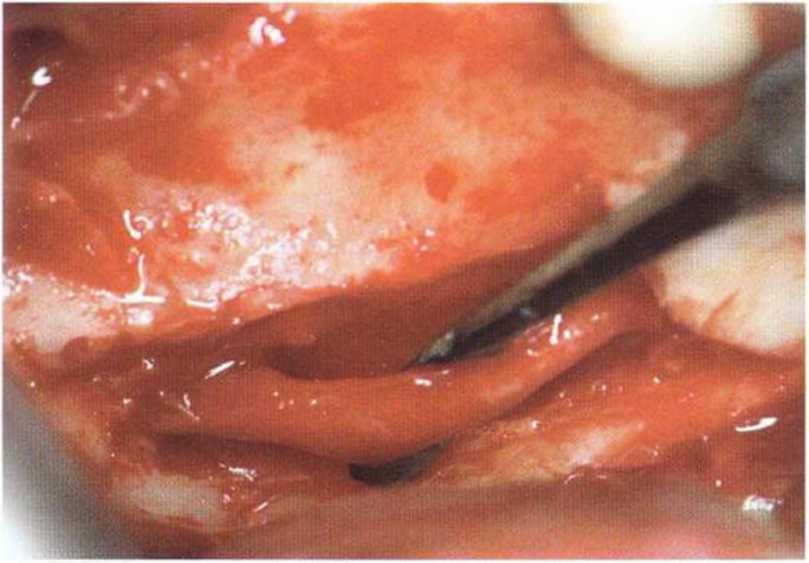
Рис. 5-18с. Латерализация нижнего альвеолярного нерва
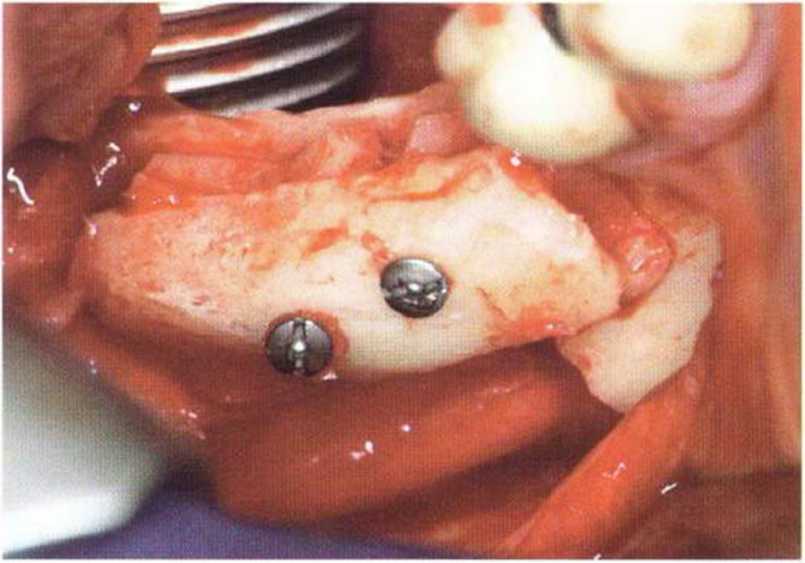
Рис. 5-18d. Увеличение толщины альвеолярного гребня с помощью костного блока, полученного в апикальной области. После ла-терализации нерв стабилизируется в новом положении с помощью небольших костных фрагментов
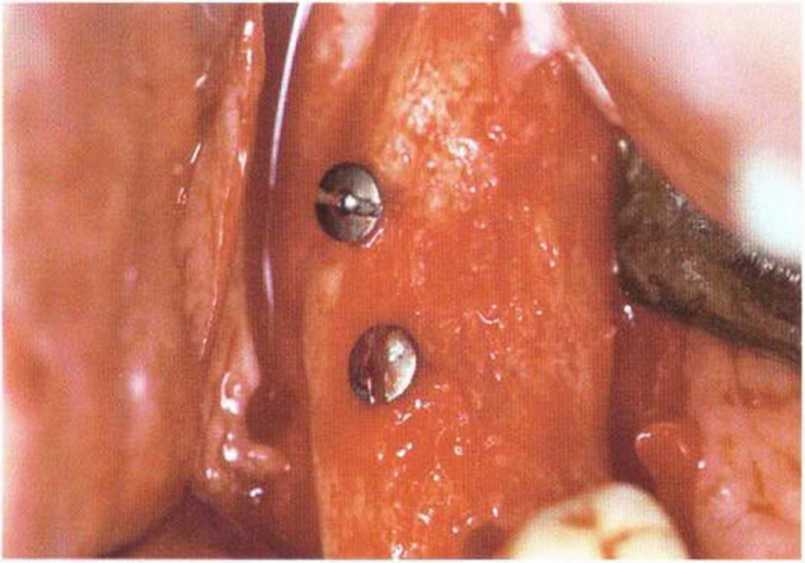
Рис. 5-18е. Клиническая ситуация через 4 мес: толщина хорошо кровоснабжаемого альвеолярного края составляет 10 мм
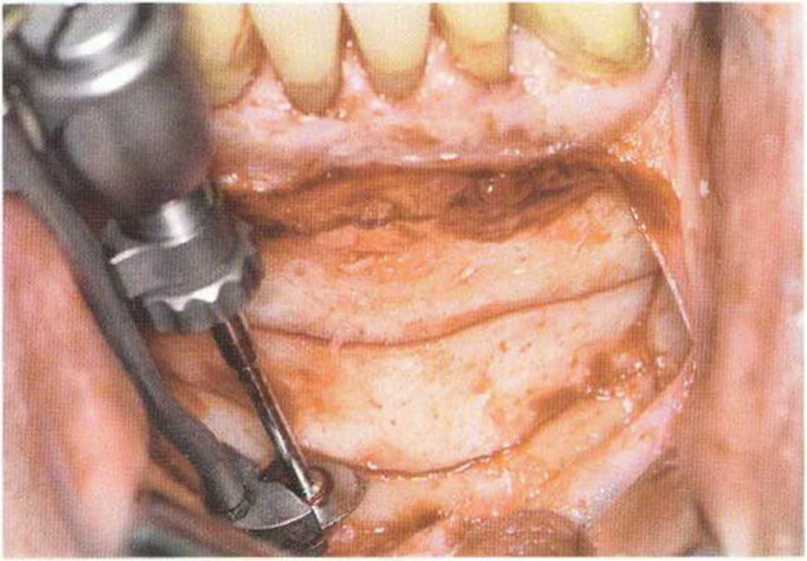
Рис. 5-19а. Горизонтальные распилы проводят с помощью углового наконечника,...
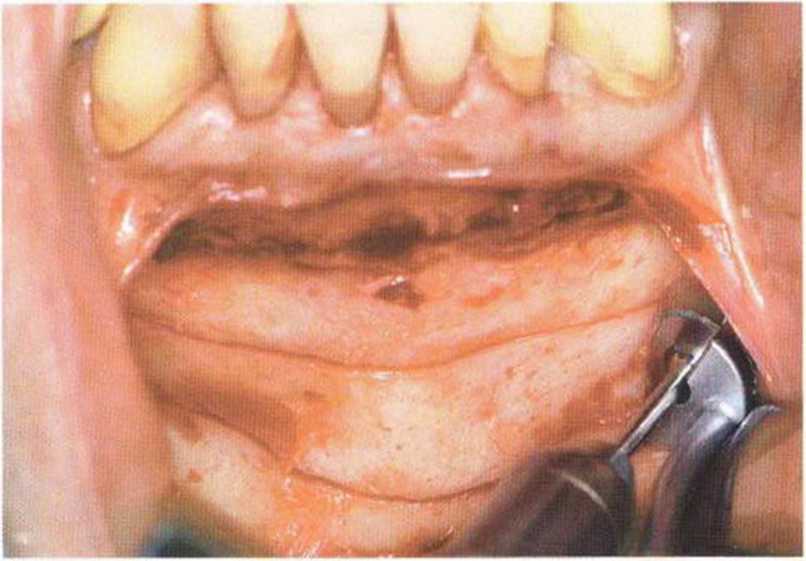
Рис. 5-19Ь. ...а вертикальные-с помощью прямого наконечника набора MicroSaw
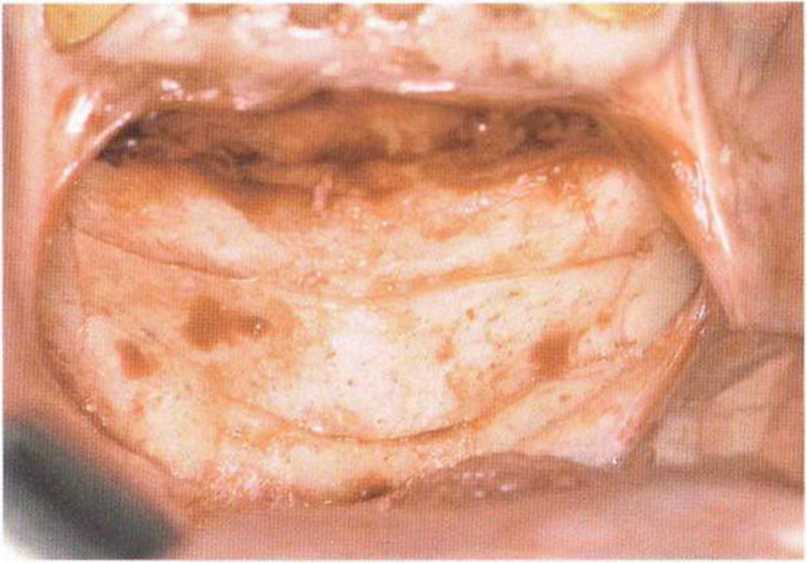
Рис. 5-19с. Распилы в области подбородка
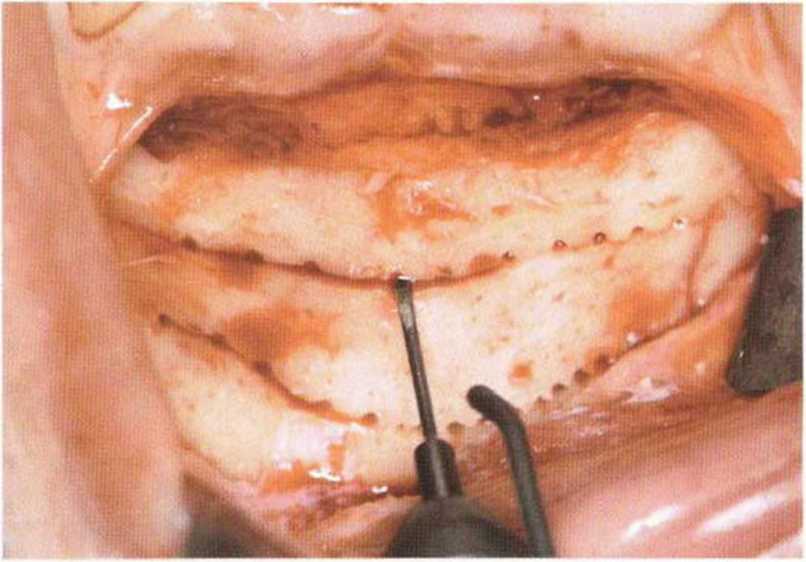
Рис. 5-19d. Вдоль распилов просверливают отверстия.
.
.
В отличие от наружной косой линии, донорские участки в подбородочной области рекомендуется заполнить костным материалом и перекрыть мембраной, после чего провести двухслойное ушивание раны (рис. 5-19к-5-19о). Чтобы облегчить отделение костного блока, его можно распилить посередине (рис. 5-19р). При отсутствии передних зубов нижней челюсти получить трансплантат можно одновременно с установкой имплантатов (рис. 5-19q).
При получении крупных костных блоков у пациентов с сохранившимися передними зубами нижней челюсти может произойти разрыв чувствительных нервных волокон (ветви нижнего альвеолярного нерва) и кровеносных сосудов, иннервирующих и кровоснабжаощих передние зубы этой челюсти (рис. 5-19г).
При ретроспективном исследовании 134 трансплантаций из подбородочной области, проводившихся в период 1989-1996 гг., были сделаны следующие наблюдения.
• Ни в одном случае не произошло изменения контура лица (рис. 5-20а).
• Увеличились сроки полного заживления донорской области без использования костного материала, даже при введении коллагеновой губки (рис. 5-20W.
• Перекрывание костного дефекта в донорской области резорбируемой или нерезорбируемой мембраной без костного материала не приводило к значительному улучшению регенерации (рис. 5-20c-5-20i).
• Лучшая регенерация достигалась при заполнении внутренней части костного дефекта (три четверти дефекта) в донорской области коллагеном с нанесением на поверхность последнего (наружная четверть дефекта) резорбируемого костного материала (например, Algipore или Biogran), который, в свою очередь, перекрывали нерезорбируемой мембраной (например, BoneSchield или Gore-Tex). В среднем через 12 мес после операции на донорских участках отмечались удовлетворительная регенерация и минерализация костной ткани (рис. 5-20j—5-20о). На рис. 5-20р и 5-20q представлена клиническая ситуация через 4 мес после заполнения дефекта коллагеном и материалом Альгипор и покрытия титановой фольгой.
После удаления титановой фольги из середины.
подбородочной области получили пробу тканей для гистологического анализа (рис. 5-20r-5-20t).
На боковых телерентгенограммах (рис. 5-20и) представлена ситуация сразу после операции и через 2 года после вмешательства (рис. 5-20v).
На рис. 5-20w-5-20x после применения костного материала Biogran и мембраны Gore-Tex также наблюдается почти полная регенерация костной ткани донорского участка.
• При фиксации резорбируемой мембраны (Bio-Guide или Guidor) поверх резорбируемого костного материала в донорской области отмечалась неполная регенерация костной ткани на фоне почти полной резорбции костного материала (рис. 5-20у—5-20z).
• Сохранение костного перешейка посередине донорской области с перекрыванием нерезорбируемой мембраной не оказывает значительного влияния на регенерацию костной ткани в донорской области (рис. 5-21a-5-21d).
Пересадка трансплантатов из подбородочной области проводится прежде всего при реконструкции переднего отдела нижней челюсти. Такой подход позволяет создать единый доступ к донорскому участку и принимающему ложу (рис. 5-22а-5-22п).
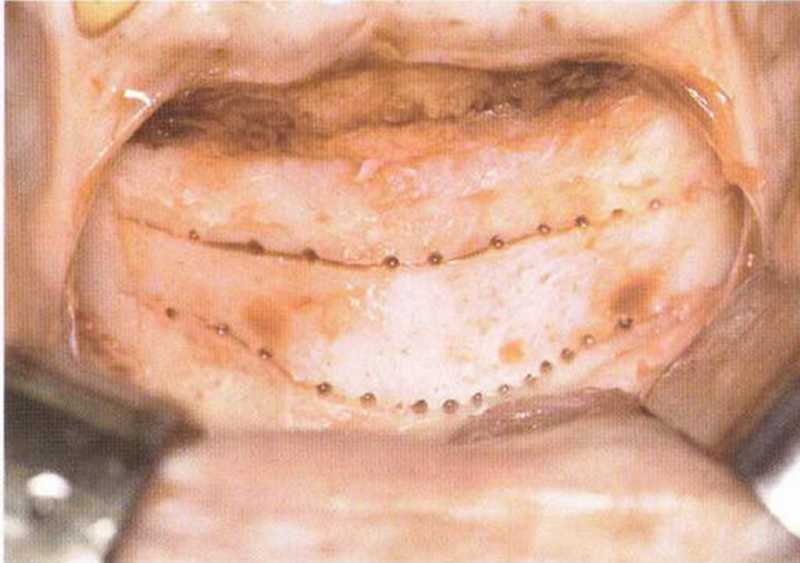
Рис. 5-19е. Перфорации в области распилов
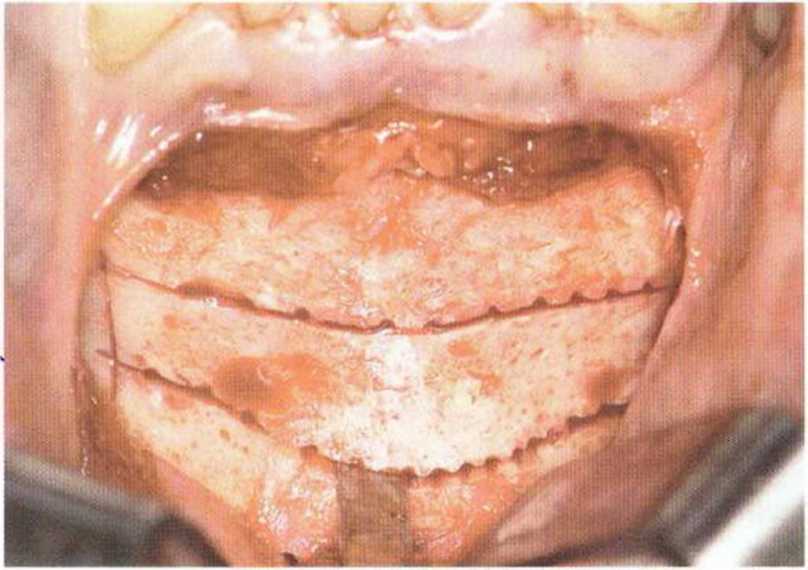
Рис. 5-19f. Отделение блока тонким долотом (4 мм)
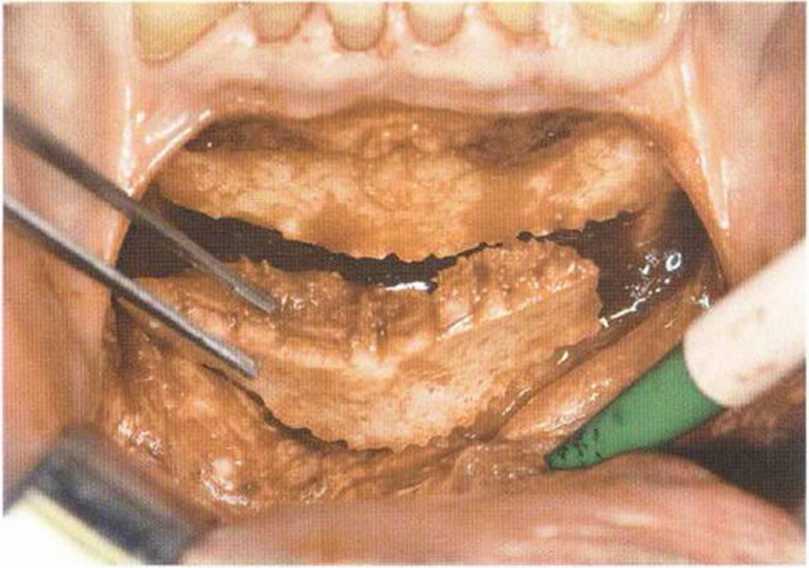
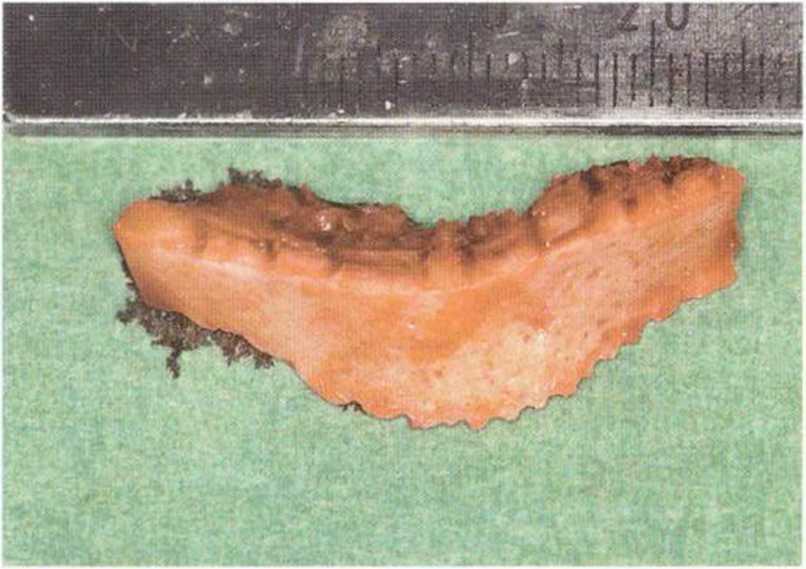
Рис. 5-19h. Вывихнутый костный блок
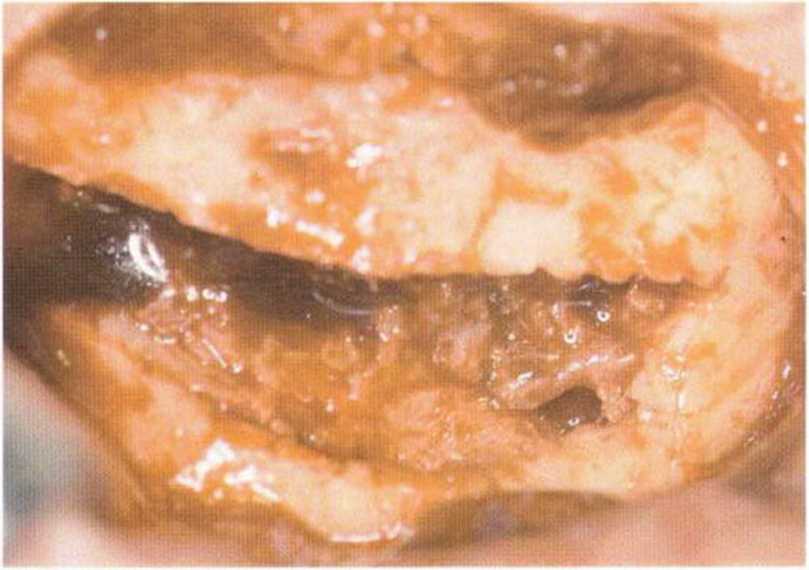
Рис. 5-19д. Получение костного блока
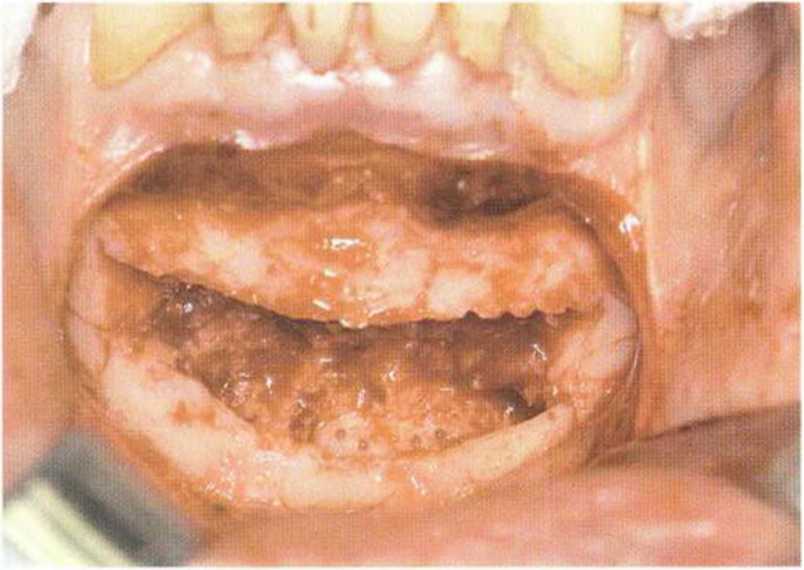
Рис. 5-19j. Донорский участок после вывихивания костного блока и забора губчатой кости до язычного кортикального слоя
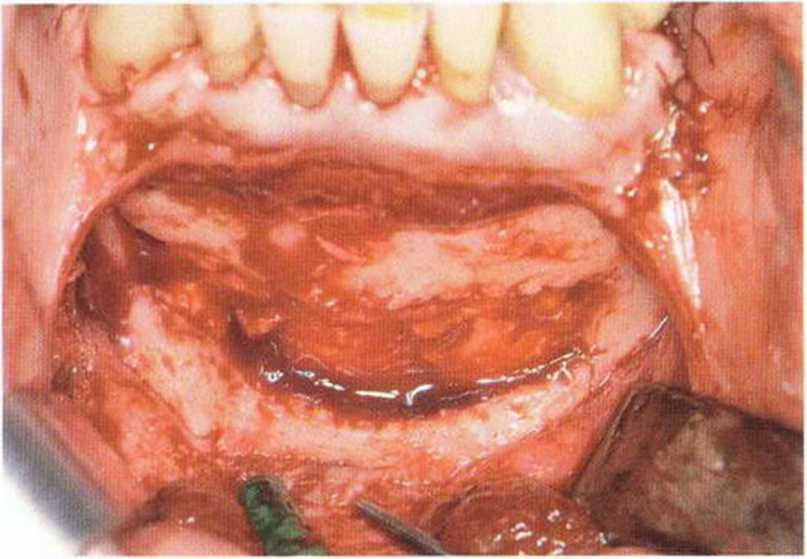
Рис. 5-191. Тонкий слой костного материала Algipore на поверхности дефекта
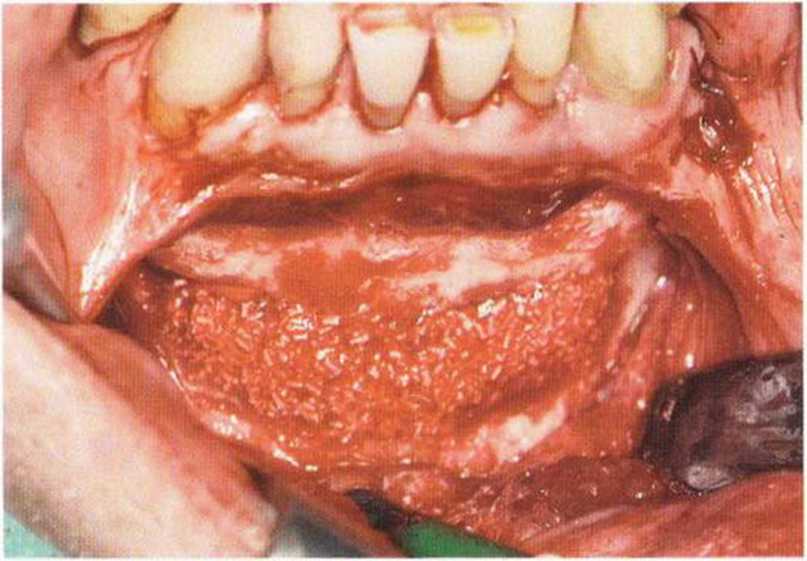
Рис. 5-19к. Область губчатой кости выстилают коллагеновым полотном
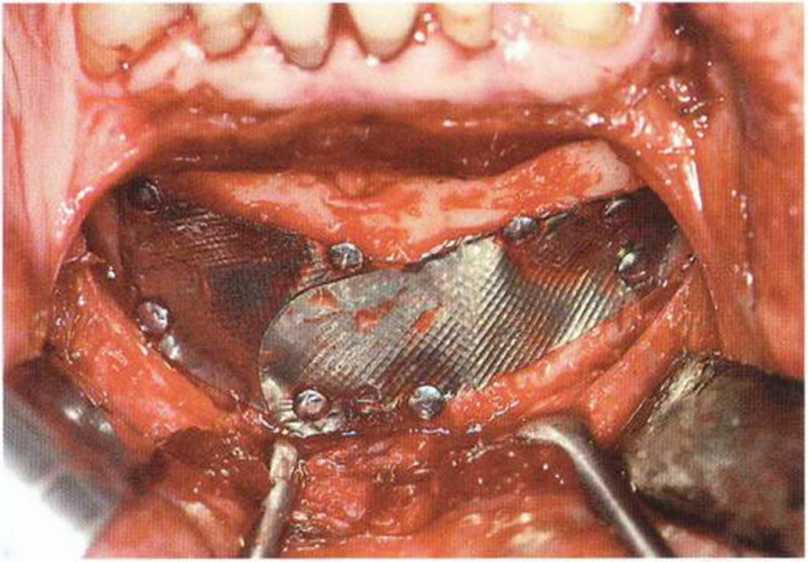
Рис. 5-19т. Стабилизация костного материала титановой фольгой BoneSchield
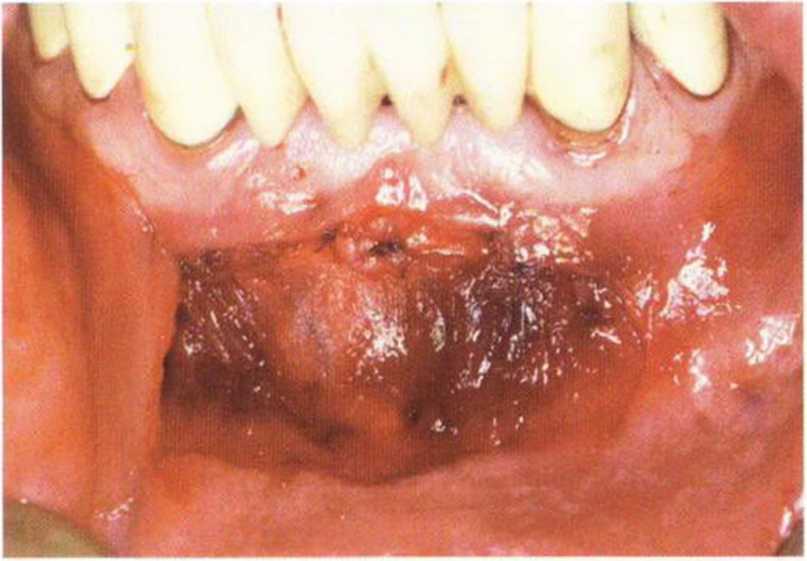
Рис. 5-19п. Первый слой (надкостница и мышцы) ушивают резор-бируемыми швами
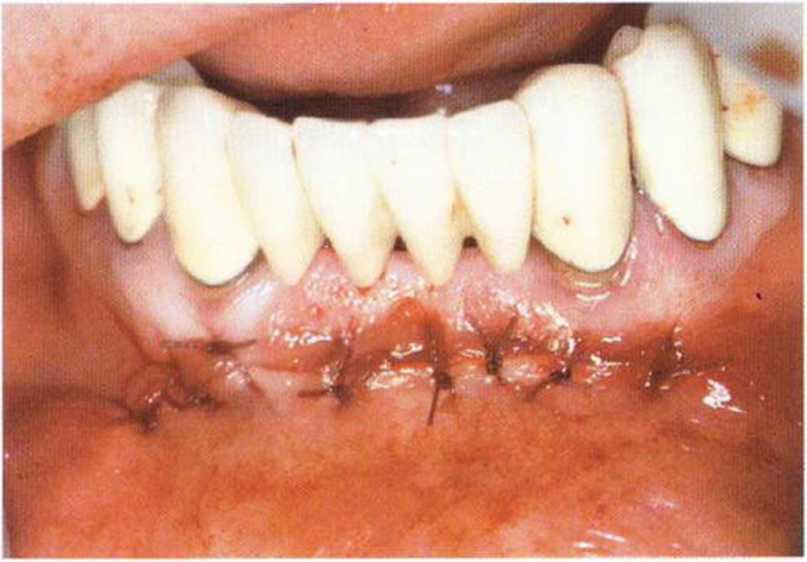
Рис. 5-19о. Затем ушивают второй слой (слизистую)
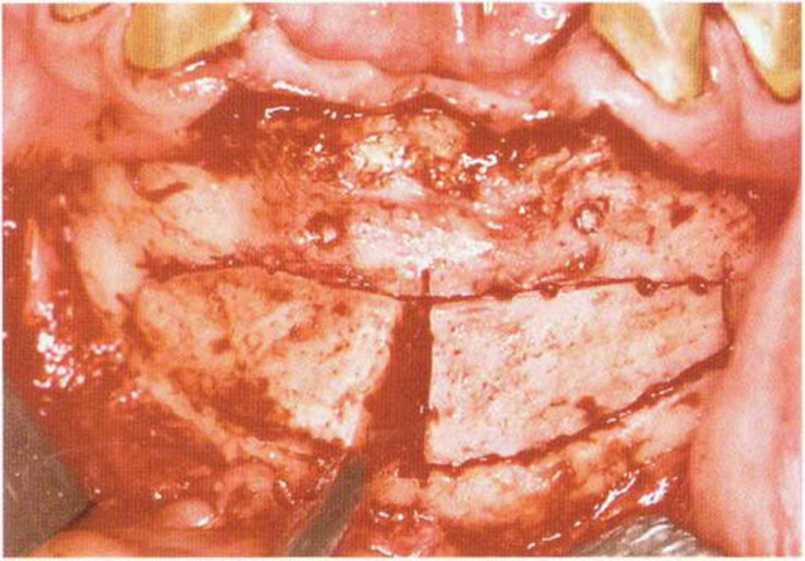
Рис. 5-19р. Вывихивание упрощается при вертикальном разделении блока посередине
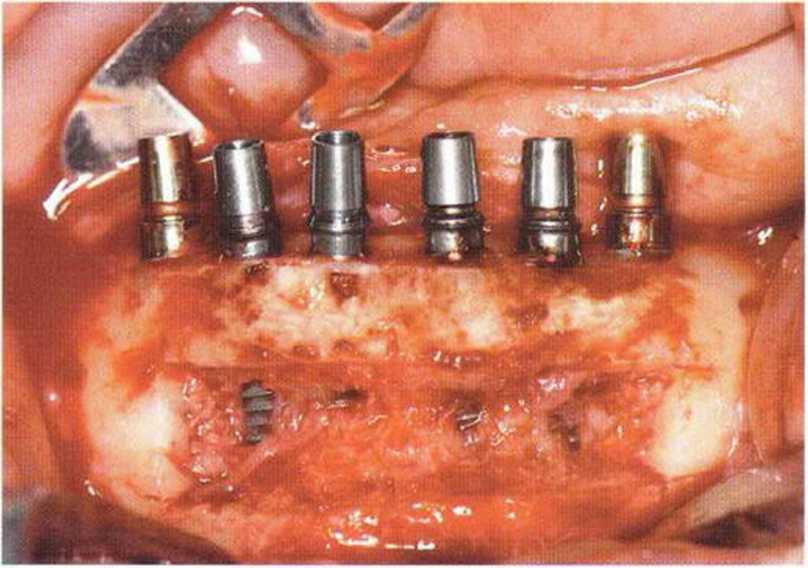
Рис. 5-19q. Получение трансплантата из подбородочной области в сочетании с установкой имплантатов. Первичная стабильность имплантатов достигается благодаря язычному кортикальному слою
Рис. 5-19г. Передние ветви нижнечелюстного нерва (передние зубные ветви)
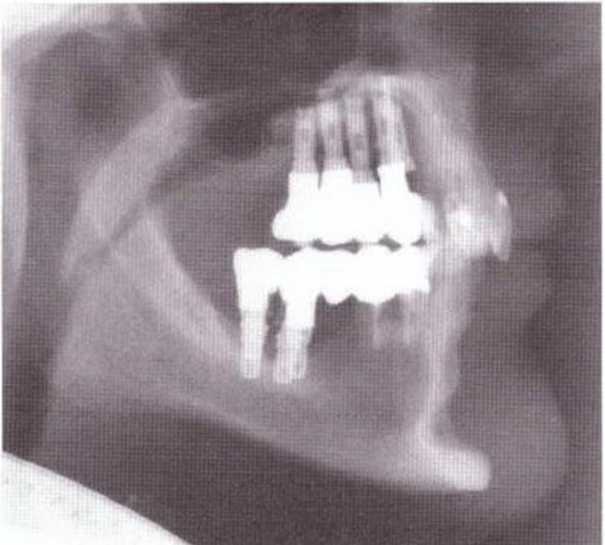
Рис. 5-20а. Соблюдение протокола позволяет сохранить контуры подбородка после пересадки трансплантатов
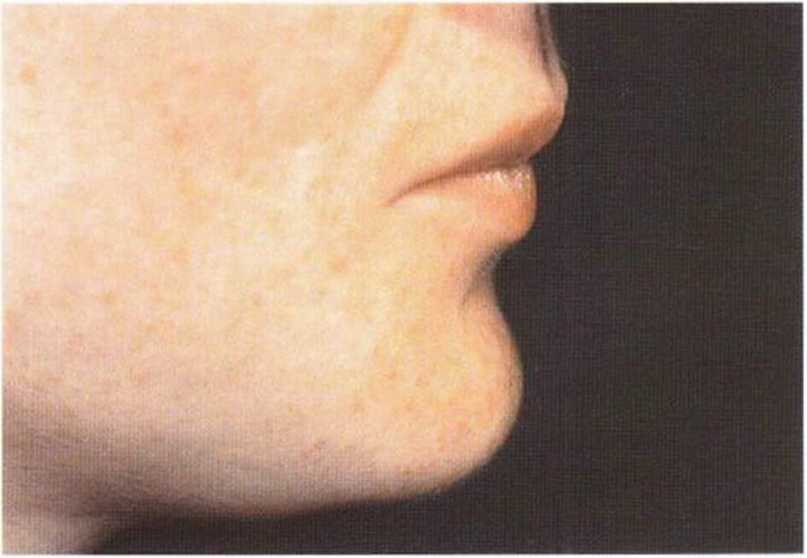
Рис. 5-20Ь. На боковой телерентгенограмме через 8 лет после пересадки блока из подбородочной области определяется неполная регенерация костной ткани в донорском участке после его заполнения только коллагеном
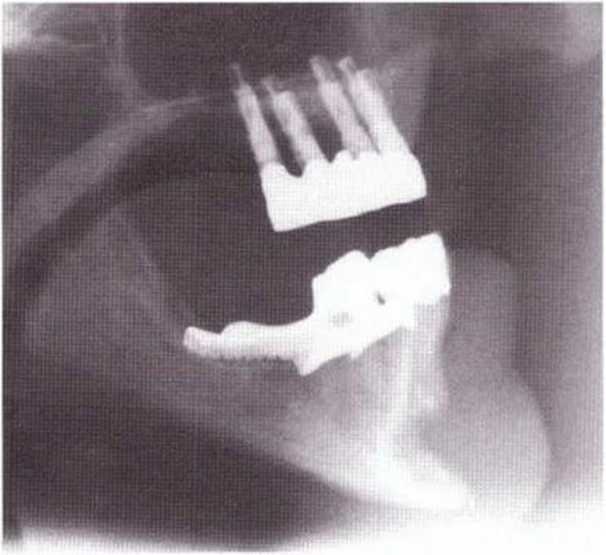
Рис. 5-20d. Донорский участок после заполнения коллагеном и покрывания мембраной Gore-Tex с титановым усилением
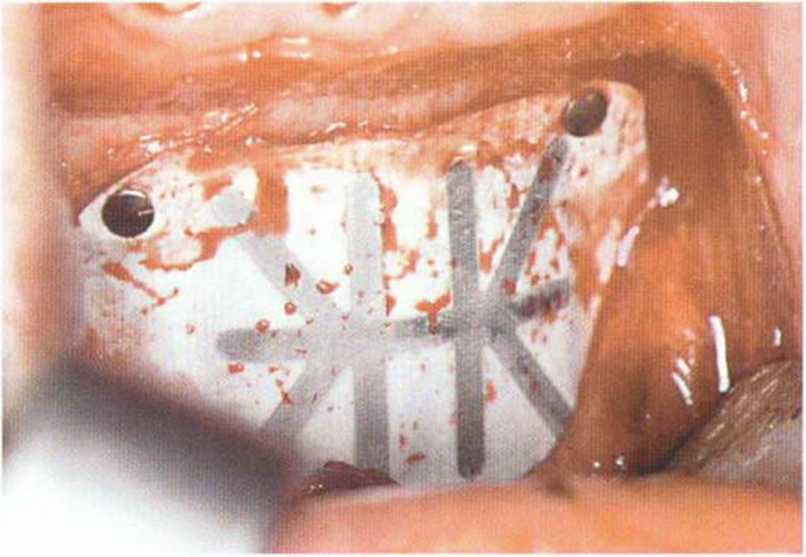
Рис. 5-20с. На боковой телерентгенограмме через 4 года после пересадки блока из подбородочной области отмечается неполная регенерация донорского участка после его заполнения коллагеном и покрывания мембраной Gore-Tex
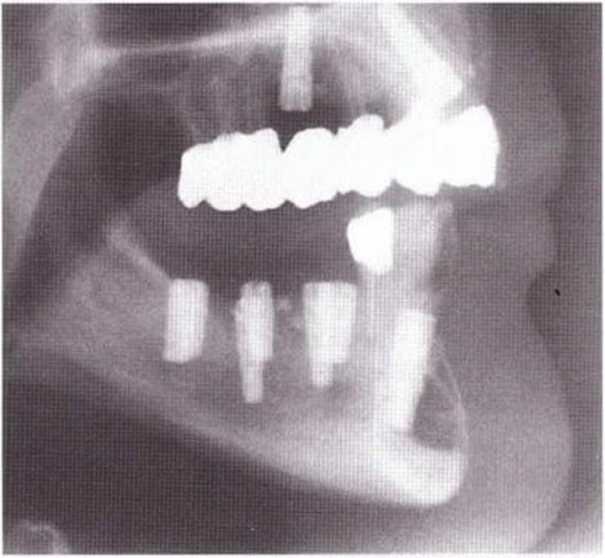
Рис. 5-20е. Телерентгенограмма непосредственно после операции
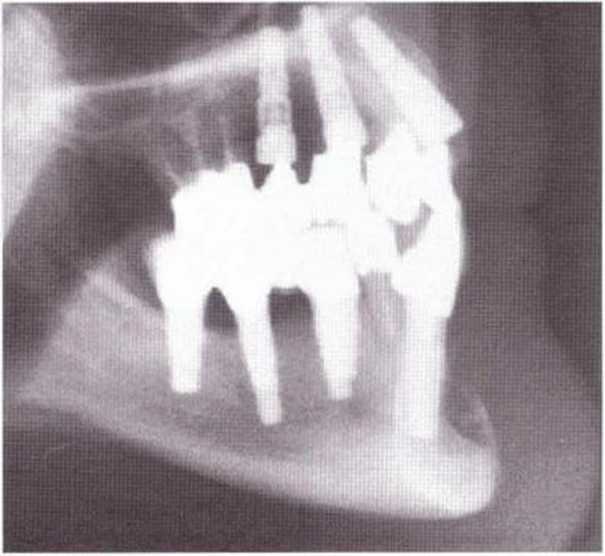
Рис. 5-20f. На телерентгенограмме через 12 мес после операции отмечается умеренная регенерация кости
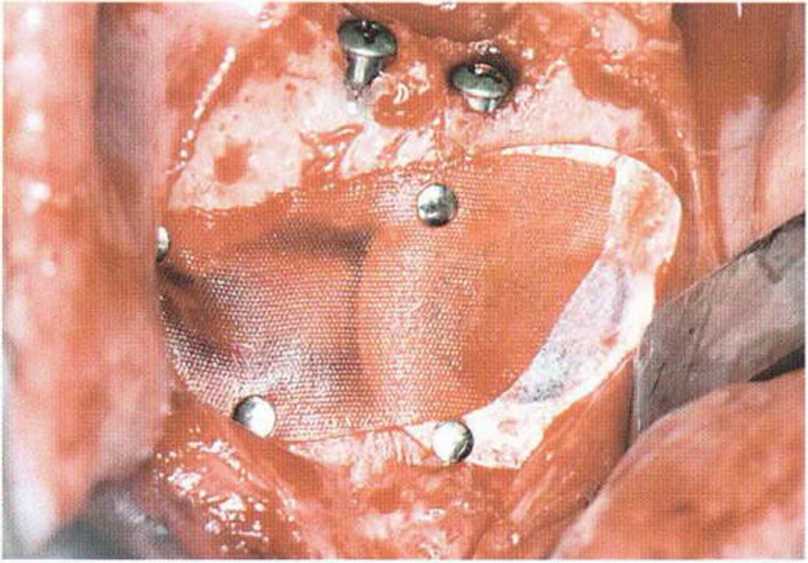
Рис. 5-20д. Заполнение донорского участка в подбородочной области коллагеном. Левая сторона покрыта нерезорбируемой мембраной (Gore-Tex), а правая - резорбируемой мембраной (Vicryl, Ethicon, Johnson & Johnson)
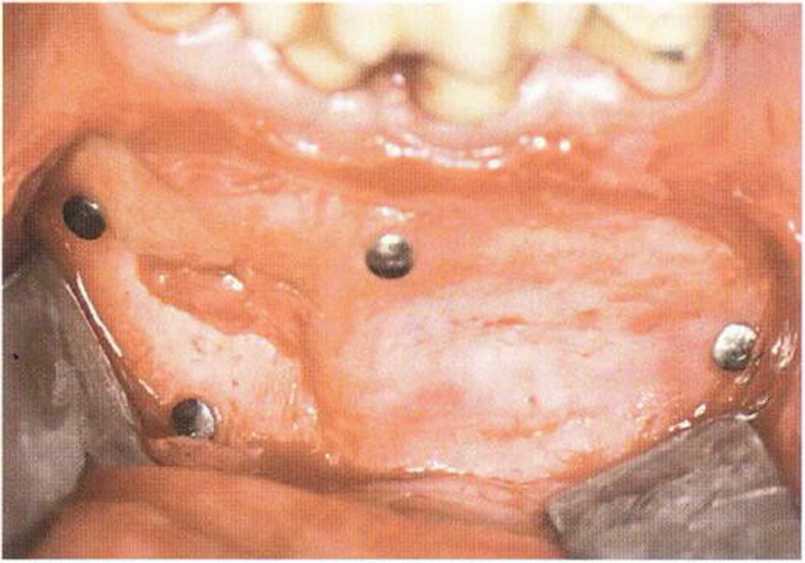
Рис. 5-20h. Клинический результат через 12 мес после операции
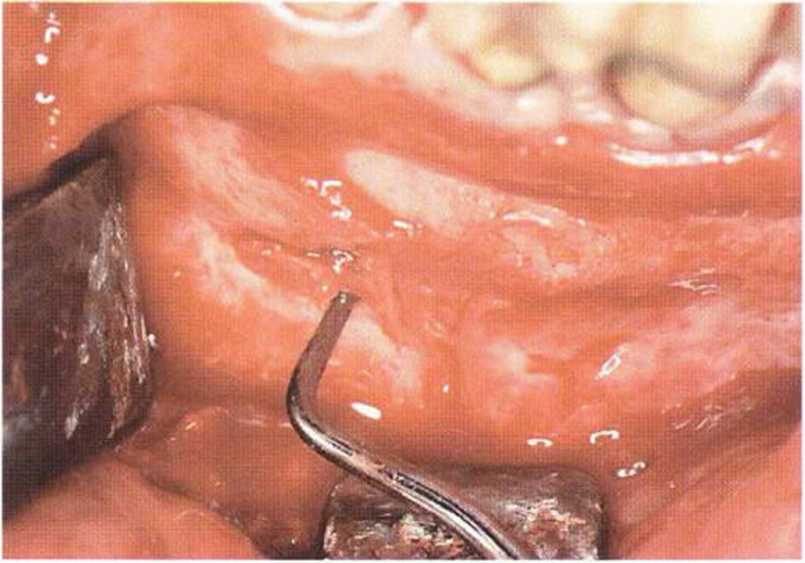
Рис. 5-20i. После удаления фиксирующих штифтов и мембраны слева: в области резорбируемой мембраны отмечается менее выраженная регенерация
Рис. 5-20j. Донорский участок после отделения костного блока и соскребания губчатой кости до язычного кортикального слоя
Рис. 5-20к. На дно донорской области поместили коллагеновую губку
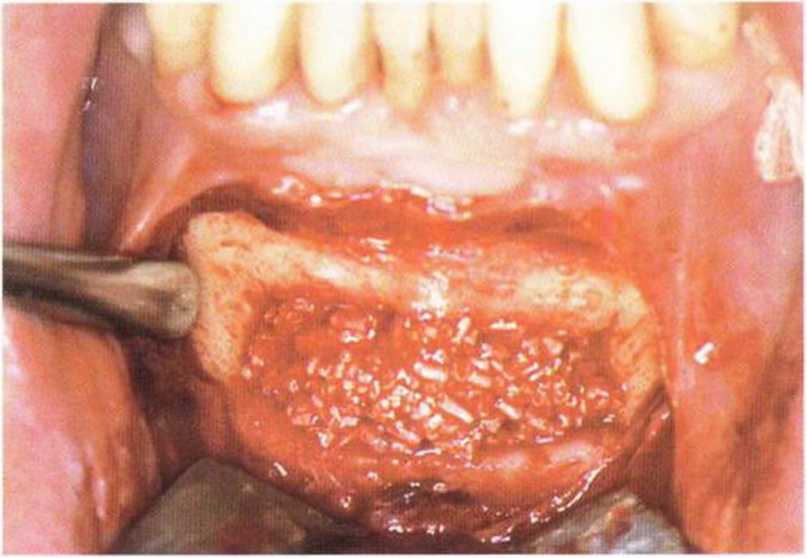
Рис. 5-201. Тонкий поверхностный слой костного материала Algipore
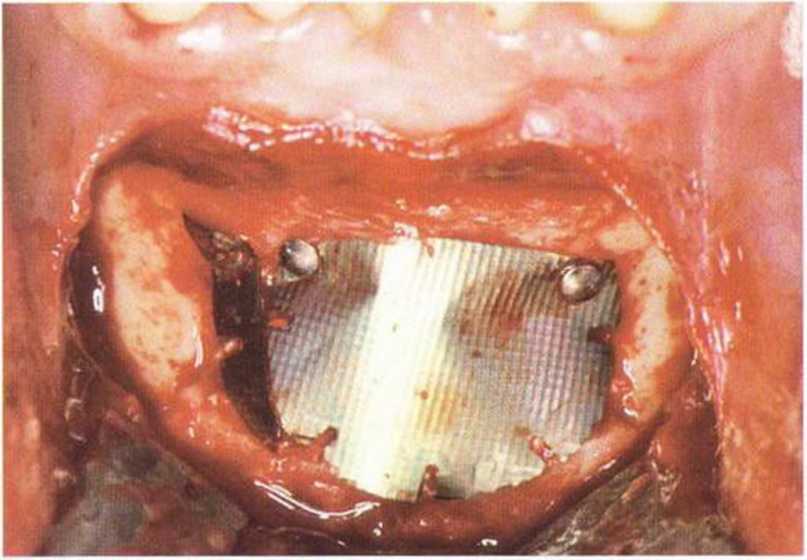
Рис. 5-20т. Стабилизация костного материала титановой фольгой (BoneSchield)
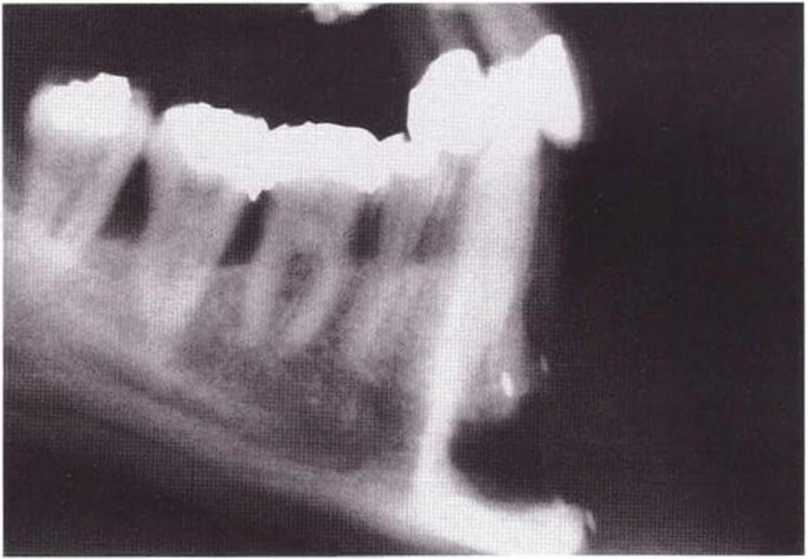
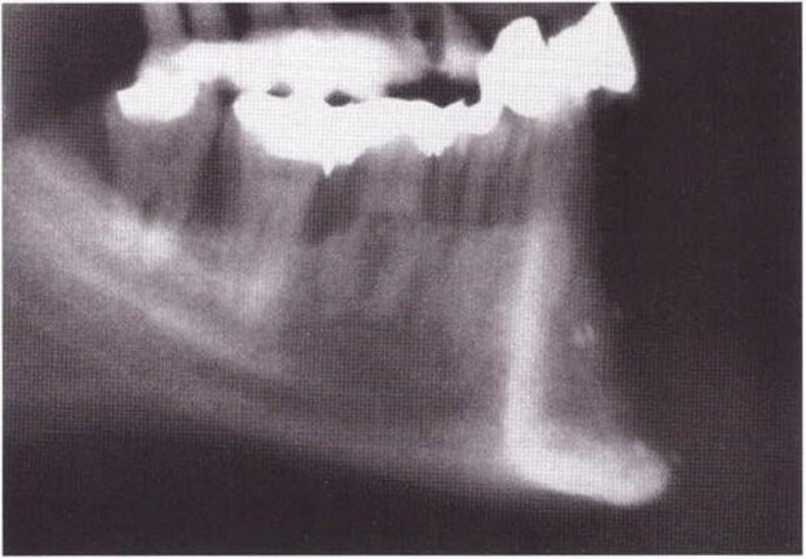
Рис. 5-20о. На боковой телерентгенограмме через 16 мес после трансплантации отмечается удовлетворительная регенерация кости
Рис. 5-20п. Телерентгенограмма непосредственно после операции
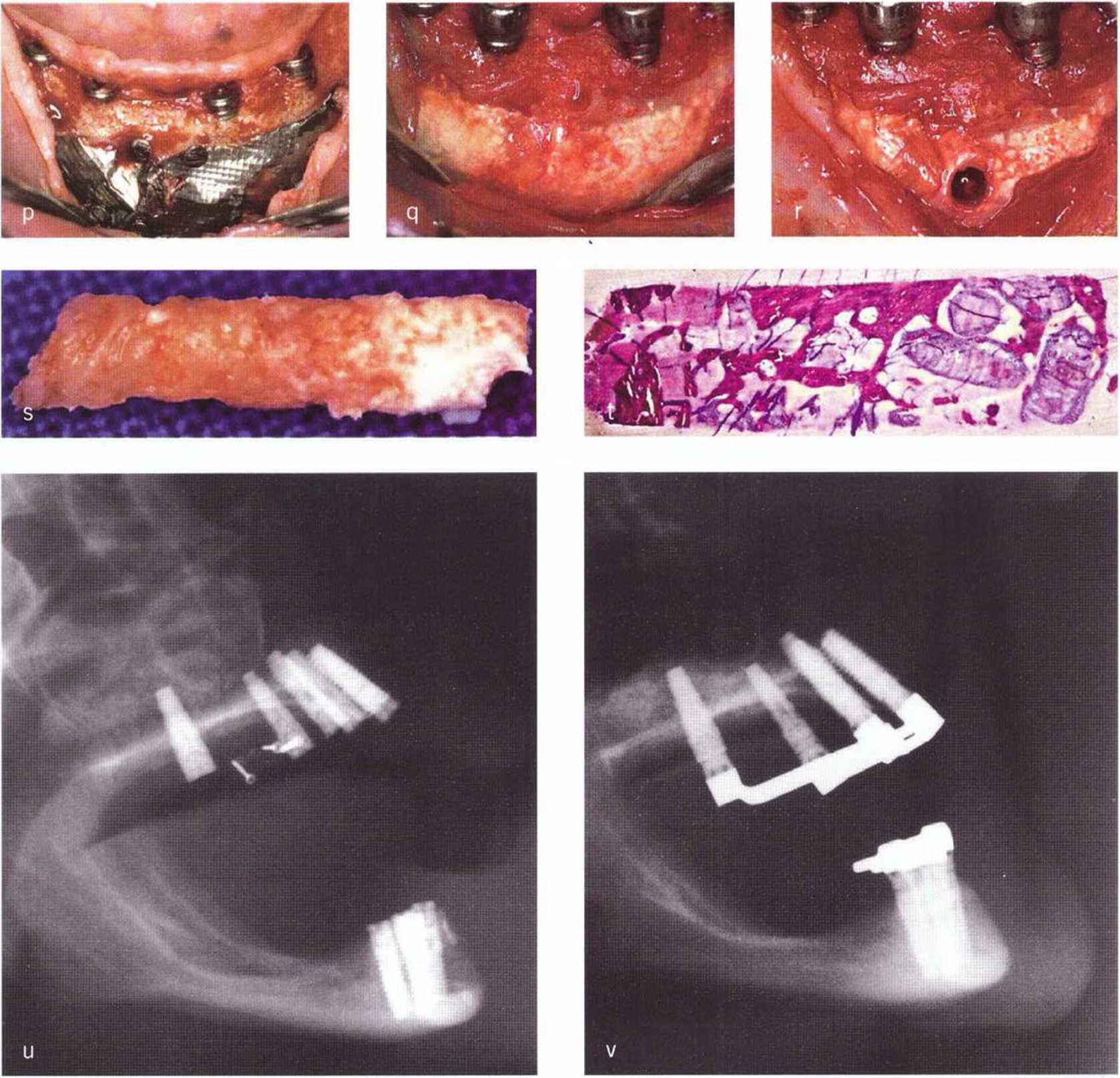
Рис. 5-20. (р) Раскрытие четырех имплантатов между подбородочными отверстиями с визуализацией титановой фольги через 4 мес после имплантации, (q) После удаления титановой фольги визуализируется костный материал, (г) Проба кости из донорского участка.
(s) Макроскопически проба кости соответствует норме, (t) Микроскопически отмечается удовлетворительная костная регенерация области, заполненной коллагеном. Во внешнем слое наблюдаются костная интеграция и перестройка частиц материала Algipore (гистологическое исследование: проф. К. Donath, Гамбургский университет, Германия), (и) Рентгенограмма донорского участка в подбородочной области сразу после операции (сочетание коллагеновой губки, материала Algipore и мембраны с титановым усилением). Взятые из подбородочной области костные блоки использованы для реконструкции верхней челюсти, (v) Боковая телерентгенограмма через 2 года после операции и клиническая картина после удаления мембраны подтверждают полную костную регенерацию донорского участка.
Рис. 5-20х. На контрольной рентгенограмме через 11 мес после трансплантации отмечается удовлетворительная регенерация
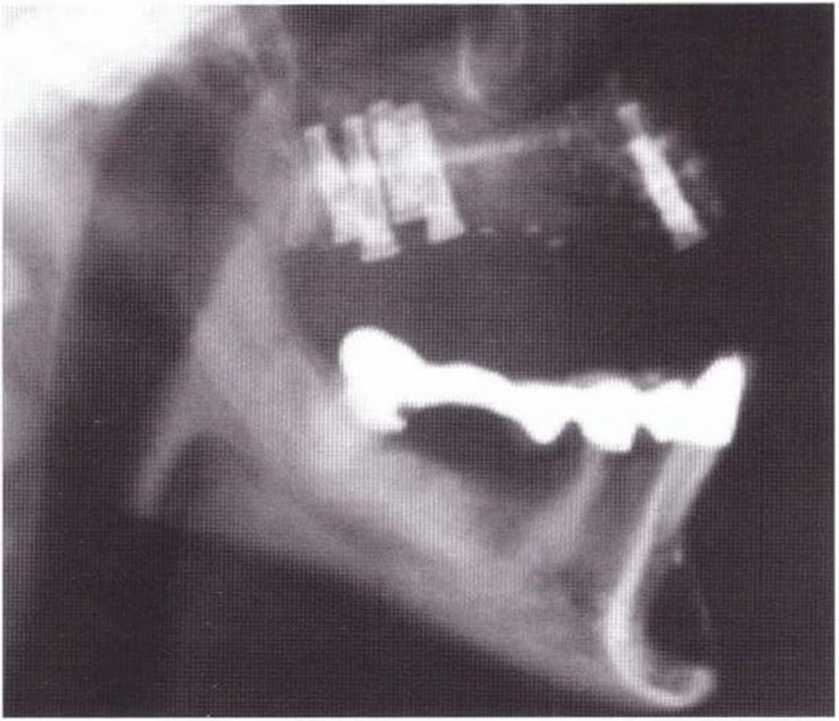
Рис. 5-20w. В донорской области использовались биологически активное стекло (Biogran, Biomet 3i) и нерезорбируемая мембрана (Gore-Tex)
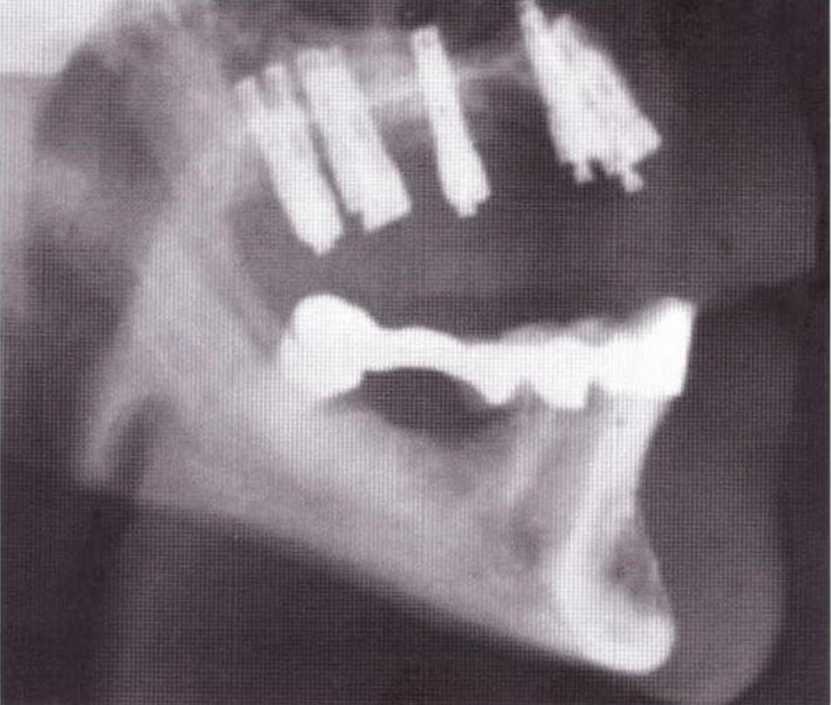
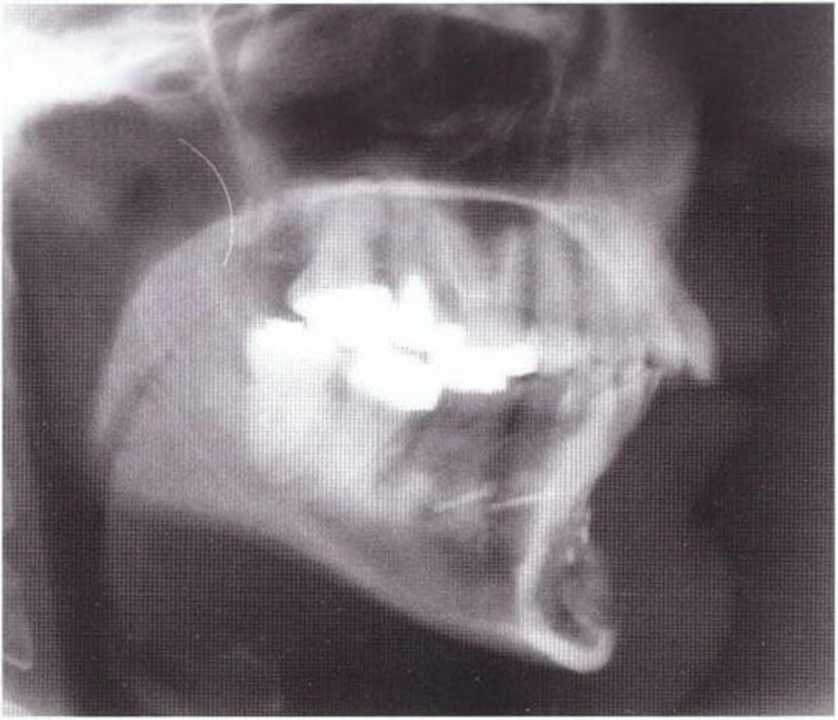
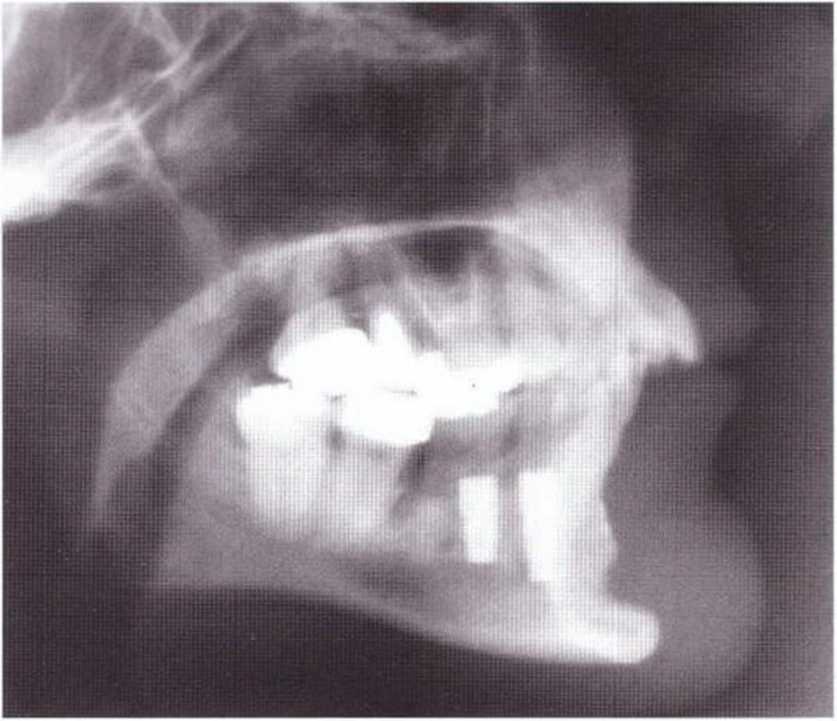
Рис. 5-20у. Аналогичная рис. 5-20w ситуация: донорский участок заполнен биостеклом (Biogran) и покрыт резорбируемой мембраной (Bio-Gide)
Рис. 5-20z. На контрольной рентгенограмме через 4 мес определяется выраженная резорбция биоматериала без костной регенерации
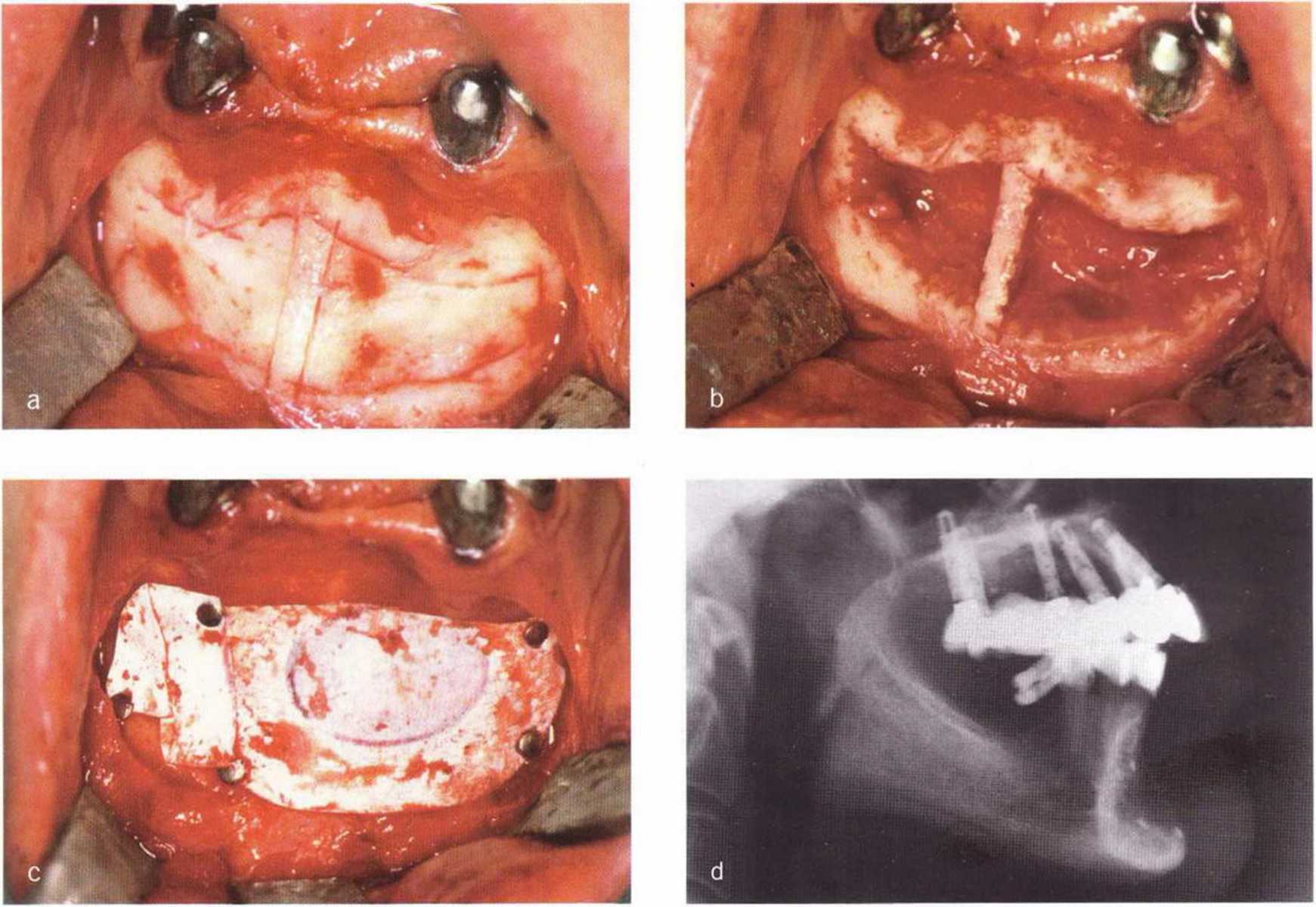
Рис. 5-21. (а) Получение двух костных блоков с сохранением узкого костного мостика посередине подбородка с помощью пилы MicroSaw. (b) Клиническая ситуация после получения трансплантата, (с) Донорский участок изолирован мембраной Gore-Tex. (d) Через 5 лет отмечается неполная регенерация костной ткани
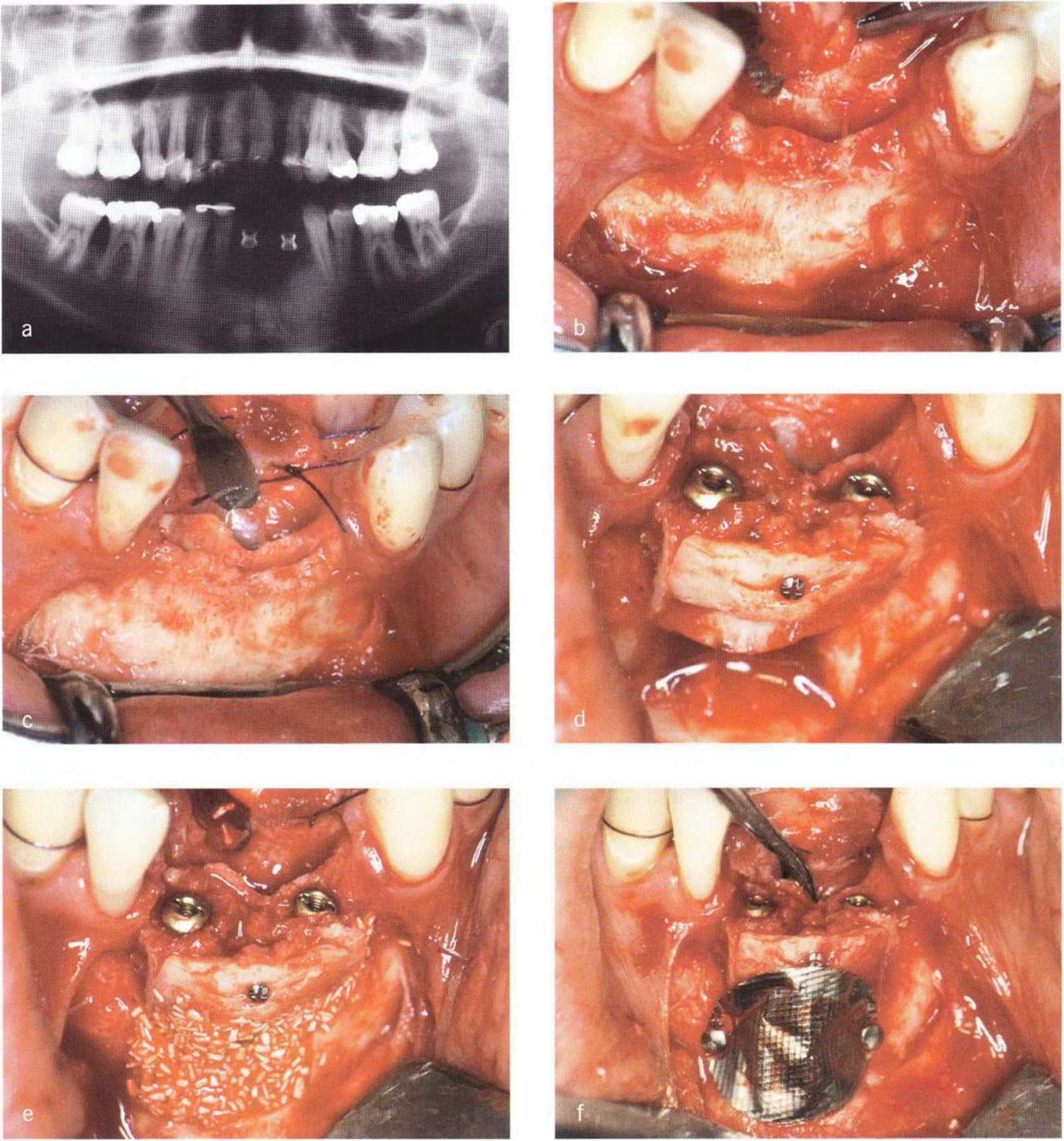
Рис. 5-22. (а) Ортопантомограмма молодого пациента с пародонтитом тяжелой степени до лечения. (Ь) Атрофия альвеолярного гребня в переднем отделе нижней челюсти, (с) Расщепление альвеолярного гребня, (d) Установка имплантатов в сочетании с пересадкой костного блока. Трансплантат получен апикальнее дефекта гребня, (е) Донорский участок заполнен коллагеном и тонким слоем биоматериала Algipore. (f) Донорский участок изолирован титановой фольгой Bone Shield
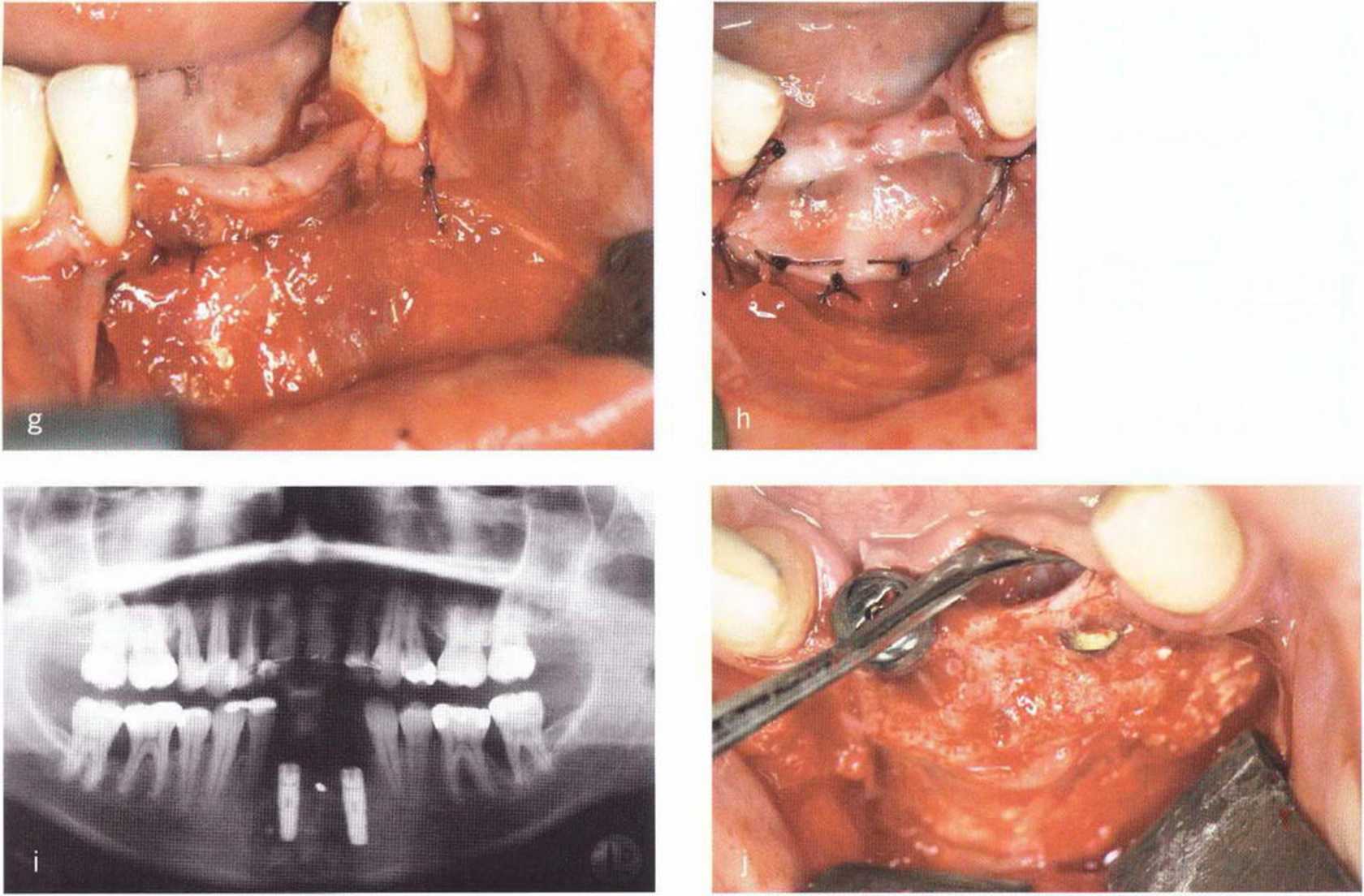
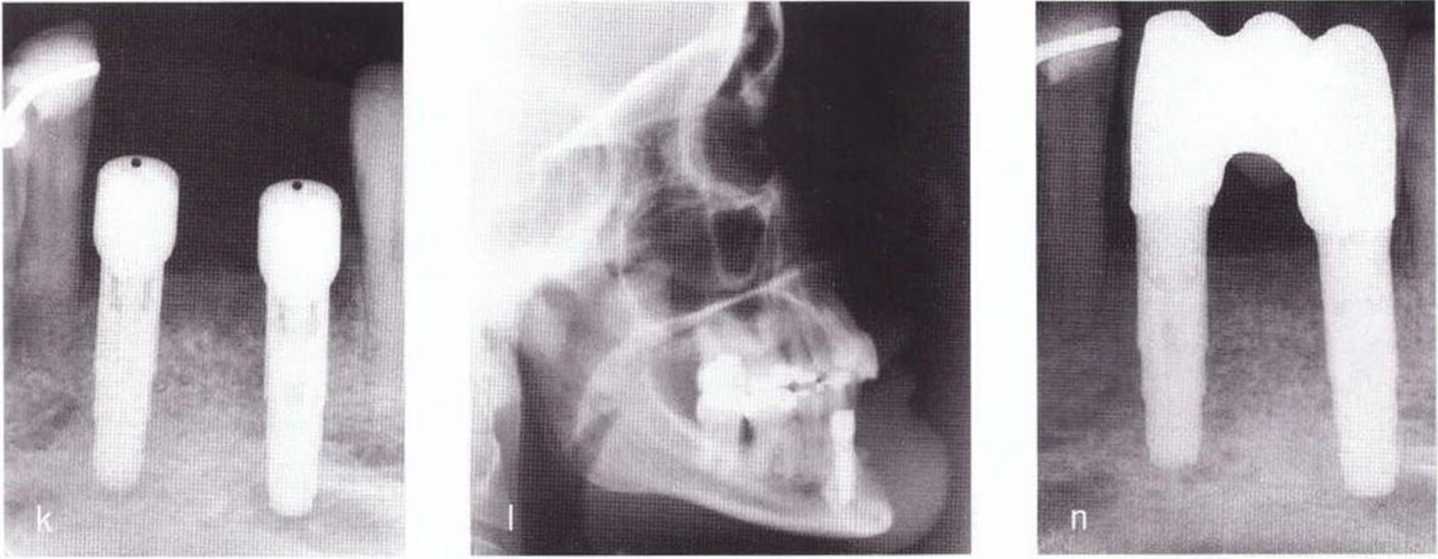
Рис. 5-22. (д) Донорский участок и трансплантат перекрыты надкостницей, (h) Слизистый лоскут фиксирован к надкостнице в глубине преддверия (вестибулопластика по Казанджяну). (i) Рентгенограмма после операции, (j) Клиническая ситуация через 4 мес после вмешательства и сразу после удаления титановой фольги.
(k) Прицельная рентгенограмма после раскрытия имплантатов.
(l) Боковая телерентгенограмма после удаления фольги и раскрытия имплантатов, (т) Клиническая ситуация через 7 лет после протезирования, (п) Контрольная рентгенограмма через 7 лет после протезирования
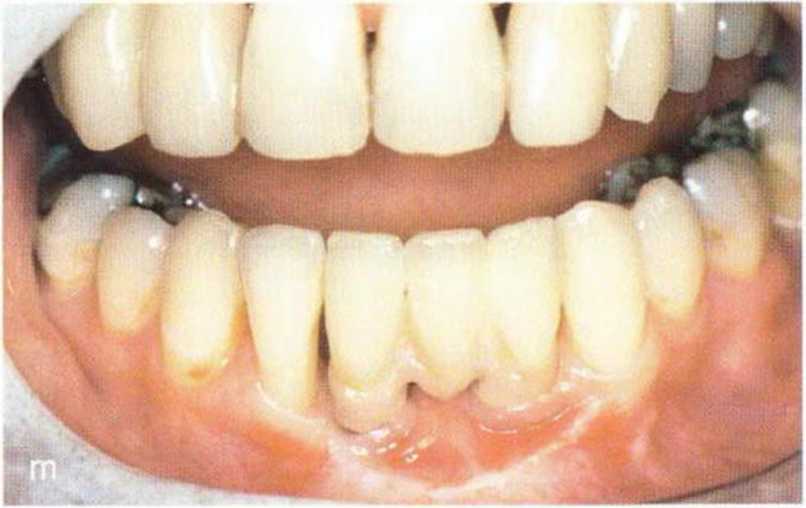
Пересадка костной ткани, полученной на участках адентии.
Под местной вестибулярной и язычной инфильтра-ционной анестезией проводится трапециевидный разрез, аналогично трансплантации из области ветви нижней челюсти. Верхний горизонтальный распил проходит на 5 мм ниже альвеолярного края для сохранения его контура (рис. 5-23a-5-23f). При этом заживление происходит быстрее, и обеспечивается возможность остеоинтеграции имплантатов. Заполнение донорского участка коллагеном предупреждает вторичное кровотечение и стабилизирует кровяной сгусток. Швы удаляют через 7-10 дней после вмешательства.
В некоторых случаях косшый трансплантат можно получить апикальнее устраняемого дефекта (рис. 5-24а-5-24к). Костный блок разделяют на две тонкие пластинки, одну из которых реплантируют в донорской области, полностью восстанавливая контур челюсти (рис. 5-25a-5-25f).
В других случаях трансплантацию костных блоков можно комбинировать с латерализацией нижнего альвеолярного нерва (см. рис. 5-18а—5-18е). При этом верхний и нижний горизонтальные распилы проводят ближе к альвеолярному краю и ниже нижнечелюстного канала, соответственно.
Вертикальные распилы должны быть относительно поверхностными, глубиной не более 2-3 мм.
Костный блок отделяют тонким долотом через горизонтальные распилы, чтобы исключить повреждение нерва.
Острый край гребня нижней челюсти на участке адентии можно срезать микропилой на 5-6 мм, однако эта манипуляция допускается только при значительной высоте альвеолярного гребня относительно дна полости рта. Таким образом хирург, с одной стороны, формирует достаточно широкую площадку альвеолярного гребня, а с другой - получает костные блоки, которые можно использовать для увеличения толщины гребня в области имплантации (рис. 5-26а-5-26р).
В редких случаях небольшие костные блоки можно получить в базальной области скуловой кости (в сочетании с синус-лифтингом), а также на участках адентии верхней челюсти (рис. 5-27a-5-27f) или в переднем отделе нёба.
Объем костных блоков можно определить по закону Архимеда (соблюдая принципы асептики и антисептики). Для этого трансплантат помещают в мерную емкость с физиологическим раствором.
Объем трансплантата вычисляют по разнице между объемом жидкости до и после погружения в нее трансплантата.
Средний объем 4831 костного трансплантата, полученного в ретромолярной области нижней челюсти, составил 1,9 см (максимум 4,4 см), толщина трансплантата достигала 9 мм. В этой области кость обычно имеет толстый кортикальный слой с небольшим количеством губчатого вещества. Послеоперационный дискомфорт (отек, боль) при пересадке трансплантата из ретромолярной области почти такой же, как при удалении ретинированного третьего моляра. Заживление раны в донорской области зависит от размера и способа получения трансплантата. При сохранении язычной части альвеолярного гребня и, следовательно, костного контура регенерация костной ткани на донорском участке в большинстве случаев протекает без особенностей. Введение коллагеновой губки обеспечивает гемостаз и стабильность кровяного сгустка, что способствует заживлению и костной регенерации. Напротив, при получении большого трансплантата, включающего в себя всю наружную косую линию и часть язычной поверхности, нередко наблюдается лишь частичная регенерация. В таких случаях рентгенологически подтверждается длительное сохранение вертикального дефекта, а полное восстановление практически невозможно без использования мембран и костных материалов.
Протокол ведения пациента с донорским участком аналогичен тому, который применяется при пересадке трансплантата из подбородочной области. Основную часть дефекта заполняют коллагеном, поверх которого наносят слой костного материала.
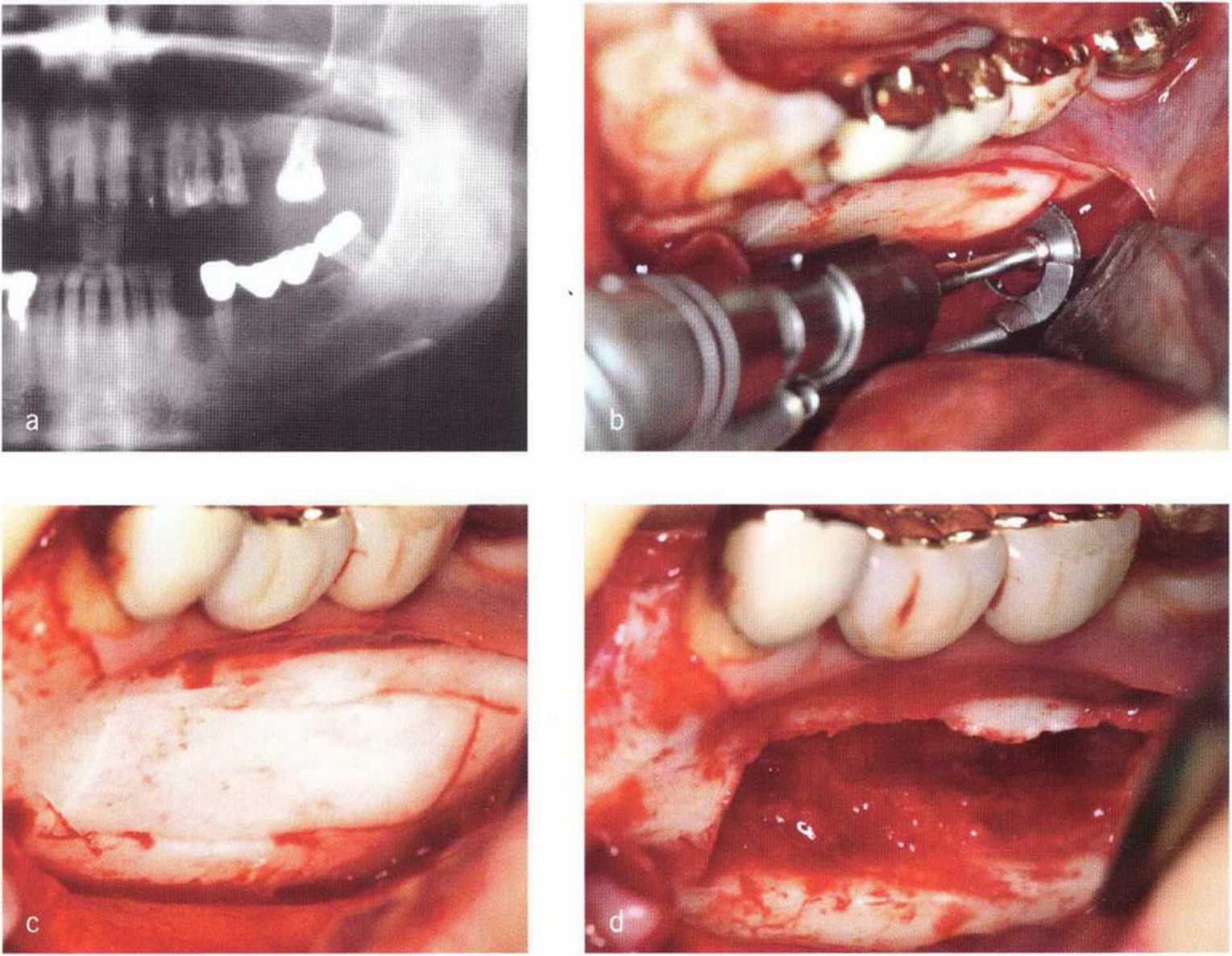
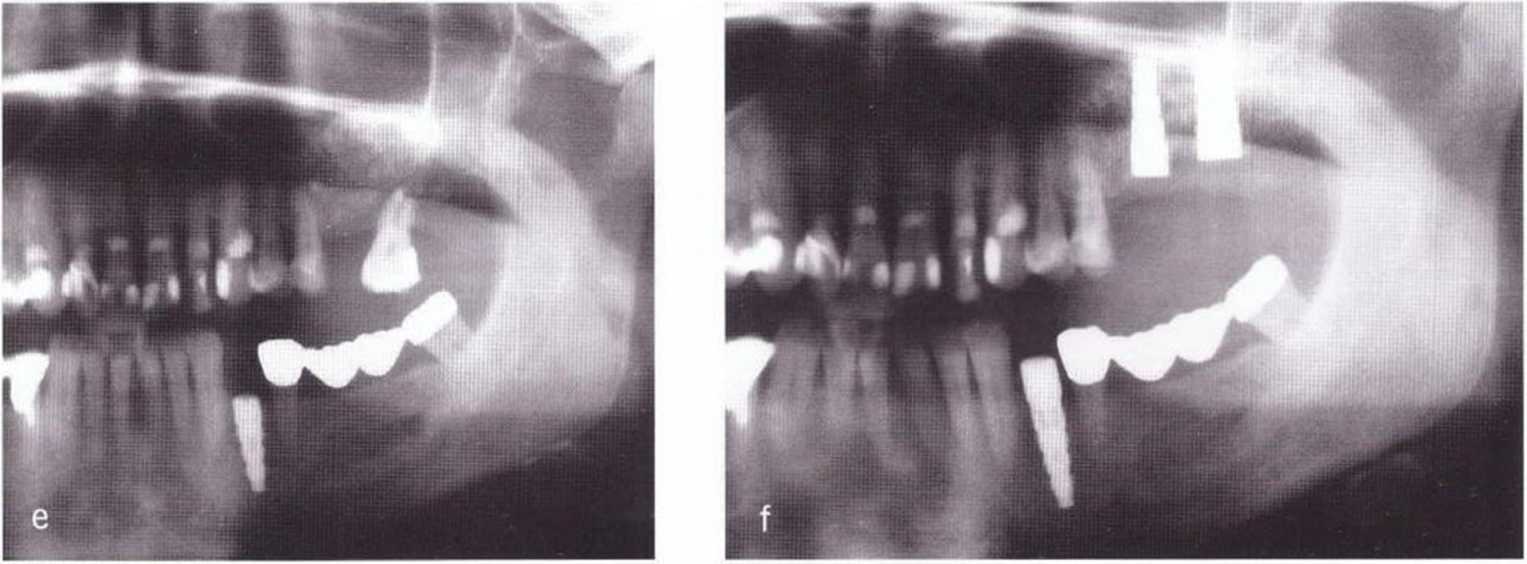
Рис. 5-23 (а) Рентгенограмма до трансплантации костного блока из области апикальнее промежуточной части мостовидного протеза зубов 36-37 при левостороннем синус-лифтинге и регенеративном вмешательстве в области зуба 34. (Ь) Распилы сделаны пилой MicroSaw. (с) Верхний распил расположен примерно на 5 мм ниже края альвеолярного гребня, (d) Клиническая ситуация после получения костного блока, (е) Панорамная рентгенограмма через 3 мес после трансплантации (в день установки имплантата в области зуба 34). Отмечается результат левостороннего синус-лифтинга, (f) Через 6 мес после синус-лифтинга в дистальном отделе верхней челюсти удалили второй моляр и установили имплантат. Отмечается удовлетвооительная регенерация кости в донорской области
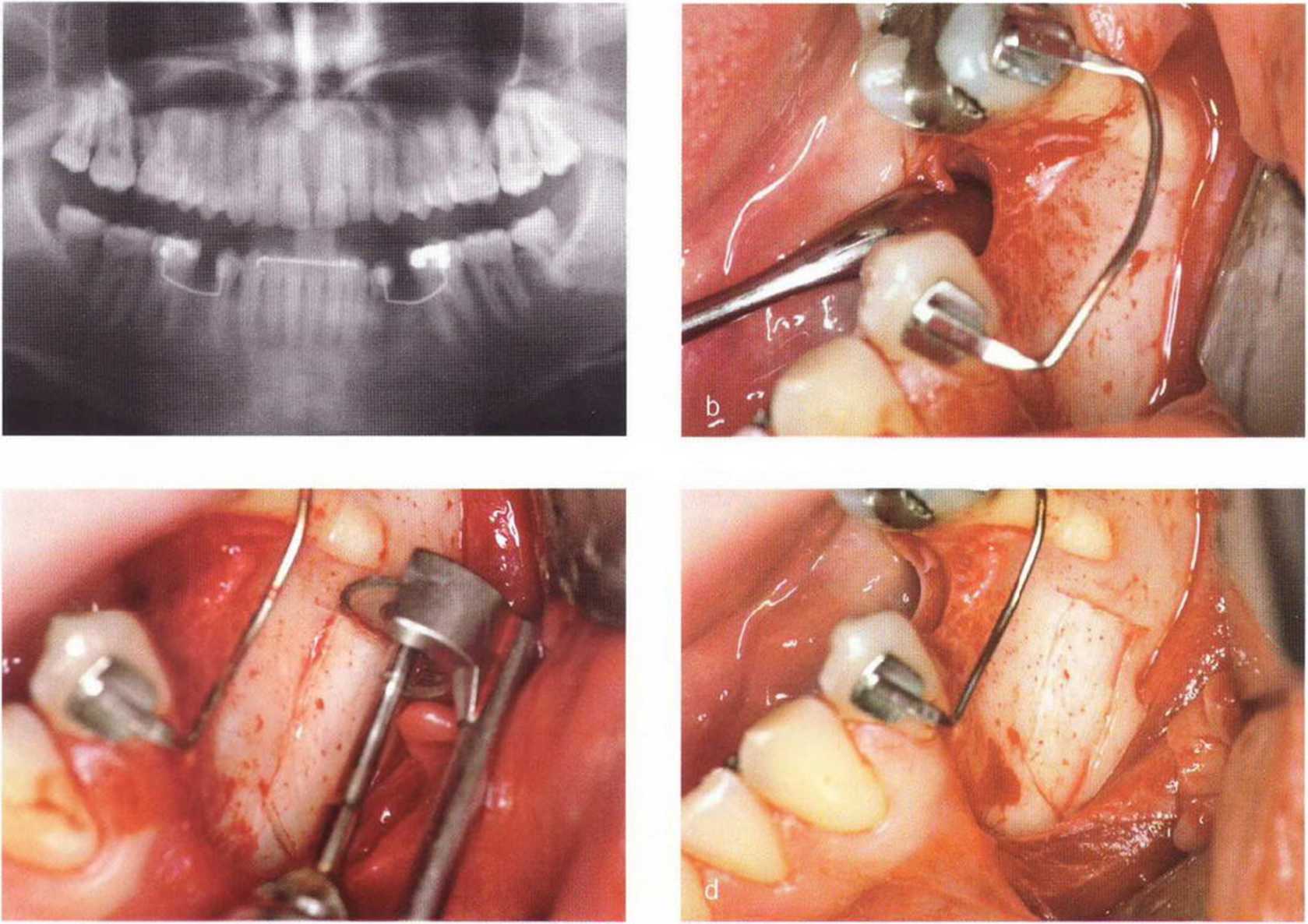
Рис. 5-24. (а) Отсутствие зубов 35 и 44. (Ь) Атрофия альвеолярного гребня, (с) Формирование костного блока в апикальной части альвеолярного гребня пилой MicroSaw. (d) Распил располагается примерно на 10 мм ниже края альвеолярного гребня, (е) Клиническая ситуация после получения одного большого и двух маленьких костных блоков, (f) Трансплантация костных блоков, большой блок фиксирован винтом
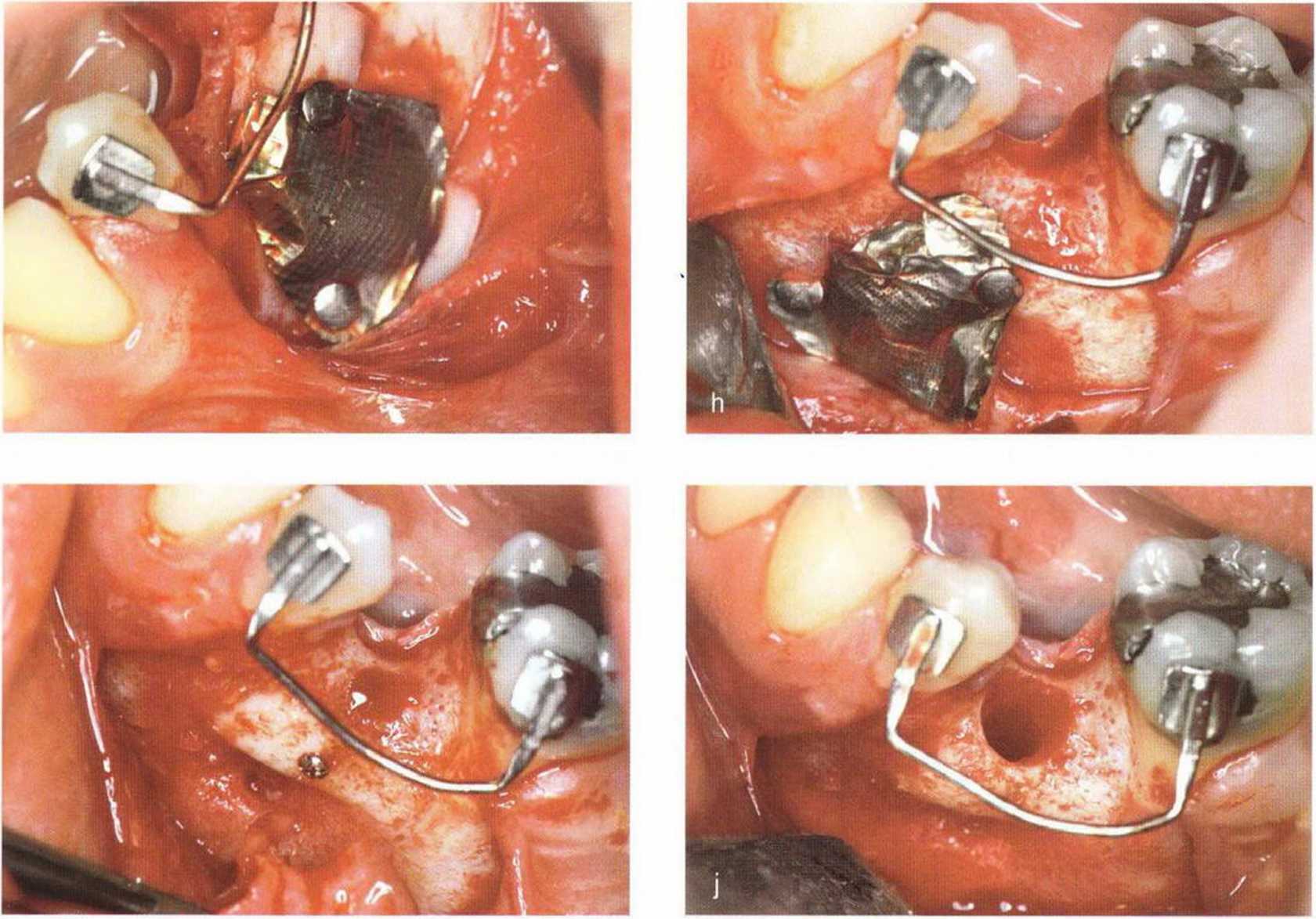
Рис. 5-24. (д) Донорский участок заполнен коллагеновой губкой и накрыт титановой мембраной, (h) Клиническая ситуация через 4 мес после операции, (i) Умеренная костная регенерация донорского участка после удаления мембраны, (j) Препарирование ложа имплантата, (к) Установка имплантатов в области трансплантации
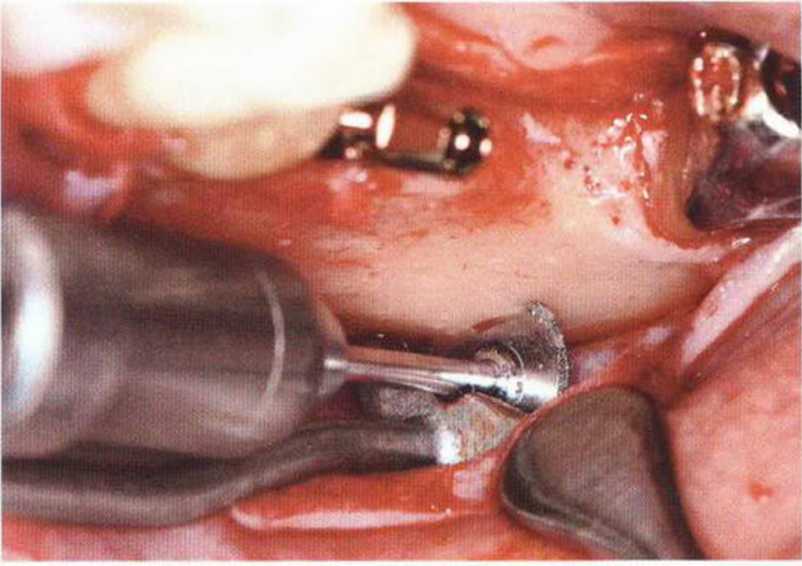
Рис. 5-25а. Получение костного фрагмента апикальнее зоны атрофии
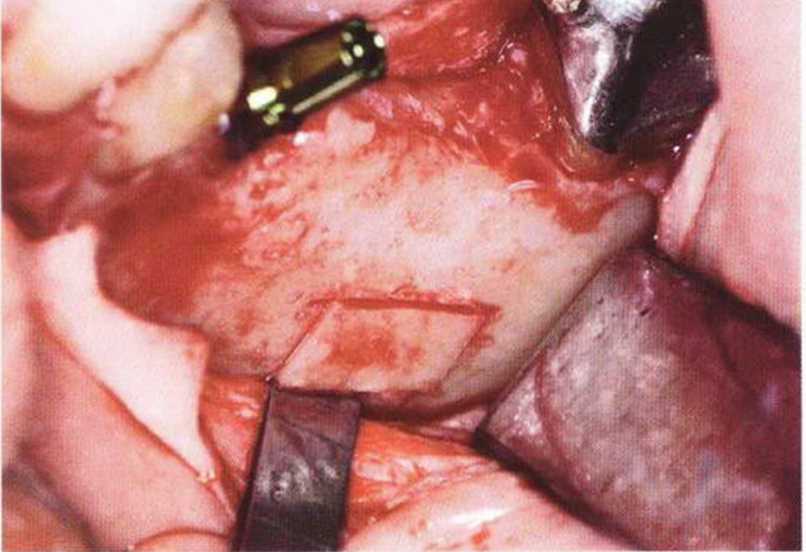
Рис. 5-25Ь. Отделение костного фрагмента тонким долотом
Рис. 5-25d. Получено два тонких костных блока
Рис. 5-25с. Продольный распил костного блока пилой MicroSaw
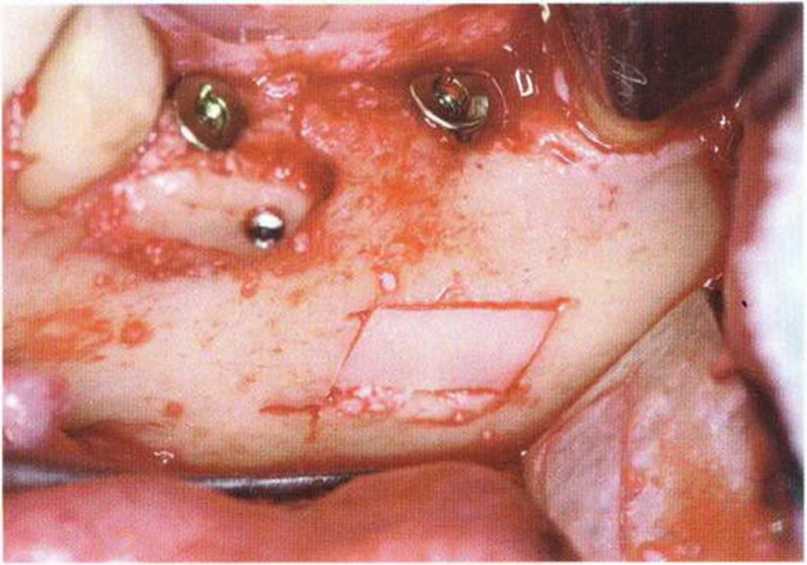
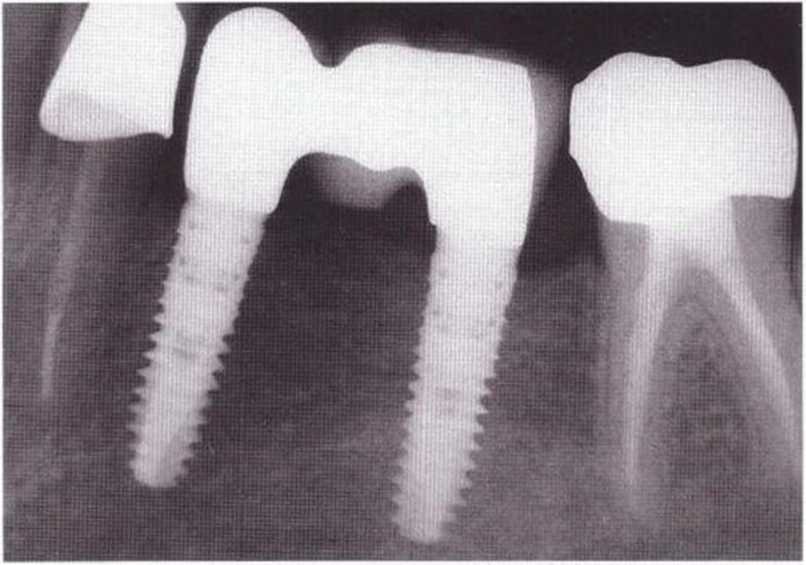
Рис. 5-25е. Один костный блок фиксировали вестибулярнее имплантата в области зуба 35, второй блок репозиционировали в донорской зоне
Рис. 5-25f. Контрольная рентгенограмма через 4 года после операции
Рис. 5-26а. Острый край альвеолярного гребня
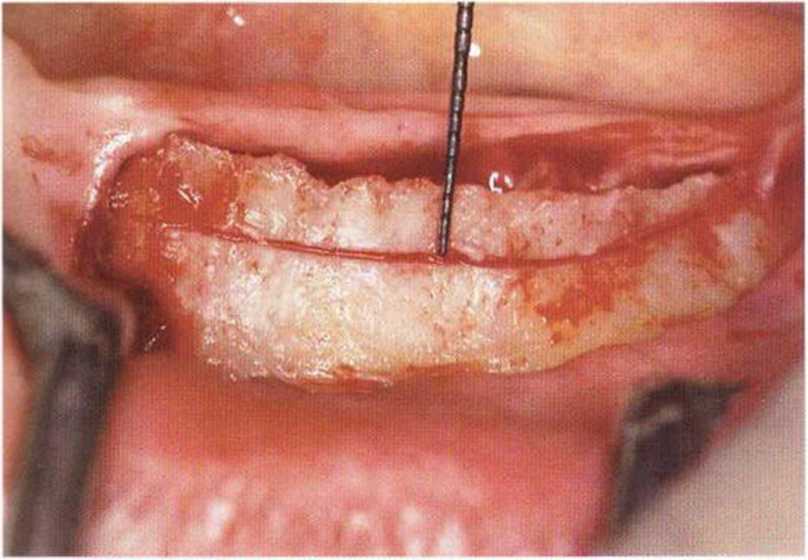
Рис. 5-26Ь. Распил провели пилой MicroSaw примерно на 4 мм ниже края альвеолярного гребня с левой стороны нижней челюсти
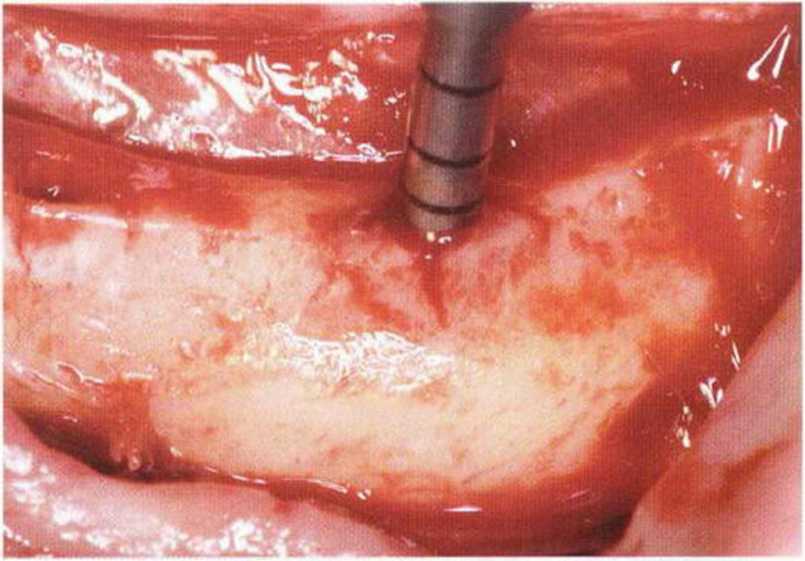
Рис. 5-26с. Вид перед отделением костного блока
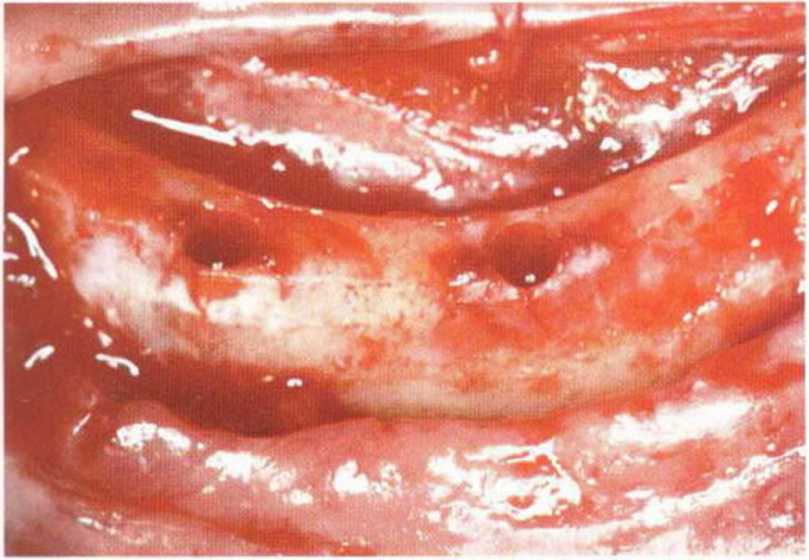
Рис. 5-26е. После расщепления гребня создали ложе для двух имплантатов
Рис. 5-26d. После удаления костного блока образуется платформа шириной 3,5-4 мм. Просверлив пилотное отверстие, альвеолярный гребень расщепляют
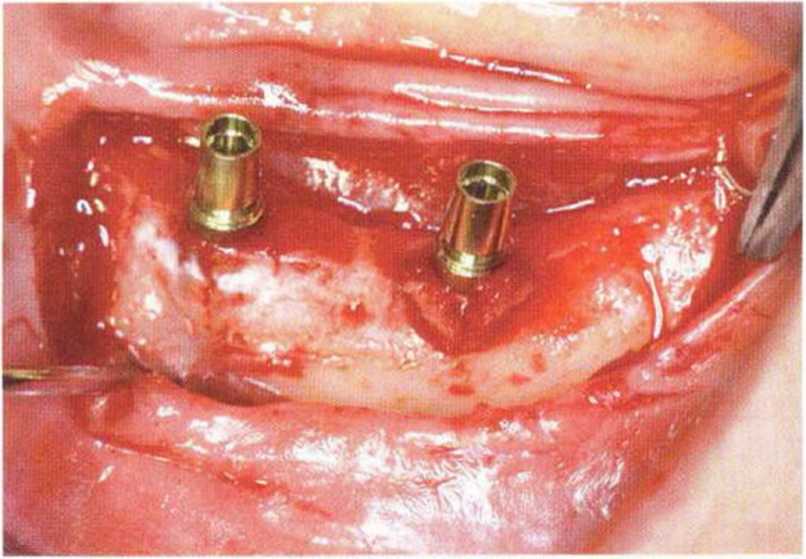
Рис. 5-26f. Установка двух имплантатов. Вестибулярная стенка истончена и ослаблена
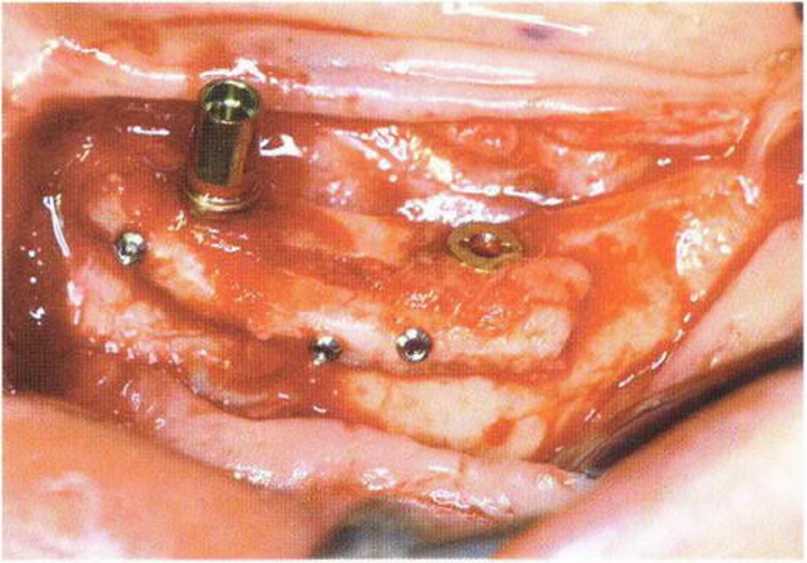
Рис. 5-26д. Стабилизация и расширение вестибулярной костной пластинки с помощью полученного ранее костного блока
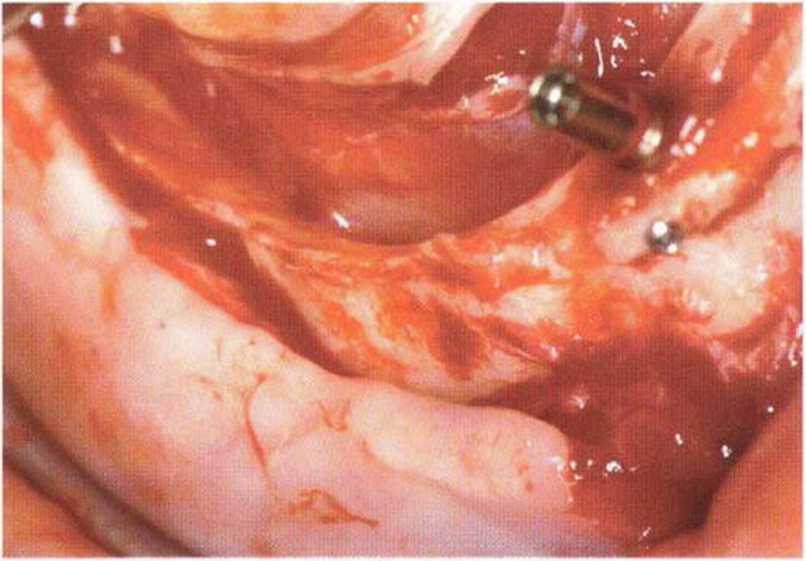
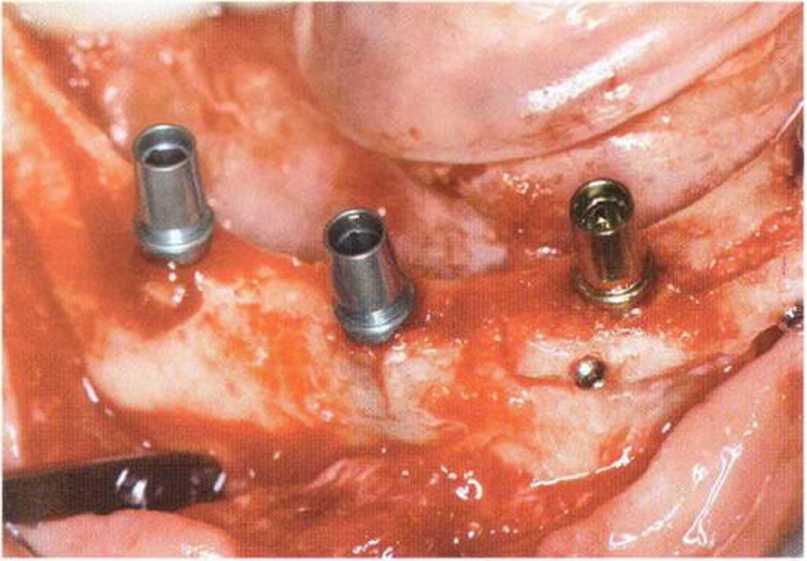
Рис. 5-26h. Аналогичная ситуация справа
Рис. 5-26i. Схожий протокол имплантации справа
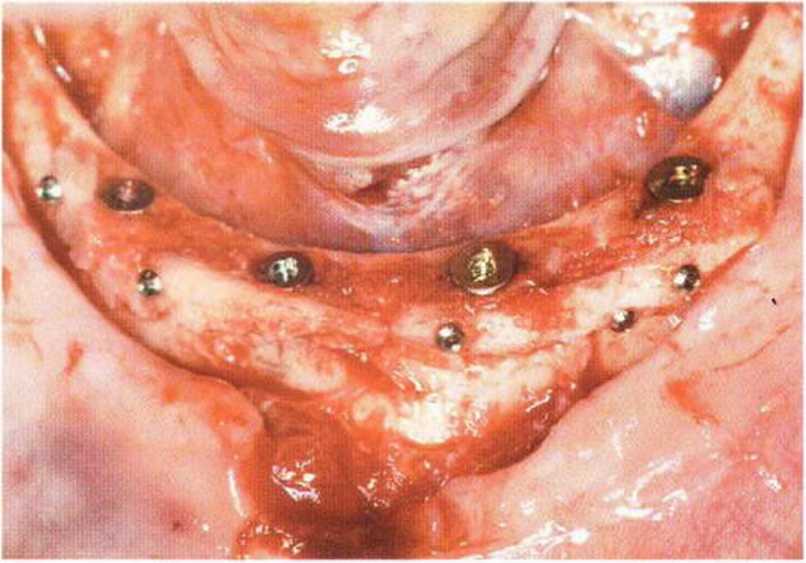
Рис. 5-26j. Вестибулярная костная пластинка также истончена и ослаблена
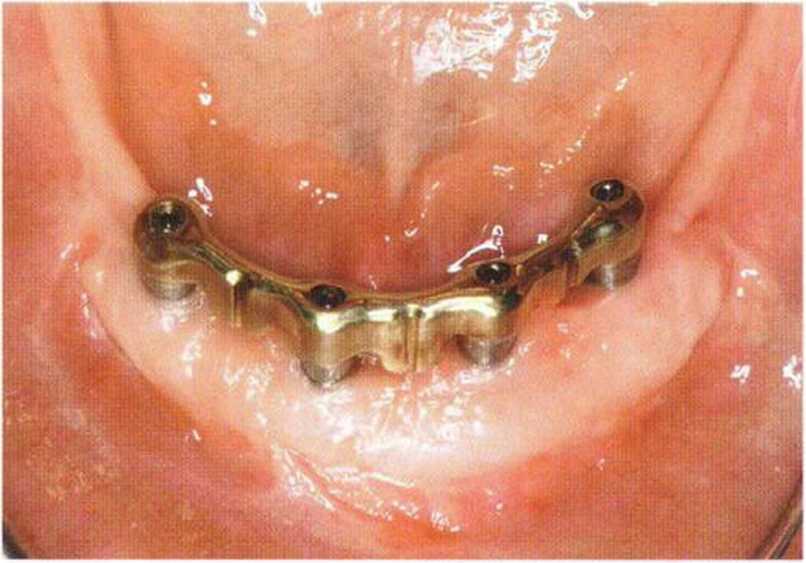
Рис. 5-261. Клиническая ситуация через 2 года после протезирования
Рис. 5-26к. Одинаковый протокол применялся с обеих сторон нижней челюсти
Рис. 5-27а. Получение костного трансплантата под мостовидным протезом в области премоляров верхней челюсти справа
Рис. 5-27Ь. Распилы для получения костного фрагмента
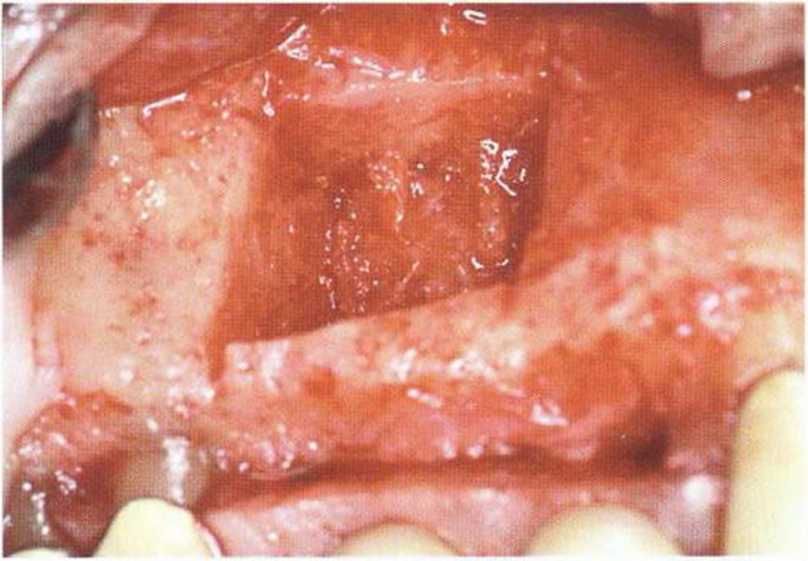
Рис. 5-27с. Донорский участок после отделения костного блока
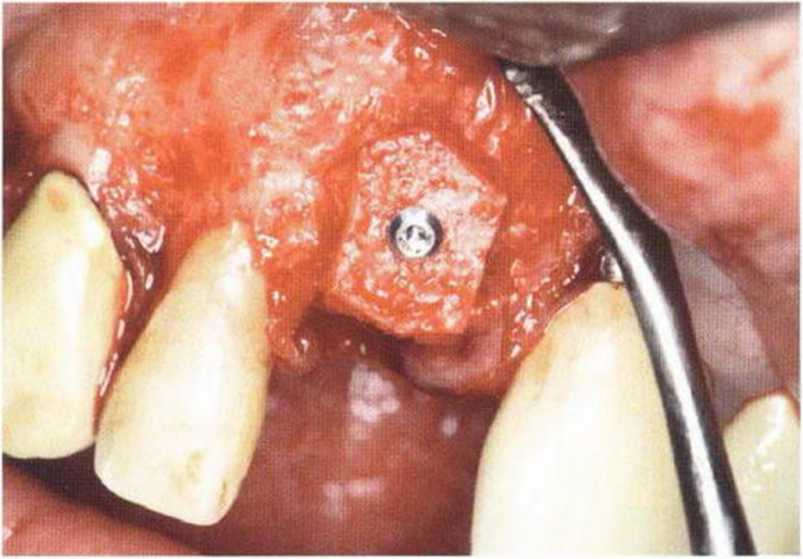
Рис. 5-27d. Трансплантация костного блока в область зуба 11
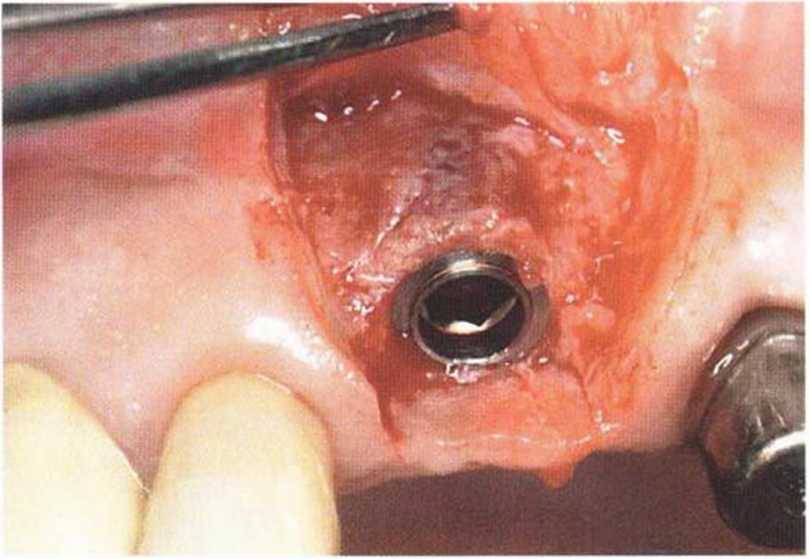
Рис. 5-27е. Установка имплантата в области зуба 11
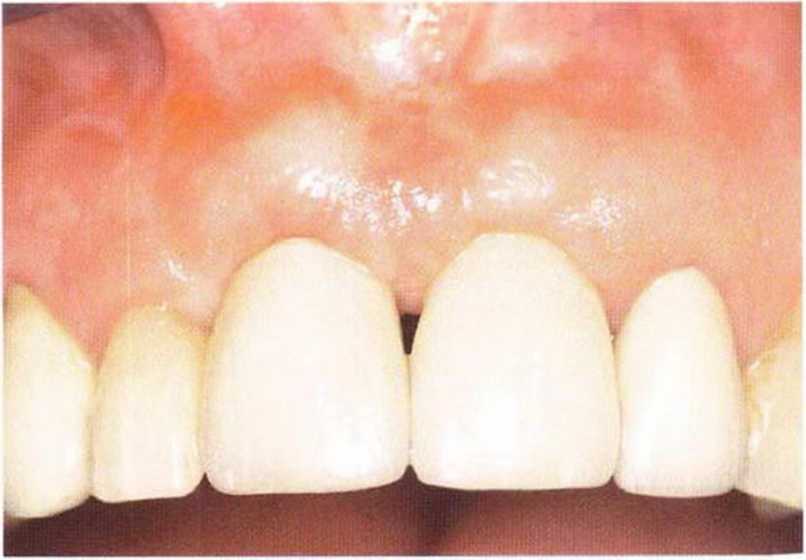
Рис. 5-27f. Клиническая ситуация через 5 лет после протезирования.
.
При случайном обнажении нижнечелюстного канала для защиты сосудисто-нервного пучка от костного материала, оказывающего повреждающее действие на нервную ткань, применяется коллагеновая прокладка.
Всего в 51 из 4831 случая (около 1 %) в результате инфицирования раны не произошло заживление донорского участка первичным натяжением. Применение антимикробных ополаскивающих средств способствовало заживлению вторичным натяжением. Кроме небольших преходящих нарушений чувствительности, продолжавшихся не более 6 мес, не наблюдалось поражений нижнего альвеолярного нерва. В 1 случае в ходе получения крупного трансплантата произошел перелом язычной стенки альвеолярного гребня нижней челюсти.
Для лучшего заживления раны костный фрагмент на надкостничной ножке фиксировали винтами для остеосинтеза. В 2 других случаях через 3 недели после операции заподозрили трещину в области угла челюсти, что, однако, не подтвердилось в ходе дополнительного обследования.
Объем трансплантата с участков адентии варьирует в пределах 1-2,8 см (в среднем 1,6 см). Заживление протекало без особенностей во всех случаях. Костная регенерация рентгенологически соответствовала состоянию после удаления моляра.
В подбородочной области получили 716 трансплантатов, объем которых в среднем составил.
2,7 см (максимум 4,8 см). Как правило, на этом участке отмечается более тонкий кортикальный слой и большее количество губчатого вещества, чем в ретромолярной области. За исключением нарушений чувствительности нижних резцов, всего наблюдалось 20 послеоперационных осложнений (2,8 %), в том числе 17 щелевидных костных дефектов с признаками воспаления. Все осложнения были успешно устранены благодаря эффективной местной терапии. В 2 случаях через несколько месяцев после пересадки трансплантатов развились периапикальные очаги поражения в области клыков. Пораженные зубы за несколько лет до обсуждаемых вмешательств были восстановлены искусственными коронками. Для устранения периапикального поражения провели эндодонтическое лечение. В 1 случае при получении трансплантата произошел перелом базального края нижней челюсти (третья трансплантация с одного и того же участка в течение 5 лет). Костный отломок успешно зафиксировали винтами для остеосинтеза (ср.
главу 9). Заживление раны в области перелома проходило без особенностей. Во всех других случаях послеоперационный дискомфорт (отек, гематома, боль) был менее выраженным, чем при трансплантации из ретромолярной области. Ни в одном случае не наблюдались изменения мимики или контура подбородка (рис. 5-20а).
Наиболее частым осложнением при пересадке костного блока из подбородочной области является продолжающееся в течение нескольких месяцев после операции нарушение чувствительности нижних резцов, которое наблюдалось у 38,8 % пациентов в первые 12 недель после операции. Симптомы отмечались прежде всего после получения крупных блоков в результате поражения мезиаль-ных ветвей нижнечелюстного нерва (ветви нижнего альвеолярного нерва: (рис. 5-19г). У 6,84 % пациентов указанное нарушение чувствительности одного или нескольких нижних резцов продолжалось больше 12 недель.
Костную регенерацию в области подбородка контролировали с помощью ортопантомографии и телерентгенографии головы в боковой проекции.
Лучшие результаты отмечались при использовании резорбируемого костного материала и нерезорби-руемой мембраны.
Ниже представлены результаты трансплантаций, проведенных в 1994-2002 гг. по описанному протоколу пересадки нижнечелюстных костных блоков.
В 14 из 1229 случаев трансплантации костных блоков для увеличения толщины альвеолярного гребня заживление первичным натяжением не было достигнуто в результате некроза лоскута и обнажения трансплантата. В 4 случаях причиной обнажения трансплантата стало механическое раздражение области вмешательства съемным протезом. Еще в 3 случаях заживление раны было нарушено в результате недостаточного и травматичного формирования лоскута. У 2 пациентов к обнажению небольшой части трансплантата привело раздражение надлежащих тканей острым краем костного блока. Своевременное проведение местной терапии с уменьшением объема трансплантата привело к заживлению раны через 6-8 недель после обнажения. Во всех случаях имплантаты были установлены в требуемом положении без дополнительной пластики костной ткани. Еще 5 пациентов, у которых отмечалось обнажение трансплантатов, были злостными курильщиками. В этих случаях местное лечение раны оказалось безуспешным, и трансплантаты были утрачены. Повторное регенеративное вмешательство с подготовкой тоннельного ложа им провели через 3 мес после удаления некротизированного костного трансплантата.
Во всех других случаях заживление и регенерация трансплантатов были достаточными для установки имплантатов через 4 мес после регенеративного вмешательства. Средняя толщина альвеолярного гребня до операции составляла.
2,1 мм и через 4 мес после трансплантации увеличилась в среднем на 6,8 мм. Через 10 лет состояние имплантатов, установленных в области регенеративного вмешательства, соответствовало результатам имплантации в интактной кости. Костная ткань вокруг имплантатов оставалась стабильной в течение всего времени наблюдения.
За период 1995-2002 гг. 209 пациентам была проведена трехмерная пластика с использованием нижнечелюстных костных блоков. Аутогенные трансплантаты получали в ретромолярной (п=184) и подбородочной области (п=25). Через 4 мес было установлено 389 имплантатов. Осложнения наблюдались у 7 пациентов. В 4 случаях произошло обнажение имплантатов, в 3 случаях вследствие несостоятельной регенерации отмечалась миграция мягких тканей в область дефекта. У всех остальных пациентов заживление протекало без осложнений, в течение первых 8-9 мес после установки было утрачено всего 3 имплантата. Оставшиеся 386 имплантатов продолжали функционировать в стабильных клинических условиях.
В четырех университетских центрах (Мюнстер и Гамбург, Германия; Тулуза, Франция; Вена, Австрия) провели гистологическое исследование 119 проб и гистоморфологический анализ 96 проб с участков, на которых использовались разные регенеративные методы. Для гистоморфологиче-ского анализа отобрали пробы верхней челюсти (рис. 5-28а-5-28е и 5-29а-5-29е) и нижней челюсти после увеличения толщины и высоты альвеолярного гребня с помощью трехмерной пластики. При увеличении толщины гребня отмечалась более плотная новообразованная кость, чем при увеличении высоты. Соответствующие различия также определялись между верхней и нижней челюстями (рис. 5-29f).
В рамках другого анализа определили соотношение витальных остеоцитов в области регенеративных вмешательств, проведенных с использованием нижнечелюстных костных блоков по традиционной методике и с помощью трехмерной пластики. Оказалось, что трехмерная пластика позволяет сохранить большее количество витальных остеоцитов, а также увеличить толщину и высоту альвеолярного гребня (рис. 5-29д и 5-29h).
Представленные выше данные подтверждают высокую эффективность и безопасность трансплантации относительно крупных костных блоков, полученных на нижней челюсти, при применении соответствующих методов и инструментов.
По данным Misch, у 50 пациентов средний объем подбородочного транспланата составлял 1,74 см и трансплантатов из ветви нижней челюсти 0,9 см. Относительно малый по сравнению с предшествующим исследованием объем трансплантатов объяснялся иным способом получения и применением других инструментов, а также различиями при заборе трансплантатов, прежде всего из подбородочной области, с учетом наличия или отсутствия зубов. При получении трансплантата Misch использовал фиссурный бор, который вызывает большую потерю кости, чем тонкий алмазный диск микропилы MicroSaw. Кроме того, микропила позволяет формировав крупные костные блоки даже на труднодоступных участках без повреждения мягких тканей.
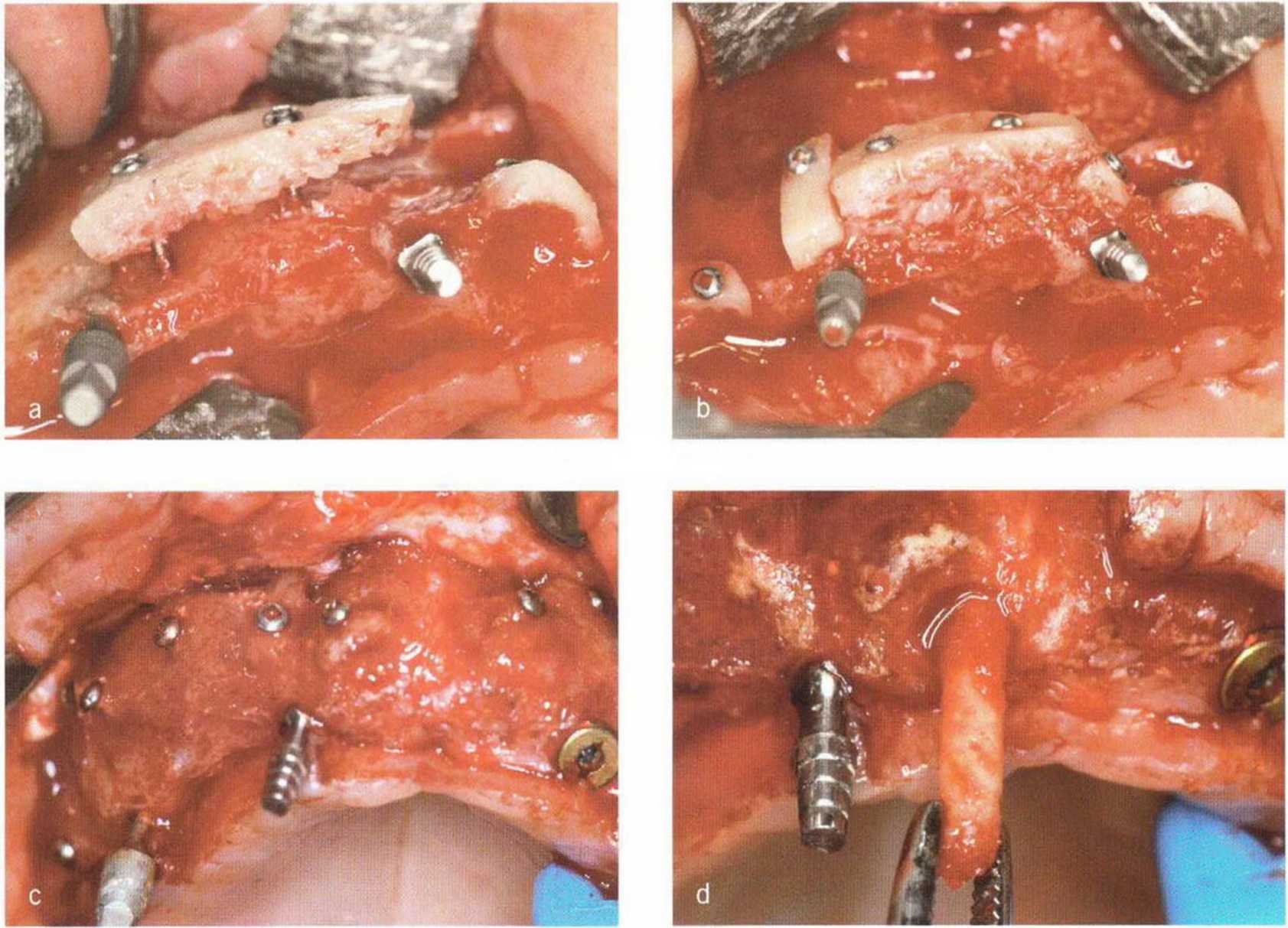
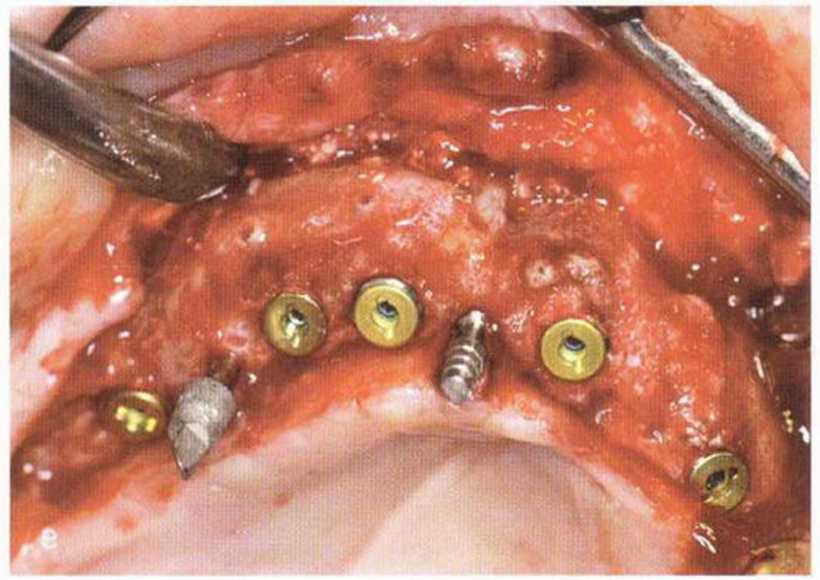
Рис. 5-28. (а) Фиксация тонких нижнечелюстных костных блоков винтами. Временные имплантаты установлены перед трансплантацией. (Ь) Пространство между костным блоком и альвеолярным гребнем заполнено костной стружкой, (с) Через 4 мес после операции клинически определяется удовлетворительное заживление в области трансплантации, (d) Трепаном получили пробу тканей для биопсии, (е) Установка имплантата в области трансплантации
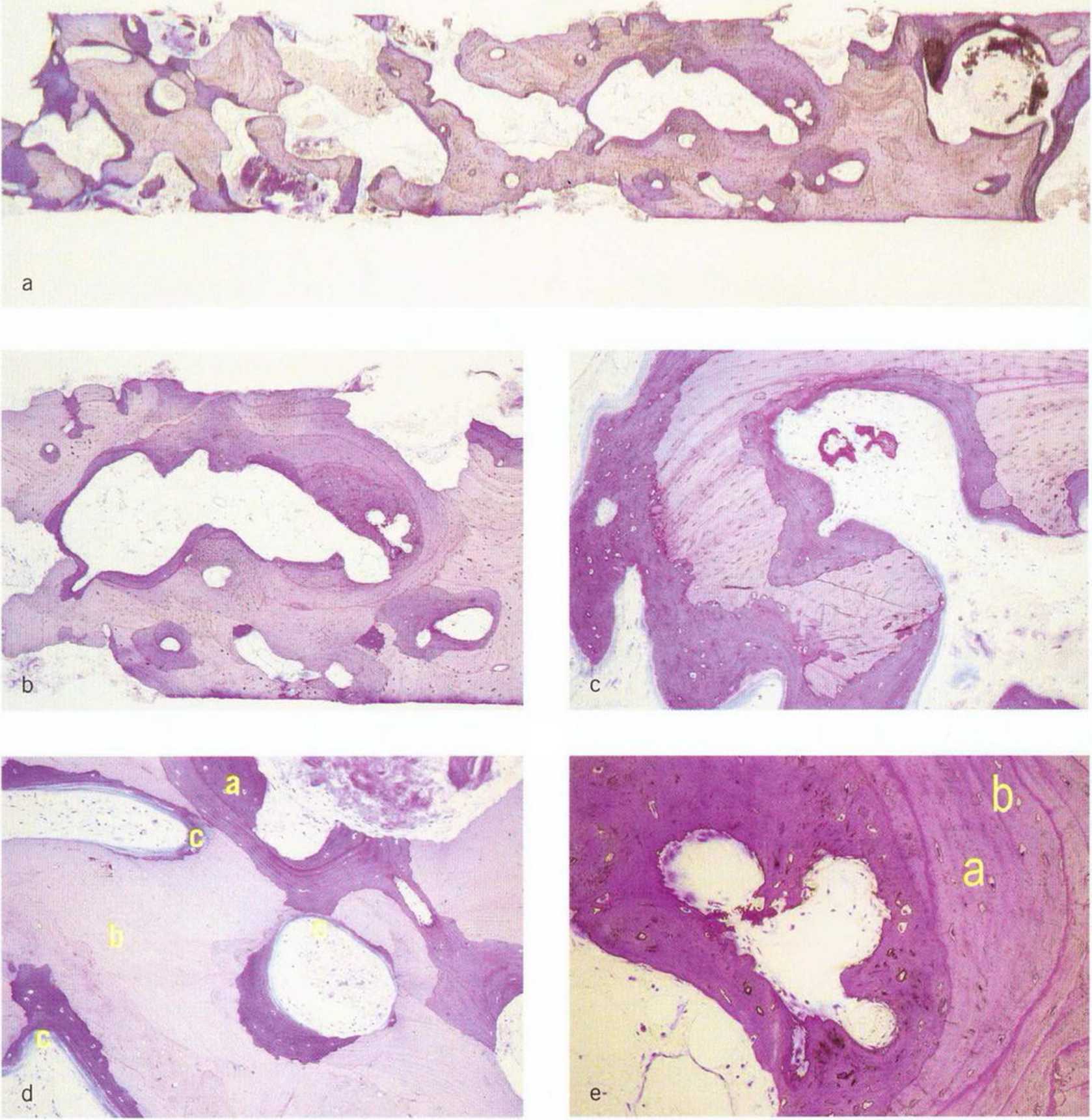
Рис. 5-29. (а) При биопсии отмечаются большое количество новообразованной костной ткани (темно-синее окрашивание) и фиброз (окраска: тионин; х1. Гистологическое исследование на рис. 5-29f-5-29j: д-р D. Moser и проф. д-р R. Ewers, Венский университет, Австрия); (Ь) При большем увеличении визуализируются остеоидные слои (темное окрашивание) и новообразованная кость (х4); (с) Новообразование костной ткани вокруг костной стружки (х10); (d) Темно-синяя новообразованная кость (а) окружает светлые участки трансплантата, в которых сохраняется большое количество мертвых остеоцитов (Ь). Также определяются остеоидные слои (голубое окрашивание, с) (х10); (е) В новообразованной костной ткани отмечаются витальные остеоциты (а) рядом с мертвыми остеоцитами (Ь) (х40).
Рис. 5-29f. Средние результаты гистоморфометрического анализа кости в области трансплантации.
Отсутствуют существенные отличия между областью трансплантации и верхней и нижней челюстью
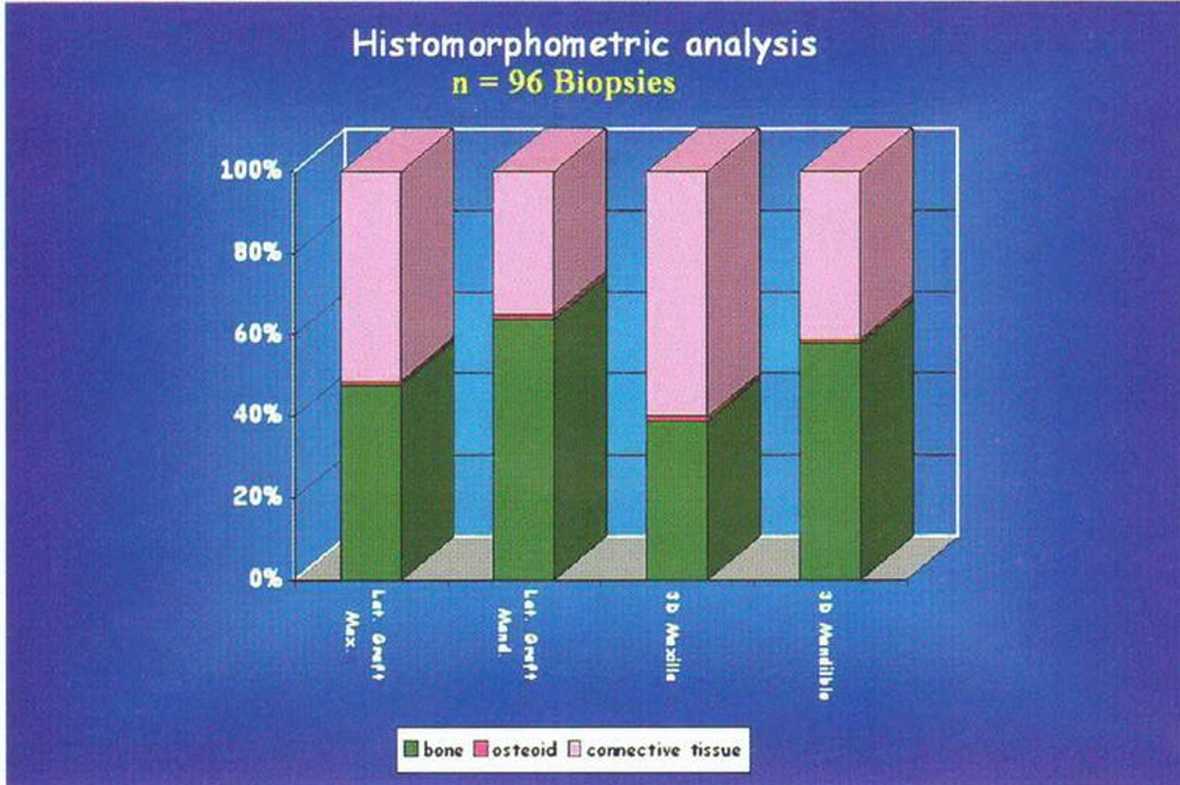
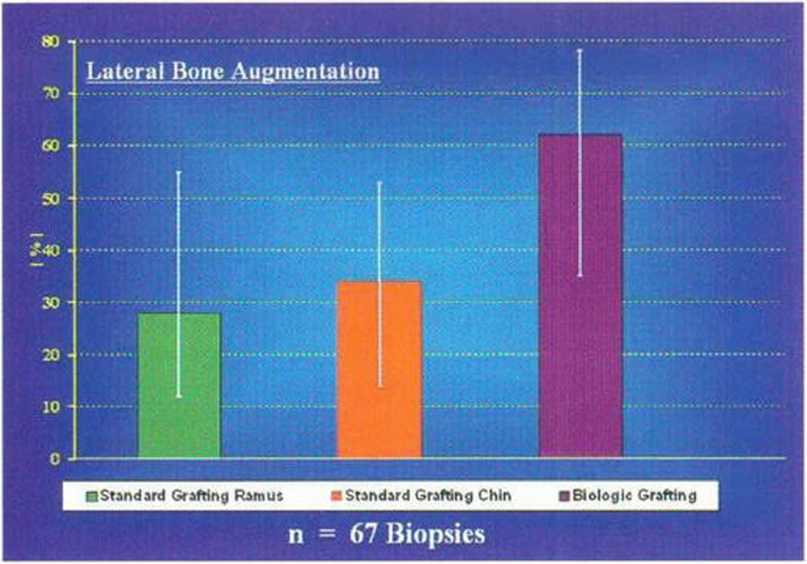
Рис. 5-29g. Среднее число витальных остеоцитов через 4 мес после увеличения толщины альвеолярного гребня костным блоком. Отмечается заметная разница между трансплантацией толстого костного блока и трехмерной пластикой
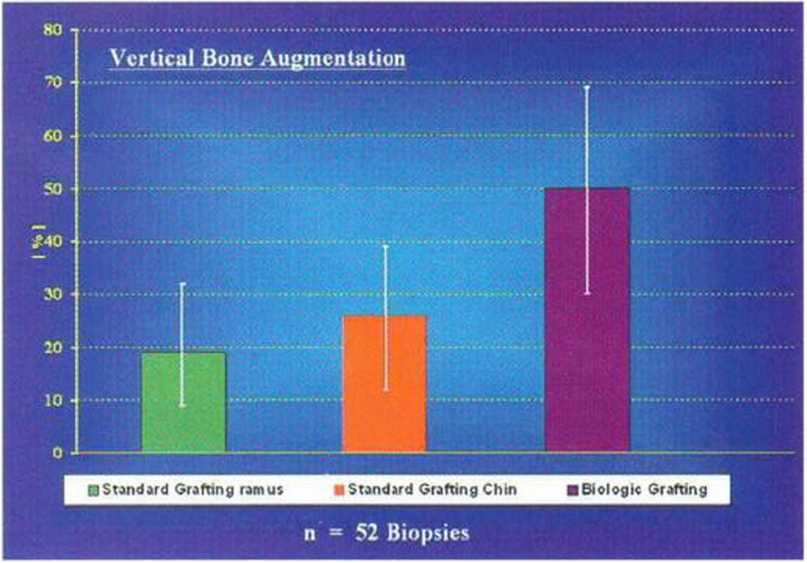
Рис. 5-29И. Среднее число витальных остеоцитов через 4 мес после увеличения высоты альвеолярного гребня. Также опреде ляется значительное отличие между трансплантацией толстых костных блоков и трехмерной пластикой
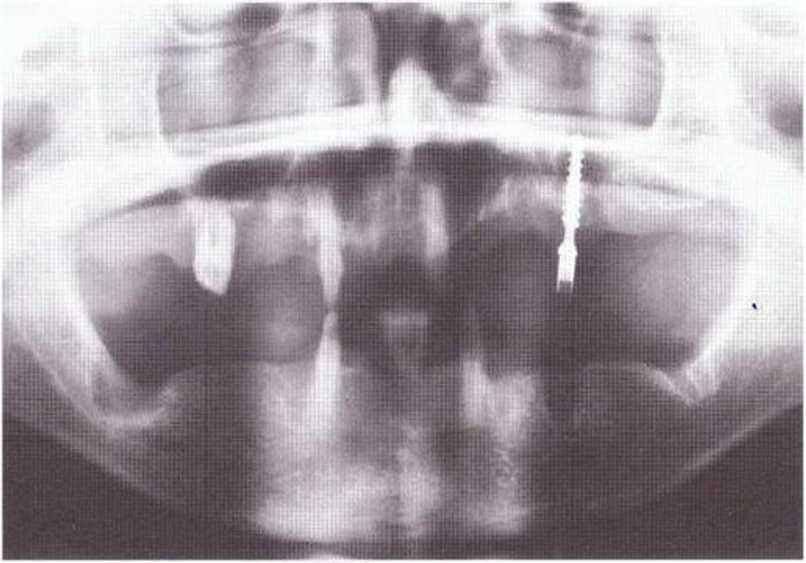
Рис. 5-29i. Ортопантомограмма до операции: множественные вертикальные костные дефекты
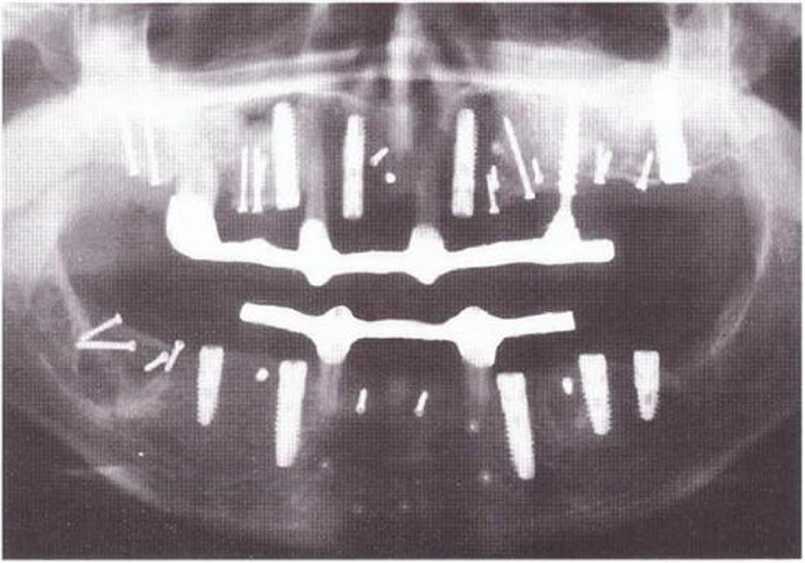
Рис. 5-29j. Всего проведено девять регенеративных вмешз-тельств (пять для увеличения высоты и четыре для увеличения толщины гребня) с пересадкой костных блоков из ретромолярной области справа и слева, а также из подбородочной области
Трепаном можно получить цилиндрические трансплантаты разного диаметра, но относительно небольшого объема. Традиционные костные пилы обычно непригодны для формирования костных блоков необходимого размера на труднодоступных участках. Отметим также, что при применении таких пил сложнее контролировать глубину распилов. Микропила MicroSaw при соблюдении соответствующего протокола позволяет быстро выпилить крупный костный блок при минимальном риске осложнений (рис. 5-29i—5-291), в том числе со стороны нижнечелюстного нерва. С помощью микропилы можно получить трансплантаты самой разной формы и толщины, а также осторожно и точно распилить блок. Полученные таким образом две костные пластинки эффективно используются для трехмерной пластики и устранения значительных костных дефектов. При необходимости второй блок можно реплантировать в донорской области для полного восстановления контуров и лучшей регенерации кости челюсти (рис. 5-29т).
Послеоперационный отек, гематома и боли после получения костного блока из ретромолярной области соответствуют состоянию после удаления ретинированного третьего моляра, однако инфекционные осложнения при удалении зубов мудрости встречаются чаще (6-8 %), чем при трансплантации (1 %). Возможно, это объясняется худшим кровоснабжением дефекта после экстракции зуба. Напротив, при трансплантации обнажается обширная поверхность хорошо васкуляризованного губчатого слоя. Заполнение дефекта в донорской области коллагеном позволяет остановить кровотечение, способствует стабилизации сгустка и заживлению раны. Несмотря на обширные дефекты после забора костной ткани в области наружной косой линии, эстетические или функциональные нарушения не определялись.
В одном исследовании сообщалось о расхождении швов и инфицировании раны на 10,7 % донорских участков в подбородочной области, но расхождения возникали после наложения простых узловых швов. Проблема устранялась после двухслойного ушивания раны. Поданным Misch, парестезия подбородочного нерва и анестезия кожи.
Рис.5-29к. На боковой телерентгенограмме визуализируются донорский участок в подбородочной области и несколько областей трансплантации
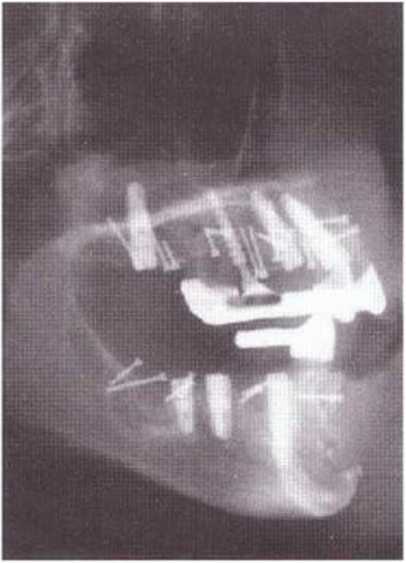
Рис. 5-291. Через 3 мес установлены имплантаты
Рис. 5-29т. Реплантация половины костного блока для восстановления наружной косой линии. В данном случае проведена дополнительная фиксация блока винтом
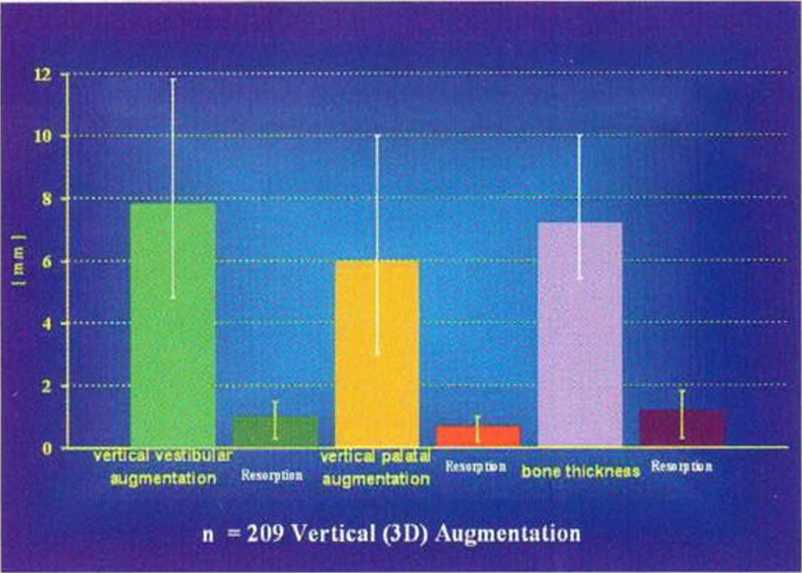
Рис. 5-29п. Среднее увеличение высоты и толщины альвеолярного гребня после трехмерной пластики
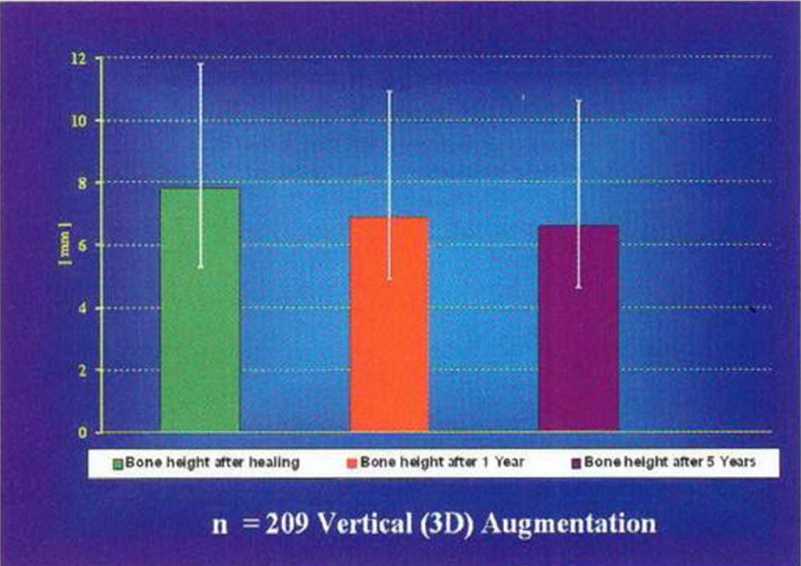
Рис. 5-29o. Стабильные костные параметры после трехмерной пластики.
подбородка отмечались в одинаковом числе случаев (9,6 %), парестезия нижних резцов наблюдалась в 29 % случаев. В исследовании Агх и Beat, несмотря на возникновение периапикальных очагов в области двух нижних клыков, что, однако, не смогли объяснить получением трансплантата, нарушения чувствительности подбородочного нерва отсутствовали. Misch рекомендует соблюдать безопасное расстояние 5 мм до верхушек корней нижних резцов. Остается спорным, является ли достаточным рекомендуемое другими авторами расстояние 3 мм. При получении костной ткани в области подбородка следует учитывать положение петли нижнего альвеолярного нерва. Кроме того, описанные парестезии подбородочного нерва,проходящие в течение 2 мес, могут быть вызваны растяжением нервных волокон при формировании и отведении лоскута.
Наиболее грозное осложнение при получении костных блоков из подбородочной области (и наличии передних зубов) заключается в стойкой анестезии или парестезии нижних резцов вследствие разрыва мезиальных ветвей нижнечелюстного нерва (ветвей нижнего альвеолярного нерва). При потере чувствительности одного или нескольких зубов без клинических признаков некроза пульпы эндодонтическое лечение не показано. Для снижения послеоперационного дискомфорта трансплантацию из подбородочной области следует ограничить случаями отсутствия передних зубов нижней челюсти или наличия выраженного подбородочного выступа и коротких корней передних зубов.
При получении трансплантата в одном случае произошел перелом основания подбородочного края. Это осложнение объясняется трехкратным получением костного трансплантата с одного участка в течение 5 лет. Для лечения перелома костный фрагмент на мышечно-надкостничной ножке стабилизировали винтами. Заживление протекало без особенностей.
В упоминавшемся выше исследовании в двух случаях после получения крупных подбородочных трансплантатов произошел некроз пульпы нижних клыков с появлением рентгенологических признаков периапикального поражения, однако осложнение не удалось объяснить только взятием трансплантата, поскольку зубы в течение многих лет были покрыты коронками.
Ни в одном из 716 случаев пересадки костных блоков из подбородочной области не наблюдались изменения мимики или контура лица пациента. Нарушения со стороны мягких тканей в области подбородка и нижней губы отсутствовали.
В других исследованиях также подтверждалось сохранение контура подбородка,’ но при потере мышечного прикрепления возможно западение мягких тканей.
Описанный выше метод трансплантации кости из нижней челюсти ассоциируется с быстрым увеличением количества витальных остеоцитов в трансплантате (рис. 5-29д), что минимизирует его резорбцию. По сравнению с классическим протоколом трансплантации костных блоков через 4 мес после трехмерной пластики в области вмешательства отмечается в 2 раза больше витальных остеоцитов (рис. 5-29д). Это способствует сохранению новообразованной костной ткани и остеоинтеграции имплантата, что подтверждается схожими показателями 10-летней выживаемости имплантатов в новообразованной и интактной кости. Кроме того, исследования демонстрируют стабильность уровня костного гребня в области имплантатов, установленных после проведения регенеративных вмешательств. Трехмерная пластика позволяет увеличить высоту альвеолярного гребня на высоту более 10 мм без применения мембран или биоматериалов (см. раздел 5.4.5). Необходимости в использовании мембран нет. С одной стороны, это снижает риск осложнений в послеоперационном периоде, а с другой - костные блоки играют роль жестких биологических мембран и обеспечивают регенерацию кости альвеолярного гребня. Среднее увеличение высоты альвеолярного гребня составило 7,8 мм (рис. 5-29п). Через 1 год после операции резорбция составила в среднем 10-15 % от объема новообразованной кости. В последующие годы значительное изменение объема не отмечалось (рис. 5-29о).
Благодаря небольшой резорбции, полноценной регенерации и увеличению высоты костного греб.
ня в среднем на 7,8 мм метод трехмерной пластики является эффективной альтернативой увеличению высоты альвеолярного гребня с помощью монокор-тикальных костных блоков или НКР с применением мембран.
Максимальная резорбция происходит в течение первых 3 мес после вмешательства и зависит от многих факторов (см. раздел 5.4.5).
Аутогенные костные трансплантаты на этапе приживления не должны подвергаться давлению со стороны съемного протеза. В эстетически значимой зоне рекомендуется изготавливать несъемный временный протез с опорой на зубы или имплантаты.