Лечение мукозита.
При мукозите, несмотря на наличие выраженного воспаления окружающей имплантат десны, отсутствуют рентгенологические признаки резорбции костной ткани. В таких случаях лечение включает в себя, прежде всего, обучение адекватной самостоятельной гигиене полости рта. Кроме того, необходимы удаление отложений с помощью пластмассовых кюрег и полирование области соединения имплантата и ортопедической конструкции (рис. 9-15). Использование ополаскивающих растворов и аппликации антимикробных препаратов могут повысить эффективность самостоятельной гигиены. Как и в пародонтологии, в имплантологии чаще всего также используется 0,2 % раствор хлоргексидина. В сравнительном исследовании эффективности Листерина (Listerin®) и плацебо оказалось, что при полоскании в течение трех месяцев полости рта Листерином снижение степени воспаления по сравнению с плацебо было незначительным (Ciancio, 1995). В двух исследованиях сравнивалась эффективность 0,12% раствора хлоргексидина (Lavigne et al., 1994) и пропитанных тетрациклином нитей (Schenk et al., 1997) для лечения мукозита. В обоих случаях не удалось получить убедительных доказательств эффективности этих методов.
Во избежание рецидива мукозита, в определенных случаях рекомендуется проведение пластических пародонтологических вмешательств на мягких тканях вокруг имплантатов.
Для уменьшения подвижности краевой десны и облегчения условий для самостоятельной гигиены может потребоваться увеличение зоны кератинизированной прикрепленной десны вокруг имплантатов с помощью свободного десневого трансплантата или лоскута на ножке (рис. 9-16).
Может быть показано уменьшение глубины кармана вокруг имплантата за счет иссечения десны и (или) апикального перемещения лоскута. Однако в таких случаях следует учитывать высоту внутри-десневой части конструкции (рис. 9-17).
Необходимо помнить, что любые хирургические вмешательства следует проводить только после устранения воспаления.
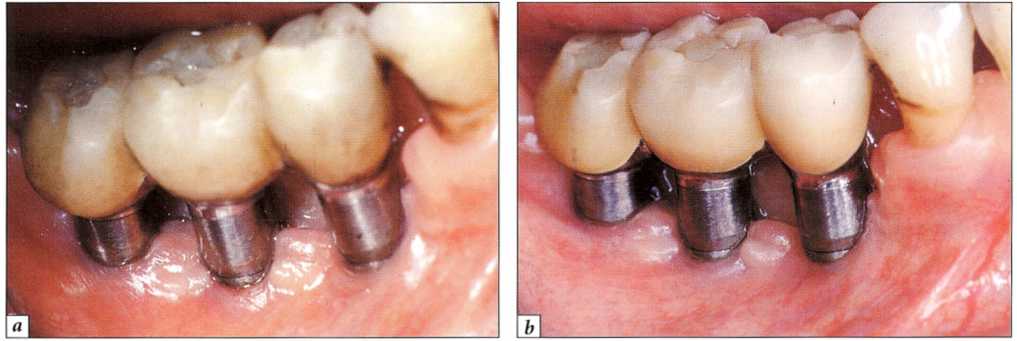
Рис. 9-15. Мукозит вылечен только с помощью полирования наддесневых элементов протеза, улучшения самостоятельной гигиены и полоскания полости рта 0,2 % раствором хлоргексидина:
а - исходное состояние;.
b - клиническое состояние после лечения - значительное стихание воспаления (данные предостав;іеньі д-ром R. Detienville)
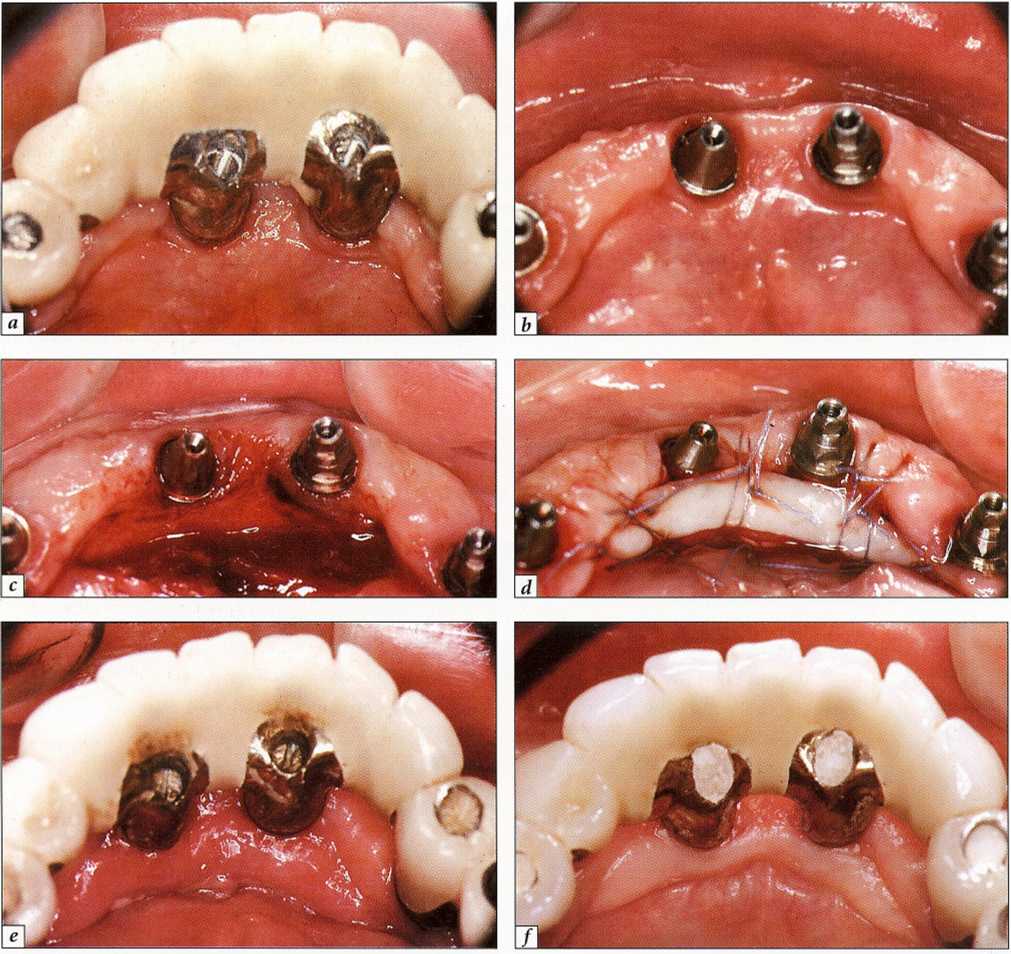
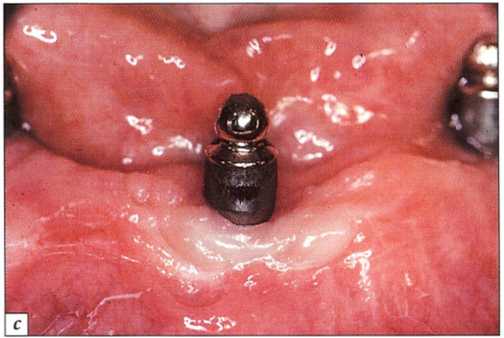
Рис. 9-16. Мукозит - показана пересадка свободного десневого трансплантата:.
а-язычный вид мостовидного протеза с опорой на имплантаты на нижней челюсти. Полное отсутствие кератинизированной прикрепленной десны. Уздечки и подвижность языка привели к раздражению десневого края и препятствовали адекватной самостоятельной гигиене; b - язычный вид после удаления мостовидного протеза; с - препарирование принимающего ложа;.
d - фиксация свободного десневого трансплантата из области неба надкостничными швами; е - заживление через две недели;.
/- заживление через 3 мес. Стабильный десневой край, воспаление отсутствует
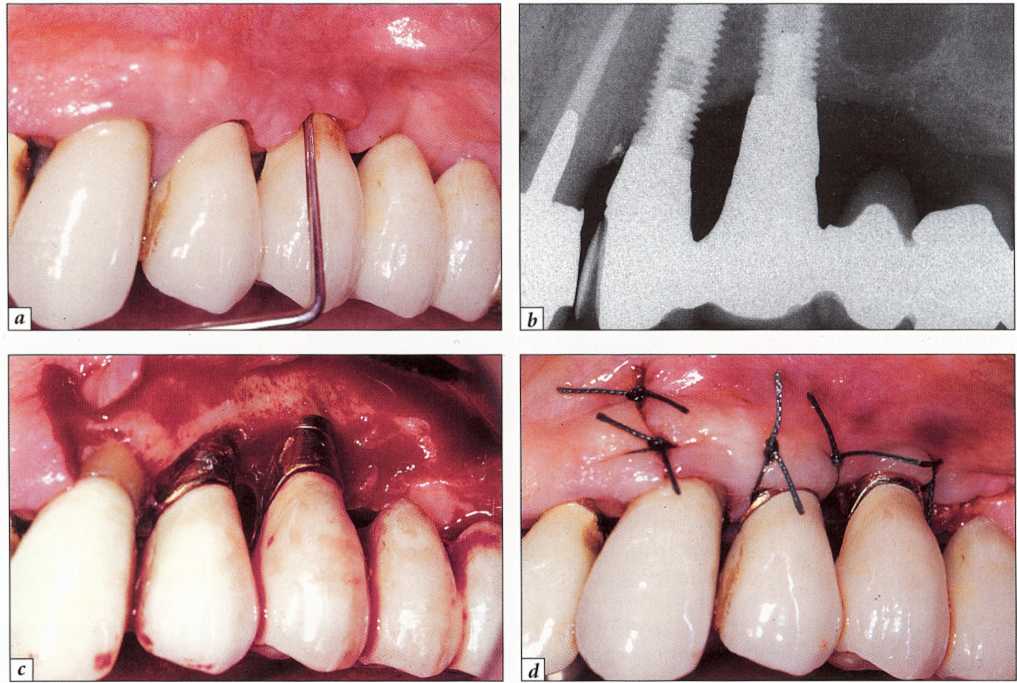
Рис. 9-17. Рецидивирующий мукозит с образованием глубокого кармана вокруг имплантата:.
а - исходная клиническая ситуация - воспаление мягких тканей, глубокий карман и кровоточивость при зондировании;.
b - рентгенологические признаки поражения в кости отсутствуют;.
с — откинут полнослойный лоскут для удаления грануляционной ткани и полирования внутридесневой части конструкции;.
d — репозиция лоскута и фиксация одиночными узловыми швами.
В каждой клинической ситуации после постановки диагноза необходимо определить цели лечения и соответствующие им методы лечения. Как и при пародонтите, лечение периимплантита заключается в устранении инфекции и дефектов тканей, а также в создании условий для обеспечения самостоятельной гигиены полости рта.
В соответствии с опубликованными в литературе данными, эффективность устранения периимплантита зависит от тяжести заболевания и морфологии поражения. Аналогично принципам последовательного лечения пародонтита, лечение периимплантита можно разделить на три этапа: этиологический, корригирующий и восстановительный (Jovanovic, 1993). Таким образом, после завершения этиологического этапа терапии можно выбрать соответствующий метод с учетом результата проведенного лечения и морфологии дефекта. В ряде случаев, прежде всего при рецидивирующем поражении или появлении подвижности имплантата, показано его удаление.
■ Этиологический этап.
Механические и хирургические методы сами по себе не позволяют устранить инфекцию. Этиологический этап терапии периимплантита включает в себя все антиинфекционные методы, которые используются при лечении пародонтита. В первую очередь необходимо добиться улучшения гигиены полости рта (инструктаж пациента) и удаления отложений с помощью пластмассовых кюрет. Кроме того пациенту назначают антимикробные средства: 0,2 % раствор хлоргексидина для полоскания полости рта и при необходимости 10 %-ную перекись водорода для аппликации в пораженных участках. Антибиотикотерапия должна быть направлена на патогенную флору. Данные литературы подтверждают эффективность комбинации амоксициллипа и метронидазола. Особое внимание следует уделять удалению поддесневых отложений из глубоких карманов. При этом следует избегать повреждения металлических поверхностей. Проведение закрытого кюретажа, т.е. обработки карманов при отсутствии прямого визуального контроля, часто очень трудоемко и усложняется наличием ортопедической конструкции. Описанный протокол можно считать эмпирическим из-за малого количества опубликованных по этой теме исследований. Он основан на факте присутствия грамотрицательных анаэробов в карманах вокруг имплантатов и опыте его применения в пародонтологии.
Mombelli и Lang (1992) у девяти пациентов с костной деструкцией и карманами глубиной более 5 мм вокруг имплантатов проводили кюретаж и назначали метронидазол по 1 г в течение 10 дней, а также обрабатывали поддесневые участки 0,5 % раствором хлоргексидина, что немедленно приводило к качественным и количественным изменениям микрофлоры карманов, а также позволяло устранить кровоточивость после зондирования и уменьшить глубину карманов.
Mombelli и соавт. (2001) оценили эффективность лечения периимплантита у 25 пациентов с частичной адентией. Глубина карманов превышала 5 мм. В карманы вокруг имплантатов вводили полимерную нить, пропитанную тетрациклином (Актисайт; Actisite®). Данное лечение приводило к значительному сокращению количества грамотрицательных анаэробов, уменьшению кровоточивости после зондирования, значительному уменьшению глубины карманов (в среднем от 6 до 4,1 мм). Кроме того, отмечались рентгенологические признаки значительного восстановления костной ткани (в среднем от 5,2 до 4,9 мм). В экспериментах на собаках было установлено, что антисептики и антибиотики позволяют устранить воспаление мягких тканей вокруг имплантатов и подавить инфекцию. Однако указанные методы не подходят для регенерации кости вблизи контаминированной в результате экспериментального периимплантита поверхности имплантата (Ericsson et al., 1996).
Нехирургические методы не позволяют провести деконтаминацию обнаженной поверхности имплантата и дают лишь краткосрочный положительный результат, что чревато грозными рецидивами.
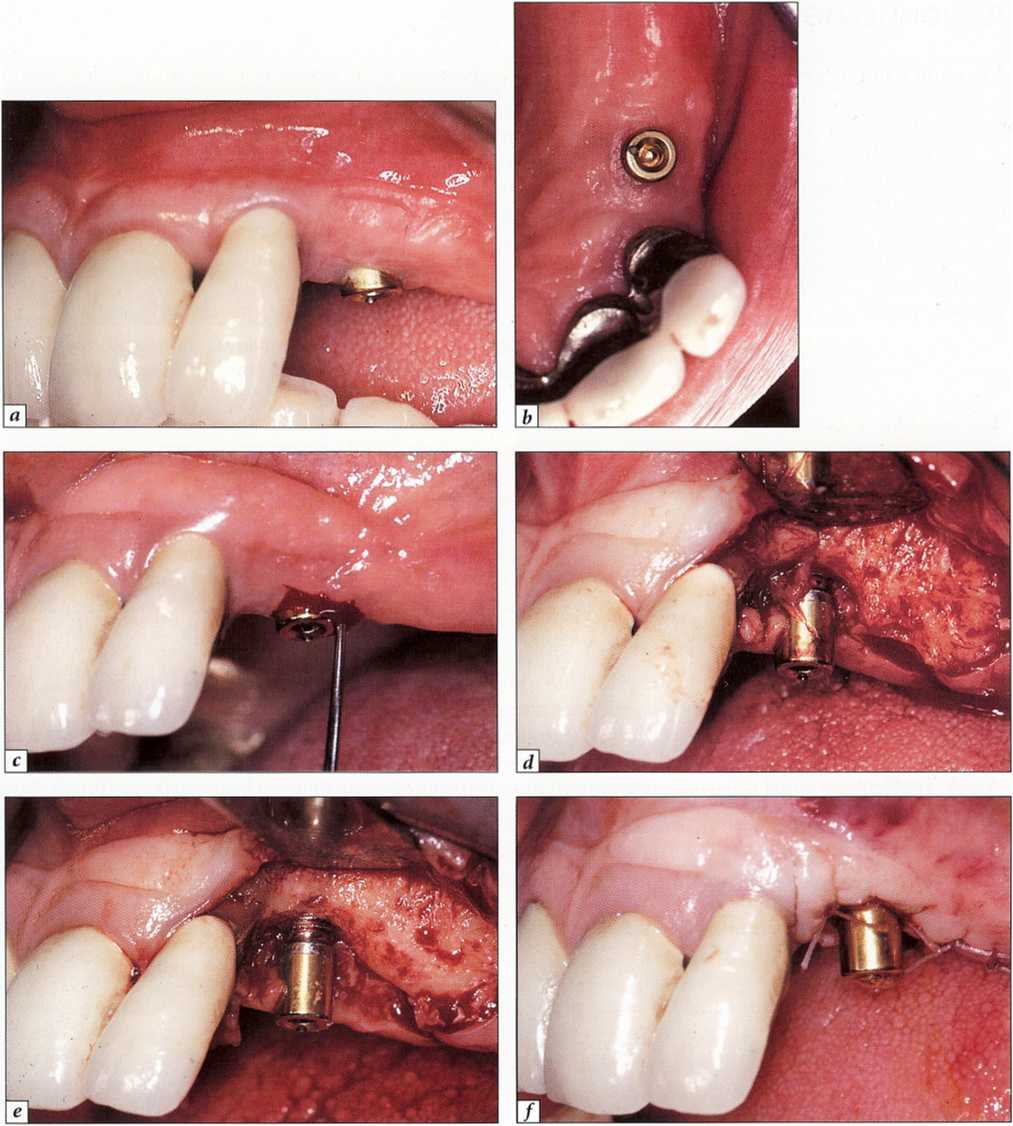
Рис. 9-18. Лечение периимплантита в области одиночного имплантата на верхней челюсти, используемого для опоры покрывного протеза:.
а-с - исходная ситуация - обширное кровотечение при зондировании; d - формирование слизисто-надкостничного лоскута;.
е - состояние после удаления грануляций и отложений с поверхности имплантата;.
/- проведена репозиция лоскута, наложены швы. Для уменьшения кармана выполнены пластика десны и апикальное перемещение лоскутая Корригирующий этап.
После устранения инфекции и уменьшения воспаления мягких тканей может потребоваться хирургическое вмешательство. При этом используются методы классической пародонтологической хирургии (Zablotsky, 1992). После формирования слизисто-надкостничного лоскута осуществляется доступ к контаминированной поверхности имплантата, апикальное перемещение лоскута позволяет уменьшить глубину кармана (рис. 9-18). Цель корригирующей операции заключается в создании условий для адекватной поддерживающей терапии, направленной на профилактику рецидивов и стабилизацию состояния тканей в течение долгосрочного периода.
В настоящее время неизвестны наиболее эффективные способы лечения при обнажении поверхности имплантатов. В литературе описано множество комбинаций механических и химических методов. После промывания физиологическим раствором некоторые авторы полируют металлические поверхности резиновыми чашками (McCollum et al., 1992) или подвергают их пескоструйной обработке (Эир-Флоу; Air-Flow). Кроме того, предлагается обрабатывать контаминированные поверхности химическими средствами, например 0,5 % раствором хлоргексидина, 10 % растворохм перекиси водорода, лимонной кислотой или раствором тетрациклина.
Для подтверждения важности этого этапа Persson и соавт. (2001) разработали оригинальный протокол экспериментального периимплантита. На одной стороне полости рта проводили только промывание физиологическим раствором, на другой - авторы заменяли контаминированные имплантаты. При замене имплантатов происходила их остеоинтеграция, а на контрольной стороне повторно добиться остеоинтеграции в области контаминированных поверхностей не удавалось.
Для обработки шероховатых поверхностей, в настоящее время преобладающих у большинства имплантатов, в основном используется Эир-Флоу в сочетании с лимонной кислотой. Как и в пародонтологии, ключевым условием для достижения оптимального результата является деконтахминация поверхности имплантата.
Апикальное перемещение лоскута показано при множественных поражениях или горизонтальной деструкции кости, если морфология дефекта исключает возможность ее восстановления.
При поражениях хмягких тканей, способствующих ретенции налета, на этой стадии также можно использовать методы пластической пародонтологической хирургии для оптимизации контура десны и (или) увеличения зоны кератинизированной прикрепленной десны вокруг Ихмплантатов (рис. 9-19).
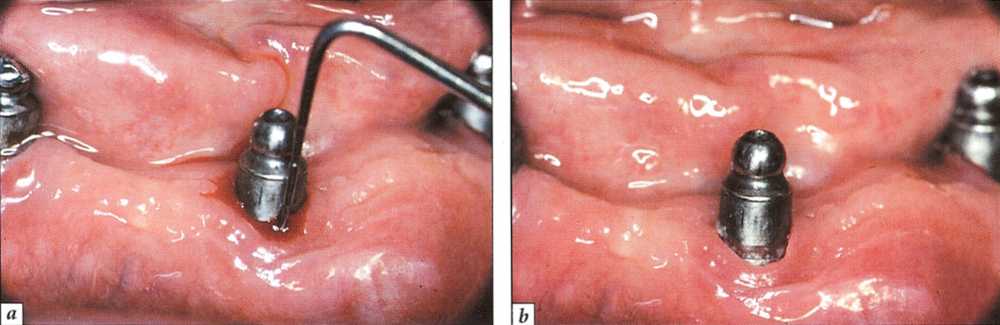
Рис. 9-19. Периимплантит в области имплантата, являющегося опорой съемного протеза:
а - исходное состояние - воспаление десны вокруг имплантата с кровоточивостью после зондирования и наличием глубоких карманов;.
Ь — клиническая картина после антибиотикотера-пии, тщательного удаления налета и полосканий 0,2 % раствором хлоргексидина; с —состояние после пересадки свободного трансплантата - стихание воспаления.
■ Восстановительный этап.
После устранения инфекции и уменьшения воспаления может быть показано восстановление тканей, утраченных в результате патологического процесса. Однако подобные вмешательства возможны только при исключении риска рецидива.
Для устранения костных дефектов в области имплантатов можно использовать методы регенерации костной ткани.
В литературе представлены данные нескольких экспериментальных исследований, демонстрирующие возможность достижения этой цели. У авторов данного издания также имеется достаточно благоприятных клинических результатов. Однако в настоящее время отсутствуют клинические исследования, подтверждающие повторное достижение остеоинтеграции в области контаминированной поверхности имплантата.
Существует большое число эмпирических рекомендаций, основанных на опыте в области пародонтологии и имплантологии.
Морфология костных дефектов и количество сохранившихся костных стенок определяют выбор метода лечения и позволяют оценить возможности восстановления кости. Известно несколько методов костной регенерации, которые условно можно разделить на три группы: трансплантация аутогенной кости или использование костных заменителей; направленная регенерация кости в сочетании с нерезорбируемыми или резорбируемыми мембранами; комбинация костного трансплантата и мембраны. Кроме того, возможно сочетание нескольких методик.
а - исходная клиническая ситуация; b - зондирование после удаления коронки; с-после откидывания слизисто-надкостничного лоскута визуализируется вестибулярный щелевидный дефект; d — после деконтаминации обнаженной поверхности дефект заполнен костным сгустком; е- установка резорбируемой синтетической мембраны;.
/- рана ушита, мембрана полностью закрыта; g - состояние через 3 мес
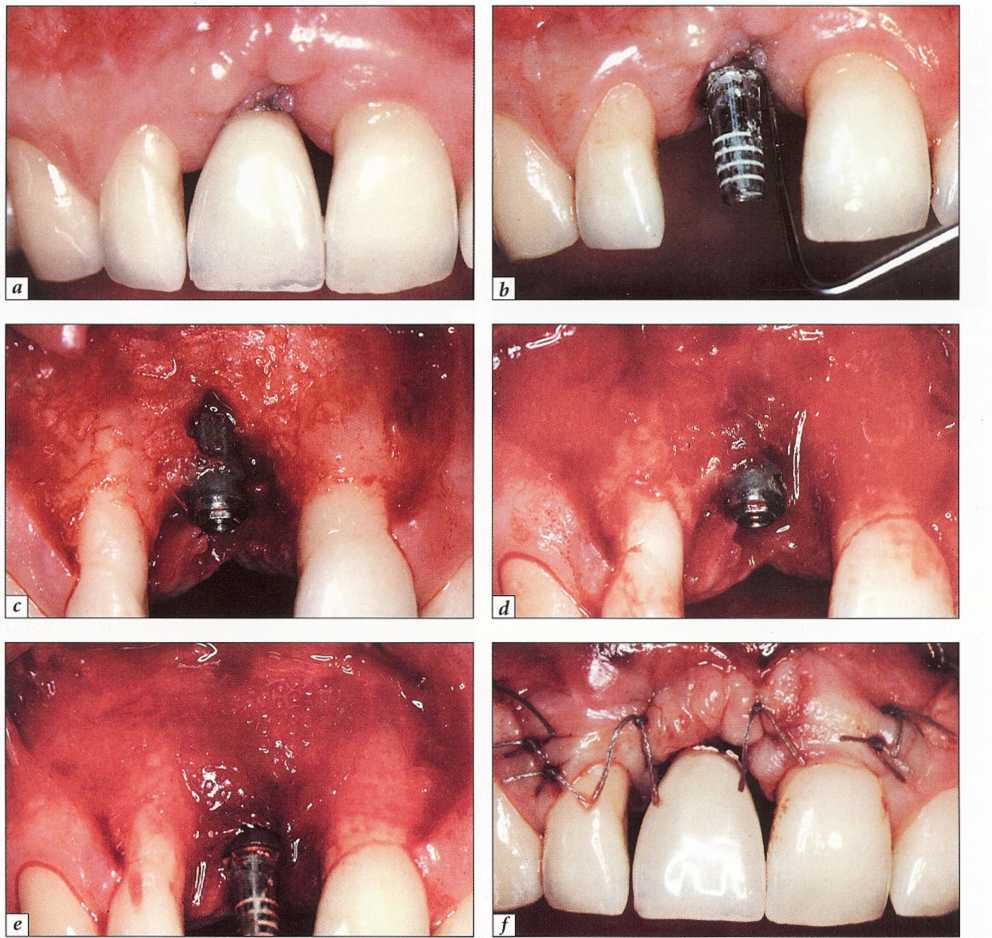
Рис. 9-20. Хирургическое лечение периимплантита в области имплантата на верхней челюсти:
Учитывая риск и возможные последствия инфекционного осложнения для имплантатов, все авторы рекомендуют проводить хирургический этап на фоне антимикробной профилактики.
1.
Трансплантация кости и костные материалы.
Опубликовано несколько исследований, посвященных оценке эффективности трансплантации кости и костных материалов при периимплантите (Roos-Janker el al., 2003). В описанных методиках использовались аутогенная, лиофилизированная минерализованная или деминерализованная кость, гидро-ксиапатит или бычья депротеинизированная кость. Протокол выполнения всех вмешательств заключался в формировании слизисто-надкостничного лоскута, удалении грануляций, деконтаминации поверхности имплантата, заполнении дефекта костным трансплантатом или материалом, а также в ушивании лоскутов без натяжения. При проведении указанных вмешательств не всегда проводится удаление протеза.
Во всех случаях клинические результаты выглядят удовлетворительными - авторам удалось достичь улучшения состояния десны и восстановления кости в области дефекта (по данным рентгенографии). Однако в литературе не представлены долгосрочные результаты и отсутствуют сведения о достижении повторной остеоинтеграции в области подвергшейся контаминации поверхности имплантата.
Behneke и соавт. (2000) в проспективном исследовании 17 пациентов с периимплантитом вокруг 25 имплантатов ITI с карманами глубже 5 мм использовали аутогенные костные трансплантаты. Через 4 мес проводили повторные вмешательства для визуализации дефектов.
Авторы отметили заполнение костного дефекта на 23-77 % с клинически подтвержденной повторной остеоинтеграцией 0-36 %. Через три года ни в одном случае не возник рецидив периимплантита. Глубина кармана уменьшилась в среднем на 3,3 мм, среднее значение регенерации кости по данным рентгенографии составило 4,9 мм.
На основании этого исследования можно заключить, что частичная повторная остеоинтеграция с частичным заполнением костного дефекта фиброзной тканью является достаточной для исключения рецидива периимплантита и улучшения долгосрочного прогноза имплантатов.
2.
Направленная костная регенерация.
В литературе описано несколько исследований, посвященных оценке эффективности направленной регенерации кости (НРК) при лечении периимплантита (Roos-Janker et al., 2003). Рекомендуется использование нерезорбируемых мембран из расширенного политетрафторэтилена (р-ПТФЭ; e-PTFE) или резорбируемых из полимеров молочной кислоты или коллагена. Методика применения мембран практически не отличается от направленной тканевой регенерации в пародонтологии. Мембрану фиксируют вокруг шейки имплантата для образования достаточного пространства, после чего проводят ушивание лоскутов, обычно без повторного погружения имплантата (рис. 9-20).
Hammerle и соавт. (1995) использовали НРК у двух пациентов с двумя дефектами (5 и 6 мм) в области двух имплантатов. Авторы использовали нерезорбируемую мембрану и через 18 мес отметили улучшение состояния мягких тканей и увеличение уровня кости в среднем на 2,3 мм (по данным рентгенографии). Несмотря на хорошие результаты, необходимо учитывать высокий риск обнажения мембраны и осложнений, связанных с присоединением суперинфекции.
Aughtun и соавт. (1992) исследовали 12 пациентов с дефектами глубже 5 мм в области имплантатов IMZ. Через 4-6 недель произошло обнажение 13 из 15 мембран.
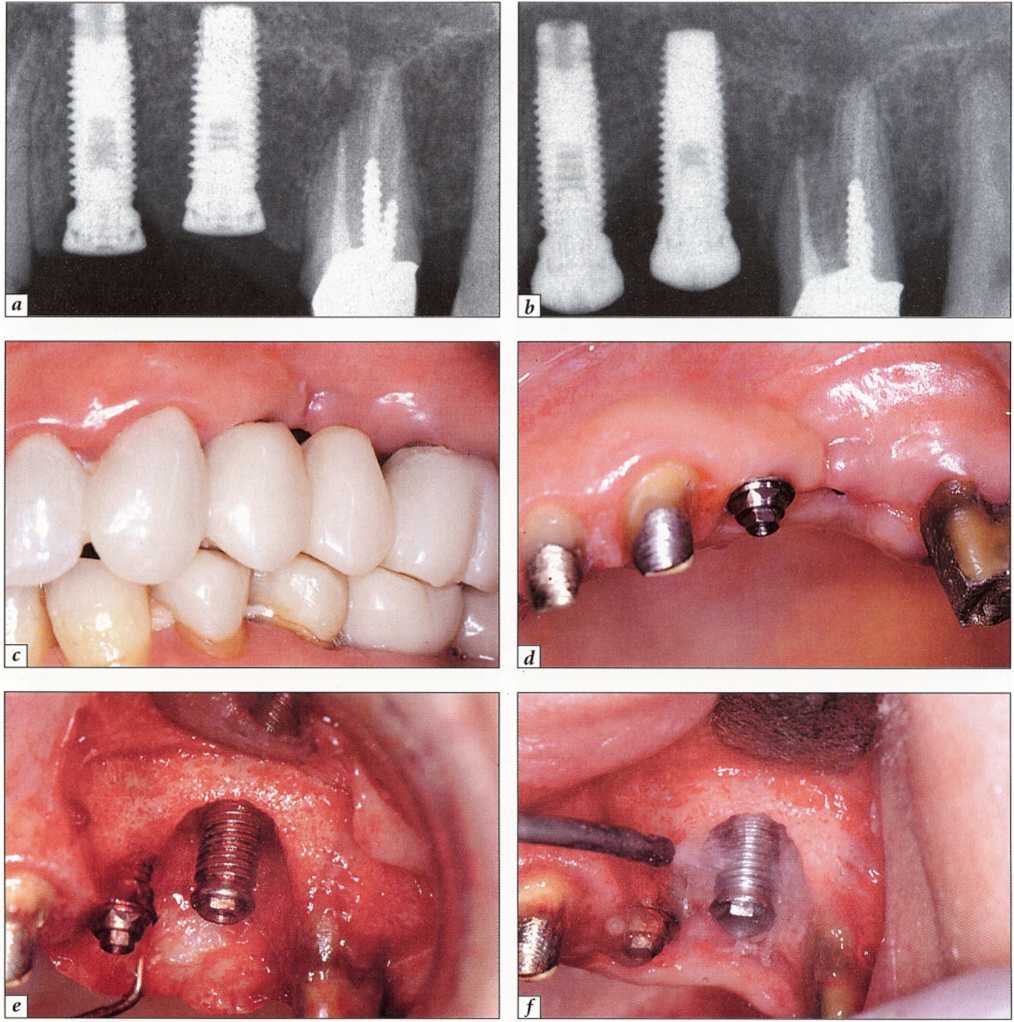
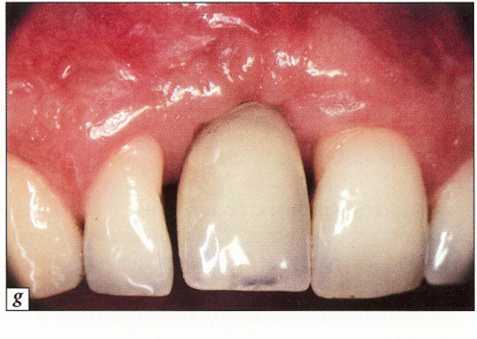
Рис. 9-21. Периимплантит в области остеоинтегрированного имплантата (зуб № 25):.
а - контрольная рентгенограмма сразу после протезирования имплантатов; b - через 2 мес обнаружена деструкция кости, т.е. периимплантит; с - провизорный мостовидный протез не включает в себя пораженный имплантат; d - состояние до операции;.
е - откинут слизисто-надкостничный лоскут,удалена грануляционная ткань, в обширном костном дефекте обнажаются витки резьбы; f- деконтаминация поверхности имплантата с помощью пескоструйной обработки
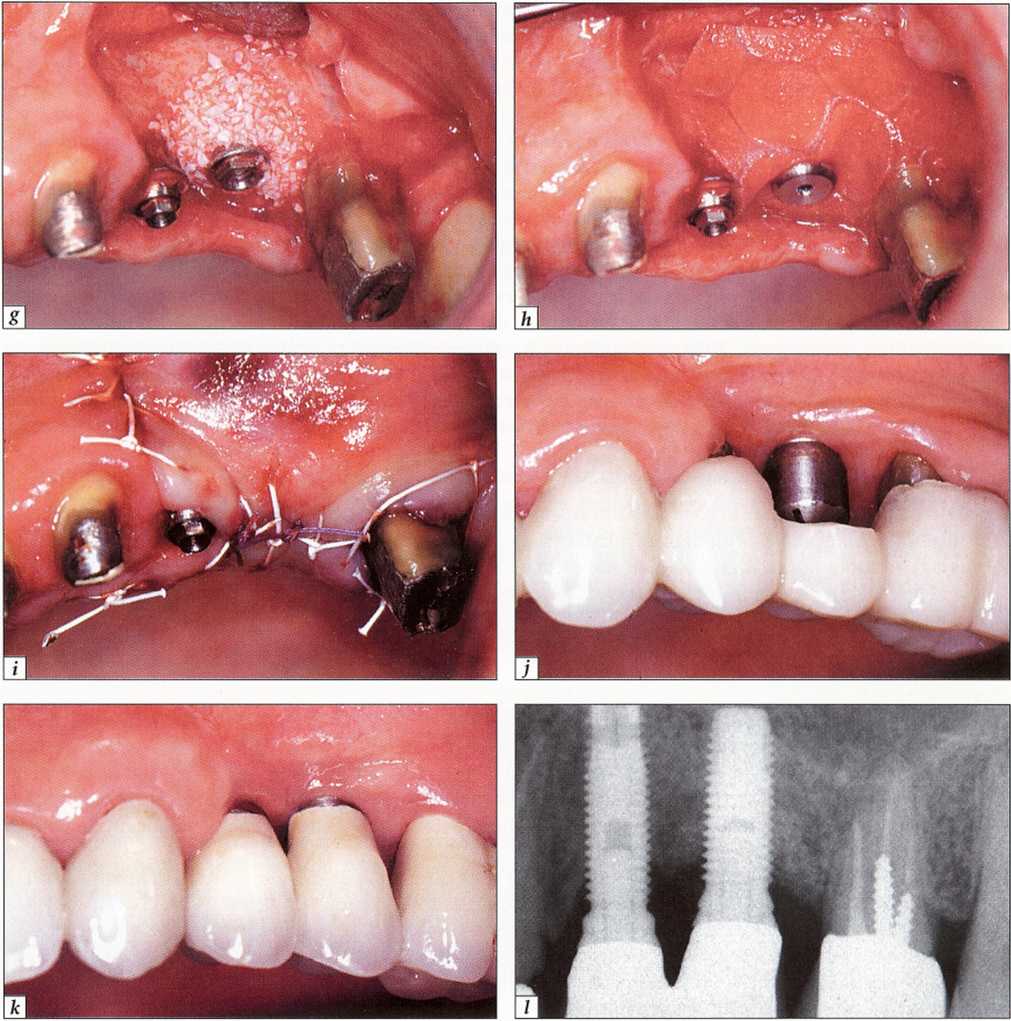
Рис. 9-21. Периимплантит в области остеоинтегрированного имплантата (зуб № 25):.
g- введен костный материал Био-Осс (Bio-Oss®); h - установлена резорбируемая мембрана (Оссеоквест; Osseoquest®); і - после репозиции лоскут ушит. Сделана попытка полностью перекрыть имплантат; j - состояние после лечения периимплантита и протезирования;.
к-контрольная рентгенограмма через один год после операции. Отмечается регенерация кости вокруг имплантата;.
I - контрольная рентгенограмма через один год после лечения. Выраженная регенерация кости вокруг имплантата.
Методика повторного погружения имплантата соответствует биологическим принципам НРК, однако отсутствуют данные сравнительных клинических исследований, подтверждающих превосходство какого-либо метода (Grunder et al., 1993).
Повторное погружение имплантата максимально снижает риск осложнений только при условии, что мембрана и имплантат остаются закрытыми в течение всей фазы заживления.
На практике эту методику, лишающую пациента протеза на весь период лечения, сложно выполнить из-за плохого состояния десны, что характерно для периимплантита.
Несколько исследований на собаках с моделью экспериментального периимплантита проводилось с целью идентификации типа новообразованной ткани под мембраной и подтверждения повторной остеоинтеграции в области контаминированной ранее поверхности имплантата. Результаты гистологических исследований очень противоречивы. По данным ряда авторов (Jovanovic et al., 1993), использование нерезорбируемой мембраны способствует восстановлению кости и частичной повторной остеоинтеграции. Persson и соавт. (1996), напротив, обнаружили лишь плотную соединительнотканную инкапсуляцию имплантата. Таким образом, при лечении периимплантита с использованием одной только мембраны происходят определенное улучшение состояния десны и заполнение костного дефекта плотной тканью, что подтверждается рентгенологически. В настоящее время отсутствуют данные, подтверждающие возможность повторной остеоинтеграции.
3. Сочетание костного трансплантата и мембраны.
Опубликовано несколько исследований комбинированного использования костного трансплантата и мембраны при лечении периимплантита (Roos-Janker, 2003). В описанных методиках используется аутогенная кость или костные материалы и в большинстве случаев нерезорбируемая мембрана (р-ПТФЭ), причем рекомендуется полное погружение имплантата для исключения обнажения мембраны (рис. 9-21).
При соблюдении требуемых условий комбинированная методика, вероятно, обеспечивает лучшие клинические результаты.
Haas и соавт. (2000) провели исследование с участием 17 пациентов с 24 глубокими поражениями вокруг имплантатов более 6 мм. Лечение периимплантита проводилось с использованием аутогенной кости и нерезорбируемой мембраны (р-ПТФЭ). По рентгенологическим данным, через 9 мес увеличение уровня кости в среднем составило 2 мм, однако во всех случаях произошло преждевременное обнажение мембраны. Авторы исследования установили, что степень увеличения уровня кости зависит от длительности использования мембраны.
Khoury и Buchmann (2001) сравнили результаты трех методик у 25 пациентов: аутогенный костный трансплантат; костный трансплантат в сочетании с нерезорбируемой мембраной (р-ПТФЭ); костный трансплантат в сочетании с резорбируемой коллагеновой мембраной. Во всех трех группах через три года по данным рентгенографии отмечалось увеличение уровня кости в среднем на 2-3 мм, вне зависимости от методики. В 60 % случаев использования ме»мбраны произошло ее обнажение. В группе, где мембраны не использовались, осложнений не было.
Авторы исследования установили, что дополнительное использование мехмбраны с костным трансплантатом клинически не дает преимуществ, но повышает риск осложнения. Комбинированная методика прежде всего показана при неблагоприятной морфологии дефекта, если материал трансплантата невозможно закрыть иным способом, или когда только мембрана позволяет сохранить пространство для регенерации.
Mellonig и Triplett (1993) в исследовании 12 обширных циркулярных дефектов использовали лио-филизированную деминерализованную кость и нерезорбируемую мембрану (р-ПТФЭ). При повторном вмешательстве отмечены полное устранение десяти дефектов, в которых прежде были обнажены все витки резьбы, и частичное устранение двух дефектов.
На основании этого хможно заключить, что комбинированное использование мембраны и костного материала позволяет получить такие же клинические результаты, как метод НРК. Данная комбинация показана при неблагоприятной форме дефекта. Гистологический анализ для идентификации новообразованных тканей и повторной остеоинтеграции у человека до настоящего времени не проводился. В пародонтологии биологические свойства костных материалов были изучены в большом количестве исследований, результаты которых довольно противоречивы. Биосовместимость этих продуктов является бесспорной, однако степень их резорбции и способность стимулировать образование новой костной ткани довольно сомнительны.
В имплантологии данная тема изучена крайне слабо, однако костные материалы используются всё чаще и позволяют получить результаты, сопоставимые с применением аутогенной кости. Hiirzeler и соавт. (1997) в исследовании на собаках на модели экспериментального периимплантита сравнили возможность достижения повторной остеоинтеграции при использовании различных методик. Авторы применяли костный материал, нерезорбируемую мембрану (р-ПТФЭ) и их комбинацию. Лучшие результаты получены при использовании лиофилизированной деминерализованной кости в сочетании с мембраной, при этом отмечалось достижение повторной остеоинтеграции.
Таким образом, можно сделать вывод, что при лечении периимплантита сочетание костного материала и мембраны обеспечивает лучшие результаты. Как уже отмечалось выше, успех лечения во многом зависит от эффективности деконтаминации обнаженной поверхности имплантата. Для обработки поверхности в клинических и экспериментальных условиях (Jovanovic et al., 1993; Hiirzeler et al., 1997) большинство авторов использовали пескоструйную обработку порошком бикарбоната натрия. Однако до настоящего времени отсутствуют данные сравнительных исследований, подтверждающих превосходство этой методики над другими способами.
При обнажении нескольких витков резьбы имплантата можно быть уверенным в ее бактериальной контаминации. Гладкую поверхность легче деконтаминировать, чем шероховатую. По данным исследования на собаках с моделью экспериментального периимплантита (Persson et al., 2001), у шероховатых поверхностей потенциал повторной остеоинтеграции выше. Следовательно, прогноз устранения поражений вокруг имплантатов лучше для имплантатов с шероховатой поверхностью. Деконтаминация обнаженной поверхности должна после механического полирования включать в себя химическую детоксикацию.
Отсутствие данных долгосрочных клинических сравнительных исследований не позволяет сделать окончательных выводов. Остается много неопределенности в отношении местного использования антимикробных средств, детоксикации обнаженной поверхности имплантатов, эффективности методик восстановления кости, возможности достижения повторной остеоинтеграции и долгосрочного прогноза достигнутых результатов.
Однако во всех опубликованных вариантах лечения есть ряд единых рекомендаций:.
• Пациент должен освоить эффективные методы самостоятельной гигиены полости рта.
• Необходимо назначение антисептических растворов для полоскания полости рта.
• Рекомендуется применение кюрет из пластмассы.
• При поражении костной ткани показано назначение антибиотиков.
• При горизонтальной деструкции или обширных поверхностных дефектах кости после формирования слизисто-надкостничного лоскута проводятся открытый кюретаж и апикальное перемещение лоскута.
• Обнаженная поверхность имплантатов должна быть деконтаминирована.
• При наличии двух- или трехстеночных вертикальных костных дефектов показаны регенеративные вмешательства с использованием костных материалов или направленная регенерация кости.
• При наличии крупных или циркулярных дефектов показано комбинированное использование костного трансплантата и мембраны.