ная, тонкая и хорошо соединенная с основой оксидная пленка. В этих случаях биотолерантные свойства имплантатов будут наилучшими. В зависимости от особенностей окружающей среды оксидная пленка, оптимальная толщина которой 4 Нм, может истончаться, трескатся утолщаться или отслаиваться и терять защитные свойства.
Для пассивации рекомендуются следующие традиционные методики: обработка в течение 30 мин в 20-30% азотной кислоте при температуре 50 — 60 °С и последующая оксидация в течение 150 ч в изотоническом растворе хлорида натрия при температуре 38,6 °С. Механическая обработка имплантатов после пассивации допустима.
На хорошую пассивацию указывала повышенная химическая стойкость металла и смещение электропотенциала в положительную сторону. Среди других пассиваторов надо упомянуть нитраты натрия, бихромат , кислород и анодную поляризацию. Пассивность металлов и сплавов при изменении внешних условий может перейти в активное состояние. К депассиваторам относятся сульфат натрия, тиосульфат натрия, вода, а также активные ионы водорода, хлора, брома, йода. Катодная поляризация — наиболее вероятный случай механического нарушения пассивной пленки.
Из физических способов пассивации заслуживает внимания использование ультразвука. Ультразвуковая пассивация — это многофакторный способ обработки поверхности, качество которой зависит от изменения окислительно-восстановительного потенциала, возбуждения электронных оболочек атомов, локального повышения температуры, давления, рН и кавитационного действия, которое может вызвать эрозию оксидных пленок и наоборот, с ростом частоты колебаний стойкость оксидных пленок возрастает). Хорошие результаты получают в тех случаях, когда для пассивации используют ультразвук совмещенного частотного диапазона (22 МГц). В шведской фирме «Nobelpharma», выпускающей ЭИ из титана, на окончательной стадии их обработки применяется ультразвук.
Более подробно необходимо остановиться на пассивации в тлеющем разряде. Тлеющий разряд, или ионное травление, имеет применение в разных областях исследований, в частности в технике для очистки деталей перед покрытием, когда требуется особая чистота.
поверхности. Способ тлеющего разряда заключается в том,что, бомбардируя ионами поверхность объекта, обращают преимущественно атомы с нарушенными или ослабленными связями. При травлении в зависимости от времени и режима различают несколько стадий: очистки поверхности, выявления границ зерен кристаллов, формирования углублений внутри зерен и оплавления поверхности. Чрезмерное увеличение энергии ионов нецелесообразно, так как они взаимодействуют с атомами в глубине вещества, наступают объемная диффузия и миграция выбитых атомов.
В зависимости от типа источника высокого напряжения может быть катодный тлеющий разряд, может быть высокочастотным и низкочастотным. Обычно для травления применяются инертные газы, водород, кислород, воздух. В стоматологической имплантологии проводить пассивацию имплантатов в тлеющем разряде (ПИТР) предлагал R. Baier (1970) с целью повышения энергии поверхности имплантатов и достижения ее идеальной очистки. J. Doundoulakis (1988) на основании сравнительных исследований пяти методов стерилизации титановых имплантатов сделал вывод, что после ПИТР получается поверхность, способствующая адгезии клеток и фиксации имплантатов. По данным S. Winkler и Wongthai (1986), используя тлеющий разряд для подготовки металлического каркаса перед покрытием керамикой, можно избежать отколов при изгибе металлической основы. J. Dorfman (1936) отмечает перспективность ПИТР и рекомендует ее широкое применение. для внедрения нового метода стерилизации в клиническую практику сконструирована установка «Picotron» (США). Согласно рекламному проспекту, имеется возможность пассировать и стерилизовать металлические имплантаты, а также инструменты и имплантаты с покрытием трикальцийфосфат-керамикой. Вата, болты, предметы с полостями не могут полностью стерилизоваться.
Для применения тлеющего разряда мы разработали аппарат собственной модификации, а также использовали аппараты УВЧ-60 и АЛП-02. Ионизированным газом был разряженный воздух, так как под действием высокочастотного разряда получается озоновоздушная смесь, имеющая бактерицидные свойства.
Таким образом, установка для ПИТР нашей модификации состоит из аппаратов УВЧ-60 и АЛП-02,.
73
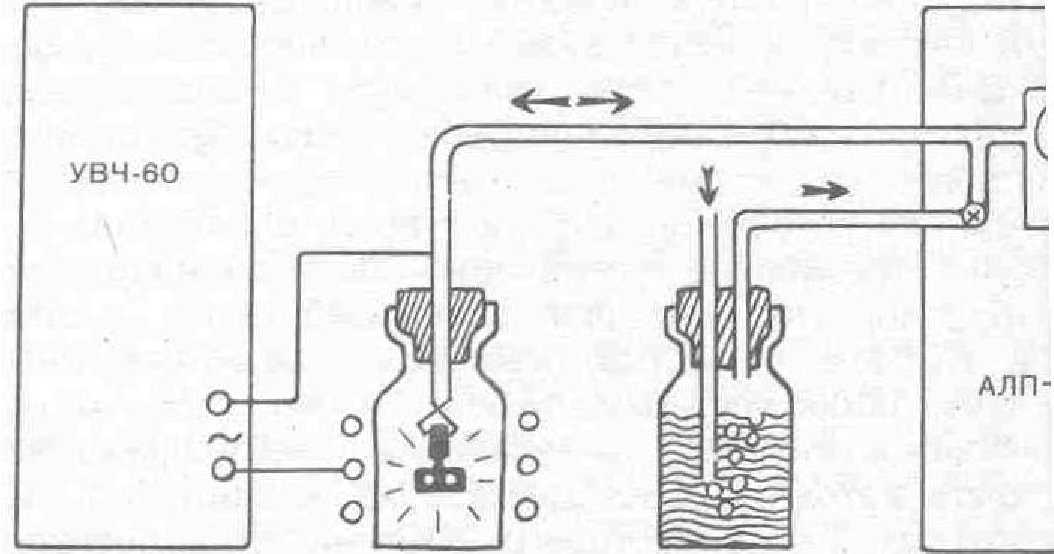
Рис. 31. Схема монтажа установки для ПИТР.
системы стерилизации всасываемого воздуха и инициаторы тлеющего разряда. Установку собирают по схеме, показанной на рис. 31. Для большей пpoизвoдительности вакуумного насоса диаметр маховика электромотора АЛП-02 целесообразно увеличить в 2 раза.
При работе с установкой выполняем следующие манипуляции. К одному из электродов фиксируем имплантат, бор, пульпэкстрактор в держателе и закрываем в бутылке объемом 100 см
3
. Для прогрева на 24 мин включаем аппарат УВЧ-60 и одновременно проверяем напряжение в сети (по инструкции). Затем закрывается вентиль-надтекатель аппарата АЛ П -0 2 и включается вакуумный насос. Через 30 с разряжение в системе составляет 0,02 кгС/см
2
(15,2 мм рт. ст.). Включаем генератор на мощность 20 Вт и поворотом рычага «настройка» добиваемся максимального свечения тлеющего разряда. В норме вся поверхность импланта равномерно светится светло-розовым цветом. По истечении 2 мин выключаем генератор. Поворотом вентиля-надтекателя против часовой стрелки подаем в систему стерильный воздух, выключив предварительно вакуумный насос. Стерилизация всасываемого воздуха происходит при прохождении его через раствор фурацилина 1:5000. Вынимаем имплантат из бутылки, освобождаем из держателя и кладем в стерильную фарфоровую чашку для остывания. Обычно через 3 мин можно приступать к операции имплантации.
Время процедуры 7 мин. Проверка отсасываемого воздуха из системы установки показала концентрацию озона 0,7 мг/м
. В данном случае мы имеем комбинированное воздействие на бактерии — это озон, ионная бомбардировка и локальный нагрев поверхности. Стерильность после ПИТР проверялась в тиоглюколевой среде Staphylococcus aureus, Preudomonas aeroginosa, Eschelia coli. Отмечено, что их рост отсутствовал в течение 5 дней. Даже заражение поверхности имплантата субстратом из колонии микробов с петлей показало хороший стерилизирующий эффект ПИТР. Измерение электропотенциала 52 имплантатов до и после ПИТР выявило, что при всех режимах работы генератора отрицательный потенциал уменьшается. Оптимальный режим для титана и КСХ 20 Вт, что уменьшает электропотенциал на 113±32 м В.
Согласно исследованиям И. В. Тодорова (1971), основным поражающим фактором является резко отрицательный потенциал металлических объектов в полости рта. В тех случаях, когда разница потенциала между включением и тканями полости рта составляет более Х мВ, развиваются патологические изменения. Таким образом, полученное "облагораживание" снижает отрицательное воздействие металлических имплантатов на костную ткань. Кроме того, наблюдается хорошая смачиваемость кровью поверхности имплантатов.
При использовании модифицированной нами установки для ПИТР практически исключены многие осложнения при операции имплантации. Пассивация обычно проводится после адаптации имплантата в ложе. К положительным моментам данной методики можно отнести очистку поверхности от органических и неорганических загрязнений, отсутствие контаминации, высокий уровень поверхностной энергии, обеспечивающей хорошую смачиваемость и биоадгезию, быстроту процесса пассивации, возможность сбора установки своими силами в любом медицинском учреждении, а также проведение ПИТР средним медицинским персоналом. По нашему мнению, ПИТР является наиболее прогрессивным способом подготовки имплантатов перед операцией.
Применение 2—5 имплантатов и 3—24 зубопротезных единиц со значительным электропотенциалом не может не отразиться на биопотенциалах полости рта. Металлический имплантат может оказывать шунтирующее, экранирующее и биоэлектрокаталитическое воздействие на.
окружающие ткани. Отсутствие ясности при изучеэтих проблем объясняется сложностью функции и многофакторностью воздействия имплантатов. Влияние имплантатов на организм общепризнано. По современным представлениям, костная ткань генерирует кинетические и динамические потенциалы. Статические потенциалы имеют топическое распределение соответственно анатомической структуре. Изменение же статического и динамического электрогенеза нарушает процесс остеорепарации. Если после протезирования на имплантате отмечается несоответствие по полярности, топическому распределению стереометрии, уровню потенциалов, то возможно усиление, ослабление или инверсия статических потенциалов кости и как следствие — нарушение остеорепарации. Идеальный имплантат не должен изменять биопотенциалы кости на месте имплантации. Как известно, металлические импланты имеют эквипотенциальную поверхность, а кость — дискретную. Это несоответствие также не может не отразиться на процессе остеорепарации.
Электрическое поле металлических включений уравновешивается или не уравновешивается потенциалом других включений или окружающих тканей. Наиболее частый случай — деформация биопотенциалов тканей организма. Поскольку отрицательный потенциал протеза и имплантата в полости рта всегда имеет большую величину, окружающие ткани не в состоянии уравновесить его, поэтому возникает состояние поляризации или гиперполяризации. Согласно данным М. Тухтиевой (1974), важна не величина потенциала металлических включений, а неравномерность его распределения в полости рта. Выраженная неравномерность распределения электропотенциалов после имплантаци и протезирования приобретает большое значение.
Нами была предложена также методика изготовления и применения титановых и кобальтохромовых имплантатов, создающих согласованную систему био- и электро потенциалов. С этой целью была разработана технология обработки поверхности металлических имплантатов, имеющих необходимый электропотенциал. Применяли электроискровое поверхностное легирование и тлеющий разряд, что позволило создать методику подготовки поверхности имплантатов, обладающих согласованием с окружающими тканями электропотенциалом. Изготовленные по методике, применяемой в нашей лаборатории,

Рис. 32. ЭИ из титана, обработанные электроискровым способом и легированные углеродом.

Рис. 33. Графики, позволяющие определить легируемую площадь в зависимости от требуемой величины электропотенциала имплантата.
имплантаты из титана ВТ-10 имеют отрицательный потенциал 164 мВ, а из КХС— 144 мВ.
Легирование — это способ улучшения металла путем введения в него добавки другого. Мы впервые в стоматологической имплантации начали использовать легированные углеродом титановые и кобальтохромовые имплантаты (рис. 32).
Вопросами применения углеродных покрытий в стоматологии занимались А. В. Смольянникова , К. А. Макаров (1980), Г. А. Хацкевич ,.
Н. Н. Дунаевская (1982), D. Leake и S. Mic (1979), S. Michieli (1979), R. Meffert (1983). Клких либо реакций костной и соединительной ткани на присутствие графитового покрытия не наблюдалось. Установлено также, что углерод обладает остеогенетическим потенциалом.
Мы осуществляли легирование в основном углеродом. Для этого были составлены графики (рис.), которые позволяли определить подлежащую легированию площадь поверхности имплантата в зависимости от биопотенциала кости на участках операции. Для осуществления электроискрового поверхностного легирования применяли отечественный аппарат «Электрон-26а». Как показали наблюдения, легирование можно проводить серебром, серебропалладиевым сплавом, золотом, платиной, углеродом, алюминием непосредственно во время операции имплантации. Легирование протезов при гальванозе можно произвести даже в полости рта при хорошем орошении протеза охлажденной дистиллированной водой. Это выгодно в тех случаях, когда имеется несколько имплантатов и протезов большой протяженности и наблюдаются явления гальваноза. Электроискровое легирование позволяет выбрать нужный участок для обработки поверхности и получить покрытие, которое допускает изгибание имплантата во время операции (рис. 34). Выбор электроискрового поверхностного легирования обусловлен большой прочностью сцепления с материалом основы, весьма малой долей диффузионного взаимодействия при формировании покрытия, быстротой процесса и простотой оборудования, что делает данный способ общедоступным. Растровая электронная микроскопия подтвердила глобулярную структуру поверхности с высотой микронеровностей 10 мкм. В случае необходимости имплантат можно легировать также во время операции с после-

Рис. 34. Легированная углеродом поверхность ЭИ из титана, растровая микроскопиях 300.
дующей обработкой его в тлеющем разряде. Растровая электронная микроскопия показала также, что поверхность имплантатов получается более чистой, чем после ЭХП. По данным R. Baier (1979), после обработки в тлеющем разряде поверхность металла имеет высокую чистоту поверхности и энергию, что проявляется хорошей смачиваемостью и адгезией. Пройдя всестороннюю проверку этот способ прочно вошел в практику работ нашей лаборатории.
Мы обрабатываем имплантаты в тлеющем разряде, благодаря чему ни в одном случае не наблюдали осложнений. Обычно на 3-й неделе после имплантации легированные имплантаты имеют потенциал от +30 до -70 мВ. Прободение металлическим имплантатом всех слоев альвеолярного отростка обусловливает сложную в электрохимическом отношении ситуацию, нарушается распределение электропотенциалов в области шейки. Согласно наблюдениям Н. Тодорова (1968), при разности потенциалов, превышающей 100 мВ, наблюдаются патологические изменения в слизистой оболочке полости рта. После наложения на имплантаты протезов создается еще более сложное положение.
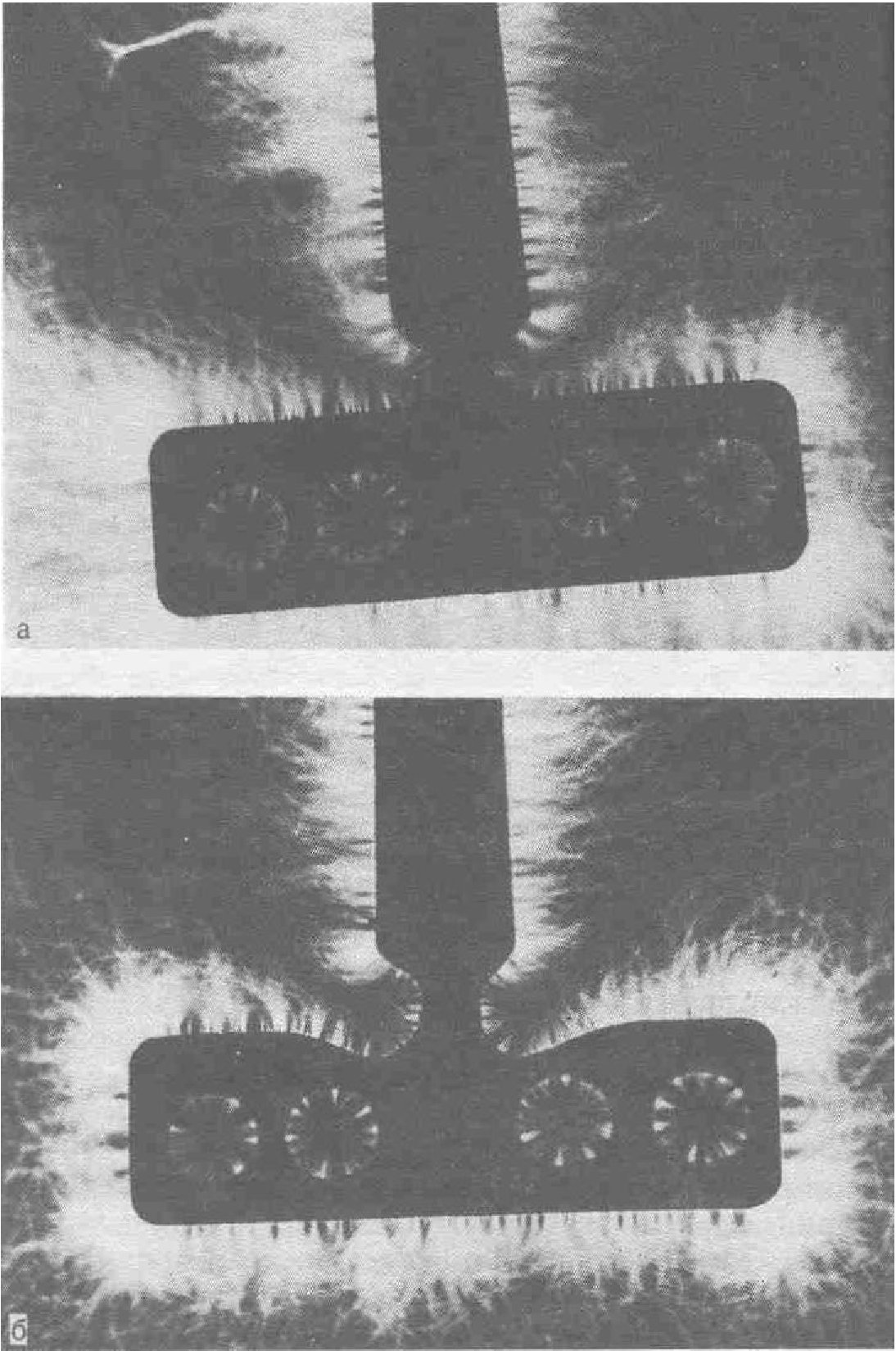
Для исследования распределения электропотенциалов мы использовали эффект Кирлиан — свечение, которое индуцируется высокочастотным тлеющим разрядом. Вторичная электронная эмиссия из катода обусловлена бомбардировкой его положительными ионами. Вторично электроны ускоряются электрическим полем и начинают возбуждать молекулы газа, в результате чего возни-
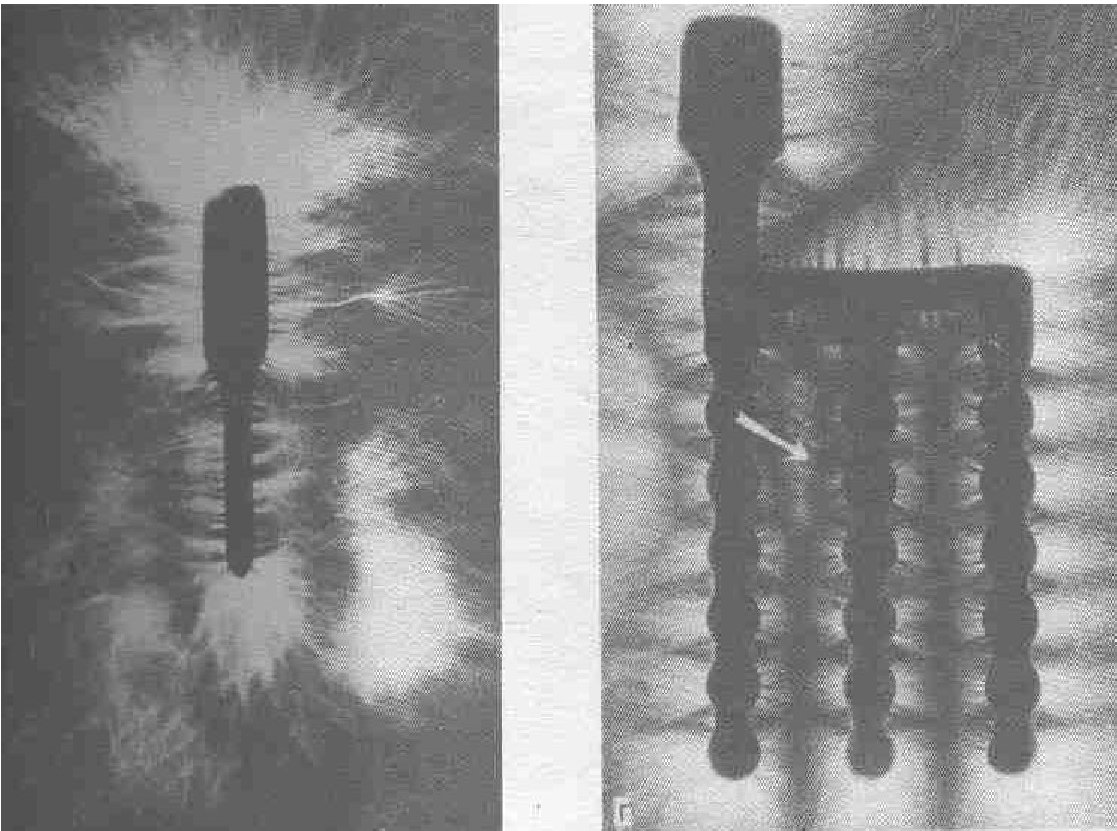
Рис. 35. Исследование имплантатов и протезов методом Кирлиан. а- ЭИ из титана с узкой шейкой; б — ЭИ из титана с модифицированной нами шейкой; в- ЭИ из титана, поперечный разрез; г — ЭСИ из КХС; д — С И из КХС,

поперечный разрез; е — ЭИ из титана и стальной протез фиксированы на цемент.
кает катодная светящаяся пленка. Разряд происходит на тех участках поверхности, где повышен градиент электрического потенциала. Именно неоднородность распределения электрического поля способствует формированию изображения в разрядах. Уже в первых наблюде-

Рис 35. Продолжение.
ниях исследователи установили возможную связь физиологического состояния организма и характера свечения. У живых объектов свечение динамическое, у неживых статическое. С прикладной целью эффект Кирлиан применяется в биологии, медицине, геологии, и криминалистике, дефектоскопии.
Используя описанный в литературе аппарат или индукционную катушку Румкорфа, по методу Кирлиан сделали 150 фотографий имплантатов из титана, КХС и нержавеющей стали. На рис. 35,а показан пластиночный ЭИ из титана, исследованный по методу Кирлиан. В шеечной части и перфорациях пластин видны экранированные электропотенциалом места. По нашему мнению, затрудненный обмен веществ после имплантации в шеечной части и деформированный биопотенциал тканей под воздействием экранирующего эффекта электропотенциала конструкции имплантата дают дополнительные предпосылки для резорбтивных процессов в костной ткани. При изменении формы, шеечной части имплантата (рис. 3, а, б) экранирующий эффект ослабляется. В перфорациях имплантата обнаруживаются экранированные места, но узкая в поперечнике конструкция и хорошее кровоснабжение компенсируют это. Рентгенологически и гистологически, как пра-
вило, выявляется нормально сформированная костная ткань. При исследовании поперечного разреза ЭИ также обнаружено экранированное место в шеечной части конструкции (рис. 35, в). Анализ показал, что в конструкции ЭСИ отсутствуют большие сильно экранированные участки. Важно, что места, где условия для репарации наилучшие, совпадают с экранированными местами, что компенсирует ситуацию. На рис. 35, . г стрелкой указано место взаимодействия биопотенциала указательного пальца и электропотенциала имплантата.
Исследование поперечного разреза СИ методом Кирлиан показало сильное экранирование биопотенциала в области его шейки. Наиболее часто оголение опорных лент, резорбция костной ткани и периимпланТИТ наблюдаются именно в этом месте. Исходя из этого, утопление опорных лент СИ надо считать обоснованным, потому что уменьшается экранирующее воздействие на окружающие ткани вокруг шейки конструкции в этой области и создаются условия для наилучшего кровоснабжения. На рис. 35,е показан имплантат с фиксированным мостовидным протезом. При анализе фотографий обнаружено, что массивные металлические протезы вместе с конструкцией имплантата создают пространство, где вследствие сильного электропотенциала угнетаются репаративные процессы.
В заключение можно сделать следующие выводы:.
1.
Факт экранирующего действия мостовидного протеза на имплантат и, естественно, на костную ткань указывает на необходимость изготовления промежуточ1ък частей и мостовидных протезов висячего типа либо утолщения облицовочного слоя.
2.
Конструкция имплантата и протеза экранируют друг друга, что особенно проявляется около шейки. Возможна деформация или нейтрализация биопотенциалов костной ткани. Это может явиться одним из пусковых механизмов резорбции костной ткани около шейки имплантата и под протезом.
3.
Наименьший экранирующий эффект дает шейка имплантата высотой 4 мм при разности диаметров головки и шейки не более 1,9 мм и радиусах перехода на головку и плечи соответственно 0,5 и 1,5 мм.
4.
Экранирующий эффект зависит от уровня потенциала протеза и имплантата.
5.
Метод Кирлиан можно применять для оценки кон-.
фигурации электрического поля конструкций имплантатов.
Исходя из наших данных о потенциалах имплантов, протезов, слизистой оболочки, кортикального слоя и спонгиозной кости, а также из анализа результатов, полученных методом Кирлиан, можно считать устаревшей рекомендацию относительно утопления плеч пластинчатых ЭИ на 2 мм. Учитывая величину биопотенцила на каждом уровне альвеолярного отростка и экранирующий эффект, следует считать оптимальной высоту шейки 4 мм. Таким образом, создаются наилучшие условия для репаративных процессов в костной ткани над плечами имплантата (см. рис. 35,б).
Взаимодействие имплантата с тканями организма должно быть предсказуемым и контролируемым. Только тогда можно применять большие имплантационные конструкции без риска для здоровья больных.
Интенсивно ведутся исследования с целью улучшения качества имплантатов путем создания на их поверхности покрытия из трикальцийфосфата-керамики, гидроксилапатитной керамики, химически чистого титана, пироуглерода.